长江中下游环境激素效应的污染特征及生态风险
陈晓雯,赵建亮,刘有胜,蒋宇霞,杨愿愿,应光国,#
1.中国科学院广州地球化学研究所有机地球化学国家重点实验室,广州510640
2.中国科学院大学,北京100049
长江中下游环境激素效应的污染特征及生态风险
陈晓雯1,2,赵建亮1,*,刘有胜1,蒋宇霞1,2,杨愿愿1,2,应光国1,#
1.中国科学院广州地球化学研究所有机地球化学国家重点实验室,广州510640
2.中国科学院大学,北京100049
生活污水和养殖废水排放导致受纳水环境中激素类物质的污染,对水生生物产生不利影响。分别利用嵌入雌激素受体和雄激素受体的基因重组酵母菌测定了长江中下游流域不同时期水体和沉积物中4种环境激素效应,即雌激素效应、抗雌激素效应、雄激素效应和抗雄激素效应。结果表明,雌激素效应污染最为普遍,在地表水和沉积物中检出率均超过50%,水体和沉积物的最高浓度分别为2.05 ng·L-1雌二醇当量(EEQ)和0.43 ng EEQ·g-1。其他3种激素效应在水体和沉积物介质中的检出率均低于雌激素效应,按总体检出率来看:抗雄激素效应>雄激素效应>抗雌激素效应,3种激素效应在水体中最大检出浓度分别为144 μg·L-1氟他胺当量(FEQ)、37.9 ng·L-1二氢睾酮当量(DEQ)和103 μg·L-1他莫西芬当量(TEQ),在沉积物中分别为53.6 μg FEQ·g-1、12.0 ng DEQ·g-1和51.5 μg TEQ·g-1。环境激素效应的浓度分布在水体中均呈现季节性的差异,雌激素效应的区域性高值位于武汉段、鄱阳湖口和芜湖-南京段,其他3种激素效应没有明显的高污染区域。环境激素效应与当地人口数量、有机质、氨氮等呈现一定相关性,表明环境激素效应与人类活动排放密切相关。雌激素效应仅在鄱阳湖口点位具有高风险,其他区域为中等风险,雄激素效应无高风险区域。研究结果有助于认识长江中下游区域的环境激素效应污染态势,为相关污染控制提供基础数据。
环境激素效应;雌激素效应;长江流域;内分泌干扰;生态风险
陈晓雯,赵建亮,刘有胜,等.长江中下游环境激素效应的污染特征及生态风险[J].生态毒理学报,2016,11(3):191-203
Chen X W,Zhao J L,Liu Y S,et al.Occurrence and ecological risks of hormonal activities in the middle and lower reaches of Yangtze River[J].Asian Journal of Ecotoxicology,2016,11(3):191-203(in Chinese)
环境激素(也称内分泌干扰物)是一类典型外源性污染物,进入生物体后可模仿内源性激素的生理、生化作用,与体内荷尔蒙受体结合,干扰机体内分泌系统正常代谢,从而产生内分泌干扰效应[1]。随着我国城市化和现代化的快速发展,产生了大量的生活污水、工业废水和养殖废水,其中含有的外源性环境激素物质、以及人类和动物排放的内源性激素物质在废水处理过程中并不能完全去除,最终随出水排放到自然环境,对水生生物产生不利的环境激素效应[2-3]。研究发现,在污水处理厂排放口附近的野生鱼体存在异常的雌性化或雄性化现象及生殖、发育系统紊乱特征[4-8]。因此,采用快速的离体方法检测河流水体和沉积物中的环境激素效应的污染程度,有助于评估水生生物的健康风险。目前,关于水环境中环境激素的报道主要集中在雌激素效应及雌激素活性物质的检测方面[9-12]。此外,环境中也存在具有雄激素、抗雄激素、抗雌激素效应的化学物质[13-16],其性质、来源、归趋及对各级生物产生的危害应引起人们的重视,但目前关于这些物质及其引起的效应在我国河流环境中污染状况的研究相对较少[17-18]。
长江是我国境内第一大河、也是我国文明的重要发源地之一,流经重庆、湖北、湖南、安徽、江苏、上海等多个人口较密集的省区和直辖市。随着人口的增长和人们生活水平的提高,更多具有激素效应的物质可能经污水处理厂排放、养殖废水排放和地表径流等途径进入长江水域中,从而对水体中的生物造成影响。已有的研究表明长江河口等区域可检测到雌激素物质的污染[19-20],但目前关于其各种环境激素效应污染状况的报道还较少[21]。本研究选取长江中下游河段人口密度较大的地区开展研究,分别利用嵌入雌激素受体和雄激素受体的基因重组酵母菌,运用离体方法测定了长江中下游流域中4种环境激素效应(雌激素、抗雌激素、雄激素、抗雄激素效应),分析其时空污染特征,探讨其与多种环境因子的相关性,并进行生态风险评估,为长江流域的环境激素污染控制提供依据。
1 材料与方法(Materials and methods)
1.1 材料
1.1.1 主要仪器及试剂
仪器:酶标仪(BMG Labtech FLUOstar Omega,德国)、卧式恒温振荡摇床(SKY-211BG)、生化培养箱(Yamato IC113C)、洁净工作台、冰箱、高压灭菌锅等。
试剂:氯酚红-β-D-半乳糖苷(Chlorophenolred-β-D galactopyranoside,CPRG,Sigma公司);(NH4)2SO4、KH2PO4、Fe2(SO4)3、KOH、MgSO4、CuSO4、L-亮氨酸、L-组氨酸、腺嘌呤、L-精氨酸-HCL、L-甲硫氨酸、L-酪氨酸、L-异亮氨酸、L-赖氨酸-HCL、L-苯基丙氨酸、L-缬氨酸、L-谷氨酸、L-丝氨酸、L-天冬氨酸、L-苏氨酸、维生素B1、维生素B6、泛酸、肌醇、D-(+)-葡萄糖、甘油等配制培养基所用试剂均来自Sigma公司;17β-雌二醇(17β-estradiol,E2)、5α-二氢睾酮(5α-dihydrotestosterone,DHT),他莫西芬(tamoxifen,TAM),氟他胺(flutamide,FLU)等化学标准品均来自Sigma公司,纯度>97%。甲醇、二氯甲烷、正乙烷等样品溶剂和化学提取试剂均来自默克公司。
实验过程所用的玻璃器皿使用前经重铬酸钾/硫酸洗液洗涤,自来水冲洗3次,超纯水冲洗2次,烘干后置于马弗炉(400℃)中焙烧4 h。过滤水样的滤膜为Whatman GF/F(直径47 mm,0.7 μm孔径),使用前于马弗炉中经400℃烘烤4 h;浓缩后样品过滤所使用的滤膜均为有机相微孔滤膜(直径13 mm,0.22 μm孔径)。固相萃取柱为Waters Oasis HLB柱(6 cc,500 mg吸附剂)。
1.1.2 试验菌株
本试验所用菌种分别为重组雌激素和雄激素受体基因的酵母菌,均由英国Dr.J.P.Sumpter提供(Brunel University,Uxbridge,UK)。
1.2 方法
1.2.1 样品采集
本研究选取的调查范围为长江中下游流域,从湖北省三峡水库到上海市入海口处共24个采样点,分别于2013年7月、2013年12月采集了丰水期和枯水期的地表水及沉积物样品,采样点位置分布如图1,名称如下:C1(三峡水库)、C2(宜昌)、C3(荆州)、C4 (洪湖)、C5(洞庭湖口)、C6(武汉前)、C7(武汉)、C8(东湖)、C9(汉江口)、C10(武汉后)、C11(黄石)、C12(九江)、C13(鄱阳湖口)、C14(大通)、C15(芜湖)、C16(马鞍山)、C17(南京前)、C18(南京)、C19(南京后)、C20(镇江)、C21 (淮河口)、C22(扬中)、C23(南通)、C24(上海)。
分别采集了水样和沉积物样品。每个采样点于同一断面(水平面下约0.5 m)多方位采集1 L的混合水样,用棕色玻璃瓶收集,每个采样点采集2个平行样。采集后的水样立即加入50 mL色谱纯甲醇用于抑制微生物降解,并加入400 μL 4 mol·L-1H2SO4调节pH至3.0,样品存放于4℃冰盒中运回实验室,并于48 h内进行前处理(见1.2.2)。以抓斗采样器采集表层沉积物,分别采集所在截面的左中右等份样,混合后取1 L左右沉积物于玻璃瓶中,立即加入1 g叠氮钠,混匀后于4℃冰盒中运回实验室,保存于-18℃,并尽快将沉积物于-50℃进行冷冻干燥,冻干后的沉积物过20目(孔径1.1 cm)筛,保存于4℃冷库中待提取净化。

图1 长江中下游流域24个采样点分布图
1.2.2 样品前处理
采集的样品,水样需要进行固相萃取进行浓缩,沉积物样品冻干后需进行超声提取并进行硅胶柱净化和浓缩,浓缩后的样品于-18℃保存。
水样采用固相萃取法提取:将采集的1 L水样过GF/F滤膜,HLB固相萃取柱分别用10 mL甲醇和10 mL Milli-Q水进行活化,然后样品以3~5 mL· min-1的流速过HLB柱;完毕后,以2×50 mL 5%甲醇的水溶液润洗采样瓶,并过HLB柱,再分别往每根柱上加入2×5 mL Milli-Q水,抽干2 h;先后以7 mL甲醇和5 mL二氯甲烷洗脱,合并洗脱液,于氮气下吹干,以1 mL甲醇定容,过0.22 μm有机相滤膜并转移至2 mL的棕色小瓶中,样品测试前于-18℃保存。
沉积物采用超声提取-硅胶柱净化法:分别称取2份平行的5 g冻干后沉积物于30 mL玻璃离心管中。加入10 mL乙酸乙酯:甲酸(50:1,V/V)混合液,涡旋振荡2 min,然后超声提取15 min,于2 500 r· min-1离心10 min;用胶头滴管将上层溶剂轻轻吸至100 mL梨形烧瓶中;分别再加入10 mL和5 mL乙酸乙酯:甲酸(50:1,V/V)的混合液,重复上述提取步骤,合并提取液,于氮气下吹干。称取1 g硅胶于直径约6 mm的玻璃柱内,加入约0.5 cm厚无水Na2SO4,轻敲柱子使其匀实后,先后以6 mL甲醇、6 mL乙酸乙酯和6 mL正己烷活化硅胶柱;以2 mL正己烷溶解吹干的样品,并加载到净化柱中,重复2次,弃去流出液(正己烷相);再用2 mL乙酸乙酯溶解样品,过柱,重复3次,收集流出液(乙酸乙酯相),于氮气下吹干,加入1 mL甲醇重新溶解定容,过0.22 μm有机相滤膜并转移至2 mL棕色小瓶中,样品测试前于-18℃保存。
1.2.3 样品的环境激素效应测试
经固相萃取浓缩的水样和超声提取浓缩的沉积物样品分别采用嵌入雌激素受体(下文简称YES酵母菌)和雄激素受体(下文简称YAS酵母菌)的酵母菌进行雌激素效应筛选(yeast estrogen screening, YES)、抗雌激素效应筛选(yeast anti-estrogen screening,YAES)、雄激素效应筛选(yeast androgen screening,YAS)和抗雄激素效应筛选(yeast anti-androgen screening,YAAS)。其基本原理如下:将雌/雄激素受体基因嵌入酵母主染色体中,环境中的激素物质能够与之结合形成活性受体,引起报告基因Lac-Z的表达,产生β-半乳糖苷酶并从酵母细胞内分泌到胞外介质中,促使黄色的底物CPRG转变为红色的产物,此产物在540 nm具有强烈的可见光吸收,吸光度值越大则激素效应强度越大,从而可以通过测量吸光度定量检测环境样品的激素效应强度。样品的4种环境激素效应测试方法参照文献报道[22]的操作进行,主要步骤如下。
菌种培养:2种实验菌株的培养方法基本一致。取125 μL 10倍浓缩的YES/YAS酵母菌液于50 mL生长培养基中,28℃恒温振荡培养约24 h,待其620 nm下吸光度约为1.0时可进行暴露测试。其中,YES酵母菌用于雌激素和抗雌激素效应测试,YAS酵母菌用于雄激素和抗雄激素效应测试。
样品准备:经固相萃取浓缩的水样、超声提取浓缩的沉积物样品、及阳性对照样品测试前需从起始浓度进行等倍梯度稀释,以便获得合适的剂量-效应曲线,稀释过程在96孔板上进行,步骤如下。YES (YAS)实验以E2(DHT)作为阳性控制,以0.2 μmol· L-1E2(2 μmol·L-1DHT)为初始浓度,甲醇为稀释剂,于96孔板上按2倍梯度依次稀释12个浓度,同时纯甲醇作为阴性对照。样品的稀释方法类似阳性控制,小瓶内的样品依次按2倍进行8个浓度梯度稀释。取10 μL稀释后的样品移至另外一个96微孔板上相应的孔内,于超净台内使甲醇挥发干。YAES (YAAS)实验以TAM(FLU)作为阳性控制和标准曲线,以2 mmol·L-1TAM(2 mmol·L-1FLU)为初始浓度,纯甲醇作为阴性对照,按照上述YES(YAS)实验的方法稀释标准品和样品后,于超净台内晾干后每个孔再加入10 μL 0.005 μmol·L-1低剂量的E2(10 μL 0.15 μmol·L-1DHT)作为诱导拮抗剂,再次晾干。稀释完毕后,将孔板密封冷藏保存,并尽快进行测试。
暴露及测试:菌液浓度培养达到要求后,按接种量约为2 mL(原培养菌液)/50 mL生长培养基(新配培养基)的比例,再加入一定体积的10 mg·mL-1的CPRG,使之最终浓度为0.1 mg·mL-1,加入200 μL混合后的培养液于已加入样品的孔内。微孔板以封口膜密封好,并以锡纸完全包好,于微孔板振荡器上1 000 r·min-1震荡2 min,使样品与酵母细胞溶液完全混合,然后置于32℃恒温箱内培养约24 h,再次震荡2 min,YES和YAS实验继续培养48 h,YAS和YAAS实验需转移至28℃继续恒温培养24 h。最终以酶标仪在620 nm和540 nm分别测定菌液浓度和CPRG底物的吸光度,测得的数据汇总后进行数据分析(见1.4)。
1.3 化学分析
采集的水样和沉积物样品分别测定了主要的水质和沉积物性质参数。水质参数有pH值、溶解氧(DO)值、生物需氧量(BOD5)、化学需氧量(COD)、总磷(TP)、总氮(TN)、氨氮(NH3-N)含量,沉积物参数有总有机碳(TOC)、TP、TN、NH3-N含量。同时还对水体和沉积物中的雌激素物质含量进行了测定,测试方法按照实验室已建立的分析方法进行[23]:水样采用HLB固相萃取,沉积物采用超声提取+硅胶柱净化的方法萃取,萃取物经五氟苄基酰氯衍生化后,以GC-MS(Gas Chromatography-Mass Spectrometer)测定辛基酚(4-t-OP)、壬基酚(4-NP)、双酚A(BPA)、雌酮(E1)、雌二醇(E2)、乙炔基雌二醇(EE2)、乙烯雌酚(DES)、三氯生(TCS)共8种雌激素物质的含量。
1.4 数据分析
1.4.1 样品的当量效应浓度计算
阳性对照或样品的激素效应与浓度符合标准的“S”型剂量-效应关系。因此,对阳性对照的吸光度值和浓度进行log-logistic方程拟合,得到相应的标准曲线,样品则根据标准曲线拟合得到的方程进行当量效应浓度计算,过程如下。
先通过吸光度计算浊度,计算公式如式1:

其中,Ax是x孔计算出的相对吸光度;Ax,540是x孔在540 nm处的绝对吸光度;Ax,620是x孔在620 nm处的绝对吸光度;A—0,620是甲醇在620 nm处的平均吸光度;A—0,540是甲醇在540 nm处的平均吸光度。上式计算可扣除由于浊度引起的吸光度的偏差,再扣除由空白引起的吸光度偏差,其结果为CPRG变色所得到的吸光度变化。
各个标准物质的曲线采用Origin 9.0软件进行log-logistic模型拟合,模型方程如式2:

其中,Amax为曲线所达到的最大值;Amin为曲线所达到的最小值;p为斜率;C为对应标准品的浓度,单位为ng·L-1或μg·L-1;EC50是50%效应浓度,单位同C。样品的当量效应浓度根据测得的吸光度值,通过式2逆运算推导得到。

表1 风险评价使用的4种激素效应阳性对照的PNEC值Table 1 PNEC values of the four reference compounds for ecological risk assessment of hormonal effects
1.4.2 生态风险评估方法
采用风险商(RQ,risk quotient)法评估地表水中4种环境激素效应的生态风险。RQ计算公式如式3:

其中,测定的环境激素效应为各效应的阳性对照当量浓度,PNEC(predicted no effect concentrations)为各效应阳性对照的预测无效应浓度。RQ<0.1为低风险;0.1≤RQ<1为中等风险;RQ≥1为高风险。
对于PNEC值,通过搜集了各阳性对照的生态毒理数据,采用评价因子(assessment factor,AF)法,并根据毒性数据类别选取合适的评价因子推导[24],即PNEC=最小NOEC/AF。其中17β-雌二醇直接使用文献中已报道的PNEC值。5α-二氢睾酮和他莫西芬的PNEC值根据生物慢性NOEC(no observed effect concentration,最大无影响浓度)数据,AF取100得到;氟他胺的PNEC值选取最小NOEC,AF取50得到。4种激素效应阳性对照的PNEC值见表1。
1.4.3 环境激素效应与环境因子的相关性分析
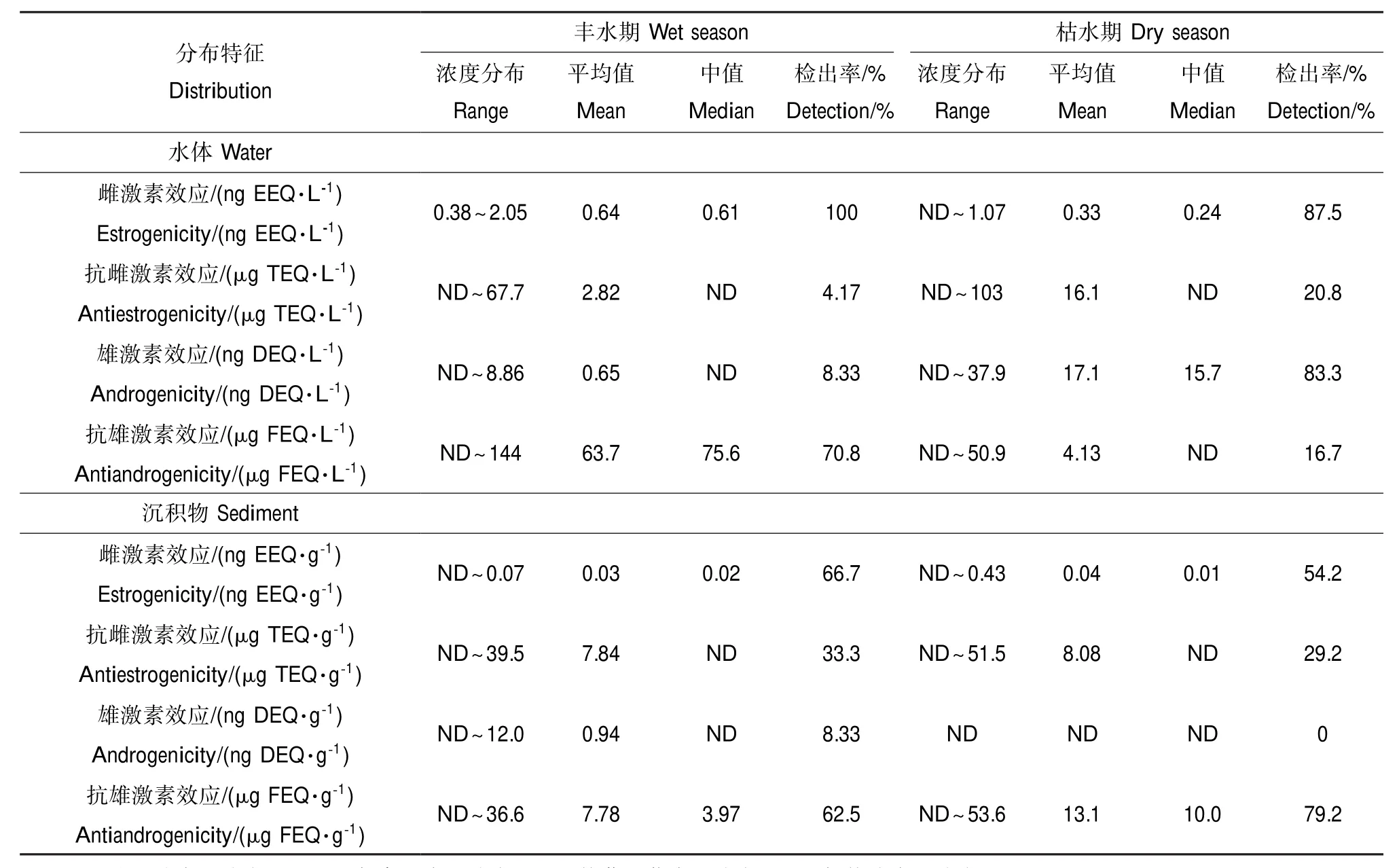
表2 长江中下游地表水和沉积物中4种环境激素效应的分布特征Table 2 Distribution of four hormonal activities in river water and sediment from the middle and lower reaches of Yangtze River
为进一步分析激素效应在环境中分布差异的原因,本研究参照文献选取了环境介质中通常关注的几种环境因子,包括常见雌激素物质的含量、水质参数和沉积物参数、以及人口数量、GDP等,将其与激素效应采用约束性排序方法(constrained ordination methods)进行统计分析:先通过降趋对应分析(detrended correspondence analysis,DCA)确定变量符合的模型(单峰还是线型模型)和对应的分析方法,本研究响应变量组为4种激素效应浓度,解释变量组为各个环境因子数据,所有原始数据均进行lg(x+1)转换,变量的显著性经过499次的蒙特卡罗(Monte Carlo)检验。结果表明,本研究沉积物和地表水中的激素效应均适合用典范对应分析(canonical correspondence analysis,CCA),通过条件检验,选取p值小于0.5,即贡献因子较大的指标绘制分析图。CCA是一种针对单峰模型的直接梯度分析方法,从统计学的角度来评价一组变量与另一组多变量数据之间的关系,并且独立保持各个变量对响应变量的贡献率。上述统计分析均在软件CANOCO 4.5中运行。

图2 长江中下游地表水和沉积物中4种激素效应季节分布
2 结果(Results)
2.1 环境激素效应的污染特征
2.1.1 环境激素效应的整体分布
离体生物测试结果显示长江中下游地区地表水和沉积物中4种环境激素效应都有不同程度的检出,其整体分布特征见表2。雌激素效应的污染最为显著,在地表水和沉积物中检出率均超过50%。水体雌激素效应在两季整体检出率为93.8%,其中丰水期高达100%,地表水丰水期和枯水期的最高浓度分别为2.05和1.07 ng EEQ·L-1;沉积物中两季整体检出率为60.4%,其中丰水期为66.7%,丰水期和枯水期最高浓度分别为0.07和0.43 ng EEQ·g-1。抗雌激素效应检出情况明显低于雌激素效应,地表水中两季的检出率均低于25%,在丰水期和枯水期最大浓度分别为67.7和103 μg TEQ·L-1,沉积物中在两季的检出率略高于水体,但都低于34%,在丰水期和枯水期最大浓度分别为39.6和51.5 μg TEQ·g-1。
雄激素效应在地表水中枯水期检出率为83%,显著高于丰水期(8%),在丰水期和枯水期最大浓度分别为8.86和37.9 ng DEQ·L-1,沉积物中雄激素效应在枯水期未检出,在丰水期中检出率仅为8%,最大浓度为12.0 ng DEQ·g-1。抗雄激素效应除地表水枯水期检出率为17%以外,地表水丰水期和沉积物两季的检出率都处于60%~80%,地表水丰水期和枯水期的最高浓度分别为144和50.9 μg FEQ· L-1,沉积物丰水期和枯水期的最高浓度分别为36.6和53.6 μg FEQ·g-1。
2.1.2 环境激素效应的空间分布和季节变化
4种环境激素效应在长江中下游24个采样点位的空间分布和季节变化如图2所示。对于检出频率最高的雌激素效应,地表水中丰水期浓度整体上高于枯水期浓度,丰水期平均浓度(0.64 ng EEQ· L-1)约为枯水期平均浓度(0.33 ng EEQ·L-1)的2倍左右(图2a)。从空间分布来看,中部地区的采样点位(C7~C18)雌激素效应浓度较高,其中最高点位于丰水期的C13点位(鄱阳湖口处)。沉积物中两季的平均浓度则差异不大(丰水期和枯水期分别为0.03和0.04 ng EEQ·g-1),但有些在丰水期没有检出的点位在枯水期时有检出,且浓度超过0.1 ng EEQ·g-1,如C8~C9武汉段、C12~C13九江段(图2b)。对于抗雌激素效应,虽在水体环境中检出率不高,但两季水体中均可在武汉市及周边采样点(C7~C8)检测到,如武汉东湖(C8)水体枯水期浓度达81.6 μg TEQ· L-1,鄱阳湖口处(C13)也出现区域性高值,叶家洲附近(C10)地表水枯水期最高浓度达到103 μg TEQ· L-1(图2c)。而沉积物污染则分布较零散,检出点位多位于湖北境内,丰水期和枯水期平均浓度分别为7.84和8.08 μg TEQ·g-1,季节性差异不大(图2d)。
对于雄激素效应,多数点位的效应强度较弱,或基本未检出,但地表水中枯水期的污染程度明显较高(图2e),平均浓度达到17.1 ng DEQ·L-1,而丰水期仅武汉东湖(C8)和汉江口处(C9)检出雄激素效应,平均浓度仅为0.65 ng DEQ·L-1。沉积物中两季仅在丰水期的南通(C22)和上海市靠近入海口处(C23)检出雄激素效应,浓度分别为12.0和10.7 ng DEQ· g-1(图2f)。抗雄激素效应在地表水中的检出率与雄激素效应差别不大,但在沉积物中则明显大于雄激素效应,抗雄激素效应两季的效应强度也具有较大差异:地表水枯水期中平均浓度为4.13 μg FEQ· L-1,丰水期却高达63.7 μg FEQ·L-1(图2g),约高出14倍。沉积物中抗雄激素的季节变化则相对较小,但整个采样区域的两季样品中均可零散检测出该效应,丰水期和枯水期的平均浓度分别为7.78和13.1 μg FEQ·g-1(图2h)。
2.2 环境激素效应的影响因素
水环境是城市和农村面源污染物的重要“汇”,河流中的环境激素物质主要来源于城市和农村人口排放的生活污水、养殖场禽畜排放的废水[2,14],因此其环境激素效应可能与研究区域内的人口数量(Pop)、当地经济状况(即国内生产总值GDP)、生活污水排放量等密切相关。本研究搜集了三类环境因子,包括:(1)各采样点位所处区域的Pop、GDP的基础数据,其中因武汉市范围内有4个点位分布,东湖C8点处于武汉市中心,其范围与其他3个点位有重复,为方便人口数量的统计,C8点不纳入统计范围;(2)与水体和沉积物相关的环境参数(TN、TP、NH3-N、水体的pH、DO、COD、BOD5及沉积物的TOC);(3)代表性的环境激素物质含量(E1、E2、EE2、4-NP、4-OP、BPA、DES、TCS)。然后选取这些环境因子与4种激素效应的关系进行统计分析,筛选相关性较强(p<0.5)的环境因子绘图,如图3所示。
通过CCA统计分析发现,环境中的激素效应浓度与多个环境指标具有相关性。地表水相关分析图中第一、第二轴的特征值分别为0.722和0.147,共解释了激素效应数据组累计方差值的86.9%。环境激素效应中检出较多的雌激素、抗雄激素效应,与该地区基质中总磷含量的指标以及4-NP和TCS的含量呈正相关,同时当地的人口数量和GDP也是影响这2种激素效应的重要因子,随着人口数量的增加和GDP的增长,激素物质排放量将逐渐增加,出现激素效应的风险亦随之增加,而DO、COD、TN等化学指标与这2种激素效应却呈现较弱的相关性。可以看出,这2类检出较多的激素效应存在一些共同影响因素。
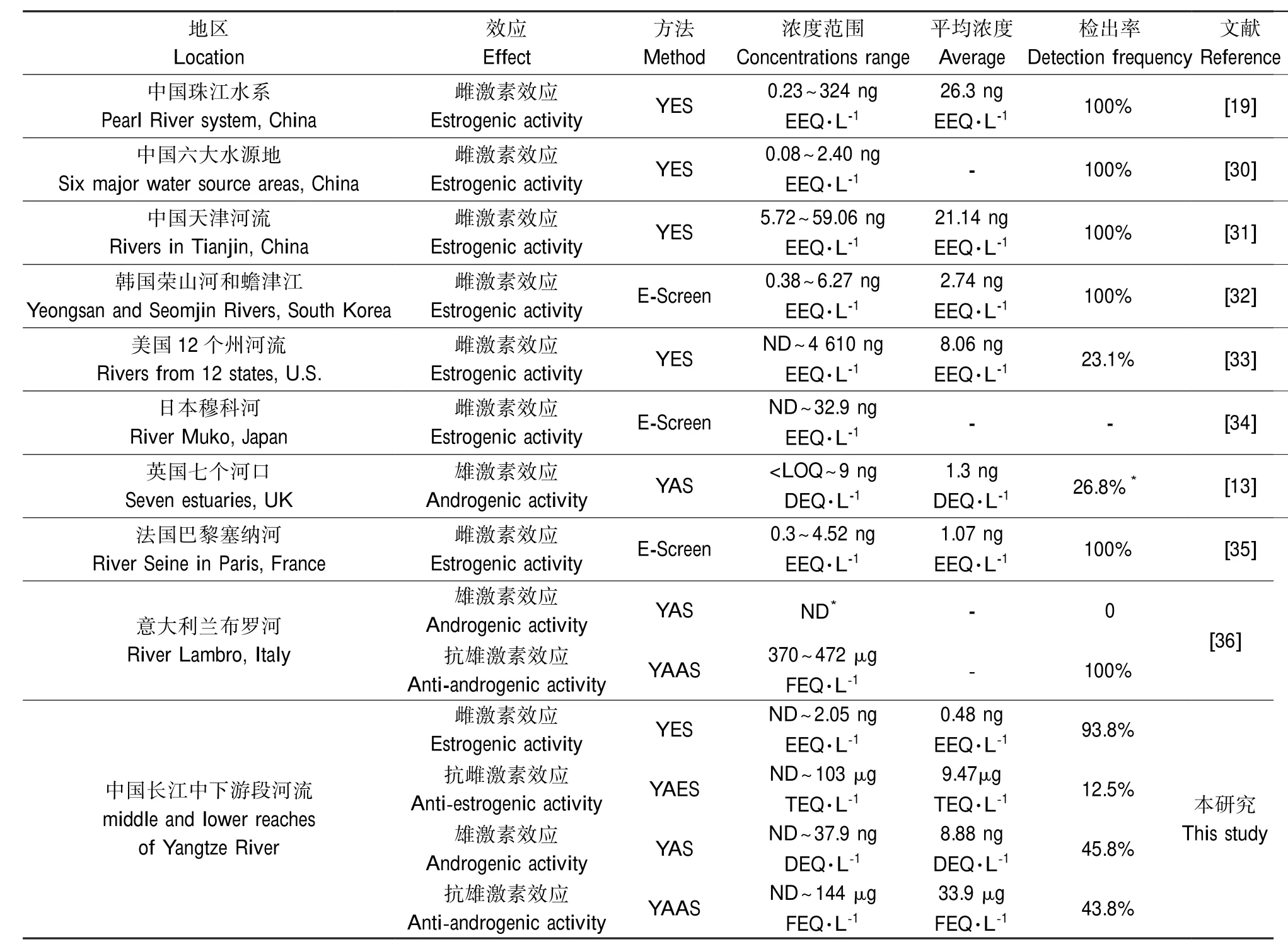
表3 与其他地区水环境中激素效应的污染情况比较Table 3 Summarized data of hormonal activities in water environment reported in different countries and regions
与地表水不同,沉积物的相关分析表明上述水体中影响环境激素效应的因子不足以影响4种激素效应的强度。相应地,沉积物中2个特征轴(0.246和0.059)解释的变量累计方差较小,仅为30.5%,可能是由于存在其他相关的未知因子未列入统计范围所致。从各变量分布看,YAAS与Pop和GDP有一定的相关性,表明人为排放对抗雄激素效应有重要影响;YAES与DES、4-NP、TN、TOC等多种化合物含量相关性较强,这些可能引起激素效应的化合物含量对激素效应的贡献较大,而与之相比,YAS和YES与各环境因子的相关性则较弱,可能与纳入分析的环境因子有限有关。
3 讨论(Discussion)
3.1 长江环境激素效应的污染趋势及与其他地区比较
4种激素效应在我国长江中下游地表水和沉积物中均有不同程度的检出,其中雌激素效应检出率在2种介质中均较高,都大于60%(表2),最高效应强度在地表水和沉积物中分别达到2.05 ng EEQ· L-1和0.43 ng EEQ·g-1,表明长江中下游的雌激素效应污染较为普遍,需引起足够的重视。目前,国内外学者对环境中的雌激素效应研究较多(表3)。本研究中,长江中下游的雌激素效应浓度范围为ND~2.05 ng EEQ·L-1,与Jiang等[30]对我国松花江、淮河、辽河、珠江等水源地的雌激素活性监测结果(0.08~2.40 ng EEQ·L-1)较为接近,但明显低于天津河流的浓度[31],最大值也明显低于珠江水系报道的最大值[17]。与国外的研究相比,长江中下游的雌激素活性水平与法国和意大利的河流较为接近[35,36],但明显低于美国、韩国和日本报道的河流中的雌激素活性水平[32-34]。其他几种环境激素效应的研究较少,英国河流中报道的雄激素活性水平为几个ng DEQ ·L-1,意大利的河流中报道的抗雄激素活性水平为数百μg FEQ·L-1[36],这些研究结果与本研究结果接近。此外,对于沉积物中的环境激素效应,德国Galluba等[37]调查了海塞州河流中沉积物的雌激素和雄激素效应污染情况,其检出率分别为66%和68%,平均浓度分别为7.78 ng EEQ·kg-1和32.0 ng TEQ· kg-1(TEQ:testosterone equivalents,睾酮当量活性),高于长江中下游沉积物中的雌激素效应水平。
河流是多种污染源的重要受纳环境。有报道指出我国长江多个沿江城市,如南京、武汉等地污水处理厂最终出水中也可检出雌激素效应污染[38-39],这些生活污水最终排放到长江支流或干流,导致太湖、淮河、长江下游段也不同程度检出激素效应[40],因此城市排放的生活污水可能是长江水环境中雌激素效应的重要污染源,这与统计分析结果显示人口数量与雌激素效应具有很强的相关性是一致的(图3)。本研究还发现长江九江段附近区域(C12~C13)也具有较高的雌激素效应,可能由于该区域地处江西省禽畜和水产养殖渔业密集区,禽畜、水产养殖业等排放的废水中也含有大量雌激素物质,从而易出现区域性雌激素效应污染[41]。此外,季节性变化也导致各地区的环境激素效应产生一定的差异,如雌激素效应在丰水期总体高于枯水期(图2a),可能由于丰水期地表径流量大,城市面源排放的雌激素类污染物易随地表径流进入长江水体。相对而言,抗雌激素、雄激素效应和抗雄激素效应在国内外的研究相对较少。已有的研究表明雄激素效应也可能与城市污水处理厂、畜禽养殖场、以及水产养殖废水排放有关,特别是造纸厂废水中发现大量雄激素物质,是受纳环境中雄激素效应的重要来源[41]。抗雄激素活性在长江流域水体和沉积物2种环境介质中的检出率也较高,统计结果显示与人口数据等环境因子相关(图3)。
总的来说,长江干流的环境激素效应与其他地区相比处于中等偏下水平。但长江是我国第一大河,长江中下游干流靠近入海处水流量在丰水期和枯水期可分别高达41 400和13 000 m3·s-1[42],其入海雌激素效应排放通量在丰水期和枯水期分别达到2.4×10-2kg EEQ·s-1和1.3×10-3kg EEQ·s-1,大于珠江广州段的入海通量(丰水期和枯水期分别为8.7× 10-3kg EEQ·s-1和3.0×10-4kg EEQ·s-1)[25]和黄河的入海通量(<1×10-4kg EEQ·s-1)[11]。且随着长江中下游区域城市经济的快速发展,人口数量也逐渐增加,生活污水排放量逐年增加,使得长江干流环境激素效应污染态势有加重趋势,亟待关注和采取相关控制手段。
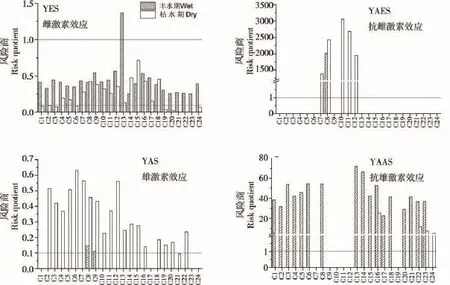
图4 长江中下游流域环境激素效应的生态风险
3.2 水体中环境激素效应的生态风险
根据RQ风险商评价法评估了我国长江中下游地区水体环境中两季环境激素效应的生态风险水平,如图4所示。生态风险评价结果表明长江流域雌激素效应风险多数处于中等风险水平(RQ<0.8),仅鄱阳湖口(C13)为高风险,该区域可能是由于周边生活污染的汇入有关,虽然鄱阳湖汇入长江后雌激素风险由于上游来水稀释作用而降低,但应加大污染区域的生活污水排放控制力度。长江流域雄激素效应的RQ值都低于1,大部分在0.1~1,表明雄激素效应的生态风险为中等。抗雌激素效应和抗雄激素效应虽检出率不高,但在检出点位均为高风险,可能对河流水体中的生物产生内分泌干扰效应。不过,由于目前对于抗雌激素和抗雄激素这类内分泌干扰物对生物体往往表现为生殖繁殖障碍,尚无法推导抗激素对生殖繁殖系统影响的阈值,因此本研究单纯用RQ风险商评价法得出的高风险结论只能作为指示和参考,亟待借助更多毒理学实验手段探索抗雌激素和抗雄激素这类物质对生殖系统障碍的影响,以便更全面进行生态风险评价。总体来说,通过环境激素效应的生态风险评价,有助于我们认识长江中下游区域的环境激素效的污染态势,为环境管理部门采取应对措施提供依据。
致谢:感谢中国地质大学(武汉)祁士华教授、江苏省农业科学院刘贤金研究员和余向阳研究员在样品采集过程中给予的帮助。
(References):
[1] Diamanti K E,Bourguignon J P,Giudice L C,et al.Endocrine-disrupting chemicals:An endocrine society scientific statement[J].Endocrine Reviews,2009,30(4):293-342
[2] Auriol M,Filali-Meknassi Y,Tyagi R D,et al.Endocrine disrupting compounds removal from wastewater,a new challenge[J].Process Biochemistry,2006,41(3):525-539
[3] Goksoyr A.Endocrine disruptors in the marine environment:Mechanisms of toxicity and their influence on reproductive processes in fish[J].Journal of Toxicology and Environmental Health,Part A,2006,69(1-2):175-184
[4] Jobling S,Nolan M,Tyler C R,et al.Widespread sexual disruption in wild fish[J].Environmental Science and Technology,1998,32(17):2498-2506
[5] Van A R,Nolan T M,Jobling S,et al.Sexual disruption in a second species of wild cyprinid fish(the gudgeon, Gobio gobio)in United Kingdom freshwaters[J].Environmental Toxicology and Chemistry,2001,20(12):2841-2847
[6] Cutolo M,Brizzolara R,Atzeni F.The immunomodulatory effects of estrogens[J].Annals of the New York Academy of Sciences,2010,1193(1):36-42
[7] Vajda A M,Barber L B,Gray J L,et al.Demasculinization of male fish by wastewater treatment plant effluent [J].Aquatic Toxicology,2011,103(3-4):213-221
[8] 王祥川,孙彬,陈桂来,等.环境激素的毒害效应及其表观遗传机制[J].国际生殖健康/计划生育杂志,2011, 30(3):243-246
Wang X C,Sun B,Chen G L,et al.Adverse effects of environmental hormones and epigenetics[J].Journal of International Reproductive Health/Family Planning,2011, 30(3):243-246(in Chinese)
[9] Campbell C G,Borglin S E,Green F B,et al.Biologically directed environmental monitoring,fate,and transport of estrogenic endocrine disrupting compounds in water:A review[J].Chemosphere,2006,65(8):1265-1280
[10] Vermeirssen E L,Suter M J,Burkhardt H P.Estrogenicity patterns in the Swiss midland river Lutzelmurg in relation to treated domestic sewage effluent discharges and hydrology[J].Environmental Toxicology and Chemistry, 2006,25(9):2413-2422
[11] Wang L,Ying G G,Chen F,et al.Monitoring of selected estrogenic compounds and estrogenic activity in surface water and sediment of the Yellow River in China using combined chemical and biological tools[J].Environmental Pollution,2012,165:241-249
[12] 刘芸,李娜,马梅,等.酚类化合物雌激素效应的比较研究[J].中国环境科学,2009,29(8):873-878
Liu Y,Li N,Ma M,et al.Comparative study of phenolic compounds estrogenic and anti-estrogenic activities[J]. China Environmental Science,2009,29(8):873-878(in Chinese)
[13] Thomas K V,Hurst M R,Matthiessen P,et al.An assessment of in vitro androgenic activity and the identification of environmental androgens in United Kingdom estuaries [J].Environmental Toxicology and Chemistry,2002,21 (7):1456-1461
[14] Svenson A,Allard A S.Occurrence andsome properties of the androgenic activity in municipal sewage effluents [J].Journal of Environmental Science and Health,2004, 39(3):693-701
[15] Hill E M,Evans K L,Horwood J,et al.Profiles and some initial identifications of(anti)androgenic compounds in fish exposed to wastewater treatment works effluents[J]. Environmental Science and Technology,2010,44(3): 1137-1143
[16] Gerlach T,Knaust J,Kaiser C,et al.Development and assessment of a novelArxula adeninivoransandrogen screen(A-YAS)assay and its application in analysis of cattle urine[J].Science of the Total Environment,2014, 490:1073-1081
[17] Soto A M,Calabro J M,Prechtl N V,et al.Androgenic and estrogenic activity in water bodies receiving cattle feedlot effluent in eastern Nebraska,USA[J].2004,11(3): 346-352
[18] Milla S,Depiereux S,Kestemont P.The effects of estrogenic and androgenic endocrine disruptors on the immune system of fish:A review[J].Ecotoxicology,2011,20(2): 305-319
[19] Zhao J L,Ying G G,Yang B,et al.Screening of multiple hormonal activities in surface water and sediment from the Pearl River system,South China,using effect-directed in vitro bioassays[J].Environmental Toxicology and Chemistry,2011,30(10):2208-2215
[20] Nie M H,Yan C X,Dong W B,et al.Occurrence,distribution and risk assessment of estrogens in surface water, suspended particulate matter,and sediments of the Yangtze Estuary[J].Chemosphere,2015,127:109-116
[21] Nie M H,Yang Y,Liu M,et al.Environmental estrogens in a drinking water reservoir area in Shanghai:Occurrence,colloidal contribution and risk assessment[J].Science of the Total Environment,2014,487:785-791
[22] Routledge E J,Sumpter J P.Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen[J].Environmental Toxicology and Chemistry,1996,15(3):241-248
[23] Zhao J L,Ying G G,Wang L,et al.Determination of phenolic endocrine disrupting chemicals and acidic pharmaceuticals in surface water of the Pearl Rivers in South China by gas chromatography-negative chemical ionization-mass spectrometry[J].Science of the Total Environment,2009,407:962-974
[24] 赵建亮,应光国,魏东斌,等.水体和沉积物中毒害污染物的生态风险评价方法体系研究进展[J].生态毒理学报,2011,6(6):577-588
Zhao J L,Ying G G,Wei D B,et al.Ecological risk assessment methodology of toxic pollutants in surface water and sediments:A review[J].Asian Journal of Ecotoxicology,2011,6(6):577-588(in Chinese)
[25] Zhao J L,Ying G G,Chen F,et al.Estrogenic activityprofiles and risks in surface waters and sediments of the Pearl River system in South China assessed by chemical analysis and in vitro bioassay[J].Journal of Environmental Monitoring,2011,13(4):813-821
[26] Panter G H,Hutchinson T H,Hurd K S,et al.Successful detection of(anti-)androgenic and aromatase inhibitors in pre-spawningadultfatheadminnows(Pimephales promelas)using easily measured endpoints of sexual development[J].Aquatic Toxicology,2004,70(1):11-21
[27] Williams T D,Caunter J E,Lillicrap A D,et al.Evaluation of the reproductive effects of tamoxifen citrate in partial and full life-cycle studies using fathead minnows (Pimephales promelas)[J].Environmental Toxicology and Chemistry,2007,26(4):695-707
[28] Sebire M,Allen Y,Bersuder P,et al.The model anti-androgen flutamide suppresses the expression of typical male stickleback reproductive behaviour[J].Aquatic Toxicology,2008,90(1):37-47
[29] Haeba1 M H,Hilscherová K,Mazurová E,et al.Selected endocrine disrupting compounds(vinclozolin,flutamide, ketoconazole and dicofol):Effects on survival,occurrence of males,growth,molting and reproduction ofDaphnia magna[J].Environmental Science and Pollution Research, 2008,15(3):222-227
[30] Jiang W W,Yan Y,Ma M,et al.Assessment of source water contamination by estrogenic disrupting compounds in China[J].Journal of Environmental Sciences,2012,24 (2):320-328
[31] Rao K F,Lei B L,Li N.et al.Determination of estrogens and estrogenic activities in water from three rivers in Tianjin,China[J].Journal of Environmental Sciences, 2013,25(6):1164-1171
[32] Ra J S,Lee S H,Lee J,et al.Occurrence of estrogenic chemicals in South Korean surface waters and municipal wastewaters[J].Journal of Environmental Monitoring, 2011,13(1):101-109
[33] Alvarez D A,Shappell N W,Billey L O,et al.Bioassay of estrogenicity and chemical analyses of estrogens in streams across the United States associated with livestock operations[J].Water Research,2013,47(10):3347-3363
[34] Sumiko M,Misa K,Sachi K,et al.Determination of estrogenic substances in the water of Muko River using in vitro assays,and the degradation of natrural estrogens by aquatic bacteria[J].Journal of Health Science,2005,51 (2):178-184
[35] Cargouёt M,Perdiz D,Mouatassim-Souali A,et al.Assessment of river contamination by estrogenic compounds in Paris area(France)[J].Science of the Total Environment,2004,324(1-3):55-66
[36] Ralph U,Anne V C,Silvia M,et al.Androgenic and antiandrogenic activities in water and sediment samples from the river Lambro,Italy,detected by yeast androgen screen and chemical analyses[J].Chemophere,2007,67:1080-1087
[37] Galluba S,Oehlmann J.Widespread endocrine activity in river sediments in Hesse,Germany,assessed by a combination of in vitro and in vivo bioassays[J].Journal of Soils and Sediments,2012,12(2):252-264
[38] Lu G H,Zhang H Z,Wang C.Assessment of estrogenic activity conducted by combining bioassay and chemical analyses of the effluent from wastewater treatment plants in Nanjing,China[J].Environmental Toxicology and Chemistry,2010,29(6):1279-1286
[39] Jin S W,Yang F X,Liao T,et al.Seasonal variations of estrogenic compounds and their estrogenicities in influent and effluent from a municipal sewage treatment plant in China[J].Environmental Toxicology and Chemistry, 2008,27(1):146-153
[40] Hu X X,Shi W,Cao F,et al.Bioanalytical and instrumental analysis of estrogenic activities in drinking water sources from Yangtze River Delta[J].Chemosphere, 2013,90:2123-2128
[41] 韩伟,李艳霞,杨明,等.环境雄激素的危害、来源与环境行为[J].生态学报,2010,30(6):1594-1603
Han W,Li Y X,Yang M,et al.Effects,sources and behaviors of environmental androgens[J].Acta Ecologica Sinica,2010,30(6):1594-1603(in Chinese)
[42] Liu W R,Zhao J L,Liu Y S,et al.Biocides in the Yangtze River of China:Spatiotemporal distribution,mass load and risk assessment[J].Environmental Pollution, 2015,200:53-63◆
Occurrence and Ecological Risks of Hormonal Activities in the Middle and Lower Reaches of Yangtze River
Chen Xiaowen1,2,Zhao Jianliang1,*,Liu Yousheng1,Jiang Yuxia1,2,Yang Yuanyuan1,2,Ying Guangguo1,#
1.State Key Laboratory of Organic Geochemistry,Guangzhou Institute of Geochemistry,Chinese Academy of Sciences,Guangzhou 510640,China
2.University of Chinese Academy of Sciences,Beijing 100049,China
16 June 2015 accepted 17 August 2015
Discharge of domestic sewage and livestock wastewater results in the pollution of endocrine disrupting chemicals in the aquatic environment,which may cause adverse effects on aquatic organisms.This study aimed to evaluate four kinds of environmental hormone effects including estrogenic activity,anti-estrogenic activity,andro-genic activity and anti-androgenic activity in surface water and sediment of the middle and lower reaches of the Yangtze River during different seasons by using recombinant yeast screening assays.The results showed widespread detection of estrogenic activity in the river,with the detection frequencies higher than 50%in both surface water and sediment.The highest estrogenic activity was up to 2.05 ng·L-1estradiol equivalents(EEQ)in surface water and 0.43 ng EEQ·g-1in sediment.In contrast,the detection frequencies of the other three hormonal activities were generally lower than that of estrogen activity in the river.The overall detection frequencies of those three hormonal activities ranked as follows:anti-androgenic activity>androgenic activity>anti-estrogenic activity,with the maximum detected concentrations of 144 μg·L-1flutamide equivalents(FEQ),37.9 ng·L-1dihydrotestosterone equivalents(DEQ)and 103 μg·L-1tamoxifen equivalents(TEQ)in surface water,and 53.6 μg FEQ·g-1,12.0 ng DEQ·g-1and 51.5 μg TEQ·g-1in sediments.Seasonal variations were observed for the four hormonal activities in surface water.Sites with relatively higher estrogenic activity were located at Wuhan,Nanjing-Wuhu sections and the outlet of Poyang Lake.However no obvious regional differences were observed for the other three hormonal activities.The hormonal activities in the river were positively correlated to the general environmental parameters such as local population,organic matter,and ammonia nitrogen,suggesting that environmental hormones are mainly originated from the wastewater discharge due to human activities.A preliminary risk assessment showed a high estrogenic risk level at the site of Poyang Lake,with medium risk levels in the rest sites.For the all study sites,no high androgenic risks were found in surface water.The results of this study provide better understanding of the pollution characteristics of those chemicals with hormonal activities in the middle and lower reaches of Yangtze River, which can help take proper control measures.
hormonal activities;estrogenic activity;Yangtze River;endocrine disruption;ecological risk assessment
2015-06-16 录用日期:2015-08-17
1673-5897(2016)3-191-13
X171.5
A
10.7524/AJE.1673-5897.20150616001
简介:赵建亮(1979—),男,环境科学博士,副研究员,主要研究方向新型污染物化学及其生态毒理,发表学术论文70余篇。
应光国(1964—),男,环境科学博士,研究员,主要研究方向为新型环境污染物化学、污染物生态毒理、水质提高技术、以及流域污染与风险管控技术的研究,发表学术论文150余篇。
国家水体污染控制与治理科技重大专项(2014ZX07206-005);广州市环保局污染防治新技术新工艺开发项目
陈晓雯(1991-),女,硕士,研究方向为环境新型有机污染物的生态毒理学效应,E-mail:chen_xiaowen@foxmail.com;
*通讯作者(Corresponding author),E-mail:zhaojianliang@gig.ac.cn
#共同通讯作者(Co-corresponding author),E-mail:guang-guo.ying@gig.ac.cn

