重金属Cd、Pb对褐菖鲉肝脏组织中HSPs基因表达的影响
陈晔,陈荣,*,莫正平
厦门大学环境与生态学院,近海海洋环境科学国家重点实验室,厦门361102
重金属Cd、Pb对褐菖鲉肝脏组织中HSPs基因表达的影响
陈晔1,陈荣1,*,莫正平1
厦门大学环境与生态学院,近海海洋环境科学国家重点实验室,厦门361102
为了解重金属污染对海洋鱼类热休克蛋白(HSPs)基因表达的影响,将褐菖鲉(Sebastiscus marmoratus)分别暴露于1.6、8、40、200、500 μg·L-1Cd、Pb溶液中,用环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)定量检测褐菖鲉肝脏HSP60、HSP70、HSP90、HSC70 mRNA表达量。结果表明:Pb仅在40 μg·L-1时显著抑制HSP60、HSP90、HSC70 mRNA表达量,8 μg·L-1时即可显著抑制HSP70 mRNA表达量,并在40 μg·L-1时达到最小值;Cd对HSP60、HSP90、HSC70的诱导不明显,但能显著诱导HSP70,并在500 μg·L-1时达到最大值。相比之下,褐菖鲉肝HSP70基因对重金属Cd、Pb污染较为敏感,有潜力成为监测海洋重金属污染的预警分子。
Cd;Pb;褐菖鲉;肝脏;热休克蛋白;HSPs;环介导等温扩增
陈晔,陈荣,莫正平.重金属Cd、Pb对褐菖鲉肝脏组织中HSPs基因表达的影响[J].生态毒理学报,2016,11(3):124-130
Chen Y,Chen R,Mo Z P.The effects of Cd and Pb on the levels of hepatic HSPs mRNA inSebastiscus marmoratus[J].Asian Journal of Ecotoxicology, 2016,11(3):124-130(in Chinese)
近些年来,我国海洋经济发展迅速,海洋环境问题凸显,其中海洋重金属污染问题已经引起各界的高度关注。国家环保部的一项调查显示,我国近岸海域的海水采集样品中,铅的超标率高达62.9%,最大值超第一类海水标准49倍,镉的超标率为25.9%。并且,我国重金属排海量较大且呈逐年上升趋势[1]。污染物的危害主要体现为对生物体的毒害作用,因此,利用生物体内毒性伤害状况监测其所处的环境,可对污染总体效应进行直观、综合的评价[2]。
研究表明,在嗅觉器官中,镉的蓄积比其他器官要高得多,并且抑制了血浆皮质醇浓度的升高。显然,水环境中的镉破坏了鱼群对示警物质的正常行为和生理反应,改变了鱼群的回避策略[3]。镉离子也可以直接进入脑组织而发生影响,造成脑机能障碍,特别造成小脑机能障碍,使中毒鱼失去平衡,引起侧翻,甚至沉入水底[4]。铅是一种神经毒性物质,能通过各种途径进入水生生态系统中,造成许多生物体包括鱼类的行为产生改变。在铅的毒性作用下,鱼类活动过度兴奋,游泳行为出现异常或出现环绕游动的不稳定反应[5]。但也有研究发现,铅中毒后鱼类的活动下降。铅也会影响鱼类的摄食行为使鱼类的捕食能力下降,主要影响的方面是降低捕食的时间、增加捕食失误的次数[6]。铅还会干扰鱼类对有害刺激的反应能力,如降低其对电击的躲避行为[7]。
1962年,Ritossa[8]首先在果蝇(Drosophila melanogaster)中发现HSPs,进一步的研究发现,从原核细胞到高等真核细胞的整个生物界中,都普遍存在着HSPs,热休克基因家族是迄今为止发现的最为保守的家族[9]。后来Tisseres证实,热休克反应中合成的是一组特殊蛋白质,命名为热休克蛋白[10]。热休克蛋白分为4个家族:HSP90家族(分子量为83~90 kDa)、HSP70家族(分子量为66~78 kDa)、HSP60家族以及小分子量的HSPs家族(12~43 kDa)。HSC70是HSP70家族中组成型的基因,主要参与蛋白质的折叠、解折叠和组配[11],并且能被外界刺激所诱导[12]。
目前对鱼类HSPs的研究主要集中在分子克隆、组织表达方面,而涉及功能基因组学和HSPs表达变化的研究相对较少[13]。Airaksinen等[14]比较了斑马鱼(Danio rerio)在热胁迫下的表达差异,发现在热胁迫条件下,HSP70呈显著升高。此外,国外一些科学家还进行了水域热污染的研究,而我国对鱼类HSPs的研究起步较晚,有关污染胁迫对鱼体HSPs的影响研究较少。盛连喜等[15]发现鲤鱼(Cyprinus carpio)HSP70的合成和温度总体呈正相关关系。周鑫等[16]的研究表明,高浓度的亚硝酸盐暴露后,草鱼(Ctenopharyngodon idellus)HSP90的表达显著上调。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术是Notomi等[17]建立的一种新颖的核酸扩增技术,具有高特异性、高效率、便捷等特点,在等温条件下即可高效、快速地完成扩增反应,可用于现场的快速检测。自2000年开发以来,LAMP技术已广泛应用于细菌、病毒、寄生虫等病原体的定性检测及动物胚胎性别的鉴定[18-20]。本文将LAMP技术引入海洋环境监测领域,研究不同浓度的重金属Cd、Pb污染后褐菖鲉肝HSPs mRNA的表达量,从而为探索HSPs基因的生物功能以及其作为生物标志物监测海洋重金属污染的可行性研究提供依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
主要仪器:净化工作台(SW-CJ-1FD,苏州净化设备工程有限公司),恒温金属浴(CHB-A4-9602,杭州博日科技有限公司),NanoDrop 2000 Spectrophotometer(Thermo Fisher公司),LA-320C实时浊度仪(北京蓝谱生物科技有限公司,精度±2%),PCR仪(Bioer Serves Life公司),5415R型冷冻离心机(Eppendorf公司)。
主要试剂:Bst DNA聚合酶(NEB公司),琼脂糖(西班牙Biowest公司),MgCl2(Sigma公司),betaine (Bio Basic公司),SYBR Green qPCR Mix(厦门鹭隆生物科技有限公司),dNTP和DS2000 DNA Marker (东盛生物公司),Tris和EDTA(上海生物工程公司),CdCl2和PbCl2均为国产分析纯(Alfaaesar公司)。
1.2 实验动物
褐菖鲉购自厦门市第八市场,平均体长(11.7± 1.2)cm,平均体重(24.79±5.8)g,雌雄不拘,先在清洁沙滤海水中暂养7 d,选取活力好的个体进行污染实验。实验过程中如有个体死亡,减少缸内水量确保每只个体占据水体积2 L。
1.3 实验方法
1.3.1 暴露实验
实验前,褐菖鲉先在清洁沙滤海水中暂养,驯养期间水温严格控制在17~20℃,盐度22‰~27‰,选取活力好的个体进行污染实验。将褐菖鲉暴露于不同浓度重金属(Cd、Pb)溶液中(实验浓度见表1)。每浓度组10条鱼,每组设2个平行,对照组50 L沙滤海水不含Cd、Pb。用充气机连续进行充气,并喂以人工饵料,每天采用静态半置换法更新相应浓度的含Cd、Pb海水溶液的50%。暴露5 d后取样,将鱼击昏,迅速剖取肝脏,冰上采集后置于-80℃冰箱中保存至使用。
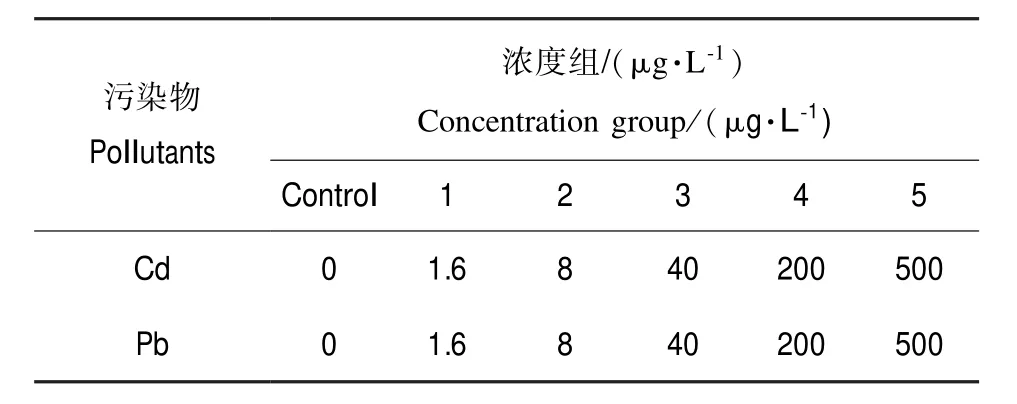
表1 污染物种类与浓度Table 1 Contaminant type and concentration
1.3.2 RNA提取及反转录
总RNA提取参照TaKaRa公司所提供的RNAiso Plus说明书进行,得到的RNA加入适量DEPC水使其浓度均为1000 ng·μL-1;反转录按照Thermo公司提供的ReverAid First Strand cDNA Synthesis Kit使用说明书进行,产物cDNA稀释5倍,保存于-20℃冰箱待用。
1.3.3 LAMP引物设计
根据褐菖鲉HSP60基因(GeneBank序列号JX185808)、HSP70基因(GeneBank序列号JX185809)、HSP90基因(GeneBank序列号JX255674)和HSC70基因(GeneBank序列号JX255673)序列,利用在线引物设计软件(http://primerexplorer.jp/elamp4.0.0/index.html)设计LAMP特异引物:FIP、BIP、F3和B3(表2)。
1.3.4 LAMP测定
LAMP反应体系的设定参照Notomi等[17]的方法。总体积25 μL,经优化后体系内各试剂含量为:0.4 mol·L-1Betaine,8 mmol·L-1Mg2+,1.4 mmol·L-1dNTPs,2.4 μmol·L-1内引物,0.4 μmol·L-1外引物,1 ×ThermoPol Reaction Buffer,8 U Bst DNA聚合酶,2 μL模板DNA,5 μL dd H2O。反应的温度为64℃。反应过程产生焦磷酸镁乳白色沉淀的含量与DNA含量成正比,可利用浊度仪进行定量检测。

表2 LAMP引物序列Table 2 Primers sequence of LAMP
LAMP标准曲线的测定:以F3和B3(表2)为引物进行PCR反应,利用琼脂糖凝胶电泳回收PCR产物,即可得到LAMP反应的DNA标准品,利用NanoDrop 2000分光光度计测定其DNA浓度,根据公式计算拷贝数:
其中质量,DNA标准品的质量浓度,ng·μL-1;分子量,DNA标准品的平均分子量=碱基数×660道尔顿/碱基,g·mol-1;阿伏伽德罗常数,copies·mol-1。
10倍稀释标准品,配制25 μL体系标准系列。利用LA-320C实时浊度仪测定。实时浊度仪每6 s自动测定一次浊度,以浊度达到0.1时作为阳性判定标准,记录反应所需时间。制作标准曲线。
Cd、Pb暴露5 d后,每个浓度组取6尾鱼,解剖后取肝脏约0.1 g,提取总RNA,反转录得到样品cDNA。采用优化后的LAMP反应体系与反应时间,用LA-320C实时浊度仪实时检测。根据定量LAMP标准曲线换算得出样品中HSPs(HSP60、HSP70、HSC70、HSP90)mRNA扩增拷贝数。
1.4 数据统计分析
LAMP检测结果采用Microsoft Excel和SPSS 17.0软件处理,采用单因素方差分析(One-Way ANOVA),并用Origin 8.0软件绘图。所有结果均用6个平行样的平均值±标准误差表示,实验组与对照组间数据的比较采用单尾t检验分析显著性差异。P<0.05为显著差异;P<0.01为极显著差异。
2 结果(Results)
2.1 重金属Cd、Pb影响HSP60基因表达的剂量-效应关系
由图1可见,Cd污染对褐菖鲉肝HSP60 mRNA含量基本无影响,虽然随着Cd浓度的升高HSP60 mRNA含量有缓慢上升趋势,但各组与对照组均无显著性差异。Pb污染下褐菖鲉肝HSP60 mRNA含量仅在40 μg ·L-1浓度组时有显著性抑制,约为对照组的0.05倍。其他浓度组与对照组之间无显著性差异。
2.2 重金属Cd、Pb影响HSP70基因表达的剂量-效应关系
由图2可见,8 μg·L-1Cd即可显著诱导褐菖鲉肝HSP70 mRNA的表达,随污染浓度增加,HSP70 mRNA含量也持续增加,在500 μg·L-1时达到最大值,为对照组的210.65倍。而8 μg·L-1Pb显著抑制褐菖鲉肝HSP70 mRNA的表达,并在40 μg·L-1时达到最小值,为对照组的0.02倍,随后逐渐恢复到对照水平。

图1 Cd、Pb污染对褐菖鲉肝HSP60 mRNA表达量的影响

图2 Cd、Pb污染对褐菖鲉肝HSP70 mRNA表达量的影响
2.3 重金属Cd、Pb影响HSP90基因表达的剂量-效应关系
由图3可见,Cd污染对褐菖鲉肝HSP90 mRNA含量基本无影响,虽然随着Cd浓度的升高HSP60 mRNA含量有缓慢上升趋势,但各组与对照组均无显著性差异。Pb污染下褐菖鲉肝HSP90 mRNA含量仅在40 μg·L-1浓度组时有显著性抑制,为对照组的0.12倍,其他浓度组与对照组之间无显著性差异。
2.4 重金属Cd、Pb影响HSC70基因表达的剂量-效应关系
由图4可见,Cd对HSC70 mRNA表达量并无显著影响,各浓度组与对照组相比总体呈上升趋势,但均无显著性差异。Pb污染下褐菖鲉肝HSC70 mRNA含量仅在40 μg·L-1浓度组时有显著性抑制,约为对照组的0.05倍。其他浓度组与对照组之间无显著性差异。
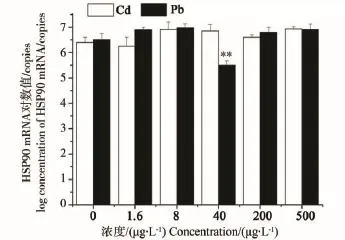
图3 Cd、Pb污染对褐菖鲉肝HSP90 mRNA表达量的影响
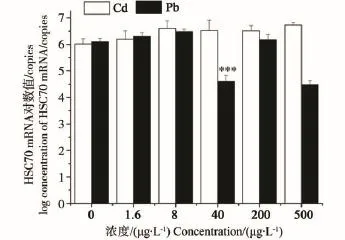
图4 Cd、Pb污染对褐菖鲉肝HSC70 mRNA表达量的影响
综上所述,不同浓度Cd对褐菖鲉肝HSP60、HSP90、HSC70 mRNA的表达基本无显著性影响,但可以显著诱导HSP70 mRNA的表达,且诱导量随着浓度的增加而增加,在500 μg·L-1时达到峰值。
不同浓度Pb影响褐菖鲉肝HSP60、HSP90、HSC70 mRNA的表达也不显著,仅在40 μg·L-1组出现显著性抑制,其他浓度组均无显著性变化。HSP70 mRNA表达量在8~40 μg·L-1时显著下降,而后逐渐回升,并在500 μg·L-1时恢复至对照组水平。
3 讨论(Discussion)
LAMP技术已在病毒、细菌、寄生虫等的定性检测运用方面得到了较为广泛的应用,但在定量检测方面的研究还较少。现有的研究中对于HSPs的热激响应的研究较多,并有研究发现HSPs的表达量与温度变化有很明显的相关性,而在生物体抵御重金属污染方面的研究却较少[21]。在本研究中,将LAMP技术应用于检测海洋重金属污染,从而定量检测海洋中重金属的污染情况。通过对Cd和Pb曝污后褐菖鲉肝脏中HSP60、HSP70、HSP90、HSC70基因的mRNA表达量进行检测表明,在重金属污染物暴露下,HSPs四种亚型基因对2种污染物呈现不同趋势的剂量效应关系。
本文结果证实,Cd可以显著诱导褐菖鲉肝HSP70 mRNA的表达,而HSP60、HSP90、HSC70 mRNA表达量在不同程度上也有所增加。这一结果与以往的许多研究结果相类似。例如,Cd能够在短时间内诱导虹鳟鱼(Oncorhynchus mykiss)肝HSC70 mRNA的表达量的升高,但诱导并不显著[22]。还有研究表明,Cd的渗透胁迫能够在一定时间内诱导轮虫(rotifer)中HSP60 mRNA表达量升高[23]。Cd能够诱导ROS的产生,而积累的ROS可迅速攻击蛋白质多肽链,尤其是其中的组氨酸、脯氨酸、精氨酸和赖氨酸,导致羰基基团的增加,而损伤或变性蛋白的积累又可进一步诱导HSPs基因的快速表达[24]。
但HSP70 mRNA的表达量不会无限增加,在达到峰值后表达水平将有所下降。相关研究表明,热休克蛋白的表达对细胞的保护是有一定范围的,它并不会无限制地持续增加[25]。虽然本研究中并未观察到HSP70基因表达被抑制,若进一步增加污染物浓度或延长暴露时间,就有可能抑制HSP70基因的表达。
Pb污染后,HSPs四种基因对Pb的反应都表现为先抑制,然后再回复到对照组水平。这种蛋白表达水平波动变化的可能机制是,重金属浓度较低时诱导细胞上调HSPs蛋白的保护性表达,然而在重金属浓度持续升高的环境下,机体消耗的HSPs量也在不断增加,结果导致了HSPs出现明显的降低。这种表达量显著降低的现象是生物体对前期积累产生的HSPs的一种消耗。类似的报道见于使用单倍或多倍剂量的阿司匹林会导致大鼠(Rattus norvegicus)胃组织中HSP90和相应的mRNA逐渐降低,适应后的胃脏中HSP90的表达量降低大约60%[26]。与之变化相类似的,500 μg·L-1的外源Pb即可显著抑制蚕豆(Vicia fabaL.)幼苗叶片内HSP60基因的表达[27]。HSPs被诱导表达是生物体克服不良环境和防止中毒的一种适应性改变,而诱导量的下降则说明生物体可能因污染的毒性作用而产生了中毒反应[28]。
本研究结果表明,与HSP60、HSP90、HSC70相比,HSP70对重金属Cd、Pb污染响应较为敏感,低浓度Cd即可显著诱导,Pb则先抑制而后随着浓度增加而升高。他人也有类似实验结果。如Rajeshkumar等[29](2013)对印度Kaattuppalli岛附近海域牛奶鱼(Chanos chanos)的研究表明,重金属Fe、Mn、Zn、Cu、Pb、Cd都会诱导HSP70的表达,其中以Fe的诱导最为明显。重金属Cd、Pb曝污能诱导淡水植物青萍(Lemna minor)中HSP70 mRNA表达量升高[30],证实HSP70对重金属污染有很好的敏感性,这些特性使得HSP70有望成为海洋重金属污染的早期预警分子。但对海洋污染的监测,不可能仅靠单一生物标志物,需要综合分析单一和联合暴露中多种生物标志物的表达情况。因此HSPs基因是否可用于海洋环境监测,还需要更多的实验研究。
(References):
[1] 夏娜娜,王军,史云娣,等.海洋重金属污染防治的对策研究[J].中国人口,资源与环境,2012,22(5):343-346
Xia N N,Wang J,Shi Y D,et al.Countermeasures for heavy metals pollution in marine environment[J].China Population,Resources and Environment,2012,22(5): 343-346(in Chinese)
[2] Lin Z F,Wang L S,Zhong P,et al.Advances on the monitoring approaches of organic pollutants in the marine environment[J].Marine Environmental Science,2006,25 (1):88-93
[3] Monikh F A,Maryamabadi A,Savari A,et al.Heavy metals’concentration in sediment,shrimp and two fish species from the northwest Persian Gulf[J].Toxicology& Industrial Health,2015,31(6):554-565
[4] 余杨,王雨春,周怀东,等.三峡库区蓄水初期大宁河鱼类重金属污染特性[J].生态学杂志,2013,32(7): 1870-1876
Yu Y,Wang Y C,Zhou H D,et al.Characteristics of heavy metals pollution of fishes in Daning River of Three Gorges Reservoir Area during initial impoundment[J]. Chinese Journal of Ecology,2013,32(7):1870-1876(in Chinese)
[5] Sato T,Nakagawa H,Oikawa S,et al.Hypothesis of the lead defense mechanism of carp(Cyprinus carpio)[J].Biomedical Research on Trace Elements,2007,18(4):387-390
[6] Mobarak Y M S,Sharaf M M.Lead acetate-induced histopathological changes in the gills and digestive system of silver sailfim molly(Poecitia latipinna)[J].International Journal of Zoological Research,2011,7(1):1-18
[7] Lee S M,Lee S B,Park C H,et al.Expression of heat shock protein and hemoglobin genes inChironomus tentans(Diptera,Chironomidae)larvae exposed to various environmental pollutants:A potential biomarker of freshwater monitoring[J].Chemosphere,2006,65(6):1074-1081
[8] Ritossa F.A new puffing pattern induced by temperature shock and DNP inDrosophila[J].Experientia,1962,18 (12):571-573
[9] Pelham H R.A regulatory upstream promoter element in theDrosophilaHSP70 heat-shock gene[J].Cell,1982,30 (2):517-528
[10] Marber M S,Mestril R,Chi S H,et al.Overexpression of the rat inducible 70-kD heat stress protein in a transgenic mouse increases the resistance of the heart to ischemic injury[J].Journal of Clinical Investigation,1995,95(4): 1446
[11] 尚进才,王亚洲,高岩,等.热休克蛋白的研究进展[J].医学理论与实践,2010,23(5):527-529
[12] 刘志刚,张其中,张占会,等.近江牡蛎HSC70基因对溶藻弧菌感染的反应[J].中国水产科学,2012,19(3): 500-508
Liu Z G,Zhang Q Z,Zhang Z H,et al.mRNA expression of heat-shock cognate protein 70 gene(HSC70)in the oyster(Crassostrea hongkongensis)in response toVibrio alginolyticuschallenge[J].Journal of Fishery Sciences ofChina,2012,19(3):500-508(in Chinese)
[13] Deane E E,Woo N Y S.Advances and perspectives on the regulation and expression of piscine heat shock proteins[J].Reviews in Fish Biology&Fisheries,2011,21 (2):153-185
[14] Airaksinen S,Jokilehto T,Rabergh C M,et al.Heat and cold inducible regulation of HSP70 expression in zebra fish ZF4 cells[J].Comparative Biochemistry&Physiology Part B,2003,136(2):275-282
[15] 盛连喜,于文广,王云彪,等.温度、铜离子对鲤鱼血清HSP70合成的影响[J].东北师大学报:自然科学版, 2007,39(1):108-113
Sheng L X,Yu W G,Wang Y B,et al.Effects of temperature and copper on HSP70 expression in carp serum[J]. Journal of Northeast Normal University:Natural Science Edition,2007,39(1):108-113(in Chinese)
[16] 周鑫.草鱼(Ctenopharyngodon idella)对亚硝酸盐、氨氮和温度胁迫的生理响应[D].青岛:中国海洋大学, 2012:1-7
Zhou X.Physiological response to stress of nitrite,ammonia and temperature in grass carp,Ctenopharyngodon idella[D].Qingdao:Ocean University of China,2012:1-7 (in Chinese)
[17] Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):66
[18] Denschlag C,Vogel R F,Niessen L.Hyd5 gene-based detection of the major gushing-inducingFusariumspp.in a loop-mediated isothermal amplification(LAMP)assays [J].International Journal of Food Microbiology,2012,156 (3):189-196
[19] Wang X,Zhu J,Zhang Q,et al.Detection of enterovirus 71 using reverse transcription loop-mediated isothermal amplification(RT-LAMP)[J].Journal of Virological Methods,2012,179(2):330-334
[20] Thekisoe O M M,Rambritch N E,Nakao R,et al.Loopmediated isothermal amplification(LAMP)assays for detection ofTheileria parvainfections targeting the PIM and p150 genes[J].International Journal for Parasitology, 2010,40(1):55-61
[21] Spijkerman E,Barua D,Gerloff-Elias A,et al.Stress responses and metal tolerance ofChlamydomonas acidophilain metal-enriched lake water and artificial medium[J]. Extremophiles,2007,11(4):551-562
[22] Boone A N,Vijayan M M.Constitutive heat shock protein70(HSC70)expression in rainbow trout hepatocytes: Effect of heat shock and heavy metal exposure[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2002,132(2):223-233
[23] Rios-Arana J V,Gardea-Torresdey J L,Webb R,et al. Heat shock protein 60(HSP60)response ofPlationus patulus(Rotifera:Monogononta)to combined exposures of arsenic and heavy metals[J].Hydrobiologia,2005,546(1): 577-585
[24] Zhu X N,Chen L P,Bai Q,et al.PP2A-AMPKα-HSF1 axis regulates the metal-inducible expression of HSPs and ROS clearance[J].Cellular Signalling,2014,26(4):825-832
[25] 刘海超.唐鱼三个分子伴侣基因的克隆及重金属对其mRNA表达的影响[D].武汉:华中农业大学,2011:87-88
Liu H C.Cloning of three molecular chaperones gene and three mRNA transcriptional regulation responding to heavy metals inTanichthys albonubesLin[J].Wuhan: Huazhong Agricultural University,2011:87-88(in Chinese)
[26] Alderman B M,Cook G A,Familari M,et al.Resistance to apoptosis is a mechanism of adaptation of rat stomach to aspirin[J].American Journal of Physiology,2000,278 (6):839-846
[27] 汪承润,王晓蓉,于红霞,等.运用蚕豆幼苗叶片生物标志物评价铅污染土壤[J].环境科学,2008,29(11): 3246-3251
Wang C R,Wang X R,Yu H X,et al.Evaluation of soil lead contamination by biomarkers in leaves ofVicia faba L.seedlings[J].Environmental Science,2008,29(11): 3246-3251(in Chinese)
[28] Sarkar S,Podder S,RoyS.Flubendiamide-induced HSP70 expression in transgenicDrosophila melanogaster [J].Current Science,2015,108(11):2044-2050
[29] Rajeshkumar S,Mini J,Munuswamy N.Effects of heavy metals on antioxidants and expression of HSP70 in different tissues of milk fish(Chanos chanos)of Kaattuppalli Is land,Chennai,India[J].Ecotoxicology and Environmental Safety,2013,98(3):8-18
[30] Basile A,Sorbo S,Cardi M,et al.Effects of heavy metals on ultrastructure and HSP70 induction inLemna minorL. exposed to water along the Sarno River,Italy[J].Ecotoxicology and Environmental Safety,2015,114:93-101◆
The Effects of Cd and Pb on the Levels of Hepatic HSPs mRNA in Sebastiscus marmoratus
Chen Ye1,Chen Rong1,*,Mo Zhengping1
State Key Laboratory of Marine Environmental Science,College of the Environment and Ecology,Xiamen University,Xiamen 361102, China
19 June 2015 accepted 17 September 2015
In order to understand the effects of heavy metal pollution on the gene expression of heat shock proteins (HSPs)in marine fish,Sebastiscus marmoratuswere exposed to different concentrations(i.e.,1.6,8,40,200,500 μg·L-1)of Cd or Pb for 5 days.A quantitative loop-mediated isothermal amplification(LAMP)method was used to analyze the hepatic mRNA levels of HSP60,HSP70,HSP90,and HSC70.Under the Pb exposure,the mRNA levels of hepatic HSP60,HSP90,HSC70 were not significantly reduced except in the 40 μg·L-1treatment,whereas the mRNA levels of HSP70 were significantly decreased by 8 μg·L-1Pb,and reached the minimum when Pb was 40 μg·L-1.Under the Cd exposure,the mRNA levels of hepatic HSP60,HSP90,HSC70 were not significantly affected;in contrast,mRNA levels of HSP70 were significantly increased and peaked at 500 μg·L-1Cd.In conclusion,the hepatic HSP70 was relatively more sensitive to heavy metal exposure than the other HSPs,and thus hadthe potential to be the early warning for heavy metal pollution in marine environment.
Cd;Pb;Sebastiscus marmoratus;liver;heat shock proteins;HSPs;loop-mediated isothermal amplification
2015-06-19 录用日期:2015-09-17
1673-5897(2016)3-124-07
X171.5
A
10.7524/AJE.1673-5897.20150619001
简介:陈荣(1974—),男,环境科学博士,副教授,主要研究方向为海洋生态毒理学,发表学术论文30余篇。
海洋公益性项目"海洋污染生物效应快速监测与评价技术应用示范"子任务-海洋污染效应生物标志物技术集成与研发II (201005016)
陈晔(1991-),女,硕士,研究方向为生态毒理学,E-mail:360321490@qq.com;
*通讯作者(Corresponding author),E-mail:chenrong@xmu.edu.cn

