杀虫剂三唑磷在室内淡水微宇宙中的生态效应
袁丙强,李少南
浙江大学农药与环境毒理研究所,杭州310029
杀虫剂三唑磷在室内淡水微宇宙中的生态效应
袁丙强,李少南*
浙江大学农药与环境毒理研究所,杭州310029
作为一种中等毒性的有机磷杀虫剂,三唑磷在稻区的使用十分普遍。为弄清其对淡水生态系统的影响,选择5组浓度(0、0.35、1.75、17.5、52.5 μg·L-1),在以藻类作为营养源的室内微宇宙系统内进行研究,采用多变量分析软件CANOCO 5对数据进行分析。非限制性排序和多重比较的结果表明,给药后0~6 d,三唑磷对于浮游动物群落的最高无作用浓度(NOECcommunity)和最低有效浓度(LOECcommunity)分别为17.5 μg·L-1和52.5 μg·L-1。给药后第9天,最高浓度组(52.5 μg·L-1)的群落结构开始恢复,此刻三唑磷在水中的实测浓度平均值为4.35 μg·L-1。对于单个物种种群密度做差异显著性分析和多重比较,结果显示浮游动物当中受影响最大的是绿色湖湾介Strandesia viridis。给药30 d后,该物种在52.5 μg·L-1处理组的种群密度明显下降,历时57 d的试验结束时,种群密度仍未恢复到对照水平。对于藻类,非限制性排序和多重比较的结果显示三唑磷在群落层次的影响未达到能够明显区分NOECcommunity和LOECcommunity的程度。在单物种层面,在给药后9~12 d,三唑磷对单细胞的羊角月牙藻Selenastrum capricornutum种群有刺激作用。其NOECspecies和LOECspecies分别为1.75 μg·L-1和17.5 μg·L-1。没有迹象表明三唑磷的引入能够明显改变水体pH、电导、浊度和水体C循环状况。结合暴露评估软件GNEEC(Version 2.0)输出的环境浓度(峰值为2.44 μg·L-1),本研究结果显示三唑磷在正常使用剂量下有可能对稻田周边浮游动物群落的内部结构造成扰动,但是它不会对整个系统造成不可恢复的影响。
三唑磷;水生微宇宙;多元分析;主效应曲线
袁丙强,李少南.杀虫剂三唑磷在室内淡水微宇宙中的生态效应[J].生态毒理学报,2016,11(3):101-114
Yuan B Q,Li S N.Ecological effects of insecticide triazophos in indoor microcosms[J].Asian Journal of Ecotoxicology,2016,11(3):101-114 (in Chinese)
三唑磷(triazophos),化学名称为O,O-二乙基-O-(1-苯基-1,2,4-三唑-3-基)硫代磷酸酯,属于硫代磷酸酯类杀虫剂,对许多重要农业害虫,如螟虫、稻飞虱、蚜虫、红蜘蛛、棉铃虫、菜青虫和线虫等都有良好的防治效果。由于对哺乳动物毒性相对较低,在全面禁止高毒有机磷农药的背景下,三唑磷的需求量反而呈上升的趋势,目前主要被加工成乳油、可湿性粉剂、微乳剂等剂型,用于水稻害虫的防治[1]。
对于三唑磷的生态毒性,国内外有较多的研究报导,但大多是基于个体水平的研究结果。如,国内资料显示,三唑磷对各种鱼类的48 h LC50介于0.008 ~8.66 mg·L-1之间[2],对各种甲壳纲动物的48~96 h LC50介于0.4~16.26 μg·L-1之间[2-4]。谭亚军等[5]测得三唑磷对于大型溞Daphnia magna繁殖量的21 d最高无作用浓度(NOEC)和最低有效浓度(LOEC)分别为0.05 μg·L-1和0.10 μg·L-1。
采用PANNA(Pesticide Action Network North A-merica)数据库中所提供的理化性质参数和环境行为数据,以数学软件GNEEC(Version 2.0)估测三唑磷在水环境中的残留水平(estimated environmental concentrations,EEC)。结果显示,用于防治水稻螟虫的三唑磷,当以450 g·公顷-1的量使用后,其在稻田周边池塘中的峰值以及4 d、21 d、60 d、90 d残留平均值分别为2.44、2.25、1.37、0.63和0.44 μg·L-1。可见三唑磷在正常使用下有可能对稻田周边水生动物造成危害,因此有必要对其生态效应做进一步探究。
界定农药水污染的生态效应,最直接也最能够令人信服的证据,理应来自天然池塘中开展的试验。然而天然生态系统十分复杂,试验过程费时费力,另外人们也难以找到从规格到内含具有相当程度一致性的一系列天然池塘可供试验。人工水生生态系统(水生微宇宙)虽然只在一定程度上保留了天然池塘的结构和功能,但其具有可操控性,并且可以根据要求设置多个重复,因此成为农药水生生态毒理学研究的得力工具[6-7]。作者选用人工组合的水生生态系统,在室内条件下对三唑磷的生态效应开展研究,了解三唑磷对构成微宇宙的生物和非生物要素的直接和间接影响,确定三唑磷在群落层面的最高无作用浓度(NOECcommunity)和最低有效浓度(LOECcommunity),希望研究结果有助于三唑磷的风险评估和风险管理。
1 材料与方法(Materials and methods)
1.1 受试物(Test substance and reagents)
受试物:三唑磷原药(精制)(浙江新农化工股份有限公司生产,纯度96.6%)。
试剂:三唑磷标准品(纯度98%)购自美国Sigma-Aldrich®,其他试剂除特别指出的之外,均为国产分析纯产品。
1.2 试验容器(Test units)
容积5 L的玻璃广口瓶(直径16.0 cm,高25.0 cm,瓶口直径10.6 cm)。
1.3 稀释水(Diluents)
参照国际材料试验协会(International Association for Testing Materials,ASTM)试验准则E 1366-02,采用T82MV培养液作为稀释水[8]。
1.4 基底(Sediments)
取大约4 kg石英砂(40~60目),放入25 L塑料桶中,加10%盐酸浸泡,2 h后倒出盐酸,先用自来水再用蒸馏水冲洗(直至冲洗液pH为7),烘干,冷却,称重备用;几丁质用蒸馏水冲洗,风干后用粉碎机粉碎,过40目筛备用;纤维素粉直接使用。
1.5 受试生物(Organisms)
1.5.1 藻类(Algae)
参照E 1366-02,选用柱孢鱼腥藻Anabaena cylindrica、纤维藻Ankistrodesmussp.、莱哈依藻Chlamydomonas reinhardii(又称“莱茵衣藻”)、普通小球藻Chlorella vulgaris、鞘丝藻Lyngbyasp.、菱形藻Nitzschiakutzigiana、斜生栅藻Scenedesmus obliquus、羊角月牙藻Selenastrum capricornutum、毛枝藻Stigeocloniumsp.和丝藻Ulothrixsp.作为构成微宇宙的藻类植物。藻种购自中国科学院淡水藻种库。购回的藻种按照供方提供的方式保存。试验开始前2周,将藻种转接到T82MV培养液,在与试验相同的温度和光照条件下扩大培养。
1.5.2 浮游动物(Zooplanktons)
选用大型溞Daphnia magna、萼花臂尾轮虫Brachionus calyciflorus和绿色湖湾介Strandesia viridis作为构成微宇宙的浮游动物。
溞种购自中国疾病预防控制中心环境与健康相关产品安全所,属于62DM生物株。购回的溞种置于OECD M4培养液[9]中,在水温22℃,光强1 000~ 2 000 lux(16 h光照:8 h黑暗)的环境下培养传代。试验开始前2周,将怀卵母溞转移到T82MV培养液中,在与试验相同的温度和光照条件下驯养。
轮虫和介形虫均采自浙江大学华家池校区试验农田的田边池塘。采回的轮虫置于T82MV培养液中进行培养。培养过程中的水温和光照条件与溞相同。试验开始前2周,收集怀卵轮虫进行驯养。
采回的介形虫置于T82MV培养液中进行培养。培养过程中的水温和光照条件与溞相同。试验开始前4周,收集怀卵成体进行驯养。
1.6 系统的组装(Microcosm setup)
称量200 g石英砂、0.5 g几丁质和0.5 g纤维素,混匀,倒入试验容器作为基底,然后加入3 L T82MV作为稀释水。
以受试物三唑磷加入的日期作为试验的第0天。藻类在加药前6天接种。藻类每个物种接种到微宇宙中的初始浓度为103cells·mL-1。接种前在荧光显微镜(尼康TE2000,日本)下用血球计数板(型号:0.1 mm,上海华壹生物科技有限公司)对扩大培养的藻种进行计数(计数前,多细胞的柱孢鱼腥藻、丝藻、毛枝藻、鞘丝藻和纤维藻在装有玻璃珠的无菌三角瓶中剧烈摇动),根据计数结果算出需要接种的培养液体积(0.1~1.0 mL·L-1)。
轮虫在加药前3天引入。引入数量为30只·L-1。引入前在体视显微镜(尼康SMZ645,日本)下用小型浮游生物计数框(型号:0.1 mL、1.0 mL,北京普力特仪器公司)对培养液中的轮虫进行计数,根据计数结果算出需要引入的培养液体积(大约0.05 mL·L-1)。
溞和介形虫在加药前3天引入。溞按照16只·容器-1(其中6只为体长大于0.7 mm的怀卵母溞,10只为小于0.7 mm的幼溞),介形虫按照6只·容器-1的数量引入
1.7 加药(Dose administration)
微宇宙试验共设置0.35、1.75、17.5和52.5 μg· L-14个浓度组和1个溶剂对照组。每组设6个重复。准确称取0.0158 g三唑磷原药,溶于丙酮,定容到10 mL,配制成浓度为1.53 mg·mL-1的母液。加药时取不同体积的母液加入到3 L稀释水中,对照组加丙酮103.2 μL,加药之后各浓度组补加丙酮,使其达到与对照组相同的体积。
1.8 试验条件(Ambient conditions)
光照强度2 000~3 000 lux(16 h光照:8 h黑暗),试验温度控制在(22±1)℃。
1.9 采样(Sampling)
采样器参照ASTM试验准则E 1366-02制作。所采水样的量视浮游动物计数以及水体理化参数和受试物浓度测量的需求而定。
用于浊度、pH、电导率、受试物浓度和浮游生物种群密度测量的水样在16 h光照开始前1小时采集。用于溶解氧测量的水样,每天分2次采集:第1次在16 h光照开始前1小时;第2次在8 h黑暗开始前1小时。
整个试验历时63 d。试验过程中每3天采1次水样。
1.10 样品测量与分析(Sample observations and analysis)
1.10.1 浮游动物(Zooplanktons)
溞和介形虫:将水样倒入培养皿中,用计数器记数。必要时使用5 mL或10 mL大型浮游动物计数框,在体视显微镜下计数。计数结果以“只·(100 mL)-1”表示。计数完成之后的溞和介形虫重新植入微宇宙当中。
轮虫:将水样移入0.1 mL或1.0 mL小型浮游动物计数框,在体视显微镜下计数。计数结果以“只·mL-1”表示。
1.10.2 藻类(Phytoplanktons)
将水样移入0.1 mm血球计数板,在荧光显微镜下计数。计数结果以“×104cell·mL-1”表示。
1.10.3 水体理化参数(Water quality parameters)
浊度测量参照中华人民共和国国家标准GB 13200—91[10]。溶解氧测量参照中华人民共和国国家标准GB 11913—89[11]。pH测量参照中华人民共和国国家标准GB 6920—86[12]。电导率测量参照中华人民共和国地质矿产行业标准DZ/T 0064.6—93[13]。每次测量按照“对照组”→“低浓度组”→“高浓度组”的顺序进行,以减少交叉污染。
1.10.4 受试物浓度测定(Pesticide analysis)
取大约20 mL水样,除去其中的悬浮物,转移至分液漏斗中,用乙酸乙酯震荡萃取,收集上层有机相于平底烧瓶,在40℃下减压浓缩近干,用丙酮定容,过0.2 μm滤膜,待测。
经过前处理的样品用气相色谱仪(岛津GC-2010,日本)进行检测。仪器配备FPD检测器和30 m×0.32 mm×0.25 μm RtxR-5交联键合型石英毛细管柱。检测条件:柱温80℃,保持1 min,以50℃· min-1的速率升至200℃,保持1 min,再以10℃· min-1的速率升至250℃,保持5 min;进样口温度230℃;检测器温度280℃;不分流进样;载气高纯氮(99.999%),恒压180 kPa;空气流量100 mL· min-1;氢气流量120 mL·min-1;进样体积1 μL。
1.11 数据处理(Data procession)
1.11.1 光合作用氧生产量和呼吸作用氧消耗量(Oxygen production and consumption)
光合作用氧生产量(DOP)和呼吸作用氧消耗量(DOR)是反映水体C循环特征的代谢参数(mg·L-1)。DOP和DOR可以由如下公式[8]计算:
DOP=DO2-DO1
DOR=DO2-DO3
式中,DO1为16 h光照开始前1小时水中溶解氧量(mg·L-1);DO2为8 h黑暗开始前1小时水中溶解氧量(mg·L-1);DO3为16 h光照重新开始前1小时水中溶解氧量(mg·L-1)。
1.11.2 生物可利用藻体积(Bioavailable volumes of algae)
藻类对于滤食者的可利用性与其细胞体积和形状有关。单位容积内藻类细胞的可利用体积(BAA) (单位:104μm3·mL-1)可以由如下公式[8]计算:

式中,CDi为藻种i的细胞浓度(104cells·mL-1);CVi为藻种i的细胞体积(μm3·cell-1);Fi为藻种i的可利用程度。此处的Fi以对大型溞作为参照;CVi和Fi的取值均参照E 1366-02。
1.11.3 排序与方差分析(Ordinations and ANOVAs)
以受试物浓度和时间作为解释变量(explanatory variable),以物种种群密度(或水体理化参数测量值)作为应变量(response variables),对试验数据做冗余分析(Redundancy Analysis,RDA)——一种基于限制性排序(constrained forms of ordination)的多元分析。排序结果以主效应曲线(principle response curves, PRC)的方式表达[14]。在排序的基础上做蒙特卡罗排列检验(Monte Carlo permutation tests),通过检验来确认解释变量浓度、时间,以及两者交互作用对于群落结构影响的统计显著性。
分别以受试物的配制浓度和实测浓度作为解释变量,以群落内所有物种种群密度(或表征水质的所有理化参数的测量值)作为应变量,对数据做非限制性排序(unconstrained forms of ordination),然后主成分分析(principle components analysis,PCA)或降趋对应分析(detrended correspondence analysis,DCA),以判断受试物作为解释变量能够解释的变异在应变量特征向量值(即样本分值sample scores)总变异中所占的比例。
在PCA或DCA的基础上,按照时间顺序对样本分值做差异显著性分析和多重比较,根据多重比较的结果确定受试物的NOECcommunity和(或)LOECcommunity[15]。
对涉及单物种的试验数据做冗余分析和蒙特卡罗检验。对于检验结果显示受三唑磷浓度、时间,以及两者交互作用影响显著的物种,分别以受试物的配制浓度和实测浓度作为解释变量,以种群密度测量值作为应变量,对数据做非限制性排序,采用PCA(或DCA)结果来判断受试物在试验过程中对于种群密度总的影响趋势,以及受试物作为解释变量能够解释的变异在种群密度总变异中所占的比例。如果PCA(或DCA)图解显示解释变量和应变量伸展方向相同,说明受试物对所涉种群有刺激作用,反之说明受试物有抑制作用。按照时间顺序对种群密度做差异显著性分析和多重比较,根据多重比较的结果确定受试物的最高无作用浓度(NOECspecies)和最低有效浓度(LOECspecies)。冗余分析和蒙特卡罗检验结果显示受三唑磷浓度、时间,以及两者交互作用影响显著的水质参数也经历同样的分析操作。
对于多重比较的结果,以连续2次或2次以上与对照组差异显著作为剂量“有效”的判断标准[16]。
排序和蒙特卡罗检验以及PCA(或DCA)均由数学软件CANOCO 5[17]来完成。对于应变量测量值和应变量特征向量值的差异显著性分析和多重比较由数学软件DPS[18]来完成。
采用公式Ln(Ax+1)对应变量数据进行转换。公式中的x是需要转换的应变量数据。在应变量数据组中寻找大于0的最小数据xmin,A的取值应该使Axmin约等于2[19]。当应变量包含多组数据时,上述转换可降低绝对值高的数据的权重,使应变量数据分布更加符合正态模型。
2 结果(Results)
2.1 浮游动物(Zooplankton communities)
以对数转化浮游动物种群密度作为应变量,以受试物浓度和时间作为解释变量,对试验数据做冗余分析和蒙特卡罗排列检验。前者的结果显示,样本分值28.2%的变异能够被解释变量所解释;蒙特卡罗检验结果显示F=124,P=0.004,这表明三唑磷浓度、时间,以及两者交互作用对于浮游动物群落结构有显著影响。基于蒙特卡罗检验结果的PRC如图1所示。PRC的x轴显示时间进程,y轴显示处理效果的第一主成分(PRC.1)。PRC显示三唑磷对浮游动物的影响以抑制为主。图1右侧的物种权重(weights)排列结果显示,相比于萼花臂尾轮虫,大型溞和绿色湖湾介种群密度受三唑磷影响更大。
以对数转化后的种群密度作为应变量,以受试物配制浓度和实测浓度分别作为解释变量,对于试验数据做非限制性排序。后续的PCA结果显示,作为解释变量,三唑磷配制浓度和实测浓度能够解释的变异在群落结构特征向量值总变异中所占比例分别为7.9%和3.5%。按照时间顺序,对不同浓度下的群落结构特征向量值做差异显著性分析和多重比较,其结果如表1所示。
从表1可以看出,在给药后的当天、第3天、第6天、第18天、第51天,群落结构特征向量值随给药浓度而发生改变且改变的方向一致。表1还显示52.5 μg·L-1处理组的向量值与对照组差异显著。若以连续2次或2次以上的显著差异作为剂量“有效”的判断标准,可以认定三唑磷对浮游动物的0~6 d NOECcommunity和LOECcommunity分别为17.5和52.5 μg· L-1,进而可以计算出浮游动物群落对于三唑磷的0~6 d耐受浓度MATC=LOECcommunity×NOECcommunity= 30.3 μg·L-1。
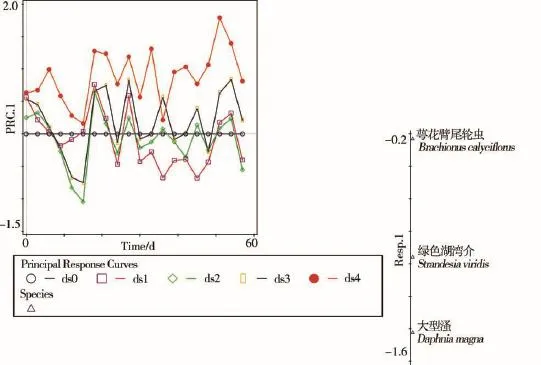
图1 基于浮游动物资料组的主效应曲线及应变量分值示意图
对于单个物种种群密度做冗余分析和蒙特卡罗检验。前者的结果显示,对于大型溞、绿色湖湾介、萼花臂尾轮虫,其种群密度分别有27.4%、52.0%、28.7%的变异能够被解释变量所解释;蒙特卡罗检验结果显示,三唑磷浓度、时间,以及两者交互作用对于大型溞、绿色湖湾介、萼花臂尾轮虫种群密度影响显著(F值分别为189、543、201,P值分别为0.002、0.002、0.002)。
为确认受试物浓度、时间,以及两者交互作用的龄期效应,对于大型溞母溞和幼溞种群密度测量值分别做冗余分析和蒙特卡罗检验。冗余分析结果显示,对于种群密度,母溞和幼溞分别有22.1%和17.1%的变异能够被解释变量所解释;蒙特卡罗检验结果显示,三唑磷浓度、时间,以及两者交互作用对于母溞种群密度影响显著(F值和P值分别为142和0.016),上述因素对于幼溞种群密度影响不显著(F值和P值分别为103和0.194)。
对于种群密度受三唑磷浓度、时间,以及两者交互作用影响显著的大型溞、绿色湖湾介、萼花臂尾轮虫分别做非限制性排序和PCA。后者的结果显示,三唑磷配制浓度和实测浓度能够解释的变异在大型溞种群密度总变异中所占比例分别为3.6%和1.0%;两者在绿色湖湾介种群密度总变异中所占比例分别为23.4%和0.2%;两者在萼花臂尾轮虫种群密度总变异中所占比例分别为0.5%和1.8%。PCA结果显示三唑磷对上述3个物种的影响方式均为抑制。
对于上述3个物种,按照时间顺序,对不同浓度下的种群密度做差异显著性分析和多重比较,其结果如表2所示。
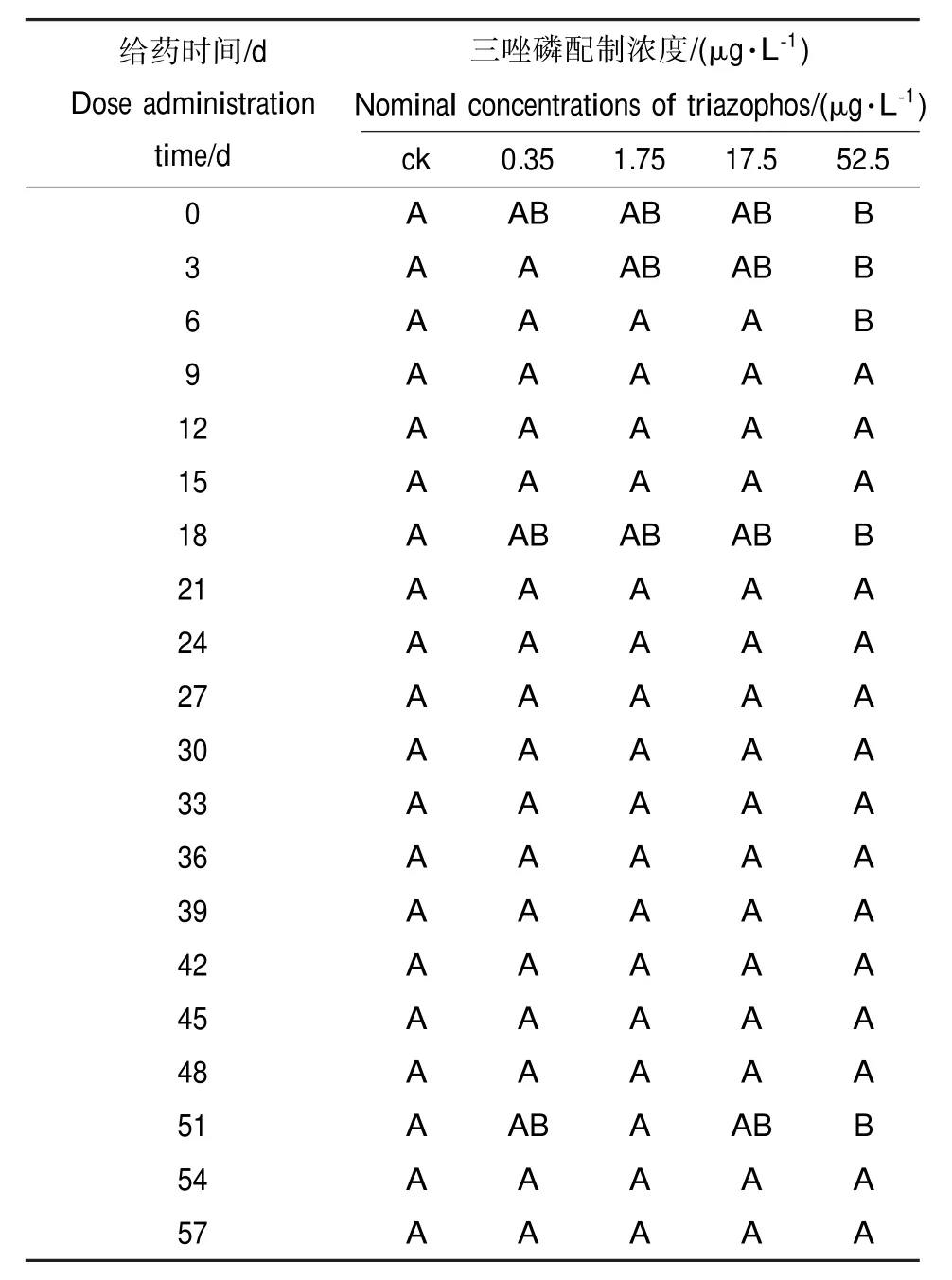
表1 浮游动物群落结构特征向量多重比较aTable 1 Multiple comparisons of eigenvector values of zooplankton communitiesa

表2 大型溞、绿色湖湾介和萼花臂尾轮虫种群密度多重比较aTable 2 Multiple comparisons of population densities ofDaphnia magna,Strandesia viridis, andBrachionus calyciflorusa

图2 基于藻类植物资料组的主效应曲线及应变量分值示意图
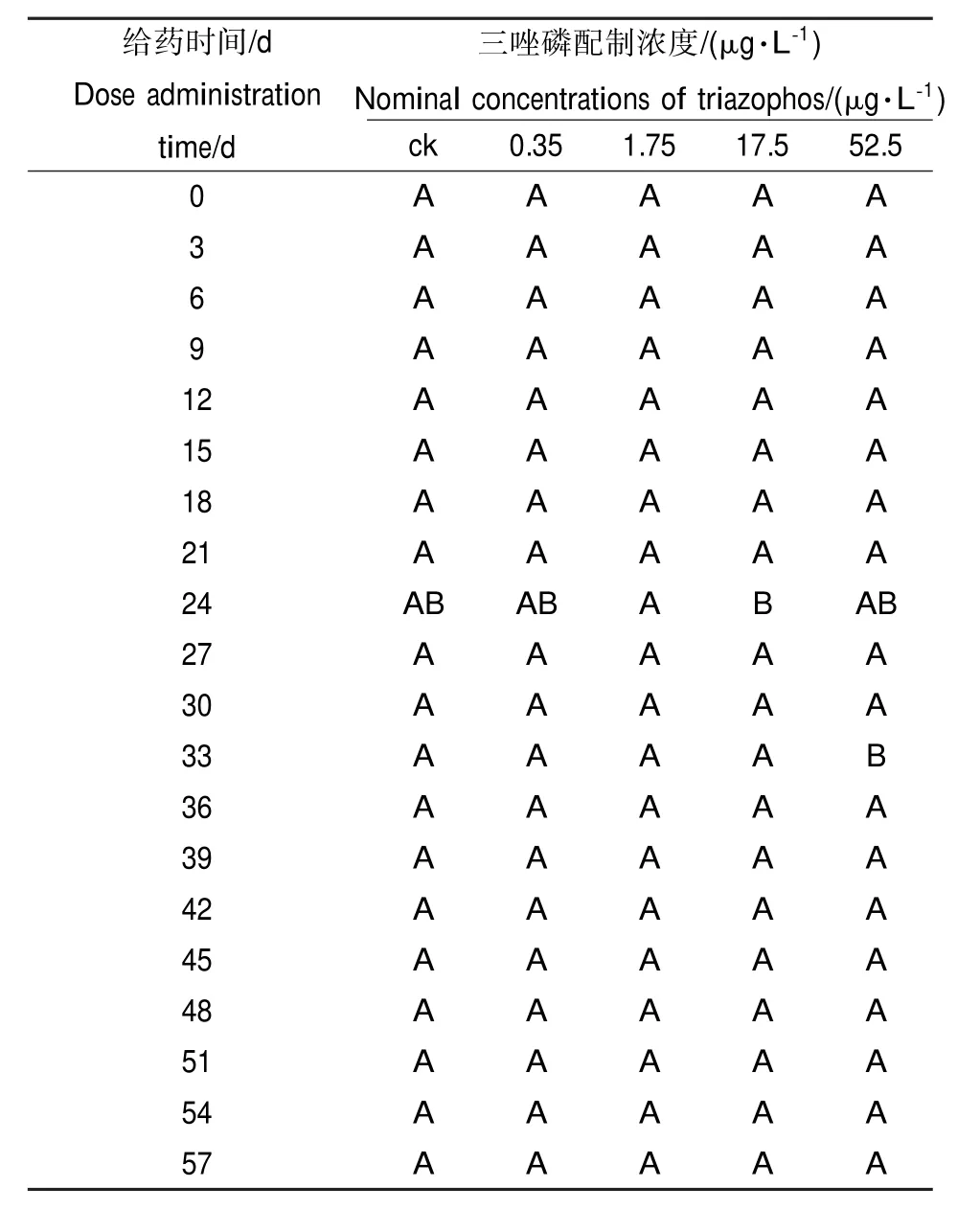
表3 藻类植物群落结构特征向量多重比较aTable 3 Multiple comparisons of eigenvector values of algal communitiesa
从表2第2列可以看出,溞的种群密度在给药后第3天沿浓度提高方向呈阶梯式下降,在第18天呈波动式下降。但这些变化未能够持续,因此认定三唑磷在所测浓度下均未达到“有效”水平,即三唑磷对溞的NOECspecies>52.5 μg·L-1。
从表2第3列可以看出,介形虫的种群密度在给药后第9天、第24天和第27天沿浓度提高方向先增后降。自给药后第30天开始,52.5 μg·L-1处理组的种群密度显著低于对照组,直至试验结束,这一处理组的种群密度也未恢复到对照水平,由此认定三唑磷抑制介形虫生长的30~57 d NOECspecies和LOECspecies分别为17.5 μg·L-1和52.5 μg·L-1。
从表3第4列可以看出,轮虫的种群密度在给药后的第12天沿浓度提高方向连续下降,第18天先下降,后又部分回升,第24呈上下波动,第57天先升后降。但这些变化未能够持续,因此认定三唑磷对轮虫的NOEC>52.5 μg·L-1。
2.2 藻类(Algal communities)
以对数转化藻类植物种群密度作为应变量,以受试物浓度和时间作为解释变量,对试验数据做冗余分析和蒙特卡罗检验。冗余分析结果显示,样本分值16.5%的分变异能够被解释变量所解释;蒙特卡罗检验结果显示F=28.4,P=0.006,这表明三唑磷浓度、时间,以及两者交互作用对于藻类群落结构有显著影响。基于蒙特卡罗检验结果的PRC如图2所示。图2右侧的物种权重排列结果显示,相比于单细胞藻类(月牙藻、斜生栅藻等),多细胞藻类(毛枝藻、柱孢鱼腥藻等)种群密度受三唑磷影响更大。
以对数转化后的种群密度作为应变量,以受试物配制浓度和实测浓度分别作为解释变量,对于试验数据做非限制性排序。后续的DCA结果显示,作为解释变量,三唑磷配制浓度和实测浓度能够解释的变异,在群落结构特征向量值总变异中所占比例分别为0.6%和2.3%。按照时间顺序,对不同浓度下的群落结构特征向量值做差异显著性分析和多重比较,其结果如表3所示。
从表3可以看出,藻类植物群落结构特征向量值只在给药后第21天沿浓度提高方向上下波动。
对于单个物种种群密度做冗余分析和蒙特卡罗检验。前者的结果显示,对于菱形藻、毛枝藻、斜生栅藻、羊角月牙藻、柱孢鱼腥藻、莱茵衣藻、普通小球藻、鞘丝藻、丝藻、纤维藻,其种群密度分别有22.8%、20.2%、19.2%、30.1%、19.2%、14.7%、11.2%、16.0%、17.4%、14.8%的分变异能够被解释变量所解释;蒙特卡罗检验结果显示,三唑磷浓度、时间,以及两者交互作用对于菱形藻、毛枝藻、斜生栅藻、羊角月牙藻、柱孢鱼腥藻种群密度影响显著(F值分别为148、127、119、215、119,P值分别为0.004、0.014、0.05、0.006、0.01),其对于莱茵衣藻、普通小球藻、鞘丝藻、丝藻、纤维藻种群密度影响不显著(F值分别为85.9、63.1、95.4、105、87.0,P值分别为0.37、0.768、0.174、0.098、0.31)。
对于藻类的生物可利用体积(BAA)做冗余分析和蒙特卡罗检验。冗余分析结果显示,对于BAA,有11.9%的分变异能够被解释变量所解释;蒙特卡罗检验结果显示,三唑磷浓度、时间,以及两者交互作用对于BAA影响不显著(F值和P值分别为67.4和0.588)。
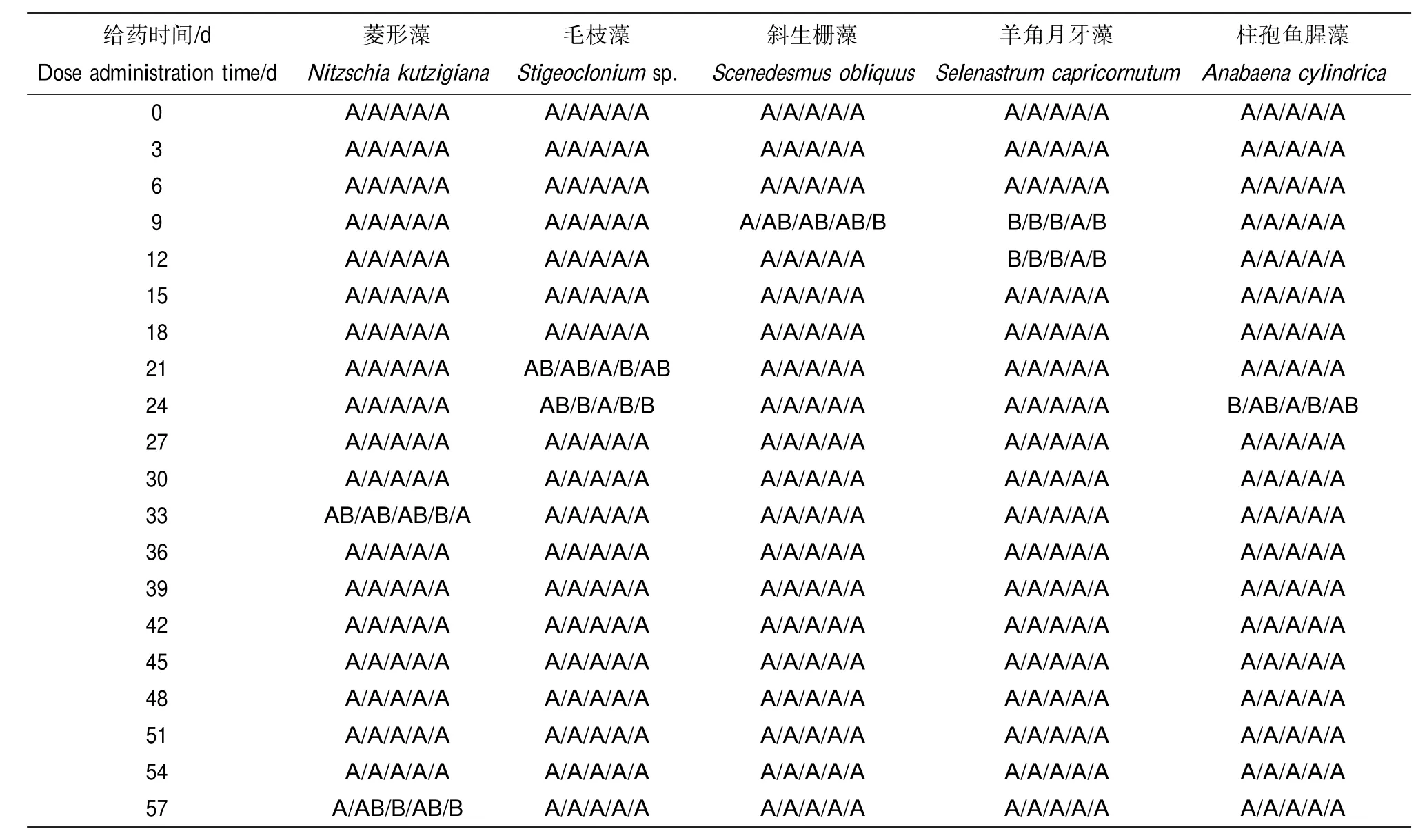
表4 藻类种群密度多重比较aTable 4 Multiple comparisons of population densities of algaea
对于种群密度受三唑磷浓度、时间,以及两者交互作用影响显著的5个物种分别做非限制性排序和PCA。后者的结果显示,单细胞藻类当中,三唑磷配制浓度和实测浓度能够解释的变异,在菱形藻种群密度总变异中所占比例分别为<0.1%和2.0%,影响方式均为刺激;两者在斜生栅藻种群密度总变异中所占比例分别为0.3%和14.3%,影响方式前者为抑制后者为刺激;两者在羊角月牙藻种群密度总变异中所占比例分别为<0.1%和23.3%,影响方式均为刺激;多细胞藻类当中,三唑磷配制浓度和实测浓度能够解释的变异,在毛枝藻种群密度总变异中所占比例分别为1.6%和0.9%,影响方式均为抑制;两者在柱孢鱼腥藻种群密度总变异中所占比例分别为3.0%和0.8%,影响方式均为抑制。
对于上述5个物种,按照时间顺序,对不同浓度下的种群密度做差异显著性分析和多重比较,其结果如表4所示。
从表4第2列可以看出,菱形藻种群密度在给药剂后的第33天沿浓度提高方向先降后升,第57天呈波动式下降。
从表4第3列可以看出,毛枝藻种群密度在给药后第21天沿浓度提高方向上下波动,第24天沿浓度提高方向呈波动式下降。
从表4第4列可以看出,斜生栅藻种群密度在给药后第9天沿浓度提高方向呈阶梯式下降。
从表4第5列可以看出,在给药后第9天和第12天,羊角月牙藻种群密度沿浓度提高方向先增后降。在这一时段,在17.5 μg·L-1处理组,藻的种群密度显著高于对照组,因此可以认定三唑磷在给药后9~12 d刺激羊角月牙藻生长的NOECspecies和LOECspecies分别为1.75 μg·L-1和17.5 μg·L-1;在同一时段,当三唑磷浓度提高到52.5 μg·L-1时,种群密度虽与对照组差异不显著但是显著低于17.5 μg·L-1处理组,故可以认定三唑磷抑制羊角月牙藻生长的NOECspecies=17.5 μg·L-1,LOECspecies=52.5 μg·L-1。
从表4第6列可以看出,在给药后第24天,柱孢鱼腥藻种群密度沿浓度提高方向呈波动式上升。
2.3 水体理化参数及C循环参数(Water quality and C circulation parameters)
以对数转化的水体理化参数(pH、电导率、浊度、溶解氧)测量值作为应变量,以受试物浓度和时间作为解释变量,对试验数据做冗余分析和蒙特卡罗检验。冗余分析结果显示,样本分值27.0%的分变异能够被解释变量所解释;蒙特卡罗检验结果显示F=138,P=0.002,这表明三唑磷浓度、时间,以及两者交互作用对水体理化参数特征向量值有显著影响。基于蒙特卡罗检验结果的PRC如图3所示。图3右侧的参数权重排列结果显示,pH、电导率和溶解氧受三唑磷影响较小,浊度受三唑磷影响相对较大。
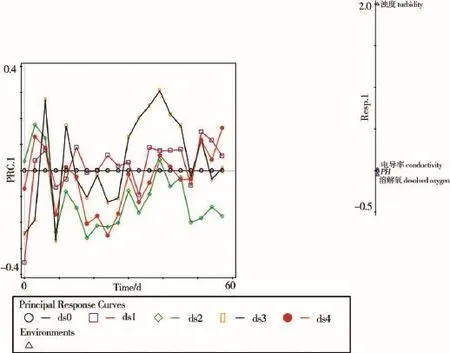
图3 基于水质资料组的主效应曲线及应变量分值示意图
以对数转化的水体理化参数测量值作为应变量,以受试物配制浓度和实测浓度分别作为解释变量,对于试验数据做非限制性排序。后续的PCA结果显示,作为解释变量,三唑磷配制浓度和实测浓度能够解释的变异,在水体理化参数特征向量值总变异中所占比例分别为<0.1%和2.8%。按照时间顺序,对不同浓度下的水体理化参数特征向量值做差异显著性分析和多重比较,其结果如表5所示。
从表5可以看出,在整个试验过程中,水体理化参数特征向量值无显著变化。
对于单个参数测量值做冗余分析和蒙特卡罗检验。前者的结果显示,对于pH、浊度、电导率、溶解氧,分别有22.9%、26.6%、22.8%、15.3%的分变异能够被解释变量所解释;蒙特卡罗检验结果显示,三唑磷浓度、时间,以及两者交互作用对于pH和浊度影响显著(F值分别为149和182,P值分别为0.004和0.004),其对于电导率和溶解氧影响不显著(F值分别为147和90.0,P值分别为0.064和0.288)。
对于介质的光合作用氧生产量(DOP)和呼吸作用氧消耗量(DOR)分别做冗余分析和蒙特卡罗检验。冗余分析结果显示,对于DOP和DOR,分别有11.4%和10.8%的分变异能够被解释变量所解释;蒙特卡罗检验结果显示,三唑磷浓度、时间,以及两者交互作用对于DOP和DOR无显著影响(F值分别为67.6和63.9,P值分别为0.856和0.928)。

表5 水质特征向量多重比较aTable 5 Multiple comparisons of eigenvector values of water qualitya

表6 水体理化参数测量值多重比较aTable 6 Result of multiple comparisons of water quality parametersa
对于测量值受三唑磷浓度、时间,以及两者交互作用影响显著的2个参数(即pH和浊度)分别做非限制性排序和PCA。PCA的结果显示,对于pH,三唑磷配制浓度和实测浓度能够解释的变异在总变异中所占比例分别为<0.1%和0.5%,两者均导致pH下降;对于浊度,三唑磷配制浓度和实测浓度能够解释的变异在总变异中所占比例分别为<0.1%和6.4%,前者导致浊度下降,后者导致浊度上升。
对于上述2个参数,按照时间顺序,对不同浓度下的测量值做差异显著性分析和多重比较,其结果如表6所示。
从表6第2列可以看出,在给药后第33天,介质的pH沿浓度提高方向先降后升。从表6第3列可以看出,在整个试验过程中,介质的浊度无显著变化。
2.4 暴露浓度(Exposure concentrations)
三唑磷在微宇宙系统中的浓度变化如图4所示。从图4中可以看出,三唑磷在微宇宙中降解较快。施药后第7天,52.5 μg·L-1浓度组中的三唑磷,其实测浓度降到10 μg·L-1以下;施药后第57天,低浓度组(0.35μg·L-1和1.75 μg·L-1)中的三唑磷未能检出。
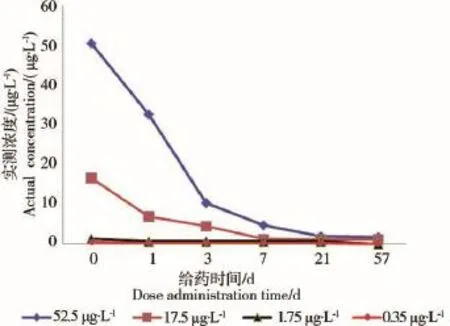
图4 三唑磷在微宇宙系统中的浓度变化
3 讨论(Discussions)
本论文采用排序的方法分析三唑磷对构成水生微宇宙的生物和非生物要素的直接和间接的影响。该方法在农药群落效应分析中的作用近年来逐渐得到认可[20]。
3.1 浮游动物(Zooplankton communities)
限制性排序和蒙特卡罗检验结果显示三唑磷浓度、时间,以及两者交互作用对浮游动物群落结构有显著影响。从PCA结果中可以看出,三唑磷配制浓度和实测浓度能够解释的变异,在群落结构特征向量值总变异中所占比例分别为7.9%和3.5%。这表明比起浓度试验过程中的即时变化,三唑磷起始浓度对浮游动物群落结构的影响更大。这从一个侧面揭示出浮游动物属于三唑磷胁迫的“直接”承受者。对基于非限制性排序的群落结构特征向量值做差异显著性分析和多重比较,结果显示三唑磷对浮游动物的NOECcommunity和LOECcommunity分别为17.5和52.5 μg·L-1。从表1中可以看出,在52.5 μg·L-1处理组,三唑磷对浮游动物群落结构的“显著”影响始于给药当天而止于给药后第9天,其中的第3天和第6天均保持着影响,这相当于Zafer等[19]定义的第3级(class 3)效应。
浓度测定结果表明,给药当天、第3天、第6天和第9天,三唑磷在52.5 μg·L-1处理组的实测浓度平均值分别为50.24、10.33、6.14和4.35 μg·L-1。可见三唑磷浓度降低到4.35 μg·L-1或以下,有可能是群落结构恢复的必要条件。
对单个物种的种群密度做差异显著性分析和多重比较,发现三唑磷抑制绿色湖湾介的NOECspecies和LOECspecies分别为17.5和52.5 μg·L-1(表2)。在52.5 μg·L-1处理组,三唑磷对介形虫的抑制始于给药后第30天并一直延续至试验结束,这相当于Zafer等[19]定义的第4级(class 4)效应。对照表1,人们不难发现两者之间的差别。这种差别提示人们,受试物与群落之间的关系有别于受试物与种群之间的关系。
微宇宙试验开始前,作为预试验,我们检测了三唑磷对浮游动物单个物种急性毒性。结果显示三唑磷对于大型溞、萼花臂尾轮虫和绿色湖湾介的24 h LC50分别为8.38×10-2、9.48×101和1.85×10-1mg·L-1。值得注意的是,基于NOECspecies/LOECspecies的视角,在本项微宇宙试验中,受影响最大的不是单物种试验中显示对三唑磷敏感性最强的大型溞,而是敏感性次强的绿色湖湾介(表2)。这可能是因为相比于大型溞,绿色湖湾介生命周期长,种群接触毒物后恢复缓慢(室内环境下尤其如此)。从这一角度看,介形虫比溞更适合作为杀虫剂胁迫的指示生物。
在水生生态系统中,轮虫对杀虫剂的反应常因为物种、环境条件,以及分析方法的不同而有所差异。例如在室外研究中,Zafar等[19]测得毒死蜱对腹棘管轮虫Mytilina ventralis和等刺异尾轮虫Tricho-cerca similis有刺激作用而对瓷甲异尾轮虫Trichocerca porcellus有抑制作用。又如在室内研究中,刘福光等[21]发现毒死蜱对晶囊轮虫Asplachnasp.、多肢轮虫Polyarthrasp.、龟纹轮虫Anuraeopsissp.有刺激作用而对单趾轮虫Monostylasp.有抑制作用。对于臂尾轮虫Brachionus,前人研究显示杀虫剂可以刺激它们的生长[22-24],但也有研究显示了相反的结果[25]。
鉴于萼花臂尾轮虫对三唑磷的敏感性远低于大型溞和绿色湖湾介。三唑磷不大可能会直接抑制萼花臂尾轮虫的生长。不仅如此,在作为食物竞争者的大型溞和作为捕食者的绿色湖湾介受到三唑磷抑制的条件下,萼花臂尾轮虫的种群生长反而有可能加快。然而单物种PCA和表2的结果均显示这种情况并未发生。这说明萼花臂尾轮虫在本项微宇宙试验中遭受的食物竞争和捕食压力并不强大。
3.2 藻类(Algal communities)
限制性排序和蒙特卡罗检验结果显示,三唑磷浓度、时间,以及两者交互作用对藻类植物群落结构有显著影响。从DCA结果中可以看出,三唑磷实测浓度能够解释的变异在藻类植物群落结构特征向量值总变异中所占比例明显高于配制浓度(两者分别为0.6%和2.3%)。这说明相对于起始浓度,三唑磷浓度在试验过程中的即时变化对于藻类植物群落结构的影响更为明显。这种表象与藻类的“机会主义”生长策略相吻合,也揭示出藻类作为三唑磷胁迫“间接”承受者的角色特征。差异显著性分析和多重比较结果显示,三唑磷影响藻类植物群落结构特征向量值,其程度尚未达到统计学意义上的显著水平(表3)。
预试验结果显示三唑磷抑制藻类生长的72 h EC50介于1.16~2.11×101mg·L-1之间,远高于本项微宇宙试验的给药浓度。由此推断三唑磷不会抑制藻类的生长。相反,在本项微宇宙试验中,藻类的生长有可能因为作为滤食者的大型溞和萼花臂尾轮虫受到三唑磷的抑制而加快。实际情况究竟如何呢?构建本项微宇宙中所用的10种藻类当中,羊角月牙藻、斜生栅藻、菱形藻、莱茵衣藻、普通小球藻、纤维藻属于单细胞藻类。从理论上讲,它们适合作为溞和轮虫的食物来源[23]。图2右侧的物种权重排列结果显示三唑磷浓度、时间,以及两者交互作用对于单细胞藻类种群密度影响不大。针对BAA的蒙特卡罗检验结果从侧面证实了这一点。然而单物种PCA结果显示羊角月牙藻、斜生栅藻、菱形藻因为三唑磷的引入而生长加快。差异显著性分析和多重比较的结果显示,三唑磷对羊角月牙藻的“刺激”效应始于给药后第9天而止于第15天,这相当于Zafer等[19]定义的第3级效应。对于另外2种单细胞藻类,三唑磷的效应(无论是刺激还是抑制)未超过Zafer等[19]定义的第2等级(表4)。这说明虽然幅度有限,单细胞藻类在试验过程中的生长仍有加速。这种恢复显然与浮游动物,特别是溞和介形虫在本项微宇宙试验中所受的压制有关。
3.3 水体理化参数及C循环参数(Water quality C circulation parameters)
限制性排序和蒙特卡罗检验结果显示,三唑磷浓度、时间,以及两者交互作用对于水体理化参数特征向量值影响显著。PCA结果显示,相对于配制浓度,实测浓度在这方面的影响更大。这说明水体理化参数在较大程度上受到三唑磷浓度在试验过程中即时变化的影响。差异显著性分析和多重比较结果显示,三唑磷影响水体理化参数特征向量值,其程度尚未达到统计学意义上的显著水平(表5)。
在以藻类植物作为初级生产者的水生生态系统中,杀虫剂的引入有时会导致水体pH值升高。究其原因,杀虫剂对滤食者的抑制使藻类生长加速,结果导致溶解氧产率上升,CO2吸收加快[14,26];除草剂则会导致相反结果[27-28]。在本项微宇宙试验中,PCA结果显示三唑磷导致水体pH下降。但这一点未能得到针对pH值的差异显著性分析和多重比较结果的证实(表6)。这说明对于pH值,三唑磷的影响尽管存在,其程度却十分微弱。作为整个微宇宙系统营养基础的藻类,其生长未能够因三唑磷的引入而明显加速,可能是造成这一结果的直接原因。此外微宇宙系统与外界的O2和CO2交换也会在一定程度上掩盖水体pH的瞬时变化[26,28]。
三唑磷对浮游动物群落的0~6 d NOECcommunity和LOECcommunity分别为17.5和52.5 μg·L-1。受药后第9天,52.5 μg·L-1处理组的群落结构开始恢复。三唑磷在此刻的实测浓度平均值为4.35 μg·L-1。浮游动物当中受三唑磷影响最大的是绿色湖湾介,试验结束时,该物种仍然未能够从三唑磷的抑制中恢复。
在所测浓度范围内,三唑磷对单细胞藻类羊角月牙藻Selenastrum capricornutum的生长有微弱刺激。
在所测浓度范围内,三唑磷未能明显改变水体pH、电导、浊度和水体C循环状况。
从起始浓度和试验过程中的浓度变化对系统内生物和非生物要素变化的影响程度上推断,三唑磷对大型溞和绿色湖湾介有“直接”影响,其对萼花臂尾轮虫、藻类和水质参数具有一定程度的“间接”影响(即这些影响主要通过种间关系而实现)。
(References):
[1] 中华人民共和国农业部农药检定所.通过有效成份查询产品-三唑磷产品明细[EB/OL].http://www.chinapesticide.gov.cn/service/aspx/B3X.aspx?aiid=AITRZ
[2] 李磊,郭东晖,朱小明.三唑磷和乙酰甲胺磷对海洋桡足类的急性毒性研究[J].厦门大学学报:自然科学版, 2008,47(4):602-606
Li L,Guo D H,Zhu X M.Study on acute toxicity of triazophos and acephate on marine copepods[J].Journal of Xiamen University:Natural Science,2008,47(4):602-606 (in Chinese)
[3] 丁跃平,金彩杏,郭远明,等.三唑磷对海水虾类、蟹类的急性毒性试验[J].浙江海洋学院学报:自然科学版, 2002,21(2):116-118
Ding Y P,Jin C X,Guo Y M,et al.The acute effect of triazophos on prawn and crab[J].Journal of Zhejiang O-cean University:Natural Science,2002,21(2):116-118 (in Chinese)
[4] 周常义,池信才,黄成,等.三唑磷对四种水生生物的毒性及安全评价研究[J].台湾海峡,2003,22(3):319-324
Zhu C Y,Chi X C,Huang C,et al.Study on toxicity and safety evaluation of triazophos on four species of hydrophytic organisms[J].Journal of Oceanography in Taiwan Strait,2003,22(3):319-324(in Chinese)
[5] 谭亚军,李少南,吴小毛.几种杀虫剂对大型溞的慢性毒性[J].农药学学报,2004,6(3):62-66
Tan Y J,Li S N,Wu X M.Chronic toxicity of several insecticides toDaphnia magna[J].Chinese Journal of Pesticide Science,2004,6(3):62-66(in Chinese)
[6] Daam M A,Van den Brink P J.Conducting model ecosystem studies in tropical climate zones-lessons learned from Thailand and way forward[J].Environmental Pollution,2011,159:940-946
[7] Mohr S,Schott J,Maletzki D,et al.Effects of toxicants with different modes of action onMyriophyllum spicatum in test systems with varying complexity[J].Ecotoxicology and Environmental Safety,2013,97:32-39
[8] International Association for Testing Materials(ASTM).E 1366-02,Standard Practice for Standardized Aquatic Microcosms:Fresh Water[S].West Conshohocken,PA,U-nited States:ASTM International,2007
[9] Organization of Economic Cooperation and Development (OECD).OECD guideline for testing of chemicals,No. 211,Reproduction test[S].Paris:OECD,2012
[10] 国家环境保护总局.GB 13200-91水质浊度的测定[S].北京:中国标准出版社,1991
Ministry of Environmental Protection of the People’s Republic of China.GB 13200-91 water quality-determination of turbidity[S].Beijing:Standard Press of China, 1991(in Chinese)
[11] 国家环境保护总局.GB 11913-89水质溶解氧的测定电化学探头法[S].北京:中国标准出版社,1989
Ministry of Environmental Protection of the People’s Republic of China.GB 11913-89 water quality-determination of dissolved oxygen-electrochemical probe method [S].Beijing:Standard Press of China,1989(in Chinese)
[12] 国家环境保护总局.GB 6920-86水质pH值的测定玻璃电极法[S].北京:中国标准出版社,1986
Ministry of Environmental Protection of the People’s Republic of China.GB 6920-86 water quality-determination of pH value-glass electrode method[S].Beijing:Standard Press of China,1986(in Chinese)
[13] 地质矿产部.DZ/T 0064.6-93地下水水质检验方法电导率的测定[S].北京:中国标准出版社,1993
[14] Van den Brink P J,Ter Braak C J F.Principal response curves:Analysis of time-dependent multivariate responses of a biological community to stress[J].Environmental Toxicology and Chemistry,1999,18:138-148
[15] Van den Brink P J,Van Wijngaarden R P A,Lucassen W G H,et al.Effects of the insecticide Dursban®4E(a.i. chlorpyrifos)in outdoor experimental ditches.II.Invertebrate community responses[J].Environmental Toxicology and Chemistry,1996,15:1143-1153
[16] Van den Brink P J,Crum S J H,Gylstra R,et al.Effects of a herbicide-insecticide mixture in freshwater microcosms:Risk assessment and ecological effect chain[J]. Environmental Pollution,2009,157:237-249
[17] Ter Braak C J F,Šmilauer P.Canoco Reference Manual and User’S Guide:Software for Ordination(version 5.0) [M].Ithaca,NY,USA:Microcomputer Power,2012:21-59,292-297
[18] 唐启义.DPS数据处理系统,第一卷基础统计及实验设计(第3版)[M].北京:科学出版社,2013:87-146
Tang Q Y.Data Processing System,Volume 1,EssentialStatistics and Experimental Designs(Third Edition)[M]. Beijing:Science Press,2013:87-146(in Chinese)
[19] Zafar M I,Van Wijngaarden R P,Roessink I,et al.Effects of time-variable exposure regimes of the insecticide chlorpyrifos on freshwater invertebrate communities in microcosms[J].Environmental Toxicology and Chemistry, 2011,30(6):1383-1394
[20] Ippolito A,Carolli M,Varolo E,et al.Evaluating pesticide effects on freshwater invertebrate communities in alpine environment:A model ecosystem experiment[J].Ecotoxicology,2012,21:2051-2067
[21] 刘福光,刘毅华,赵颖,等.毒死蜱对南方稻区水域生态效应的室内微宇宙模拟研究[J].农药学学报,2013, 15(2):198-203
Liu F G,Liu Y H,Zhao Y,et al.Indoor microcosms study on ecological effects of rice paddy applied with chlorpyrifos on zooplankton in south China[J].Chinese Journal of Pesticide Science,2013,15(2):198-203(in Chinese)
[22] Van Wijngaarden R P A,Brock T C M,Douglas M T. Effects of chlorpyrifos in freshwater model ecosystems: The influence of experimental conditions on ecotoxicological thresholds[J].Pest Management Science,2005,61: 923-935
[23] Daam M A,Van den Brink P J,Nogueira A J A.Impact of single and repeated applications of the insecticide chlorpyrifos on tropical freshwater plankton communities [J].Ecotoxicology,2008,17:756-771
[24] López-Mancisidor P,Carbonell G,Marina A,et al.Zooplankton community responses to chlorpyrifos in mesocosms under Mediterranean conditions[J].Ecotoxicology and Environmental Safety,2008,71:16-25
[25] Daam M A,Crum S J H,Van den Brink P J,et al.Fate and effects of the insecticide chlorpyrifos in outdoor plankton-dominated microcosms in Thailand[J].Environmental Toxicology and Chemistry,2008,27:2530-2538
[26] Daam M A,Van den Brink P J.Effects of chlorpyrifos, carbendazim,and linuron on the ecology of a small indoor aquatic microcosm[J].Archives of Environmental Contamination and Toxicology,2007,53:22-35
[27] Daam M A,Rodrigues A M F,Van den Brink P J,et al. Ecological effects of the herbicide linuron in tropical freshwater microcosms[J].Ecotoxicology and Environmental Safety,2009,72:410-423
[28] Cuppen J G M,Van den Brink P J,Camps E,et al.Impact of the fungicide carbendazim in freshwater microcosms.I.Water quality,breakdown of particulate organic matter and responses of macroinvertebrates[J].Aquatic Toxicology,2000,48:233-250◆
Ecological Effects of Insecticide Triazophos in Indoor Microcosms
Yuan Bingqiang,Li Shaonan*
Institute of Pesticide and Environmental Toxicology,Zhejiang University,Hangzhou 310029,China
2 September 2015 accepted 23 October 2015
As a type of organophosphorus compound with moderate toxicity,triazophos is widely used in areas of rice production.To clarify the impact of the insecticide on freshwater ecosystems,five concentrations(0,0.35,1.75, 17.5,and 52.5 μg·L-1)of the insecticide were tested in a set of algal-dominated indoor aquatic microcosms.The data were analyzed by CANOCO 5,a type of software for multivariate data analysis.Results of the unconstrained ordination and the followed multiple comparisons indicated that the highest no-effective concentration and the lowest effective concentration with respect to the eigenvectors of zooplankton communities(i.e.NOECcommunityand LOECcommunity)was 17.5 μg·L-1and 52.5 μg·L-1,respectively,from 0 to 6 d.The communities being exposed to thehighest concentration(i.e.52.5 μg·L-1)recovered at 9 d,and the average value of the actual concentrations at the date was found to be 4.35 μg·L-1.Results of the multiple comparisons with respect to population densities of single-species indicated that the species that was mostly affected wasStrandesia viridis.In group of 52.5 μg·L-1,the populations began to shrink at 30 d and they did not recover at the end of the 57 d exposure.For algae,results of the unconstrained ordination and the followed multiple comparisons showed that the impact of triazophos at community level was not so obvious as to identify the value of NOECcommunityand LOECcommunity.The insecticide was found to induce the population of unicellular speciesSelenastrum capricornutumfrom 9~12 d,with NOECspeciesand LOECspeciesbeing 1.75 μg·L-1and 17.5 μg·L-1,respectively.There was no evidence that the insecticide altered pH,conductivity, turbidity,and carbon cycle of the dilutions.To take the environmental concentrations that was estimated from GNEEC (Version 2.0),which show the peak value of 2.44 μg·L-1,into consideration,results of the study suggest that the triazophos may disturb the intrinsic structure of zooplankton communities close to paddy fields even it was applied at recommended rates,but the insecticide was unlikely to cause unrecoverable damage to the systems.
triazophos;aquatic microcosm;multivariate data analysis;principal response curves
2015-09-02 录用日期:2015-10-23
1673-5897(2016)3-101-14
X171.5
A
10.7524/AJE.1673-5897.20150902001
简介:李少南(1963-),农学博士,副教授,主要研究方向农药生态毒理,1996年以来发表相关领域论文80余篇,拥有发明专利两项。
浙江省自然科学基金(LY12B07008)
袁丙强(1985-),男,硕士,农艺师,研究方向为农药环境毒理,现就职于浙江大学新技术研究院有限公司,E-mail:yuanbingqiang@gmail.com
*通讯作者(Corresponding author),E-mail:snli@zju.edu.cn

