金黄色葡萄球菌植入总量对兔桡骨骨髓炎模型的影响
王晓波,郑 欣,陈一心,邱旭升,朱彦丞,桂雪洋,王骏飞,施鸿飞,熊 进
·论著·
金黄色葡萄球菌植入总量对兔桡骨骨髓炎模型的影响
王晓波,郑欣,陈一心,邱旭升,朱彦丞,桂雪洋,王骏飞,施鸿飞,熊进
目的通过不同量金黄色葡萄球菌植入兔桡骨,观察影像学及组织学变化,探讨兔桡骨骨髓炎动物模型中金黄色葡萄球菌的合适剂量。方法35只成年雄性新西兰兔双侧桡骨制造骨窗,注入不同量(1×104~1×109CFU)的金黄色葡萄球菌作为实验组(A~F组),对照组注入0.1mL生理盐水,每组5只。分别于术后当日、术后2周、4周行X线及CT扫描检查。术后4周完成影像学评分后,处死兔取出桡骨完成肉眼观察评分,再作细菌培养、组织病理学检查并完成组织学评分。结果F组兔因感染过重死亡2只;C、D、E、F组术后4周体重明显减轻,平均减轻量分别为(75.6±24.9)g、(119.0±42.7)g、(184.1±51.7)g、(194.9±63.2)g,体重改变组间无明显差异(P>0.05),切口渗出较多,可见窦道形成。术前术后体重变化、肉眼观察评分、影像学评分和组织学评分LSD法比较,P<0.05。术后4周影像学、肉眼观察及组织学检查D组只可见少量的骨感染表现,而E、F组可见严重的骨感染表现;E组及F组的肉眼观察评分[(2.6±0.2)和(2.8±0.1)]、影像学评分[(17.6±0.3)和(19.4±0.2)]和组织学评分[(7.2±1.1)和(8.4±0.2)]明显高于其他五组(P<0.05);细菌学检查仅D、E、F三组培养出细菌。结论兔桡骨急性骨髓炎动物模型制作的最佳细菌量为1×108CFU,本实验的方法简单易行,适用于建立骨髓炎动物模型。
桡骨; 骨髓炎; 骨感染; 细菌; 模型; 兔
随着交通事故的频繁发生,各种开放性骨折日益增加,并通常伴有感染和骨缺损而导致骨不愈合,其治疗是骨科临床中的一大难题[1-2]。感染性骨缺损动物模型的建立为其研究提供了思路和方向,目前常用先建立骨髓炎再清创制造骨缺损的方法来建立感染性骨缺损动物模型[3]。不同实验动物不同部位所需的细菌用量不同,实验中若细菌用量过多则易导致实验动物严重感染而死亡,而用量不足则实验动物无法感染致建模失败。由于兔桡骨有其独特的优势常用于骨髓炎模型的制作,但其细菌用量目前文献报道各有差异[4-5]。本实验通过对兔桡骨注射不同量细菌后评价其是否感染,以确定兔桡骨骨髓炎动物模型中金黄色葡萄球菌的最佳细菌用量,为骨感染的研究提供依据。
材料与方法
1材料
雄性新西兰兔35只(6月龄,体重2.0~2.5kg,南京大学医学院附属鼓楼医院动物实验中心提供),已排除先天性畸形、营养不良等疾病;金黄色葡萄球菌ATCC25923(杭州天和微生物有限公司,来自美国模式培养物集存库);戊巴比妥钠、氯胺酮;常规手术器械1套,牙科钻(STRONG 90磨钻),游标卡尺、直尺;CT(Discovery CT 750HD,美国GE公司),X 射线摄片机(Digital Diagnost,荷兰PHILIPS 公司);比浊仪(DENSIMAT,法国BIOMERIEUX公司)。
2实验分组及模型制作
利用比浊仪对金黄色葡萄球菌进行定量后浓缩制成浓度为1×1010CFU/mL的菌液,再分别稀释制成每0.1mL有1×109CFU 、1×108CFU、1×107CFU、1×106CFU、1×105CFU、1×104CFU细菌浓度的细菌液。选用35只6月龄雄性健康新西兰兔随机分为7组,每组5只,分别为对照组(0.1mL生理盐水)、A组(1×104CFU)、B组(1×105CFU)、C组(1×106CFU)、D组(1×107CFU)、E组(1×108CFU)和F组(1×109CFU),双侧手术共计70侧。
采用氯胺酮50mg/kg肌肉注射后,3%戊巴比妥钠20mg/kg耳缘静脉麻醉,双侧前臂备皮,取仰卧位固定于兔板,手术区消毒,铺无菌单。于前臂桡侧中下段切开皮肤、皮下组织及筋膜,分离肌肉以显露桡骨骨膜,在桡骨中下段用高转速牙科钻钻取直径3mm的孔后吸出桡骨中上段的骨髓(图1);将兔桡骨远端抬起,分别注入0.1mL生理盐水作为对照或不同量的金黄色葡萄球菌后用骨蜡封闭骨窗(图1)。依次缝合肌膜及皮下组织、皮肤,碘伏消毒切口并仔细包扎,单笼饲养。
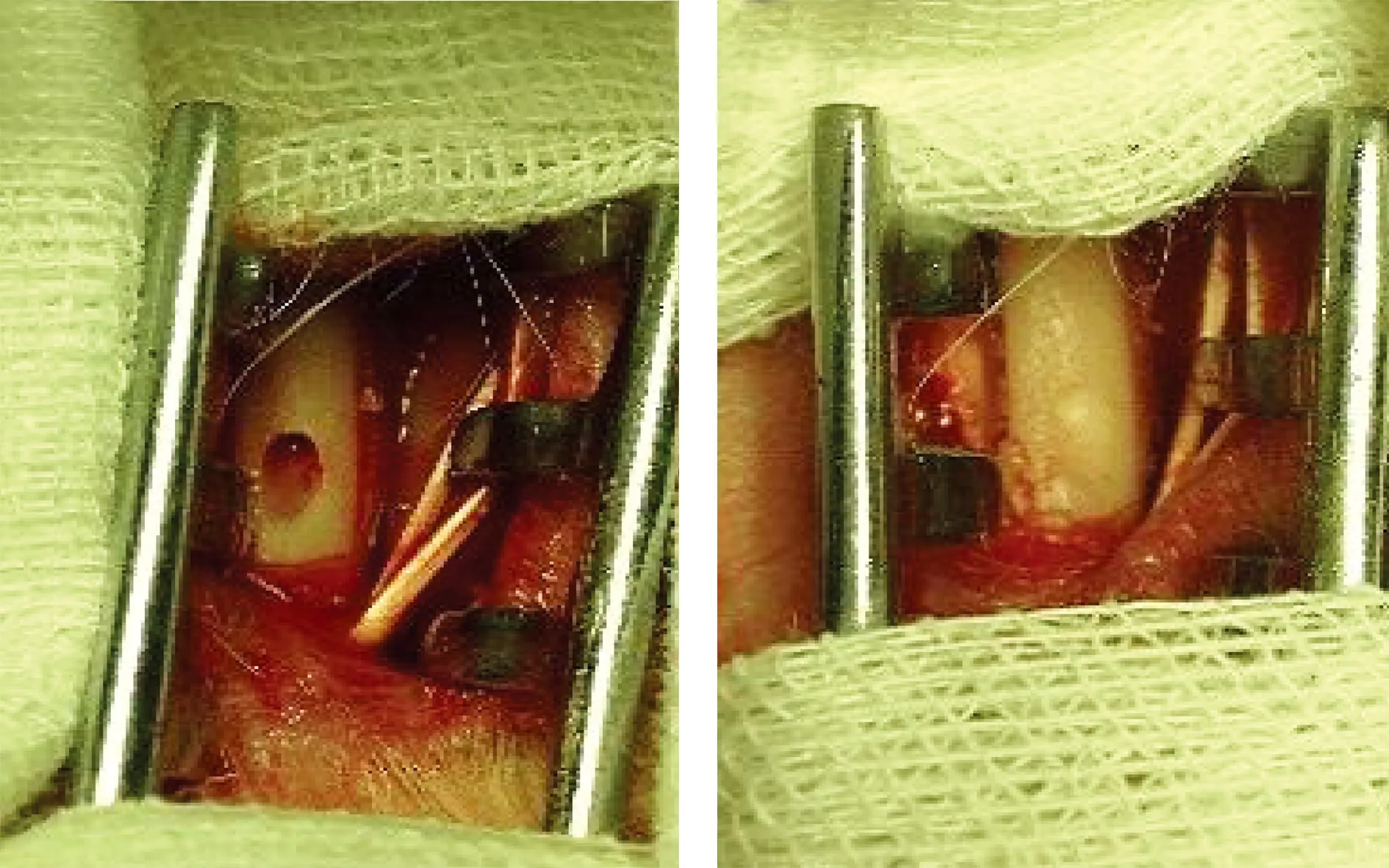
ab
图1造模实验术中照片。a.术中兔桡骨钻孔并清除桡骨近端骨髓腔骨髓注入细菌;b.注入细菌后利用骨蜡封闭骨窗,防止菌液外溢
3肉眼、影像学观察
术后观察动物的进食、活动等一般情况,记录兔切口部位的渗出情况、有无脓液流出、有无窦道形成等,记录死亡情况。术前及术后4周分别称量各新西兰兔的体重,计算体重变化。术后4周处死动物,并再次沿原切口进入暴露桡骨,观察骨形态及周围软组织情况。采用唐辉和徐永清[6]的方法,双盲完成肉眼观察评分,包括0~3分:0分,无感染征象;1分,皮肤表面仅有少量红斑;2分,红斑合并桡骨干增粗及窦道形成,或合并脓液渗出;3分,严重骨质吸收、脓肿。术后当日、术后2、4周分别行X线及CT扫描检查,观察桡骨的变化及术中所作缺损孔的大小变化,并借鉴Ambrose等[3]的方法,完成影像学评分:骨膜厚度、骨小梁结构变形、骨干拓宽、新骨形成、软组织结构变形,每个参数评分为0~4分;孔大小评分,术后分别测量每只实验兔桡骨孔的最大直径(mm),孔完全闭合记为0分、最大直径0~1mm为1分、1~2mm为2分、2~3mm为3分、≥3mm记为4分,分别计算每只实验兔的放射学参数总分。
4细菌学及组织学检查
术后4周处死实验动物并沿原切口暴露取桡骨骨髓腔内容物及周围软组织涂于血琼脂培养板上,在37℃恒温培养箱中培养24h,分别作细菌学培养。同时将取出的桡骨用磷酸盐缓冲液(PBS)冲洗后所有标本在体积分数3%的甲醛溶液中固定24h,10%的乙二胺四乙酸(EDTA)溶液脱钙,每3d更换一次脱钙液。脱钙完全后,行石蜡包埋,组织切片的厚度为5μm,用苏木精-伊红染色观察作组织学检查,并参照Ambrose等[3]的方法,完成组织学评分。细菌情况:显著脓肿形成3分,中等量脓肿形成2分,少量脓肿形成1分,无脓肿形成0分;骨内炎症情况:严重炎症、纤维化、脓肿3分,中等炎症、纤维化2分,少量炎症、纤维化1分,无炎症、仅纤维化 0分;新骨形成比例:<25%3分,25%~50% 2分,50%~75%1分,75%~100%0分。
5统计学分析
结 果
1一般情况
所有兔术后均出现精神萎靡,但对照组及A、B、C三组实验兔术后一周精神缓慢恢复,切口无明显渗出。D、E、F组实验兔术后观察期内精神状态一直欠佳,饮食较少,体重明显减轻,切口有大量渗出,并有窦道形成(图2),F组因感染过重于术后5、8d分别死亡1只。各组体重变化情况如表1,对照组及A、B三组术后4周体重较术前明显增加,C、D、E、F四组术后4周体重明显减轻。各组LSD法比较P<0.05,具体组间比较如下:对照组与A、B组体重增加无显著差异(P>0.05),而与其余组相比差异显著(P<0.05);A组与B组差异无统计学意义(P>0.05),而A、B组与C、D、E、F组均有显著差异(P<0.05);C、D、E、F组之间体重变化差异不显著(P>0.05)。术后4周处死实验兔暴露桡骨后可见D、E组桡骨周围软组织大量坏死、液化并机化包裹形成脓肿(图2)。肉眼观察评分分布如表2,各组LSD法比较P<0.05,具体组间比较如下:对照组与A组间无显著差异(P>0.05),与其余各组差异显著(P<0.05),A组与B组差异无统计学意义(P>0.05),与C、D、E、F组差异具有显著性(P<0.05);B组与C组差异不显著(P>0.05),与D、E、F三组差异显著(P<0.05);C组与D组差异无统计学意义(P>0.05),而与E、F组差异有统计学意义(P<0.05);D、E、F组之间有显著差异(P<0.05);相邻组间肉眼观察评分比较从D组与E组开始出现统计学差异(P<0.05)。
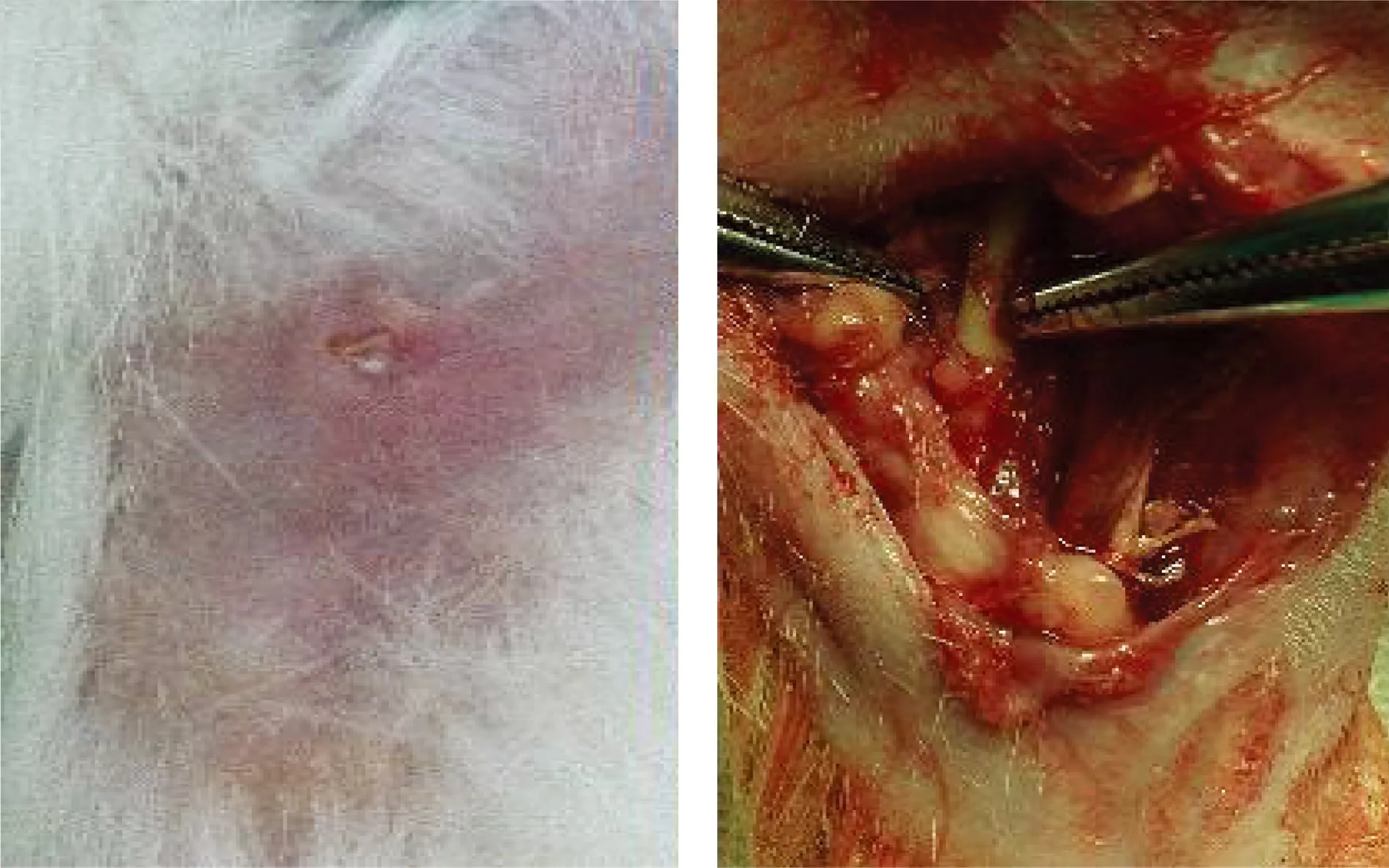
ab
图2造模术后4周外观及切开暴露后照片。a.术后4周E组兔桡骨皮肤表面仍存在窦道,并有少量脓性分泌物渗出; b.术后4周沿原切口切开皮肤暴露桡骨可见骨缺损仍存在,与术中相比并无缩小,周围软组织大量液化、坏死并存在大量机化包裹形成的脓肿
2影像学检查
A、B、C三组术后4周CT三维重建显示术中所钻孔已经完全愈合(图3),X线摄片未见明显的骨质破坏及骨密度降低,而D、E、F三组孔大小术后4周与术前无明显变化(图3),其中D组只可见少量的骨组织破坏,而E、F组可见明显的骨皮质反应及骨密度减低,骨溶解,呈虫蚀样破坏,轻度到广泛的新骨形成,骨干畸形,桡骨远端有死骨形成(图3)。影像学评分均值如表2,各组LSD法比较P<0.05,具体组间比较如下:对照组与A组差异不显著(P>0.05),其余各组间差异均具有统计学意义(P<0.05);相邻组间影像学评分比较从A组与B组开始出现显著统计学差异(P<0.05),其中B组和C组的影像学评分改变幅度较大。
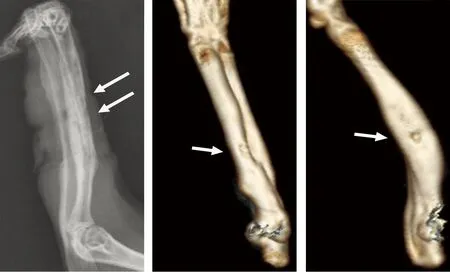
abc
图3术后4周兔桡骨X线及CT三维重建图。a.术后4周E组X线,箭头处可见骨密度减低,骨溶解,呈虫蚀样破坏,广泛的新骨形成,骨干畸形,桡骨远端有死骨形成;b.术后4周C组尺桡骨CT三维重建图,箭头处可见术中所钻孔变小,CT软件测量直径约为2mm;c.术后4周C组尺桡骨CT三维重建图,箭头处可见术中所钻孔依然较大,CT软件测量直径约为3mm
3细菌学检查
A、B、C三组术后4周骨髓腔内容物及周围软组织均未检查出细菌;而D、E、F三组均培养出细菌,为金黄色葡萄球菌。
4组织学检查
(1)大体病理:对照组及A、B、C三组无明显的脓肿形成,D、E两组可见少量的脓肿形成,F组可见明显的软组织肿胀,切开后可见黄白色脓液、较黏稠,符合金黄色葡萄球菌脓液的特点。D、E、F三组骨组织上可见死骨的外观发暗,与正常的骨组织有明显区别(图4)。(2)显微病理:镜下观察可见明显急慢性炎症表现,大量浆细胞和淋巴细胞集中,骨小梁结构破坏溶解,死骨可见大量的骨小梁结构破坏松散,骨细胞消失,形成大片嗜伊红组织即脓肿。(3)组织学观察评分见表2,各组LSD法比较P<0.05,具体组间比较如下,对照组与A组均无显著差异(P>0.05),与其余组均有统计学差异(P<0.05);A组与除对照组外的组别差异均具有显著性(P<0.05);B组与C组无明显差异(P>0.05),与C、D、E、F组具有显著性差异(P<0.05);C组与除B组外的组别差异均具有统计学意义(P<0.05);D组与其余组均具有显著差异(P<0.05);E组及F组显著高于对照组和A、B、C、D组(P<0.05),同时,E组与F组之间也有统计学差异(P<0.05)。
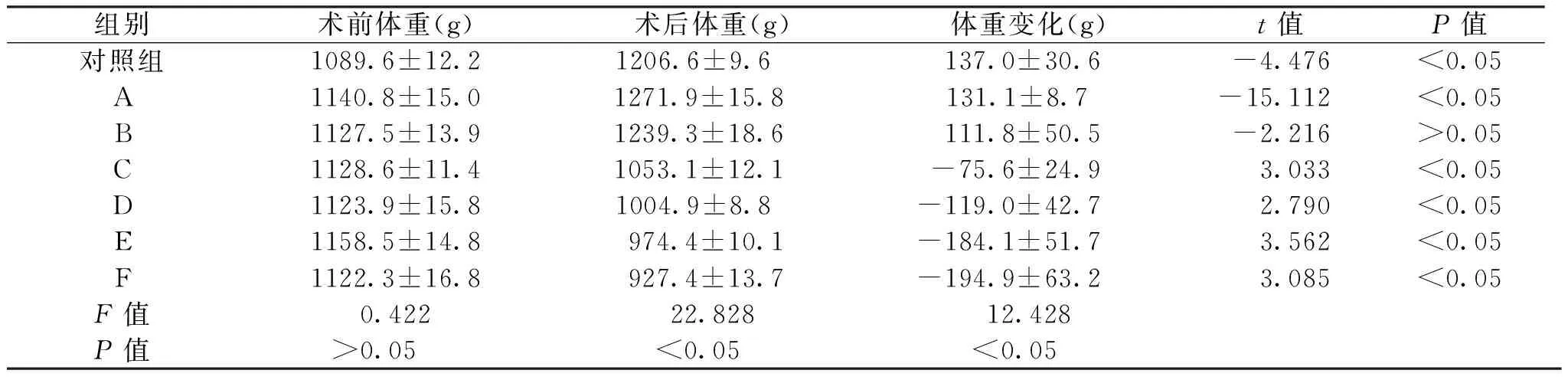
表1 术前与术后4周兔体重变化表
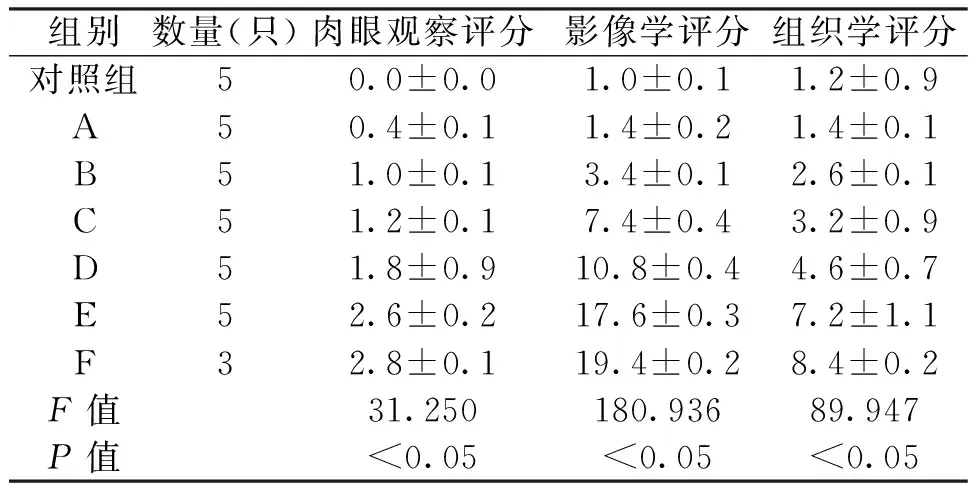
表2 肉眼观察、影像学及组织学评分表

abc
图4兔桡骨标本大体及镜下图。a.术后4周E组取出的兔桡骨大体标本图,黑色框内为术中所钻注入细菌的孔,红色框内为死骨,可见骨组织明显发暗;b.E组桡骨病理切片图(40×),可见骨小梁溶解破坏,骨组织大量破坏,骨连续性不完整;c.E组桡骨病理切片图(100×),可见大量的中性粒细胞及淋巴细胞聚集,形成骨脓肿
讨 论
近年来骨组织工程学不断发展,利用组织工程的方法来治疗骨感染已成为目前研究的热点[7],而建立实验动物的骨感染模型是其研究的基础。本研究制作的为急性骨感染模型,可在后续研究中用于药物、植入物相关感染等研究。同时,早期的骨髓炎模型与患者发病后的就医时间较为相近,更好地为临床骨髓炎或骨感染治疗的研究提供参考依据。新西兰兔在常用的实验动物中较易感染且实验成本较小而被用于各种骨组织工程研究。兔前臂桡骨和尺骨解剖学融合在一起,可在后续实验中比较完整地进行截骨手术,建立节段性感染性骨缺损模型,而不需要内固定或外固定。因此本研究中笔者选择兔桡骨制作急性骨髓炎模型[8]。众多实验表明[8-10],在兔骨髓腔内注入细菌后4周,兔桡骨急性骨髓炎即可确诊,因此本研究以术后4周作为观察期。
建立兔骨感染模型时既要保证骨成功感染的比例又需要控制感染的严重程度,所以确定合适的细菌量尤为必要,然而,对于细菌的用量一直存在争议。本研究对此进行探讨发现,若要出现明显的骨感染征象如大体观察、影像学和组织学的改变,需至少注入金黄色葡萄球菌1×108CFU,但当注入1×109CFU的金黄色葡萄球菌时,实验兔死亡率较高,笔者的研究中5只即出现2只死亡。而Gillaspy等[9]研究表明,当植入兔桡骨细菌量低于2×105CFU时,1个月后6只实验兔中仅有1只确定骨感染。Smeltzer等[5]兔桡骨感染模型研究中也发现,当在桡骨中段截取1cm骨缺损时,至少需植入1×105CFU金黄色葡萄球菌才能保证实验的成功率在95%以上,但植入1×103CFU时仍可保持75%的感染率:当植入2×105CFU金黄色葡萄球菌时,所有兔骨和软组织均有骨感染表现;当植入2×103CFU金黄色葡萄球菌时,桡骨感染率约为75%,软组织感染率仅为50%。Nelson等[11]在52只兔桡骨截取1cm骨缺损后注入1×106CFU的金黄色葡萄球菌建立感染性骨缺损模型也观察到,12周后所有兔均有红肿、发热、脓肿及窦道形成。上述两位学者的研究在术中制造了1cm的大段骨缺损,其大段骨缺损的存在可能促进了兔桡骨的感染,且骨缺损在注入细菌后未用骨蜡封闭,细菌可从骨缺损部位溢出,到达周围软组织内,周围软组织内因手术大量瘀血、肌肉组织坏死等营养丰富,为细菌大量增殖提供营养基础。因此,所用金黄色葡萄球菌量分别与本研究B组和C组相当即成功建模。以上研究均未加入其他因素促进骨感染率,如硬化剂、异体骨移植、热损伤、骨破坏等。Evans等[10]为研究不同骨损伤环境对于急性骨髓炎的影响,在兔桡骨骨髓腔中注入1×108CFU的金黄色葡萄球菌ATCC25923,12只实验兔仅有2只出现急性骨髓炎表现,即感染率仅有17%;而当植入死骨后,植入相同量的细菌28只实验兔有26只出现骨感染表现,感染率达到93%,本研究由于使用高转速牙科钻,在制造骨窗中可导致骨窗周围温度过高而形成死骨,因此与Evans等[10]植入死骨组的细菌量相仿。而李云飞等[12]利用骨髓穿刺的方法,用12号注射针头由兔胫骨结节刺入兔胫骨骨髓腔中,注入1×108CFU的金黄色葡萄球菌,术后40只实验兔中有37只有明显的胫骨骨髓炎表现。该模型的建模中未用骨蜡封闭骨缺损部位,且术中以干棉签按压止血,菌液因被棉签吸附而致实际注入菌液量较少,因此其虽未加入死骨,但结果仍与本实验相当。
本实验具有以下不足:(1)研究每组样本量较少,需进一步扩充样本量获得可靠的数据;(2)为确定急性骨髓炎模型的制作成功,本研究采用的观察时间为4周,未对4周后的结果进行观察,但鉴于后两组感染的严重性,可以预见,在8周后,仍可观察到兔桡骨较重的骨感染症状。
综上所述,本研究表明,当使用高速牙科钻钻孔注入细菌并封闭骨窗的方法,制作兔桡骨急性骨髓炎动物模型时,注射细菌量达到1×108CFU为最佳剂量,可达到明显的放射学、细菌学和组织学改变,适用于急慢性骨髓炎研究中的模型制备。
[1] Niikura T,Lee SY,Sakai Y,et al.Causative factors of fracture nonunion: the proportions of mechanical, biological,patient-dependent,and patient-independent factors[J].J Orthop Sci,2014,19(1):120-124.
[2] 石展英,赵良军,李百川,等.锁定加压钢板外固定治疗股骨远端骨折术后感染[J].中华实验外科杂志,2014,31(7):1601-1602.
[3] Ambrose CG,Clyburn TA,Louden K,et al.Effective treatment of osteomyelitis with biodegradable microspheres in a rabbit model[J].Clin Orthop Relat Res,2004,(421):293-299.
[4] Brown TL,Spencer HJ,Beenken KE,et al.Evaluation of dynamic [18F]-FDG-PET imaging for the detection of acute post-surgical bone infection[J].PLoS One,2012,7(7):e41863.
[5] Smeltzer MS,Thomas JR,Hickraon SG,et al.Characterization of a rabbit model of staphylococcal osteomyelitis[J].J Orthop Res,1997,15(3):414-421.
[6] 唐辉,徐永清.耐药金黄色葡萄球菌注射总量对兔感染性骨缺损形成的影响[J].中国矫形外科杂志,2009,17(9):700-702.
[7] Ferguson JY,Dudareva M,Riley ND,et al.The use of a biodegradable antibiotic-loaded calcium sulphate carrier containing tobramycin for the treatment of chronic osteomyelitis: a series of 195 cases[J].J Bone Joint,2014,96-B(6):829-836.
[8] An YH,Kang QK,Arciola CR.Animal models of osteomyelitis[J].Int J Artif Organs,2006,29(4):407-420.
[9] Gillaspy AF,Hickmon SG,Skinner RA,et al.Role of the accessory gene regulator (agr) in pathogenesis of staphylococcal osteomyelitis[J].Infect Immun,1995,63(9):3373-3380.
[10] Evans RP,Nelson CL,Harrison BH,et al.THE CLASSIC: The effect of wound environment on the incidence of acute osteomyelitis[J].Clin Orthop Relat Res,2005,439:4-9.
[11] Nelson CL,McLaren SG,Skinner RA,et al.The treatment of experimental osteomyelitis by surgical debridement and the implantation of calcium sulfate tobramycin pellets[J].J Orthop Res,2002,20(4):643-647.
[12] 李云飞,赵明东,戴文达,等.兔耐甲氧西林金黄色葡萄球菌慢性骨髓炎模型[J].中华实验外科杂志,2007,24(4):503-504.
(本文编辑: 郭卫)
Effect of the total implantation amount of Staphylococcus aureus in rabbit model of bone osteomyelitis
WANGXiao-bo,ZHENGXin,CHENYi-xin,QIUXu-sheng,ZHUYan-cheng,GUIXue-yang,WANGJun-fei,SHIHong-fei,XIONGJin
(Department of Orthopaedics,Nanjin Drum Tower Hospital the Affiliated Hospital of Nanjing University Medical School, Nanjing210008,China)
ObjectiveThrough implantation of different doses of Staphylococcus aureus into radial bone in rabbits,to observe the radiographic and microbial changes and to discuss an appropriate dose of Staphylococcus aureus in rabbit model of bone osteomyelitis. MethodsBone defects were made bilaterally in the radius of 35 male New Zealand rabbits. Different doses of staphylococcus aureus were inoculated as the experimental group A-F(1×104CFU for group A, 1×105CFU for group B,1×106CFU for group C,1×107CFU for group D,1×108CFU for group E,and 1×109CFU for group F). 0.1mL saline solution was injected into each rabbit in the control group(n=5). X-ray and CT were taken immediately after surgery,2-week,and 4-week postoperatively. The radiographic score,visual inspective score and histological score were estimated four weeks postoperatively. The rabbits were sacrificed four weeks after surgery and the specimens were harvested for pathologic analysis and bacterial cultivation. ResultsAnorexia and lassitude were observed in all rabbits. In group F,two rabbits died from infection and thus were excluded from analysis. Body weight loss was observed in group C[(75.6±24.9)g],group D[(119.0±42.7)g],group E[(184.1±51.7)g],and group F[(194.9±63.2)g],but there was no significant statistical difference in body weight change in these groups(P>0.05). LSD comparison showed that there were statistical differences in body weight,radiographic score,visual inspection score and histological score between preoperatively and postoperatively(P<0.05). The radiographic,visual inspective and histological appearance of osteomyelitis were evident in group E and F,but mild in group D. The radiographic score,visual inspection score and histological score were significantly higher in group E(2.6±0.2,17.6±0.3 and 7.2±1.1) and group F(2.8±0.1,19.4±0.2 and 8.4±0.2) than those of other groups(P<0.05). Bacteria culture showed positive in group D,E and F,but negative in other groups. ConclusionThe suitable dose of staphylococcus aureus should be 1×108CFU. The method of this investigation is convenient and satisfactory,which may be considered as an alternative to establish the radius osteomyelitis model in rabbits.
radius; ostemyelitis; bone infection; bacteria; model; rabbit
1009-4237(2016)07-0415-05
国家自然科学基金项目(81401793); 江苏省六大人才高峰项目(2012-WS-092); 南京市卫生局项目(ZKX12026、YKK13079); 江苏省研究生科研创新项目(省助SJZZ_0030)
210008 江苏,南京大学医学院附属鼓楼医院骨科
陈一心,E-mail:chenyixin93@126.com
R 63
A【DOI】 10.3969/j.issn.1009-4237.2016.07.009
2015-03-12;
2016-04-12)

