不同大豆品种11S球蛋白结构特性与表面疏水性关系研究
李丹,刘春雷,江连洲
(1.宁德师范学院,福建宁德352100;2.东北农业大学食品学院,哈尔滨 150030)
不同大豆品种11S球蛋白结构特性与表面疏水性关系研究
李丹1,刘春雷1,江连洲2*
(1.宁德师范学院,福建宁德352100;2.东北农业大学食品学院,哈尔滨150030)
以6个代表性大豆品种制备11S球蛋白,研究大豆11S球蛋白结构特性与表面疏水性关系。采用ANS荧光探针法测定表面疏水性,Ellman试剂分析法测定巯基和二硫键含量,激光拉曼光谱和荧光光谱分析空间构象。结论表明,大豆11S球蛋白表面疏水性与α-螺旋含量、β-折叠含量负相关,与β-转角含量、无规则卷曲含量正相关;与拉曼光谱色氨酸费米共振I1360/I1340值负相关,与拉曼光谱酪氨酸费米共振I850/I830值正相关,与暴露酪氨酸残基克分子数正相关,与N暴露∶N包埋值正相关;与暴露巯基含量、巯基暴露程度正相关,与游离巯基含量、二硫键含量、二硫键构象相关性不显著。
大豆11S球蛋白;拉曼光谱;荧光光谱;巯基和二硫键;表面疏水性
网络出版时间2016-7-20 11:10:55[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160720.1110.010.html
李丹,刘春雷,江连洲.不同大豆品种11S球蛋白结构特性与表面疏水性关系研究[J].东北农业大学学报,2016,47(7):32-39.
Li Dan,Liu Chunlei,Jiang Lianzhou.Relationship between structure characteristics and surface hydrophobicity of 11S with different soybean varieties[J].Journal of Northeast Agricultural University,2016,47(7):32-39.(in Chinese with English abstract)
大豆11S球蛋白是大豆蛋白质主要成分之一,对大豆蛋白质功能性质起决定性作用[1]。表面疏水性是重要蛋白质表面性质,是衡量蛋白质功能性质关键指标之一,研究蛋白质表面疏水性有助于更好地理解和预测蛋白质功能性质。近年来大量研究表明,蛋白质表面疏水性与理化性质、结构特性等密切相关,大豆蛋白质结构特性和理化性质随大豆品种和产地不同有差异[2],但研究大多以SPI为研究对象,无法排除大豆蛋白7S和11S组分协同作用。采用纯品大豆11S和7S球蛋白研究品种差异对大豆蛋白质结构特性及表面疏水性影响,探讨大豆蛋白质结构特性与表面疏水性构效关系,在国内外鲜有报道。
本研究选择我国具有区域代表性6个大豆品种,制备纯品大豆11S球蛋白,分析不同品种大豆11S球蛋白巯基基团组成、空间构象及表面疏水性,探讨不同大豆品种11S球蛋白结构特性与表面疏水性关系,为明确大豆蛋白质组成、空间构象与表面疏水性构效关系奠定理论基础,为开发SPI特定功能性产品提供参考。
1 材料与方法
1.1材料与仪器
材料:大豆,东农42(东北农业大学大豆研究所提供);黑农46、合丰55(黑龙江省农业科学院大豆所提供);冀豆12(河北省农林科学院粮油作物研究所提供);皖豆28(安徽省农业科学院作物研究所提供);福豆234(福建省农业科学院作物研究所提供)。大豆粉碎后过40目筛,正己烷脱脂,得脱脂大豆粉,以脱脂豆粉为原料制备大豆11S球蛋白,凯氏定氮和SDS-PAGE电泳综合分析其纯度均在95%以上[3]。
试剂:ANS(1-苯胺基-8-萘磺酸)、DTNB(5,5'-二硫双-2-硝基苯甲酸)、Na2EDTA、Tris(三羟甲基氨基甲烷)、甘氨酸均为Sigma公司,β-巯基乙醇为优级纯,其余试剂为国内分析纯。
主要仪器:PerkinElmer Raman Station 400拉曼光谱仪(美国PE公司),F-4500荧光分光光度计(日本HITACHI公司),Allegra64R台式高速冷冻离心机(美国贝克曼公司),722型可见分光光度计(上海光谱仪器有限公司)。
1.2方法
1.2.1表面疏水性测定
采用ANS荧光探针法[4]。
1.2.2巯基和二硫键含量测定
采用Ellman试剂分析方法,即DNTB比色法[5],做适当调整。
暴露巯基含量测定:称取约15 mg样品溶于5 mL Tris-Gly缓冲液中,漩涡振荡,加入50 μL Ellman试剂,混匀后于(25±1)℃恒温水浴中保温1 h,10 000×g离心15 min,上清液测定412 nm处吸光值,以试剂空白调零,测定样品空白,计算暴露巯基含量。
游离巯基含量测定:游离巯基包括暴露巯基和包藏在蛋白质内部巯基。称取约15 mg样品溶于5 mL Tris-Gly-8 M Urea溶液中,漩涡振荡,加入100 μL Ellman试剂,混匀后于(25±1)℃恒温水浴中保温1 h,10 000×g离心15 min,上清液测定412 nm处吸光值,以试剂空白调零,同时测定样品空白,计算游离巯基含量。
二硫键含量测定:总巯基基团由游离巯基和二硫键两部分组成。总巯基基团测定方法如下:称取约15 mg样品,溶于10 mL尿素-盐酸胍混合液和100 μL β-巯基乙醇,将此混合物在(25±1)℃恒温水浴中保温1 h,取出加入20 mL 12%TCA溶液,(25±1)℃恒温水浴中再次保温1 h,5 000×g离心10 min。沉淀分散在20 mL 12%TCA溶液中,然后离心除去β-巯基乙醇,重复2次后将沉淀溶解于10 mL Tris-Gly-8 M Urea溶液,漩涡振荡至完全溶解。取稀释到适宜浓度样品溶液5 mL,加Ellman试剂100 μL,漩涡混匀后于(25±1)℃恒温水浴中保温1 h,10 000×g离心15 min,上清液测定412 nm处吸光值,以试剂空白调零,同时测定样品空白,计算总巯基基团含量。总巯基基团含量减去游离巯基含量,差值再除以2,即为二硫键含量。
巯基含量计算公式如下:
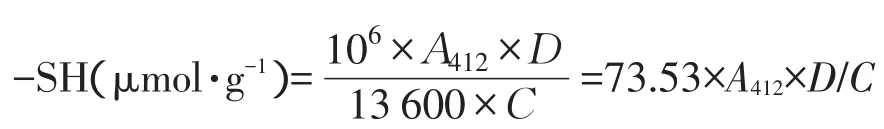
式中,A412-除去样品空白和试剂空白后吸光值;D-稀释倍数;C-样品中蛋白质含量(g·L-1);13 600-Ellman试剂摩尔吸光系数,(L·(mol·cm)-1>。
1.2.3激光拉曼光谱(Raman)测定
参考张萍方法[6]。将样品粉末直接平铺在载玻片上测定,激发光波长为785 nm,激光功率为300 mW,扫描范围400~2 000 cm-1,每次扫描时间60 s,积分10次,四次扫描进行累加。谱图基线校正、谱峰归属查找采用ACD Labs V12软件。以苯丙氨酸谱峰(1 003±1)cm-1强度作为归一化因子,得到不同品种大豆11S球蛋白拉曼光谱,采用Origin 8.0软件绘制。
1.2.4荧光光谱测定
[7]方法。采用F-4500荧光分光光度计测定不同品种大豆11S球蛋白内源性荧光光谱(色氨酸荧光光谱)。将样品分别分散于pH 7.6磷酸盐缓冲液中,配成浓度为0.4 mg·mL-1蛋白溶液。荧光发射光谱分析以蛋白质分子内部色氨酸荧光基团为探针,为降低酪氨酸贡献,荧光光谱激发波长为290 nm,发射光谱扫描范围为300~400 nm,激发狭缝和发射狭缝宽均为5 nm。
1.2.5统计与分析
单项试验重复3次,结果表示为均值±标准差。采用SPSS V18.0软件对数据进行单因素方差分析和相关性分析,如方差分析差异性显著(P<0.05),则使用Duncan作多重比较。采用Origin 8.0软件进行图谱分析和图表制作。
2 结果与分析
2.1表面疏水性分析
如图1所示,6个品种大豆11S球蛋白表面疏水性指数在1 432.73~1 623.00之间(P<0.01),东农42-11S(1 623.00)>合丰55-11S(1 588.43)>黑农46-11S(1 561.13)>冀豆12-11S(1 486.93)>皖豆28-11S(1 463.93)>福豆234-11S(1 432.73)。可见,品种差异对大豆11S球蛋白表面疏水性影响极显著,这可能与不同品种大豆11S球蛋白结构特性差异有关。
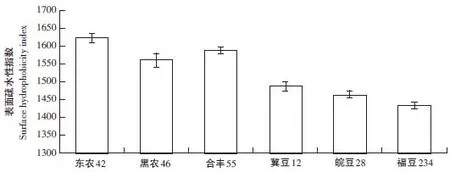
图1 不同品种大豆11S球蛋白表面疏水性Fig.1Surface hydrophobicity of 11S with different soybean varieties
2.2主链二级结构与表面疏水性关系
蛋白质主链构象主要由拉曼光谱酰胺Ⅰ带(1 630~1 690 cm-1)和酰胺Ⅲ带(1 225~1 310 cm-1)特征峰确定,不同品种大豆11S球蛋白拉曼光谱见图2。酰胺Ⅰ带结构归属普遍认为:α-螺旋结构在1 645~1 658 cm-1;β-折叠结构在1 665~1 680 cm-1;β-转角结构在1 640~1 644和1 681~1 690 cm-1;无规则卷曲结构在1 659~1 664 cm-1[8]。而酰胺Ⅲ带结构归属尚存在矛盾[9-11]。理论上酰胺Ⅰ带和酰胺Ⅲ带给出主链构象定量信息应一致,考虑酰胺Ⅲ带谱峰结构归属矛盾性,本研究仅对不同品种大豆11S球蛋白拉曼光谱酰胺Ⅰ带定量分析,采用Raman Spectral Analysis Package Version 2.1软件完成,结果见表1。
由表1可知,品种差异对大豆11S球蛋白二级结构四种类型α-螺旋、β-折叠、β-转角和无规则卷曲含量影响极显著。相关性分析表明,大豆11S球蛋白表面疏水性与α-螺旋含量呈显著负相关(r=-0.899,P=0.015),与β-折叠含量呈显著负相关(r=-0.906,P=0.013),与β-转角含量呈显著正相关(r=0.848,P=0.033),与无规则卷曲含量呈显著正相关(r=0.882,P=0.020)。
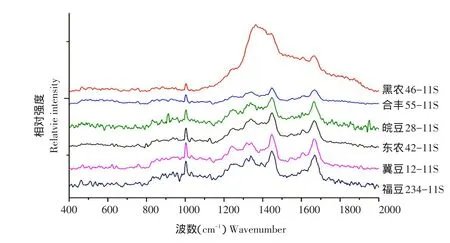
图2 不同品种大豆11S球蛋白拉曼光谱Fig.2Raman spectrum of 11S with different soybean varieties
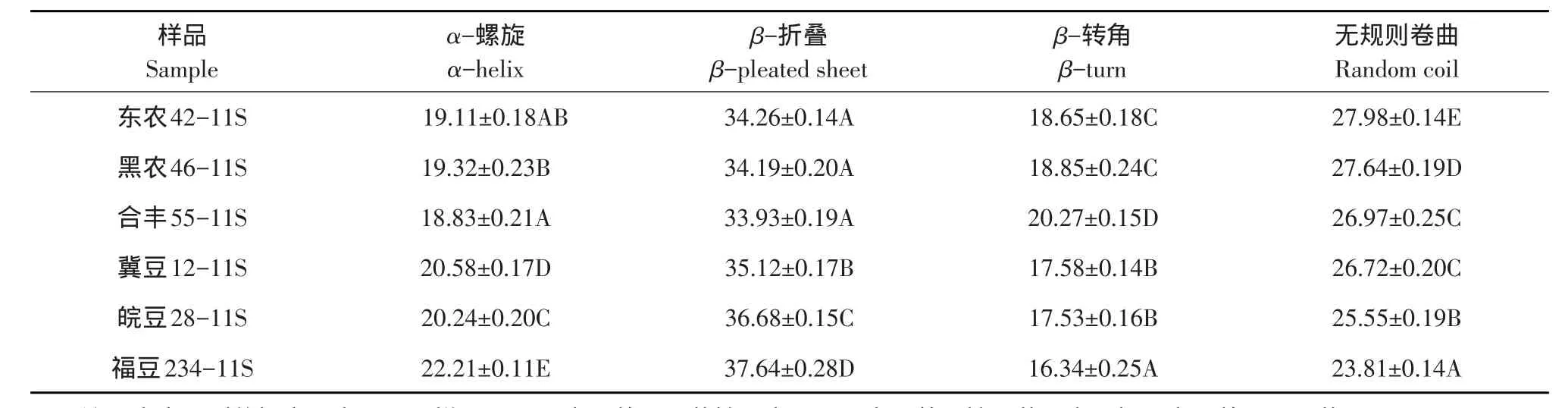
表1 不同品种大豆11S球蛋白拉曼光谱酰胺I带拟合结果Table 1Raman spectrum amide I bands results of 11S with different soybean varieties(%)
2.3侧链芳香氨基酸残基微环境与表面疏水性关系
2.3.1荧光光谱分析
由于酪氨酸残基荧光熄灭和色氨酸残基荧光增加,大豆蛋白质荧光发射光谱实际上是色氨酸残基荧光光谱。如图3所示,东农42、黑农46和合丰5511S球蛋白λmax为335.60 nm,冀豆12、皖豆28和福豆23411S球蛋白λmax为334.60 nm,说明6个品种大豆11S球蛋白色氨酸残基全部暴露于分子表面[12]。由于样品浓度相同,在λmax相同情况下,色氨酸残基荧光峰荧光强度越大,表示暴露在蛋白质表面色氨酸残基数量越多。分析结果显示,6个品种大豆11S球蛋白色氨酸残基暴露程度为东农42>合丰55>黑农46>冀豆12>皖豆28>福豆234,将此结果与表面疏水性作对比分析,色氨酸残基暴露程度越大,暴露数量越多,大豆11S球蛋白表面疏水性越高。
2.3.2拉曼光谱色氨酸残基微环境分析
蛋白质拉曼光谱1 340和1 360 cm-1附近色氨酸双线是环境疏水性标志:吲哚环亲脂反应会使1 360 cm-1附近谱峰增强,1 340 cm-1附近谱峰减弱,可用I1360/I1340反映色氨酸残基微环境情况[13],不同品种大豆11S球蛋白拉曼光谱见图2。
如图4所示,6个品种大豆11S球蛋白I1360/I1340值差异较大,说明品种差异对大豆11S球蛋白色氨酸残基微环境影响较大。相关性分析表明,大豆11S球蛋白表面疏水性与拉曼光谱I1360/I1340值呈显著负相关(r=-0.910,P=0.012)。说明大豆11S球蛋白表面疏水性与色氨酸残基暴露情况密切相关。I1360/ I1340越小,色氨酸吲哚环与环境中脂肪类基团之间亲脂反应越弱,色氨酸所处微环境极性越强,即色氨酸残基暴露程度越大,暴露数量越多,表面疏水性越高。

图3 不同品种大豆11S球蛋白荧光光谱Fig.3Fluorescence spectrum of 11S with different soybean varieties
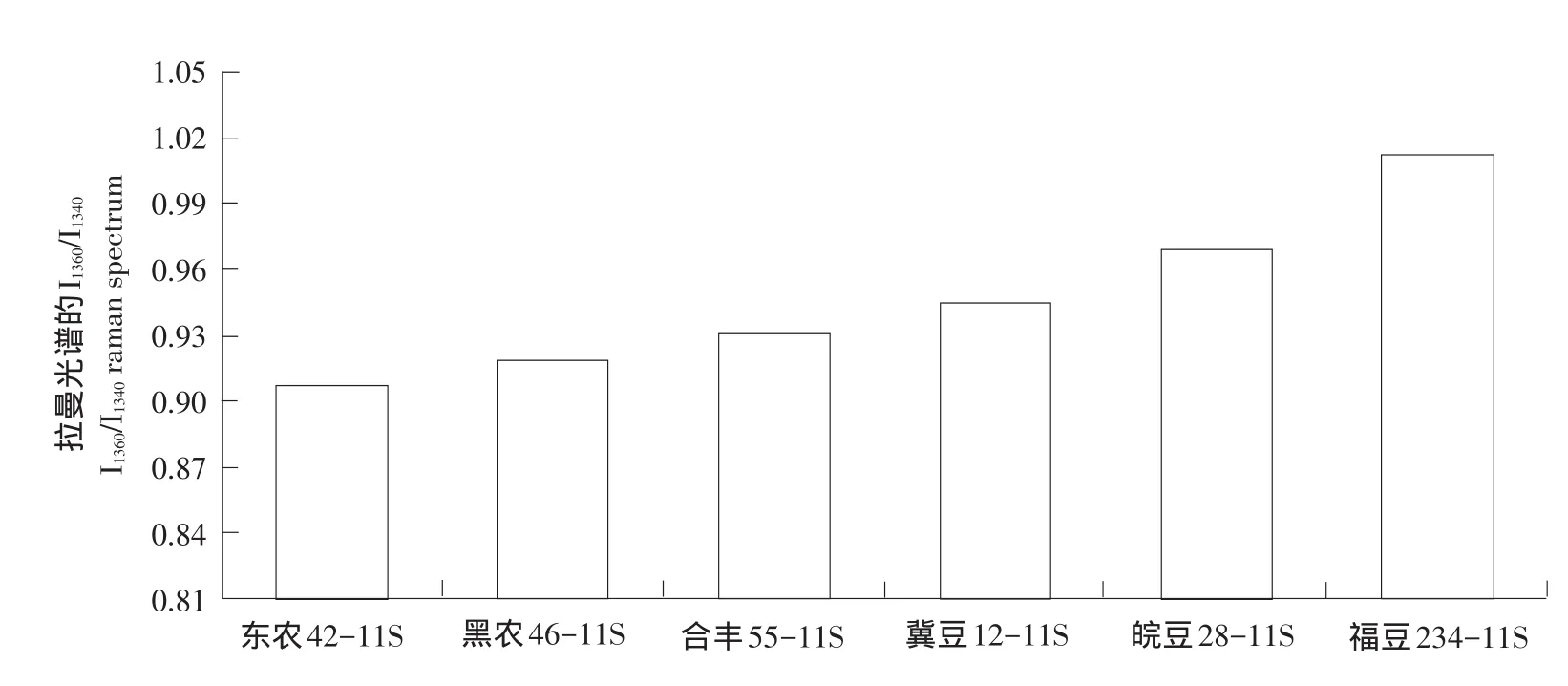
图4 不同品种大豆11S球蛋白拉曼光谱色氨酸费米共振I1360/I1340Fig.4Raman spectrum tryptophan fermi resonance I1360/I1340of 11S with different soybean varieties
2.3.3拉曼光谱酪氨酸残基微环境分析
蛋白质拉曼光谱850和830 cm-1谱峰是酪氨酸残基对位取代苯有关振动。两峰强度比I850/I830可表征酪氨酸残基暴露与包埋情况,当0.5<I850/I830<1.25时,可由方程式(0.5N包埋+1.25N暴露=I850/I830,N包埋+ N暴露=1)计算暴露在分子表面和包埋在分子内部酪氨酸残基克分子数N[14],不同品种大豆11S球蛋白拉曼光谱见图2。
由表2可知,6个品种大豆11S球蛋白酪氨酸残基均较多暴露于分子表面,且暴露程度差异较大。可见,品种差异对大豆11S球蛋白酪氨酸残基暴露程度影响显著。相关性分析表明,大豆11S球蛋白表面疏水性与拉曼光谱I850/I830值呈显著正相关(r=0.893,P=0.017),与暴露酪氨酸残基克分子数呈显著正相关(r=0.893,P=0.016),与N暴露:N包埋值呈显著正相关(r=0.894,P=0.016)。说明大豆11S球蛋白表面疏水性与酪氨酸残基暴露程度密切相关,酪氨酸残基暴露于分子表面数量越多,表面疏水性越高。
2.4巯基基团组成与表面疏水性关系
2.4.1巯基基团含量与表面疏水性关系
如图5所示,6个品种大豆11S球蛋白巯基基团主要以二硫键形式存在,且暴露巯基含量、游离巯基含量和二硫键含量均存在极显著差异(P<0.01),说明品种差异对大豆11S球蛋白巯基基团含量影响极显著。相关性分析表明,大豆11S球蛋白表面疏水性与游离巯基含量、二硫键含量相关性均不显著,与暴露巯基含量呈显著正相关(r=0.853,P=0.031),与巯基暴露程度(暴露巯基含量/游离巯基含量)呈显著正相关(r=0.822,P=0.045)。
2.4.2二硫键构象与表面疏水性关系
蛋白质拉曼光谱500~550 cm-1是二硫键伸缩振动特征频率。两个半胱氨酸形成二硫桥,其C-C-SS-C-C结构单元有三种构型,可由拉曼光谱二硫键特征振动频率判断,不同品种大豆11S球蛋白拉曼光谱见图2。通常将510 cm-1附近谱峰归属为gauche-gauche-gauche(g-g-g)构型,525 cm-1附近谱峰归属为gauche-gauche-trans(g-g-t)构型,540 cm-1附近谱峰归属为trans-gauche-trans(t-g-t)构型[13]。由表3可知,不同品种大豆11S球蛋白二硫键构型模式差异较大,说明品种差异对大豆11S球蛋白二硫键构象影响较大。相关性分析表明,大豆11S球蛋白表面疏水性与二硫键g-g-g构型含量、g-g-t构型含量、t-g-t构型含量相关性均不显著,说明大豆11S球蛋白表面疏水性与二硫键构象相关性不显著。

表2 不同品种大豆11S球蛋白I850/I830及酪氨酸残基分析结果Table 2I850/I830and tyrosine residues analysis results of 11S with different soybean varieties
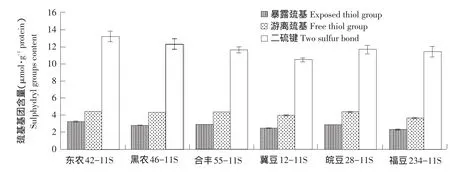
图5 不同品种大豆11S球蛋白巯基基团含量Fig.5Sulphydryl groups content of 11S with different soybean varieties
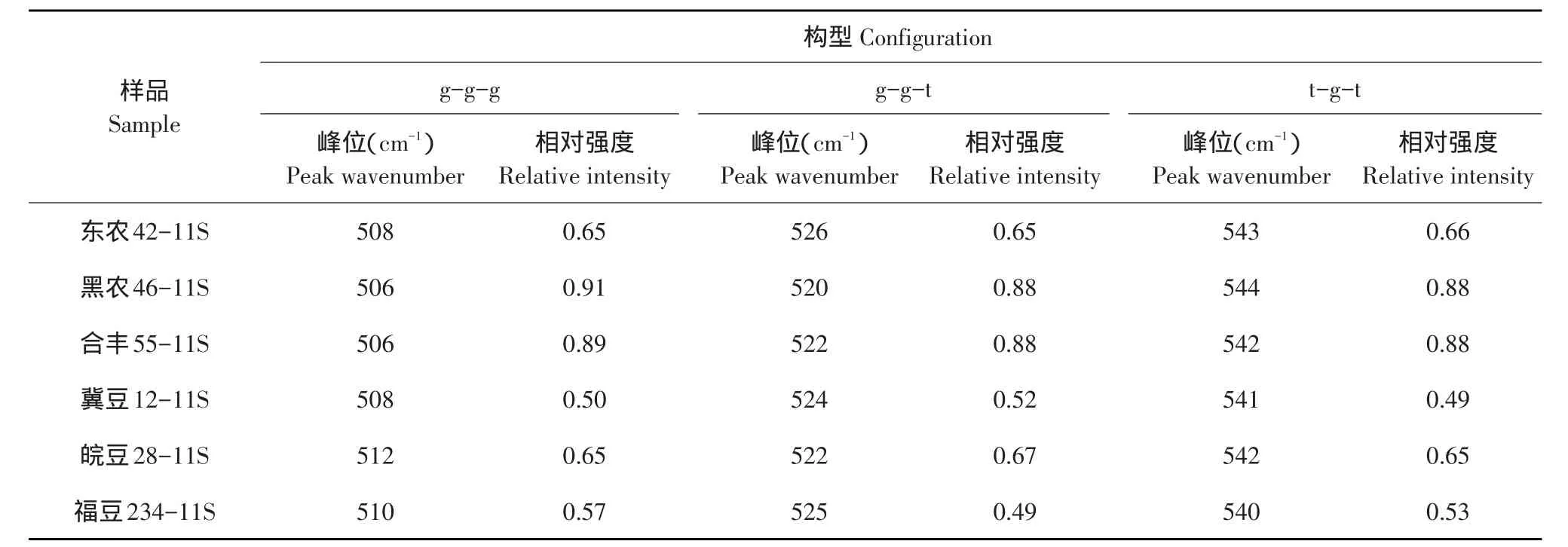
表3 不同品种大豆11S球蛋白二硫键构象分析结果Table 3Disulfide bond conformation analysis results of 11S with different soybean varieties
3 讨论
3.1主链二级结构与表面疏水性关系
蛋白质分子空间构象与其二级结构类型密切相关,影响蛋白质理化性质和功能特性。本研究应用激光拉曼光谱分析不同品种大豆11S球蛋白二级结构,结果与应用圆二色光谱和傅里叶红外光谱等手段研究结果一致[3-4],即不同品种大豆11S球蛋白表面疏水性与α-螺旋含量和β-折叠含量呈显著负相关,与β-转角含量和无规则卷曲含量呈显著正相关。这可能与α-螺旋、β-折叠、β-转角和无规则卷曲自身结构特点,及其对三级结构形成影响有关。蛋白质三级结构是指蛋白质分子在主链折叠盘曲形成构象基础上,分子中各个侧链R基所形成构象。侧链构象主要是形成微区。大豆蛋白质等球状蛋白质通过疏水相互作用形成疏水区和亲水区,亲水区多在蛋白质分子表面,由很多亲水侧链组成;疏水区多在分子内部,由疏水侧链集中构成。α-螺旋结构肽链中氨基酸侧链R基分布在螺旋外侧,β-折叠结构氨基酸侧链R基伸出在锯齿上方或下方,这两种二级结构类型氨基酸侧链R基均裸露在结构表面,疏水侧链容易通过疏水相互作用结合在一起形成紧密球形疏水区域,使疏水基团埋藏在蛋白质内部疏水核心中,使蛋白质具有较低表面疏水性。β-转角结构较小,常见转角只含有4个氨基酸残基,无规则卷曲结构松散、不规则,使氨基酸疏水侧链容易暴露于蛋白质表面,蛋白质具有较高表面疏水性。
3.2侧链芳香氨基酸残基微环境与表面疏水性关系
本研究应用荧光光谱和拉曼光谱分析不同品种大豆11S球蛋白侧链芳香氨基酸残基微环境。荧光光谱、拉曼光谱色氨酸费米共振I1360/I1340和酪氨酸费米共振I850/I830分析结果一致,表明大豆11S球蛋白表面疏水性与疏水性氨基酸残基暴露密切相关,疏水性氨基酸残基暴露程度越大,暴露数量越多,表面疏水性越大。反之,疏水性氨基酸残基暴露程度越小,暴露数量越少,表面疏水性越小,与王中江等研究结果一致[7,10]。分析其原因为:不同品种大豆11S球蛋白氨基酸组成、亚基组成和空间结构不同,导致疏水基团暴露程度差异,而大豆蛋白质疏水基团暴露程度是决定其表面疏水性主要原因[15]。
3.3巯基基团组成与表面疏水性关系
巯基(也称游离巯基)和二硫键是大豆蛋白质中重要功能基团,在蛋白质结构及功能性质方面发挥重要作用。本研究采用Ellman试剂法分析巯基和二硫键含量,采用拉曼光谱法分析二硫键构象。结果显示:不同品种大豆11S球蛋白表面疏水性与游离巯基含量、二硫键含量和二硫键构象相关性均不显著,而与暴露巯基含量呈显著正相关,与巯基暴露程度呈显著正相关。本研究分析巯基暴露程度与表面疏水性相关性时考虑不同品种大豆11S球蛋白游离巯基含量存在显著差异,仅考查暴露巯基含量对表面疏水性影响可能不够严谨,巯基暴露程度可能更说明问题。众多研究指出,在蛋白质结构发生改变时,暴露巯基含量与表面疏水性指数变化趋势一致,即暴露巯基含量越多,表面疏水性指数越大[16]。分析其原因可能是:大豆蛋白质暴露巯基含量越多,结构越伸展,疏水基团暴露在蛋白质表面几率越大,表现为表面疏水性越高。
4 结论
a.大豆11S球蛋白主链二级结构对表面疏水性影响显著:大豆11S球蛋白表面疏水性与α-螺旋含量呈显著负相关(r=-0.899),与β-折叠含量呈显著负相关(r=-0.906),与β-转角含量呈显著正相关(r=0.848),与无规则卷曲含量呈显著正相关(r= 0.882)。
b.大豆11S球蛋白表面疏水性与疏水性氨基酸残基暴露密切相关:大豆11S球蛋白表面疏水性与拉曼光谱酪氨酸费米共振I850/I830值呈显著正相关(r=0.893),与暴露酪氨酸残基克分子数呈显著正相关(r=0.893),与N暴露:N包埋值呈显著正相关(r= 0.894),即酪氨酸残基暴露于分子表面数量越多,表面疏水性越高;与拉曼光谱色氨酸费米共振I1360/ I1340值呈显著负相关(r=-0.910),即色氨酸残基暴露程度越大,表面疏水性越高,与荧光光谱分析结果一致。
c.大豆11S球蛋白表面疏水性与暴露巯基含量呈显著正相关(r=0.853),与巯基暴露程度呈显著正相关(r=0.822),与游离巯基含量、二硫键含量、二硫键构象相关性均不显著。
[参考文献]
[1]Wang W Y,Bringe N A,Berhow M A,et al.β-Conglycinins among sources of bioactives in hydrolysates of different soybean varieties that inhibit leukemia cells in vitro[J].Journal of Agricultural and Food Chemistry,2008,56(11):4012-4020.
[2]Natarajan S,Xu Chen P,Bae H,et al.Proteomic and genetic analysis of glycinin subunits of sixteen soybean genotypes[J].Plant Physiology and Biochemistry,2007,45(6/7):436-444.
[3]李丹,刘春雷,江连洲.纯品7S和11S蛋白结构与表面疏水性相关性研究[J].食品研究与开发,2015,36(7):5-9,22.
[4]刘春雷,孙立斌,李相昕,等.大豆7S和11S蛋白二级结构与表面疏水性相关性研究[J].食品科学,2015,36(17):28-32.
[5]吴伟.蛋白质氧化对大豆蛋白结构和凝胶性质影响[D].无锡:江南大学,2010.
[6]张萍,郑大威,刘晶,等.基于表面增强拉曼光谱技术豆芽6-BA残留快速检测方法[J].光谱学与光谱分析,2012(5):1266-1269.
[7]王中江,江连洲,魏冬旭,等.pH值对大豆分离蛋白构象及表面疏水性影响[J].食品与生物技术学报,2012,33(11):47-51.
[8]张莉莉.高温(100-120℃)处理对鱼糜及其复合凝胶热稳定性影响[D].青岛:中国海洋大学,2013.
[9]杨芳.豆腐凝胶形成机理及水分状态与品质关系研究[D].武汉:华中农业大学,2009.
[10]王中江,江连洲.大豆分离蛋白在不同pH下拉曼分析[J].食品工业科技,2012,33(11):63-66.
[11]孙为正.广式腊肠加工过程中脂质水解、蛋白质降解及风味成分变化研究[D].广州:华南理工大学,2011.
[12]Vivian J T,Callis P R.Mechanisms of tryptophan fluorescence shifts in proteins[J].Biophysical Journal,2001,80(5):2093-2109.
[13]赵伟.高压脉冲电场在液态蛋杀菌中应用及其对微生物和蛋白质作用机制[D].无锡:江南大学,2009.
[14]Li-chan E C Y.The applications of Raman spectroscopy in food science[J].Trends in Food Science and Technology,1996,7(11): 361-370.
[15]Matemu A O,Kayahara H,Murasawa H,et al.Improved emulsifying properties of soy proteins by acylation with saturated fatty acids[J].Food Chemistry,2011,124:596-602.
[16]胥伟,王海滨,黄迪,等.糖基化反应过程中卵白蛋白分子特性变化研究[J].东北农业大学学报,2015,46(12):33-38.
Relationship between structure characteristics and surface hydrophobicity of 11S with different soybean varieties
LI Dan1,LIU Chunlei1,JIANG Lianzhou2
(1.Ningde Normal University,Ningde Fujian 352100,China;2.School of Food Science, Northeast Agricultural University,Harbin 150030,China)
In this study,globulin(11S)was prepared with soybean from six representative regions as raw material,and the relationship between the structure characteristics and surface hydrophobicity of 11S was studied.The surface hydrophobicity of 11S was determined by ANS fluorescent probe method, the content of sulfhydryl and disulfide bond was determined by Ellman reagent analysis method,and conformation was analyzed by Raman spectroscopy and fluorescence spectroscopy.The main research results were as follows:correlation analysis showed that there was significantly negative correlation between surface hydrophobicity and the content ofα-helix,β-sheet and Fermi resonance Raman spectra of tryptophan I1360/I1340ratio.There was positive correlation between surface hydrophobicity andβturn,random coil,Fermi resonance Raman spectra of tryptophan I850/I830ratio,the number of exposed tyrosine residues,the value of Nexposure:Nembedding and the content of exposed sulfhydryl.There was not correlation between the surface hydrophobicity and the content of free sulfhydryl,the content of disulfide bond and disulfide bond conformation.
soybean globulin(11S);raman spectrum;fluorescence spectrum;sulfhydryl and disulfide bond;surface hydrophobicity
TS201.2
A
1005-9369(2016)07-0032-07
2016-04-01
国家科技支撑计划项目(2014BAD22B01);国家自然科学基金面上项目(31071493);宁德师范学院服务闽东项目(2012H314);宁德师范学院6.18项目(2012H213)
李丹(1983-),女,讲师,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:116127847@qq.com
江连洲,教授,博士生导师,研究方向为粮食、油脂及植物蛋白工程。E-mail:501342131@qq.com

