间作玉米大豆根系分泌物中有机酸的变化特征
陈 利 肖靖秀 郑 毅,
(1. 西南林业大学生命科学学院,云南 昆明 650224;2. 云南农业大学资源与环境学院,云南 昆明 650201)
间作玉米大豆根系分泌物中有机酸的变化特征
陈利1肖靖秀2郑毅1,2
(1. 西南林业大学生命科学学院,云南 昆明 650224;2. 云南农业大学资源与环境学院,云南 昆明 650201)
通过水培试验,收集了不同生育期单作玉米、单作大豆、玉米大豆分隔间作 (根系用尼龙网分隔) 及玉米大豆间作 (根系不分隔) 下的根系分泌物,并通过高效液相色谱方法分析不同种植模式下不同生育期的玉米大豆根系分泌物中有机酸的变化特征。结果表明:与单作相比,在有机酸分泌种类上,分隔间作玉米苗期增加苹果酸,减少顺丁烯二酸;喇叭口期无变化;孕穗期减少苹果酸。间作玉米苗期增加苹果酸,喇叭口期减少酒石酸和苹果酸,孕穗期减少乳酸和顺丁烯二酸;分隔间作大豆苗期增加柠檬酸,花期减少酒石酸和乳酸、增加乙酸,鼓粒期增加酒石酸和苹果酸;间作大豆苗期增加柠檬酸,花期减少酒石酸和苹果酸、增加乙酸,鼓粒期增加酒石酸和苹果酸、减少乳酸和顺丁烯二酸。在分泌速率上,分隔间作玉米喇叭口期增加了284.80%,间作玉米在喇叭口期和孕穗期分别增加了159.24%、88.01%;间作大豆在鼓粒期增加了149.59%,分隔间作大豆在苗期、花期和鼓粒期分别增加了114.65%、24.24%、389.38%。间作和分隔间作改变了有机酸分泌种类,间作能更长时期提高玉米有机酸分泌速率,分隔间作能更长时期提高大豆根系的有机酸分泌速率。
玉米;大豆;间作;根系;有机酸;分泌物
植物在生长发育的同时,不仅进行着呼吸作用、光合作用,同时在其根部进行着更为复杂的新陈代谢过程,即根系分泌物的分泌过程。1979年Rovira和Warembourg的定义被认为是经典定义因而被普遍接受[1]。根据其定义,根系分泌物可分为4类物质:分泌物、渗出物、裂解物质及粘胶质。概括的说,根系分泌物是植物生长期间,根系向介质分泌所有化合物的总称,包括低分子量的有机、无机离子 (H+、Cl-、SO42-、NO3-等)、高分子质量的黏胶物质、维生素、植物激素、根细胞脱落物及其分解物等。其中有机物包括糖类、有机酸、氨基酸、酶类、酚类、黄酮类、脂肪酸和甾类化合物等。
植物向土壤分泌根系分泌物,不仅影响自身的生长,还会影响根际微生物的生长。这些微生物包括病原菌和促生菌。它们的生长繁殖会对植物的生长发育产生促进或抑制作用。如根系分泌物中的有机酸不仅能活化植物所需的多种营养元素,还能影响植物根际土的pH,从而影响多种微生物的生长繁殖[2-3]。营养元素的活化使得植物的养分可用性大大提高,从而影响植物生长。有机酸的代谢反应主要发生在三羧酸循环,由于有机酸在活化营养元素方面起着重要作用,有机酸大量分泌的原因曾一度引起研究者的重视。
玉米 (Zeamays) 大豆 (Glycinemax) 间作的研究大多是对营养元素吸收、生物量等进行常规研究,而在间作条件下的根系分泌物却鲜有探究。本试验旨在探究玉米、大豆间作苗期、喇叭口期/花期、孕穗期/鼓粒期等时期的根系分泌物中有机酸的种类和数量的变化特征,为进一步理解植物种间互作、根土互作影响土壤养分利用效率提供参考依据。
1 材料和方法
1.1试验材料
供试大豆品种为鲜博士218,玉米品种为耕源135。
1.2试验设计
种植方法:1) 大豆单作 (2株/盆),玉米单作 (2株/盆);2) 大豆和玉米分隔间作 (1株大豆+1株玉米,根系用200目尼龙网分隔,根系不能通过,肥水可以相互通过);3) 大豆和玉米间作,根系不分隔 (1株大豆+1株玉米,根系和肥水相互通过)。
1.3水培试验及管理
试验于2015年4月21日至6月24日进行。玉米和大豆种子用浓度30% H2O2消毒10 min,用去离子水冲洗3~5次,至无H2O2残留,在育种塑料盘温室中育种。大豆根系接种根瘤菌。为了更好地模拟田间生长情况,大豆根系接种了根瘤菌:费氏中华根瘤菌 (Sinorhizobiumfredii)。菌种来源于中国农业微生物菌种保藏中心 (ACCC 15109)。根瘤菌需先在根瘤菌琼脂-1培养基中培养。根瘤菌琼脂-1培养基 (1 L) 配方为:蔗糖10 g,MgSO4·7H2O 0.2 g,K2HPO40.5 g,CaSO40.2 g,NaCl 0.1 g,酵母粉1 g,NaMoO4(1%) 1 mL,MnSO4(1%) 1 mL,FeC6H5O7(1%) 1 mL,H3BO3(1%) 1 mL,琼脂粉20 g,培养温度28 ℃。接种大豆方法:待大豆胚芽刚出时,将菌苔刮下用无菌水制成8.2 × 108/mL菌悬液,每株大豆苗接种2 mL。
试验地点:西南林业大学格林温室;容器规格:塑料盆 (直径22 cm、高27 cm);营养液体积:10 L,2叶龄后,进行水培实验。定植于5 cm厚泡沫板上,重复3次。营养液配比[4],营养液更换频率:5 d/次。通气:通气泵通气24 h。
1.4根系分泌物的收集和测定
分别于5月27日 (玉米、大豆均为苗期)、6月8日 (玉米喇叭口期、大豆花期)、6月24日 (玉米孕穗期、大豆鼓粒期) 把玉米、大豆苗从营养液中取出,先用自来水冲洗3 次,再用去离子水冲洗3次,冲洗过程中尽量避免伤根。根系洗净后先用5 mg/L的百里酚溶液浸泡3 min,在原光照条件下将植株移植到盛有1 L蒸馏水的收集袋中培养,收集袋用绳子系在培养泡沫板上,放入装有大半桶水的培养桶中,用使收集袋中的蒸馏水浸没整个根系。在上述条件下培养4 h (10:00—14:00)后,将作物根系取出,所得溶液即为根系分泌物,40 ℃于旋转蒸发仪浓缩至10 mL待测。
有机酸测定使用仪器为岛津LC-10A高效液相色谱仪 (DGU-20A3脱气机,LC-20AB泵,SIL-20A进样器,CTO-20A柱温箱,SPD-20A紫外可见检测器)。色谱柱:Inertstil ODS-SP,粒径5 μm,4.6 mm I.D × 250 mm。柱温度为28 ℃;流动相浓度为18 mmol/L的KH2PO4,pH为2.43 (用磷酸调节pH),流速1.0 mL/min,紫外检测计 (SPD-10A) 波长214 nm,进样量10 μL,分析时间15 min;用外标法进行定性和定量计算。8种有机酸混合标准品色谱图如图1所示,回归方程及线性范围如表1所示。
1.5数据分析
分泌速率的计算公式为单位时间 (h) 单位干根 (g) 分泌的有机酸含量。试验所得数据用Excel 2010和SPSS 22.0 进行处理及分析,用LSD法进行多重差异性比较。
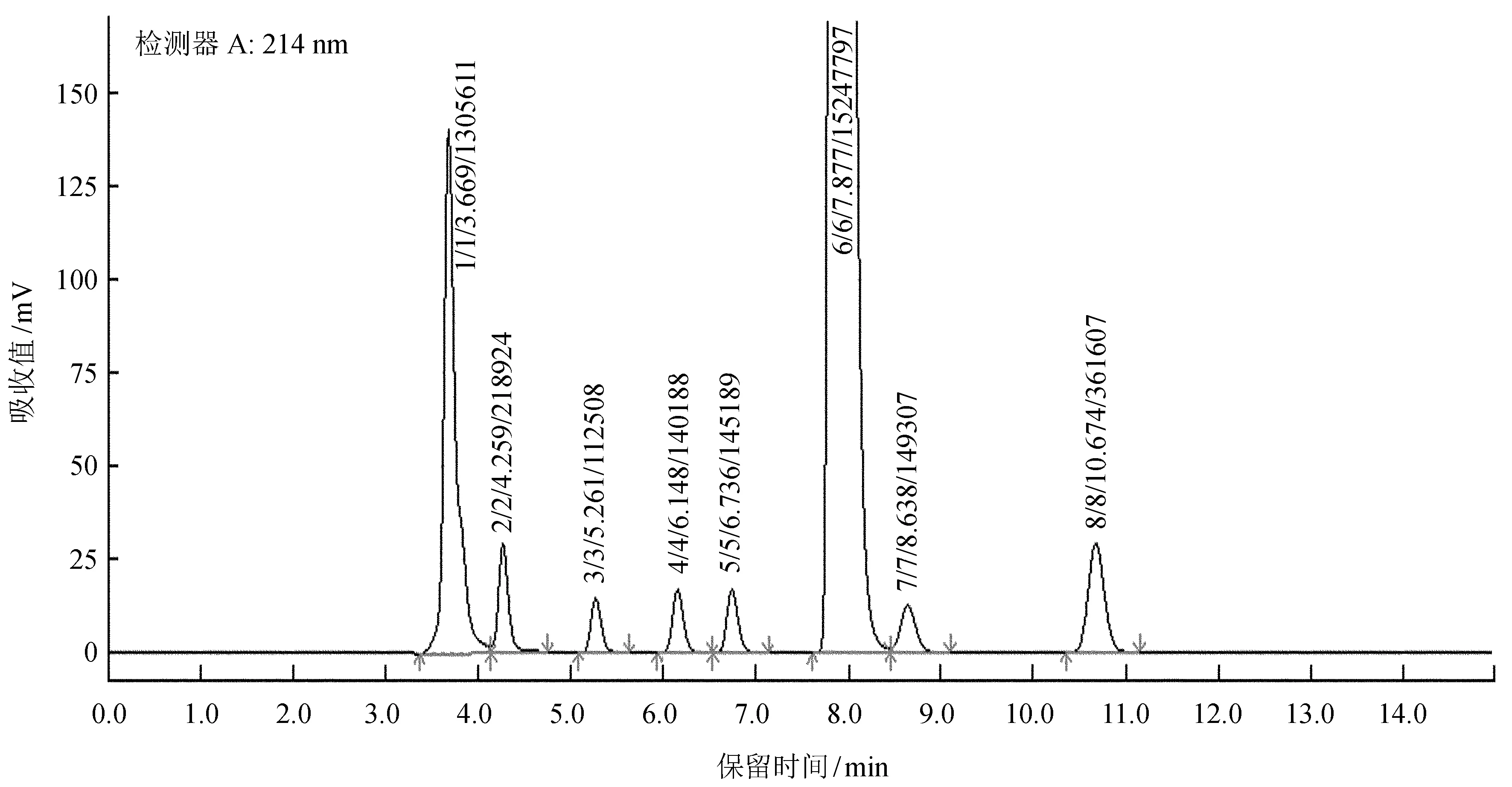
图1有机酸标准曲线色谱
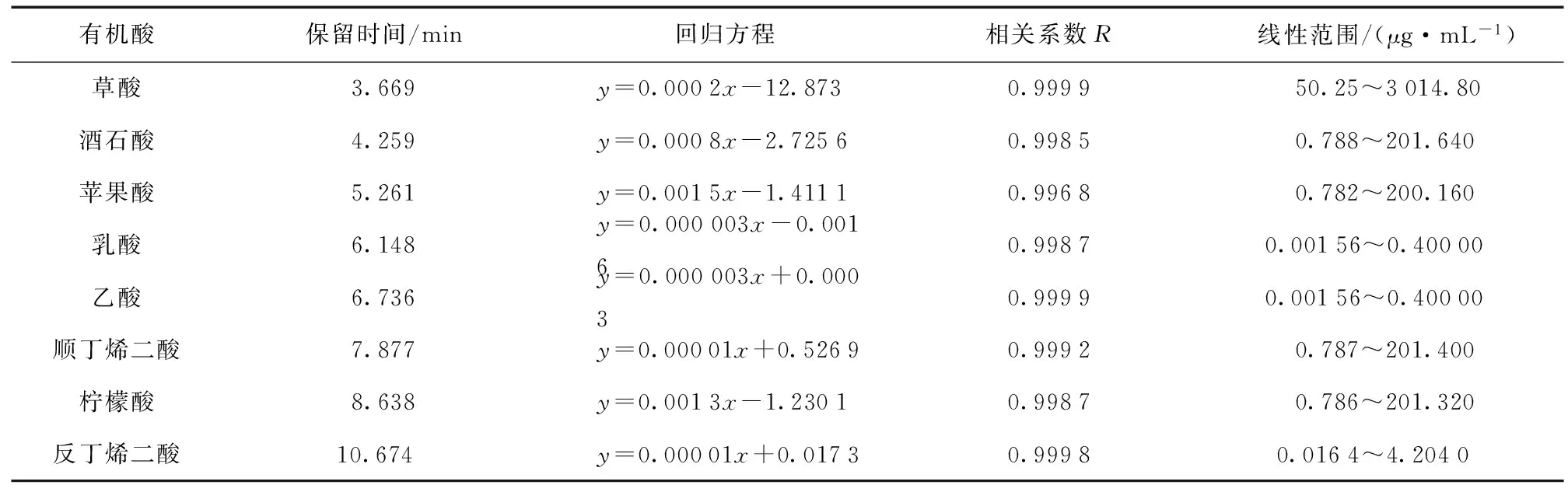
Fig.1 Chromatogram of organic acid standards
注:回归方程中,y为浓度,x为峰面积。
2 结果与分析
2.1玉米根系分泌物有机酸种类和分泌速率特征
如图2所示,与单作玉米相比,间作玉米分泌有机酸分泌速率分别在苗期降低了52.67%,喇叭口期增加了159.24%,孕穗期的有机酸分泌增加了88.01%;分隔间作玉米在苗期降低了53.67%,喇叭口期增加了284.80%,孕穗期降低了8.81%。

图2玉米根系分泌有机酸总分泌速率变化特征
Fig.2The secretion rate variation characteristics of organic acids of maize root
如表2所示,在苗期,单作、间作和分隔间作玉米根系都没有酒石酸的分泌。与单作相比,间作和分隔间作都增加了苹果酸的分泌,但分隔间作减少了顺丁烯二酸的分泌,其他有机酸种类相同。分隔间作增加分泌的有机酸有苹果酸、乙酸和反丁烯二酸;间作增加分泌的有机酸有苹果酸、乙酸、顺丁烯二酸和反丁烯二酸。
在喇叭口期,间作减少了酒石酸和苹果酸的分泌;分隔间作和单作都有8种有机酸的分泌。分隔间作玉米增加分泌的有机酸有草酸、酒石酸、苹果酸、乳酸、顺丁烯二酸、柠檬酸和反丁烯二酸;间作玉米增加分泌的有机酸有草酸、乙酸、顺丁烯二酸和柠檬酸。
在孕穗期,分隔间作在孕穗期没有苹果酸的分泌;间作玉米根系分泌有机酸种类没有乳酸和顺丁烯二酸的分泌。分隔间作玉米增加分泌的有机酸有酒石酸、乳酸、乙酸、顺丁烯二酸和柠檬酸;间作玉米增加分泌的有机酸有草酸、苹果酸、乙酸、柠檬酸、反丁烯二酸。
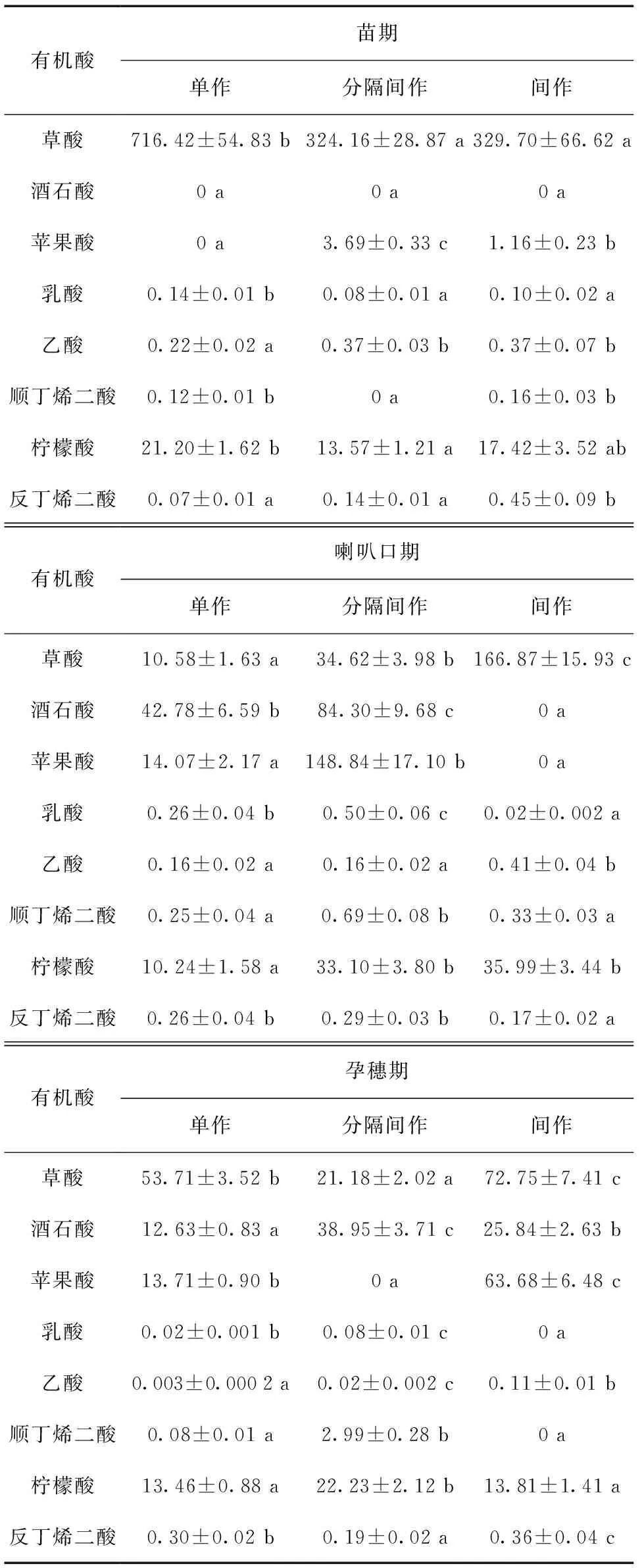
表2 玉米根系分泌有机酸分泌速率比较
注:本文表中测定数据后的小写字母表示同一时期处理间差异显著水平P< 0.05。
2.2大豆根系分泌物有机酸种类和分泌速率变化特征
如图3所示,与单作大豆相比,间作大豆分泌有机酸分泌速率分别在苗期降低了76.56%,花期降低了54.03%,在鼓粒期有机酸分泌增加了149.59%;分隔间作大豆在苗期增加了114.65%,花期增加了24.24%,鼓粒期增加了389.38%。
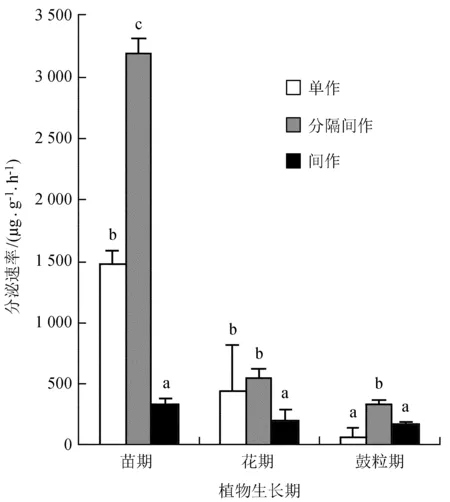
图3大豆根系分泌有机酸总分泌速率变化特征
Fig.3The secretion rate variation characteristics of organic acids of soybean root
如表3所示,在苗期,与单作大豆相比,间作和分隔间作大豆有柠檬酸的分泌。3种种植方式里均没有酒石酸的分泌。分隔间作大豆增加分泌的有机酸有草酸、苹果酸、乳酸、乙酸、顺丁烯二酸、柠檬酸和反丁烯二酸;间作大豆增加分泌的有机酸有柠檬酸和反丁烯二酸。
在花期,分隔间作无酒石酸和乳酸,而有乙酸的分泌;间作大豆无酒石酸和苹果酸,而有乙酸的分泌。分隔间作大豆增加分泌的有机酸有苹果酸、乙酸、顺丁烯二酸、柠檬酸、反丁烯二酸。间作大豆增加分泌的有机酸有乙酸、柠檬酸、反丁烯二酸。
在鼓粒期,间作大豆增加了酒石酸和苹果酸,减少了乳酸和顺丁烯二酸的分泌;分隔间作也增加了酒石酸和苹果酸的分泌。分隔间作大豆增加分泌的有机酸有酒石酸、苹果酸、乳酸、乙酸和反丁烯二酸;间作大豆增加分泌的有机酸有草酸、酒石酸、苹果酸、乙酸、反丁烯二酸。
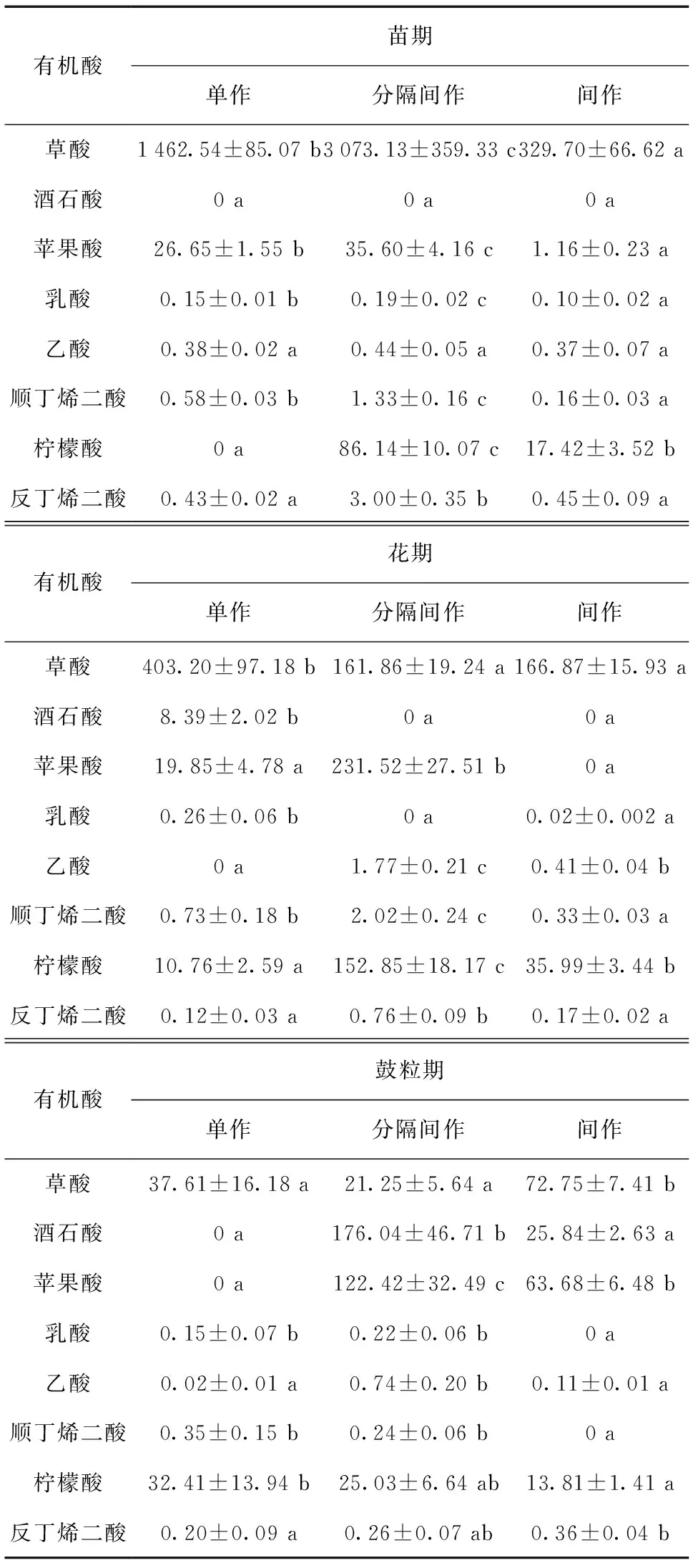
表3 大豆根系分泌有机酸分泌速率比较
3 结论与讨论
结果表明间作和分隔间作能改变玉米大豆有机酸的种类。这与周丽莉[4]关于玉米大豆间作研究的结果相同。与郝艳茹等[5]在小麦和玉米水培间作体系中在苗期发现间作增加了小麦和玉米有机酸分泌的种类和速率。本研究结果发现分隔间作玉米仅喇叭口期有机酸的分泌速率增加,而间作玉米在喇叭口期和孕穗期增加;间作大豆仅鼓粒期的分泌速率增加,分隔间作能增加大豆全生育期的有机酸分泌速率。说明间作能更长时期提高玉米有机酸分泌速率,分隔间作能更长时期提高大豆根系的有机酸分泌速率。
植物单间作的问题,已经有大量的研究者进行研究[6-9],他们主要是从生物量及营养元素的吸收进行研究或者只是研究单作条件下的根系分泌物的变化特征[10]。研究根系分泌物时,一般研究养分胁迫对根系分泌物的影响。玉米大豆间作时,会引起养分竞争,可能引起有机酸分泌速率的增加。在缺素情况下,往往改变有机酸分泌种类和数量[11],并且分泌种类和数量增加。当玉米在N、P、K、Fe的缺失时有机酸分泌量会增加[12]。
根系分泌物的影响因素是多方面的,主要因素有植物自身因素:如植物的种类及生育时期;另外还有光、温度因素;根系的土壤因素:pH、水分含量及通气情况、养分胁迫、根系微生物种类[13-14]。在本研究中,由于玉米对大豆的遮挡和养分竞争,影响因素主要是光和养分胁迫。这2个因素很可能引起单间作有机酸种类和分泌速率的差异。
在根系分泌物中对营养元素起活化作用主要是有机酸,植物根系分泌物中最常见的有机酸有:草酸、柠檬酸、乙酸、琥珀酸、酒石酸、苹果酸和丙二酸等[15]。它们一方面可降低根际土壤的pH值,提高难溶性的磷化合物的溶解度,另一方面可与钙、铝、铁等金属元素形成螯合物[16],使根际土壤中难溶性的磷释放出来,从而显著提高根际土壤有效磷的浓度,达到自身调节和改善营养状况的目的。另外,还能与土壤中的毒害金属离子发生反应,形成毒性较小的化合物,减轻毒害离子对植物根系的毒害作用[17]。玉米大豆间作根系有机酸分泌速率增加为作物提高产量提供了保证。
[1]吴彩霞, 傅华. 根系分泌物的作用及影响因素[J]. 草业科学, 2009, 6(9): 24-29.
[2]Raaijmakers J M, Paulitz T C. The rhizosphere: a playground and battlefield for soilborne pathogens and beneficial microorganisms[J]. Plant Soil, 2009, 321: 341-361.
[3]Tikhonovich I A, Kravchenko L V, Shaposhnikov A I. Root exudates as an important factor of formation of nanomolecular structures of the rhizosphere[J]. Microbiology, 2011, 37(1): 40-42.
[4]周丽莉. 蚕豆、大豆、玉米根系质子和有机酸分泌差异及其在间作磷营养中的意义[D]. 北京: 中国农业大学, 2005: 17-21.
[5]郝艳茹, 劳秀荣, 彭少麟, 等. 小麦/玉米间作作物根系与根际微环境的交互作用[J]. 农村生态环境, 2003, 19(4): 18-22.
[6]杨升辉, 邱家训, 徐长帅, 等. 间作种植模式对玉米大豆干物质积累与转运的影响[J]. 安徽农业科学, 2013, 41(21): 8947-8949.
[7]Muyayabantu G M, Kadiata B D, Nkongolo K K. Assessing the effects of integrated soil fertility management on biological efficiency and economic advantages of intercropped maize (ZeamaysL.) and Soybean (GlycinemaxL.) in DR Congo[J]. American Journal of Experimental Agriculture, 2013, 3(3): 520-541.
[8]郑毅, 汤利. 间作作物的养分吸收利用与病害控制关系研究[M]. 昆明: 云南科技出版社, 2008: 75-87.
[9]刘均霞, 陆引罡, 远红伟, 等. 玉米/大豆间作条件下作物根系对氮素的吸收利用[J]. 华北农学报, 2008, 23(1): 173-175.
[10]Hassan Z A. Studies on the allelopathic potential of corn aqueous extracts and root exudates[J]. Journal of Agricultural Science and Technology, 2012(2): 432-437.
[11]Degryse F, Verma V K. Smolders E. Mobilization of Cu and Zn by root exudates of dicotyledonous plants resin-buffered solutions and in soil[J]. Plant Soil, 2008, 306: 69-84.
[12]Carvalhais L C, Dennis P G. Root exudation of sugars, amino acids, and organic acids by maize as affected by nitrogen, phosphorus, potassium, and iron deficiency[J]. Plant Nutr Soil Sci, 2011, 174: 3-11.
[13]罗标. 根系分泌物及其在植物营养中的作[J]. 素质教育, 2014(25): 214.
[14]严小龙, 廖红, 年海. 根系生物学: 原理与应用[M]. 北京: 科学出版社, 2007: 114-157.
[15]王平, 周荣. 高效液相色谱法测定植物根系分泌物中的有机酸[J]. 色谱, 2006, 24(3): 239-242.
[16]Dakora F D, Phillips D A. Root exudates as mediators of mineral acquisition in low-nutrient Environments[J]. Plant Soil, 2002, 245: 35-47.
[17]王瑞琳, 刘金宇, 郭天荣. 铝毒和低磷胁迫对水稻幼苗生长根系有机酸分泌的影响[J]. 安徽农业科学, 2014, 42(6): 1603-1606.
(责任编辑张坤)
Characteristics of Organic Acids from Root Exudation in Maize and Soybean Intercropping
Chen Li1, Xiao Jingxiu2, Zheng Yi1,2
(1. College of Life Science, Southwest Forestry University, Kunming Yunnan 650224, China; 2. College of Resources and Environment, Yunnan Agricultural University, Kunming Yunnan 650201, China)
By hydroponic experiment, collected root exudation of different growth stages in monocropped maize, monocropped soybean, separation intercropping maize and soybean(roots mesh barrier)and intercropping maize and soybean (roots no mesh barrier) and by HPLC method for analysis variation characteristics of organic acids from root exudates in the different planting modes, different growth stages of maize and soybean intercropping system. The results showed that compared with monoculture, in the kinds of organic acids, separation intercropping maize: malic acid was identified and maleic acid was not identified in seedling stage; No change in bell mouth period; Malic acid was not identified in booting stage. Intercropping maize: malic acid was identified in seedling stage; tartaric acid and malic acid were not identified in bell mouth period; Lactic acid and maleic acid were not identified in booting stage. Separation intercropping soybean: citric acid was identified in in seedling stage; Tartaric acid and malic acid were not identified and acetic acid was identified in flowering phase; Tartaric acid and malic acid were identified in seed filling period. Intercropping soybean: citric acid was identified in seedling stage; Tartaric acid and malic acid were not identified and acetic acid was identified in flowering phase; Tartaric acid and malic acid were identified in seed filling period, Lactic acid and maleic acid were not identified in seed filling period. The secretion rate of organic acids, separation intercropping maize was increased by 284.80% in bell mouth period, intercropping maize was increased by 159.24%, 88.01% in bell mouth period and booting stage respectively. Intercropping soybean was increased by 149.59% in seed filling period, separation intercropping soybean was increased by 114.65%, 24.24%, 389.38% in seedling, flowering and seed filling stage respectively. Intercropping and separation intercropping affect kind of organic acids, Intercropping increased the rate of organic acid secretion of maize in the longer period, separation intercropping increased the rate of organic acid secretion of soybean root in the longer period.
maize, soybean, intercropping, root system, organic acids, secretion

10. 11929/j. issn. 2095-1914. 2016. 05. 013
2016-03-07
国家自然科学基金资助项目 (31260504, 31560581, 31460551)。
郑毅 (1964—),男,博士,教授。研究方向:土壤与植物营养。Email: zhengyi-64@163.com。
S311
A
2095-1914(2016)05-0078-06
第1作者:陈利 (1990—),男,硕士生。研究方向:间作系统中根系互作对根系分泌物的影响。Email: 765203673@qq.com。

