成人慢性ITP患者外周血CD4+CD25+CD127-/low调节性T细胞、TCRv24+v11+NKT细胞和Th1/Th2细胞因子的变化
邵凤,徐瑞龙,郑昭璟,马拥军,胡少龙
成人慢性ITP患者外周血CD4+CD25+CD127-/low调节性T细胞、TCRv24+v11+NKT细胞和Th1/Th2细胞因子的变化
邵凤,徐瑞龙,郑昭璟,马拥军,胡少龙
目的探讨成人慢性特发性血小板减少性紫癜(ITP)患者外周血自然杀伤T细胞(NKT)和CD4+CD25+调节性T细胞(Tregs)的变化及关系。方法利用多色流式细胞术检测ITP患者和健康体检者外周血NKT和Tregs细胞,双色流式细胞术检测外周血网织血小板(RP)数量,CBA技术结合流式细胞术分析血清IL-12p70、IL-10、IL-2、IL-8、IL-6、IL-5、IL-4、IL-1b、IFN-、TNF-和TNF-水平。结果慢性ITP组RP高于健康对照组(<0.05);但两组NKT细胞比例、11种血清细胞因子水平、Th1/Th2型细胞因子比值及1型/2型细胞因子比值差异均无统计学意义(均>0.05)。Plt计数<20×109/L的慢性ITP患者组RP及NKT高于健康对照组和Plt计数>20×109/ L的慢性ITP患者组(均<0.05)。慢性ITP患者外周血Plt计数与NKT细胞呈负相关(=-0.373,=0.033)。ITP组患者外周血Tregs和NKT细胞无关,但是Tregs细胞与Th1/Th2细胞因子比值呈正相关(=0.451,=0.011),血小板数与血清IL-12p70、IFN、IL-4及TNF也呈正相关(=0.354、0.365、0.354、0.366,均<0.05)。结论NKT细胞和Tregs细胞可能与慢性ITP患者中细胞因子分泌的异常有关。
紫癜,血小板减少性,特发性,慢性;自然杀伤T细胞;调节性T细胞;细胞因子谱;网织血小板
特发性血小板减少性紫癜(ITP)是一种以1型T细胞反应为主的自身免疫性疾病,以外周血血小板计数(Plt)持续<100×109/L为特征[1-4]。CD4+CD25+调节性T细胞(Tregs)和自然杀伤T细胞(NKT)是两种具有免疫调节功能的T细胞亚群。研究证明,活化的NKT细胞能通过IL-2依赖机制调节Tregs细胞的功能,而Tregs细胞能通过细胞接触依赖机制抑制NKT细胞的增殖、细胞因子分泌和细胞毒活性[5]。本研究对慢性ITP患者外周血NKT、Tregs、血清细胞因子谱进行分析,探讨上述因素在ITP中的变化。报道如下。
1 资料与方法
1.1一般资料选取2008年1月至2010年3月浙江省金华中心医院就诊的活动期慢性ITP患者68例,符合慢性ITP的诊断标准[6]。其中男40例,女28例;年龄(43.82±2.46)岁;PLT(26.69± 3.90)×109/L。另选年龄、性别匹配的同期健康体检者38例为健康对照组,其中男24例,女14例;年龄(38.53±1.97)岁;PLT(230.84±11.29)×109/L。受试者在标本采集前2周内均未进行激素治疗或其他可以影响血小板代谢的药物。按照Plt将慢性ITP患者分为两组,即<20×109/L和>20×109/L。
1.2外周血单个核细胞(PBMNC)的分离受试者静脉穿刺6 ml,用乙二胺四乙酸二钾(EDTA-K2)抗凝,以等量0.9%氯化钠注射液稀释后置于6 mlLympho-Prep密度梯度分离液上置水平离心机800 r/min室温离心20 min;以毛细滴管吸取介于分离液和血浆层间的单个核细胞转移至另外一根试管内,加入等量0.9%氯化钠注射液,300 r/min室温继续离心10 min;去上清,漩涡振荡重悬单个核细胞,以pH7.4磷酸盐缓冲液(PBS)洗涤细胞,重复3次;最后PBS重悬细胞并调节细胞浓度为5×106/ml待用。
1.3网织血小板(RP)的检测利用EDTA-K2抗凝全血,在样品采集后2 h内完成。在对照管和测定管中加入5 l PE荧光标记血小板膜糖蛋白(CD41-PE)抗体,PBS 30l,加混匀全血标本5l,漩涡振荡混匀后避光室温孵育15 min;孵育后在测定管中加入IOSTONⅢ10倍稀释的噻唑橙试剂(TO)1 ml,在对照管中加入IOSTONⅢ液1 ml,避光室温孵育1h后上机检测。检测时以SSC对数放大信号(SSC Log)和CD41设门识别血小板。CD41+TO+的颗粒为RP。利用对照管进行TO阳性域值的设定。每次实验至少计数5 000个血小板,同时每次测定均平行检测Plt正常人的RP。RP的结果以占全部血小板的百分比表示。
1.4CD4+CD25+CD127-/lowTregs的检测采用三色流式细胞术检测Tregs细胞。取2根12 mm×75 mm流式试管分别标记同型对照和测试管,按照试剂说明书进行抗体标记染色;吸取20l Cocktail of FITC anti-human CD4和PE anti-humanCD25至试管底部,在同型对照管中加入IgG1-PE-Cy5 10l,在测试管中加入CD127-PE-Cy5 20 l;每管中均加入100 l5×106/ml的PBMNC,漩涡振荡混匀后避光、室温孵育15 min;每管中加入PBS 2 ml混匀,置水平离心机350 r/min室温离心5min;弃上清,加0.5ml PBS重悬细胞、待测。流式细胞术分析中,以SSC/FSC结合SSC/CD4设门圈定CD4+淋巴细胞分析其中CD4+CD25+CD127-/low细胞占CD4+的百分比即为Tregs细胞水平。每次测试至少检测70 000个CD3+细胞。
1.5TCRv 24+v 11+NKT的检测采用三色流式细胞术检测NKT细胞。取2根12 mm×75 mm流式试管分别标记同型对照和测试管;吸取10 l CD3-PECy5至试管底部,在对照管中加入IgG1-FITC、IgG2a-PE各20 l,在测试管中加入V 24-FITC、V 11-PE各20l;每管中均加入100 l细胞密度为5×106/ml的PBMNC,漩涡振荡混匀后避光室温孵育15min;每管中加入PBS 2ml混匀;置水平离心机350 r/min室温离心5 min;弃上清,加0.5 mlPBS重悬细胞、待测。以SSC/FSC结合SSC/CD3设门圈定CD3+细胞分析其中V 24+V 11+占CD3+的百分比即为NKT细胞的水平。每个测试至少检测100 000个CD3+细胞。
1.6Th1/Th2细胞因子谱分析受试者采集不抗凝静脉血3 ml静置,待血清析出后置800 r/min离心机离心5 min,收集血清至1 mlEppendorf管并做好标签,置-76℃超低温冰箱保存。检测时将标本置37℃水浴箱,采用CBA Human Th1/Th211plex试剂盒测定11种细胞因子(IL-12p70、IL-10、IL-2、IL-8、IL-6、IL-5、IL-4、IL-1b、IFN-、TNF-和TNF-),按说明书要求进行。
1.7统计方法采用SPSS16.0和Graph Pad Prism4.0统计软件进行分析。计量资料以均数±标准误表示,两组比较采用检验;多组比较采用单因素方差分析,多重比较采用LSD法;相关分析采用线性回归法。<0.05为差异有统计学意义。
2 结果
2.1ITP患者和健康对照者外周血RP水平慢性ITP组外周血RP的比例为(10.08±3.33)%,高于健康对照组([1.82± 0.26)%,=2.474,<0.05](封三彩图4)。Plt<20×109/L的慢性ITP患者组RP为(17.53±7.56)%,显著高于健康对照组和Plt>20×109/L组([4.95±1.37)%,=5.48,均<0.05],而后两组差异无统计学意义(>0.05)。
2.2ITP患者和健康对照者外周血NKT细胞水平慢性ITP组PBMNCs 中NKT细胞的比例为(0.13±0.03)%,对照组为(0.09±0.03)%,两者差异无统计学意义(=0.845,>0.05)(封三彩图5)。Plt<20×109/L的慢性ITP患者组NKT为(0.22±0.05)%,显著高于健康对照组的和Plt>20×109/L组([0.05±0.01)%,=7.27,均<0.05],而后两组差异无统计学意义(>0.05)。
2.3ITP患者和健康对照者外周血Tregs细胞水平慢性ITP组外周血Tregs细胞占CD4细胞的(3.97±0.44)%,对照组为(3.70±0.31)%,两者差异无统计学意义(=0.50,>0.05)(封三彩图6)。Plt <20×109/L慢性ITP组([4.21±0.67)%],Plt>20×109/L组([3.78±0.60)%]及对照组Tregs细胞比例差异无统计学意义(=0.24,>0.05)。
2.4ITP患者和健康对照者血清Th1/ Th2细胞因子水平两组在11种血清细胞因子水平上差异均无统计学意义(≤1.67,均>0.05)(表1)。慢性ITP组和对照组Th1/Th2型细胞因子比值差异无统计学意义(3.77±1.346.67± 3.45,=0.94,>0.05);1型/2型细胞因子比值差异无统计学意义(3.14±1.07 4.23±1.48,=0.60,>0.05)。Plt>20×109/L的慢性ITP组血清IFN-、IL-12p70、IL-4及TNF-水平要高于另外两组,但差异无统计学意义(≤1.29,均>0.05)(表2)。Plt<20×109/L的慢性ITP组(3.14±1.20)、Plt>20×109/L组(4.26±2.21)及对照组Th1/Th2型细胞因子比值差异无统计学意义(=0.48,>0.05);3组1型/2型细胞因子比值分别为3.02±1.05、3.25±1.76及4.23±1.48,差异也无统计学意义(=0.18,>0.05)。
2.5ITP患者外周血NKT、Tregs、细胞因子与Plt的关系慢性ITP患者外周血Plt与NKT细胞呈负相关(=-0.373,=0.033)。Tregs和NKT细胞间无相关关系,但Tregs细胞与Th1/Th2细胞因子比值间呈正相关关系(=0.451,=0.011)。同时,Plt与血清IL-12p70、IFN、IL-4及TNF水平也呈正相关(= 0.354、0.365、0.354、0.366,均<0.05)。
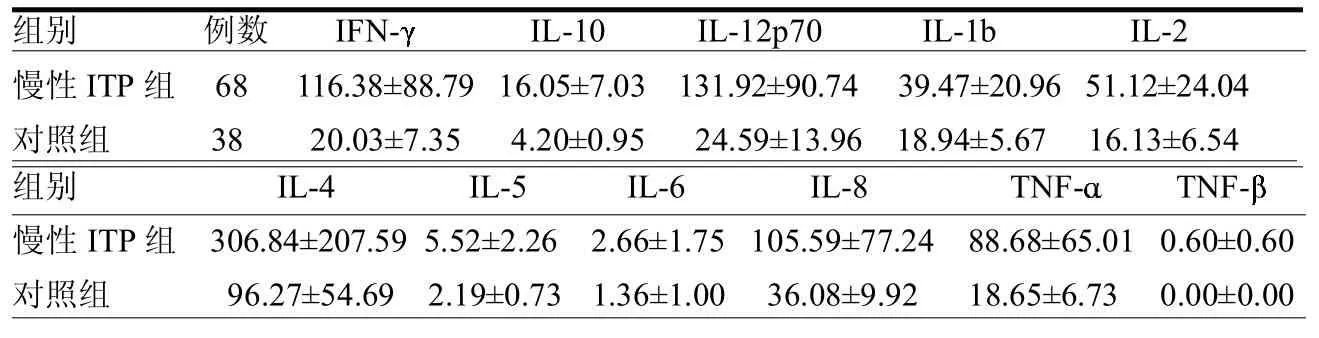
表1 慢性ITP组和对照组血清细胞因子表达水平pg/ml
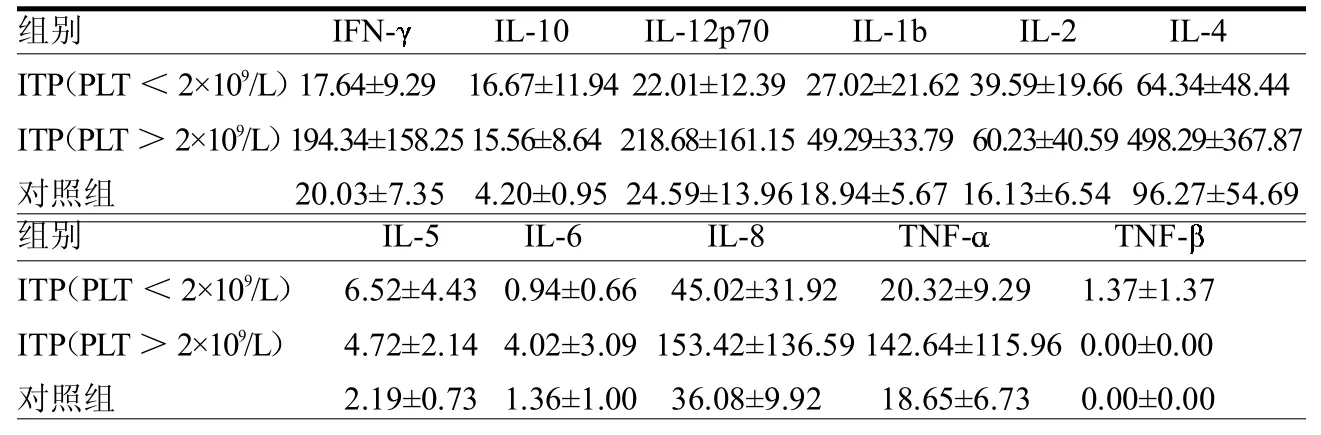
表2 不同Plt数的慢性ITP患者和健康对照细胞因子表达水平pg/ml
3 讨论
ITP的发病机制涉及机体失去对自身血小板抗原的外周耐受从而导致自体免疫细胞识别自身血小板抗原、产生自身反应性T细胞和自身抗体,最后导致血小板的异常破坏。目前认为NKT和 Tregs细胞是机体维持外周耐受最为重要的两种免疫调节细胞。
Johannson等[7]发现ITP患者外周血NKT细胞的增殖潜力显著减低,因此认为NKT细胞在ITP发病中发挥重要作用。Johannson等[8]在1例女性ITP患者中发现外周血NKT细胞的显著增高,并且这种增加的NKT细胞能够抑制自体CD4+细胞的体外增殖活性,推测NKT细胞对ITP患者起保护作用。这一观点得到Ho等[9]的支持。本研究发现,ITP患者外周血NKT细胞数量依血小板数量减少程度的不同而有显著差异,即Plt<20×109/L的慢性ITP患者组NKT细胞数量高于对照组和Plt>20×109/L组,且ITP患者外周血NKT细胞与Plt呈负相关(=-0.373,=0.033)。
NKT和Tregs细胞在体内相互影响对方的功能。Azuma等[10]发现,Tregs细胞通过细胞-细胞接触机制抑制CD4+和CD4-CD8-NKT细胞的增殖、细胞因子(IFN-,IL-4,IL-13,IL-10)分泌和细胞毒活性,而NKT细胞、尤其是CD4+NKT细胞通过分泌IL-2促进Tregs细胞的增殖[11]。本研究未发现NKT细胞和Tregs细胞间的关系。血清细胞因子分析显示,ITP患者和健康对照组在血清IL-12p70、IL-10、IL-2、IL-8、IL-6、IL-5、IL-4、IL-1b、IFN-、TNF-和TNF-水平,Th1/Th2细胞因子比值(反应抗原特异性免疫反应Th0细胞极化方向)和1型/2型细胞因子比值(反应机体总体免疫反应性质)差异均无统计学意义(均>0.05),推测可能与检测标本间结果数据的离散度太大有关。但相关分析表明,ITP患者血小板数量与IL-12p70、IFN-、IL-4及TNF-呈正相关,即细胞因子在ITP中发挥作用的观点。由于ITP的诊断仍是排除性的[12],加之疾病本身的异质性,因此很多的研究结果之间很难进行有效的比较。正如Zehnder等[13]认为,对血小板抗原特异性T和B细胞进行可靠识别和定量是今后ITP研究的方向之一。相应地,结合血小板抗原特异性T和B细胞进行NKT、Tregs及细胞因子表达谱分析将会极大地提高相关研究的可靠性。
[1]Cines DB,Blanchette VS.Immune thrombocytopenicpurpura[J].NEnglJMed,2002,346(13):995-1008.
[2]Panitsas FP,Theodoropoulou M,Kouraklis A,et al.Adult chronic idiopathicthrombocytopenic purpura(ITP)is the manifestationofatype-1polarizedimmuneresponse [J].Blood,2004,103(7):2645-2647.
[3]WangTT,ZhaoH,RenH,etal.Type1and Type 2 T-cell profiles in idiopathic throm bocytopenic purpura[J].Haematologica,2005,90(7):914-923.
[4]Zhang J,Ma DX,Zhu XJ,et al.Elevated profileofTh17,Th1andTc1cellsinpatients with immune thrombocytopenic purpura [J].Haematologica,2009,94(9):1326-1328.
[5]Cava AL,Kaer LV,Fu-Dong-Shi.CD4+CD25+Tregs and NKT cells:regulators regu lating regulators[J].Trends Immunol,2006,27(7):322-327.
[6]Zhang L,Li H,Zhao H,et al.Hepatitis C virus-relatedadultchronicidiopathicthrombocytopenicpurpura:experiencefromasingle Chinesecenter[J].EurJHaematol,2003,70 (3):196-197.
[7]JohanssonU,MaceyMG,KennyD,et al. a-Galactosylceramide-driven expansion of humannatural killerT cellsisinhibitedby prednisolone treatment[J].Br J Haematol,2004,125(3):400-404.
[8]JohanssonU,MaceyMG,KennyD,et al. Therole of natural killer T(NKT)cells in immunethrombocytopenia:isstronginvitroNKT cell activityrelatedtothe develop-ment of remission[J]?Br J Haematol,2005,129(4):564-565.
[9]HoLP,UrbanBC,JonesL,etal.CD4-CD8 alphaalpha subset of CD1d-restricted NKT cellscontrolsT cell expansion[J].JImmunol,2004,172(12):7350-7358.
[10]Azuma T,Takahashi T,Kunisato A,et al. HumanCD4+CD25+RegulatoryTCells Suppress NKT Cell Functions[J].Cancer Res,2003,63(15):4516-4520.
[11]Jiang S,Game,Davies D,et al.Activated CD1d-restrictednaturalkillerTcellssecrete IL-2:innate help for CD4CCD25C regulatory T cells[J]?Eur J Immunol,2005,35(4):1193-1200.
[12]British Society for Haematology.Guidelinesfortheinvestigationandmanagement of idiopathic thrombocytopenic purpura inadults,children and in pregnancy[J].Br J Haematol,2003,120(4):574-596.
[13]Zehnder JL,Semple JW,Imbach P,et al. Future research in ITP:an ICIS consensus [J].Ann Hematol,2010,89:S19-S23.
10.3969/j.issn.1671-0800.2016.08.048
R554+.6;R558+.2
A
1671-0800(2016)08-1069-04
2016-05-15
(本文编辑:孙海儿)
316100浙江省舟山,舟山市普陀区人民医院(邵凤);宁波开发区中心医院(徐瑞龙);金华市中心医院(郑昭璟、马拥军、胡少龙)
徐瑞龙,Email:ruilongxu@sina.com

