弥漫性腱鞘巨细胞瘤的影像学分析
广州中医药大学附属骨伤科医院放射科(广东 广州 510240)
肖 林 张延伟 胡剑波欧晓婷
弥漫性腱鞘巨细胞瘤的影像学分析
广州中医药大学附属骨伤科医院放射科(广东 广州 510240)
肖 林 张延伟 胡剑波欧晓婷
目的 探讨弥漫性腱鞘巨细胞瘤的临床和影像学表现。方法 收集18例经手术病理证实的弥漫性腱鞘巨细胞瘤患者的临床和影像学资料,进行回顾性分析。18例患者年龄19-52岁,平均29岁,均行X线平片及MRI检查。结果 病变位于膝部6例,踝部6例,足部3例,手部3例。X线上病变均表现为局部软组织肿块,其内均未见明显钙化灶,15例可见邻近骨质的破坏。MRI上病变呈分叶状肿块,边缘欠清,T1WI 呈等、低为主混杂信号,T2WI呈等低信号为主,高信号并存,所有病例均可见特征性的含铁血黄素沉着的低信号区域。增强扫描病灶呈明显不均匀强化。MRI上有12例病变累及邻近骨髓,3例造成邻近骨皮质压迫性骨质吸收,3例邻近骨质未见异常。结论 弥漫性腱鞘巨细胞瘤的临床表现和影像学特点对其的临床诊断与治疗很有价值。
弥漫性腱鞘巨细胞瘤;X线平片;磁共振成像
腱鞘巨细胞瘤是一种良性软组织肿瘤,最早由Jaffe[1]等首次报道。初时此病被认为是炎症性病变,后发现其细胞增殖异常[2],又因其缓慢生长而被认为是良性肿瘤。2003年WHO骨和软组织肿瘤分类将其归为起源于纤维组织细胞的肿瘤[3]。腱鞘巨细胞瘤又分为局限性和弥漫性两种,后者少见,具有一定的侵袭性,手术切除后容易复发[4]。本文对其临床表现和影像学特点进行分析,以提高诊断水平。
1 材料和方法
1.1 一般资料 对自2005年至2015年间在我院经手术病理证实的18例弥漫性腱鞘巨细胞瘤(DGTTS)的临床和影像学资料进行回顾性分析。男性12例,女性6例,患者年龄19~52岁,平均年龄29岁。患者均以发现肿物就诊,病史3~14年,3例有局部疼痛,3例有外伤史。查体病灶均表现为质硬肿物,局部无红肿,3例有轻压痛。
1.2 影像学检查 所有患者均行X线平片及MRI检查。MR设备为GE公司的Signa Hde 1.5T全身磁共振扫描仪,采用肢体表面线圈,行轴位、冠状位、矢状位扫描,扫描序列为SE T1WI(TR 500-660ms,TE 11-16ms)及FSE T2WI(TR 2500-4000ms,TE 80-100ms)。造影剂为先灵公司生产的马根维显,剂量为0.1mmol/kg。
1.3 图像分析 所有图像由放射科2位副主任医师采用双盲法共同阅片,意见有分歧时经协商并取得一致意见。图像观察的主要内容包括:①X线平片上的局部软组织肿块、有无钙化、周围骨质是否破坏。②MRI上病变的位置、形态、边缘、大小、信号强度及分布特点(25%以下区域信号不一致为轻度不均,25%~50%的区域信号不一致为中度不均,50%以上区域信号不一致为明显不均),病灶的强化特点。③病灶内部是否有新鲜出血、坏死或囊变,周围软组织是否水肿及周围骨质有无破坏。
2 结 果
病变位于膝部6例,踝部6例,足部3例,手部3例。X线平片上所有病变均表现为局部软组织肿块,边界较清,其内均未见钙化灶,15例可见邻近骨质破坏,表现为局部一侧骨皮质的完全破坏缺损或仅为皮质的局限性吸收变薄(图1),均未见骨膜反应,亦未见增生硬化、钙化或骨化。18例病变MRI均呈分叶状肿块,边缘欠清;病变最大径2.3cm~6.3cm,平均约(3.6±0.2)cm。以肌肉为等信号,T1WI病变信号都不均匀,除3例间杂少许高信号外均表现为等、低混杂信号;T2WI加权病变信号也不均匀,呈等、低、高混杂信号,且等低信号所占比例约35%~50%甚至以上。所有病例都可见到特征性的含铁血黄素沉积的低信号区域,形态不一,呈线状、条带状、结节状或斑片状(图1-8)。增强扫描,病灶明显不均匀强化(图4、8)。所有病变均未见坏死或囊变区, 3例病灶内见少量新鲜出血;12例周围软组织有轻度水肿(图3); 12例破坏邻近骨皮质,累及骨髓(图4),3例对邻近骨皮质造成压迫性骨质吸收(图8),3例紧贴邻近的骨皮质,未见明显骨破坏。
3 讨 论
1941年Jaffe等首次报道一组发生于关节、腱鞘或滑膜的慢性增殖性疾病,这些病变中都有滑膜样单核细胞、多核巨细胞、泡沫细胞、炎性细胞和含铁细胞等细胞成分,其间质内含有胶原纤维,且常有不同程度的玻璃样变性[5]。这些病变最初被认为是炎症性病变,但后来发现其细胞增殖异常,具有一定的自主性,临床上可见手术切除后复发及少数恶变[6]的病例,现普遍认为是一种肿瘤。2003年WHO骨和软组织肿瘤分类将其归类于起源于纤维组织细胞的肿瘤。此类病变根据其生长部位及生长方式的不同可分为数种亚型,其生物学行为和临床表现各异。目前一般将发生在关节内的称为色素沉着绒毛结节性滑膜炎,将发生在关节外软组织内的分为局限性和弥漫性腱鞘巨细胞瘤。
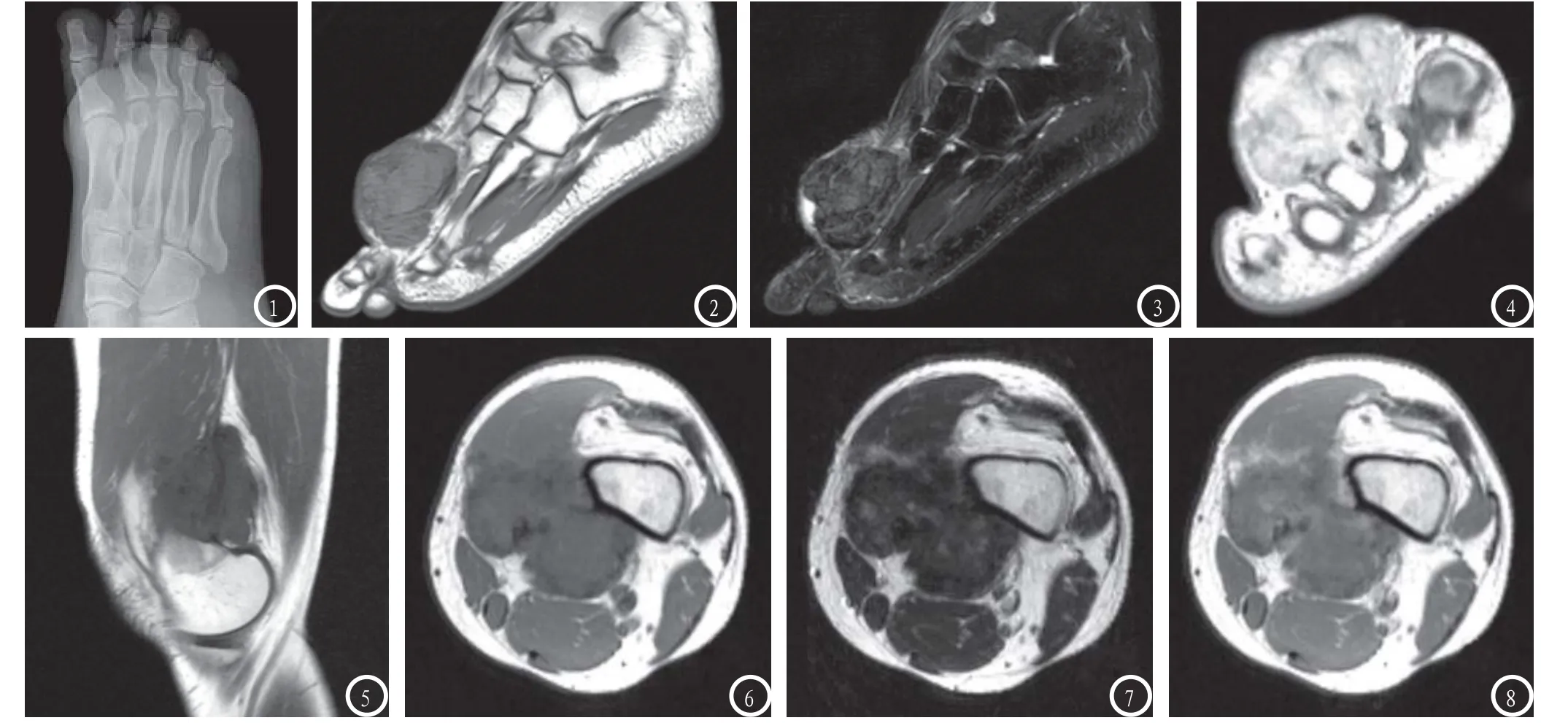
图1-4 足部弥漫性腱鞘巨细胞瘤。图1:X线平片显示足远端第1、2跖骨间见一软组织肿块影,其内未见明显钙化,第2跖骨可见骨质破坏,但无骨膜反应,周围骨质未见硬化或骨化。图2 矢状面T1WI加权显示足远端背侧见一等、低混杂信号肿块。图3 矢状面T2WI压脂显示该肿块等、低、高信号并存,且前两者为主,肿块内某些区域T1WI及T2WI加权均呈低信号,肿块周围软组织轻度水肿。图4 轴位增强扫描显示肿块明显不均匀强化。肿块呈分叶状,边缘欠清,侵犯第2跖骨骨髓腔。图5-8 膝部弥漫性腱鞘巨细胞瘤。图5-6 轴位及矢状面T1WI加权显示膝关节周围呈等、低信号的分叶状肿块。图7 轴位T2WI加权显示该肿块等、低、高信号并存,前两者为主。肿块内某些区域T1WI及T2WI加权均呈低信号。图8 增强扫描肿块明显不均匀强化,肿块边缘欠清,压迫领近股骨远端皮质造成轻微的骨质吸收。
弥漫性腱鞘巨细胞瘤也可认为是发生在关节外软组织的色素沉着绒毛结节性滑膜炎,常见于20到50岁之间的成年人[5],本组患者的发病年龄范在17至52岁。该病主要症状为生长缓慢的肿块,疼痛少见[3],本组病例中仅有3例有自觉疼痛,3例有轻压痛。本组病例中仅2例有外伤史,提示其与弥漫型腱鞘巨细胞瘤发生的相关性不大。弥漫性腱鞘巨细胞瘤可发生在很多部位,但以膝、踝等大关节旁和足部多见[7],中轴骨罕见。本组病变15例发生在这些部位,3例见于手指。
弥漫性腱鞘巨细胞瘤的MR信号特点与其病理学组织成分相关。本组弥漫性腱鞘巨细胞瘤病例T2WI加权呈等低信号为主的混杂信号,等低信号所占比例约35%~50%甚至以上,并可见特征性的含铁血黄素沉积所致的在T1WI和T2WI加权上均呈低信号区域,增强扫描病变明显强化,这可能与沉积的含铁血黄素周围丰富的胶原增生内存在大量新生的毛细血管有关。Somerhausen等[5]将弥漫性腱鞘巨细胞瘤定义为在肉眼或镜下至少局灶性地呈浸润性表现,没有明显边界的病变。本组18例病变都表现为部分或全部边界不清,15例侵犯邻近骨骼(12例侵犯骨髓,3例对皮质造成压迫性吸收),反映其具有一定的侵袭性的特征。
临床上将弥漫性、局限性腱鞘巨细胞和及色素沉着绒毛结节性滑膜炎这三者分辨清楚十分重要,因为各自的预后和治疗方法都不同。局限性腱鞘巨细胞瘤容易被切除,并且局部复发率低,仅约为10%~20%[5];弥漫性腱鞘巨细胞瘤具有相当的侵袭性,局部复发率约在40%~50%[5,7],需广泛切除肿瘤并包括其周围的卫星结节;色素沉着绒毛结节性滑膜炎发生在关节内,使滑膜呈绒毛状弥漫性受累,局部复发率高,常需行包括滑膜切除术在内的彻底切除[7]。这三种病变的病理组织学成分相似,在磁共振上都可见特征性的含铁血黄素沉积的低信号区域,且明显强化,因此单独影像学检查或病理学检查难于鉴别,临床上需结合病变生长部位、症状体征、流行病学等多方面综合判断。色素沉着绒毛结节性滑膜炎发生在关节内,好发于膝、踝、髋、肘等大关节,形成分叶状的绒毛结节,结节内有丰富的含铁血黄素沉积,常伴大量关节积液和邻近骨的侵蚀[8]。局限性腱鞘巨细胞瘤又被称为局限结节性腱鞘滑膜炎,与弥漫性腱鞘巨细胞瘤一样发生在关节外,多见于手或足部,尤其是前者,有作者报道称其所占比例可达85%[4];在显微镜下局限性腱鞘巨细胞瘤一般可见纤维包膜,在MRI上其病灶较小,信号较均匀,且边界清楚,邻近骨质侵犯比较少见,不同于其他两者[9]。此外弥漫性腱鞘巨细胞瘤还应与韧带硬纤维瘤相鉴别,后者一般表现为位于深部肌间的肿物,倾向于沿着筋膜生长,可以推移包绕或侵犯邻近的肌肉、肌腱和韧带。骨的侵犯不少见,但多表现为压迫性吸收而不是骨髓的侵犯。多数病变信号是不均匀的,其低信号是由纤维成分形成,所以其T2WI加权信号较腱鞘巨细胞瘤更高,病灶内纤维组织形成的线状或带状低信号区是典型表现,部分可与邻近肌腱或筋膜相延续[10,11]。
总之,弥漫性腱鞘巨细胞瘤多见于中青年,膝、踝关节旁和足部是其好发部位,临床多表现为质硬无痛性肿物。平片上一般无钙化或骨化,MRI上多表现为边界不清的分叶状软组织肿块,T2WI加权等低信号为主,各序列均见固定的低信号区域,增强扫描病灶明显强化,病变邻近骨骼常受侵犯。如有病变符合以上表现,需考虑弥漫性腱鞘巨细胞瘤可能,手术切除时应尽可能广泛切除,以防止复发。
[1]Jaffe HL, Lichtenstein L, Sutro CJ. Pigmented villonodular synovitis, bursitis and tensynovitis[J]. Arch Pathol, 1941, 31:731-765.
[2]Sciot R, Rosai J, Dal Cin P, et al. Analysis of 35 cases of localized and diffuse tenosynovial giant cell tumor: a report from the chromosomes and morphology(CHAMP) study group[J]. Mod Pathol,1999, 12(6):576-579.
[3]朱雄增.软组织肿瘤WHO最新分类特点[J].临床与实验病理学杂志,2003,19(1):94-96.
[4]Sanghvi DA, Purandare NC, Jambhekar NA, et al. Diffusetype giant cell tumor of the subcutaneous thigh [J]. Skeletal Radiol, 2007, 36(4): 327-330.
[5]Somerhausen NS, Fletcher CD.Diffuse-type giant cell tumor: clinicopathologic and immunohistochemical analysis of 50 cases with extra-articular disease[J]. Am J Surg Pathol, 2000, 24(4): 479-492.
[6]Layfield LJ, Meloni-Ehrig A, Liu K, el al. Malignant giant cell tumor of synovium(malignant p i g m e n t e d v i l l o n o d u l a r synovitis)[J]. Arch Pathol Lab Med, 2000, 124(11):1636-1641.
[7]Jelinek JS, Kransdorf MJ, Shmookler BM, et al. Giant cell tumor of the tendon sheath: MR findings in nine cases[J]. AJR Am J Roentgenol,1994,162(4): 919-922.
[8]Woertler K. Soft tissue masses in the foot and ankle: characteristics on MR Imaging [J].Semin Musculoskelet Radiol, 2005, 9(3): 227-242.
[9] Kitagawa Y, Ito H, Amano Y, et al. MR imaging for preoperative diagnosis and assessment of local tumor extent on localized giant cell tumor of tendon sheath[J]. Skeletal Radiol, 2003, 32(11): 633-638.
[10]Edmonds LD, Ly JQ,LaGatta LM, et al. Quiz case.Extraabdominal desmoid tumor of the upper arm[J]. Eur J Radiol, 2003, 48(3): 312-315.
[11]Tanaka H, Harasawa A, Furui S. Usefulness of MR imaging in assessment of tumor extent of aggressive fibromatosis[J]. Radiat Med,2005,23(2):111-115.
Imaging Diagnosis of Diffuse-type Giant Cell Tumor of Tendon Sheath
XIAO Lin, ZHANG Yan-Wei, HU Jian-Bo,et al., Department of Radiology, Guangzhou University of Traditional Chinese Medicine Orthopedic Hospital, Guangzhou 510240, China
Objective To analyze the clinical and imaging characteristics of diffuse-type giant cell tumor of tendon sheath (D-GCTTS). Methods Clinical and imaging data from 18 patients with pathologically confirmed D-GCTTS were retrospectively analyzed. X-ray and MRI examination were performed on all cases. The age of the patients ranged from 19 to 52 years with an average age of 29 years. Results Six tumors occurred in knee, six in ankle, three in foot and three in hand. On X-ray films, all cases showed local soft tissue mass. There was no visible calcification in the soft tissue. Invasion of adjacent bone was identified in 15 of them. On MRI, all lesions appeared as lobulated soft tissue masses with ill-defined margin. All lesions displayed isointense and hypointense signal on T1WI and heterogeneous appearance on T2WI, mainly isointense and hypointense signal mixed with hyperintense signal. Characteristic low signal intensity areas where hemosiderin was deposited in the different sequences were identified in all cases. After the injection of Gd-DTPA, all tumors showed heterogeneous and strong enhancement. Twelve cases showed medullary invasion of the adjacent bone, three cases showed pressure erosion of the cortex, and three showed normal of the adjacent bone. Conclusion Characteristic imaging and clinical features of D-GCTTS is very valuable for the diagnosis and treatment of this disease.
Giant Cell Tumor of Tendon Sheath; Magnetic Resonance Imaging; Radiography
R686.1
A
DOI:10.3969/j.issn.1672-5131.2016.05.036
欧晓婷
(本文编辑: 刘龙平)
2016-04-09
论 著

