青檀叶片内生和附生真菌组成及生态分布
柴新义,柴钢青,向玉勇,张微微,殷培峰
滁州学院生物与食品工程学院, 滁州 239000
青檀叶片内生和附生真菌组成及生态分布
柴新义*,柴钢青,向玉勇,张微微,殷培峰
滁州学院生物与食品工程学院, 滁州239000
对我国古老特有植物青檀叶片进行内生和附生真菌的研究,以了解青檀叶片内生和附生真菌的组成特点和探讨内生和附生真菌菌群之间的可能联系,为研究真菌资源多样性、植物附生和内生真菌的相互演化关系及真菌与宿主植物协同进化等提供有益参考资料。研究结果表明,从健康的青檀叶片获得可培养内生真菌839株,附生真菌1857株,共计2696株,鉴定其分属于4目,5科,43属。在目的分类水平上,内生和附生真菌均以丛梗孢目Moniliales为优势菌群,分别占90.23%和 92.51%;在科的水平上,内生真菌以暗梗孢科 Dematiaceae和丛梗孢科Moniliaceae为优势菌群,分别占47.56%和42.67%,附生真菌以丛梗孢科Moniliaceae 和暗梗孢科 Dematiaceae为优势菌群,分别占67.04%和25.47%;在属的水平上,内生真菌以黑团孢属Periconia和青霉属Penicillium为优势菌群,分别占31.47%和10.73%,附生真菌以小球霉属Glomerularia、膝葡孢属Gonatobotrys和青霉属Penicillium为优势菌群,分别占20.03%、13.95%和12.22%。青檀叶片内生真菌和附生真菌均存在的菌群数量达到23个属,占53.49%。内生真菌特有的属有6个,共分离19株,占0.70%,附生真菌特有的属有14个,共分离120株,占4.45%。 内生真菌的Shannon-Wiener index (H′) 多样性指数(2.44)和Margalef index (R) 丰富度指数(2.88)分别小于附生真菌Shannon-Wiener index (H′) 多样性指数(2.57)和Margalef index (R) 丰富度指数(3.32),但两者的Evenness index (E) 均匀度指数几乎相等。青檀叶片内生和附生真菌菌群组成具有较高的相似性,相似性系数达0.70。通过Fisher′s exact test分析表明青檀叶片内生和附生真菌菌群组成无明显差异(P=0.072)。
青檀叶片;内生真菌;附生真菌;多样性指数;相似性系数
植物内生真菌的研究已有100多年的历史,早期主要集中在对热带地区的经济植物内生真菌的种类组成和生态分布特征的研究[ 1- 4],后来涉及的地区、植物种类、组织部位、生长季节等都有了较大的扩展[ 5- 6]。近年来,主要集中在植物内生真菌代谢产物的种类和结构方面的研究[7- 9],同时,对植物内生真菌在促进宿主植物生长、增加产量、增强宿主抗逆性、改善微生态环境方面进行了较多的研究[10- 14]。对古老或特有植物种类内生真菌的研究报道明显较少,对附生植物表面和内生植物中的真菌菌群的组成和相互关系的研究未见报道。青檀Pteroceltistatarinowii是我国特有的第三纪孑遗植物[15],青檀作为一种古老的植物在长期的进化过程中与其叶片内生和附生真菌菌群可能已经形成了较好的、稳定的适应关系[16],所以本研究选择野生健康的青檀植物上部和下部,向阳和向阴等不同部位的叶片进行内生和附生真菌的分离研究,以了解青檀叶片内生和附生真菌的组成特点,并探讨内生和附生真菌菌群之间的可能联系,以期为研究真菌资源多样性、植物附生和内生真菌的相互演化关系及真菌与宿主植物协同进化等提供有益的参考资料。
1 材料与方法
1.1材料1.1.1植物样本
夏季(8月),在安徽琅琊山自然保护区内选择10棵树龄一致的多年生野生健康青檀植株,每株分别从上部、下部、向阳和向阴各部位选取当年生的健康叶片10个。样品放置于已灭菌的培养皿中,密封,详细编号,冰箱4℃保存,24h内完成分离实验。
1.1.2培养基
分离培养基:配制和制作过程参照参考文献[16]。保藏培养基:PDA培养基,即马铃薯葡萄糖琼脂培养基,马铃薯 200g(煮汁)、葡萄糖 20g、琼脂15—18g、加水定容1000mL、pH 自然。
1.2方法1.2.1附生和内生真菌的分离
青檀叶片附生和内生真菌的分离主要参照参考文献[16],并根据实际做了一些修改。用无菌剪刀把叶片剪成适当大小,无菌水冲洗5次,混匀该无菌水冲洗液,涂布平板进行叶片附生真菌的分离培养。同时,做空白对照。将上述无菌水冲洗后的叶片在2%的次氯酸钠中消毒1min;用无菌水冲洗2次,转入75%的乙醇中浸泡1min;用无菌水清洗5次,晾干,用无菌剪刀将叶片剪成2mm×2mm大小的组织小块,接种到分离培养基上。同时,做空白对照。在(25±1)℃恒温培养箱中培养,并每天观察记录生长状况,用接种针及时挑取边缘菌丝转接到PDA平板上继续培养,纯化2—3次后得到单一菌种。
1.2.2内生和附生真菌的鉴定
采取形态分类鉴定法进行菌株鉴定,对未产孢的种类采取低温、干燥(降低湿度)、紫外线照射和降低营养供给等方法诱导和刺激产孢。分类主要依据Barnett和Hunter和Sutton的分类系统[17- 18]。同时,参照其它有关真菌鉴定工具书进行鉴定[19- 20]。
1.2.3数据分析
分离频率:某一指定类型真菌的菌株数量占分离培养的内生和附生真菌菌株数量的百分率,用于比较和判断优势菌群。
利用软件spss16.0分析青檀叶片内生和附生真菌菌群的组成差异。
2 结果与分析
2.1青檀叶片内生和附生真菌菌群组成分析
从青檀叶片共分离可培养内生真菌839株,附生真菌1857株,共计2696株,鉴定结果显示其分属于4目,5科,43属(表1)。子囊菌的无性型(丝孢类无性型真菌和腔孢类无性型真菌)在青檀叶片内生和附生真菌分离的菌群中占据绝对优势,分别达到94.64%和97.41%。在目的分类水平上,青檀叶片内生和附生真菌均以丛梗孢目Moniliales为优势菌群,分别占90.23%和 92.51%;在科的水平上,内生真菌以暗梗孢科 Dematiaceae和丛梗孢科Moniliaceae为优势菌群,分别占47.56%和42.67%,附生真菌以丛梗孢科Moniliaceae 和暗梗孢科 Dematiaceae为优势菌群,分别占67.04%和25.47;在属的水平上,内生真菌以黑团孢属Periconia和青霉属Penicillium为优势菌群,分别占31.47%和10.73%,附生真菌以小球霉属Glomerularia、膝葡孢属Gonatobotrys和青霉属Penicillium为优势菌群,分别占20.03%、13.95%和12.22%(表 1)。
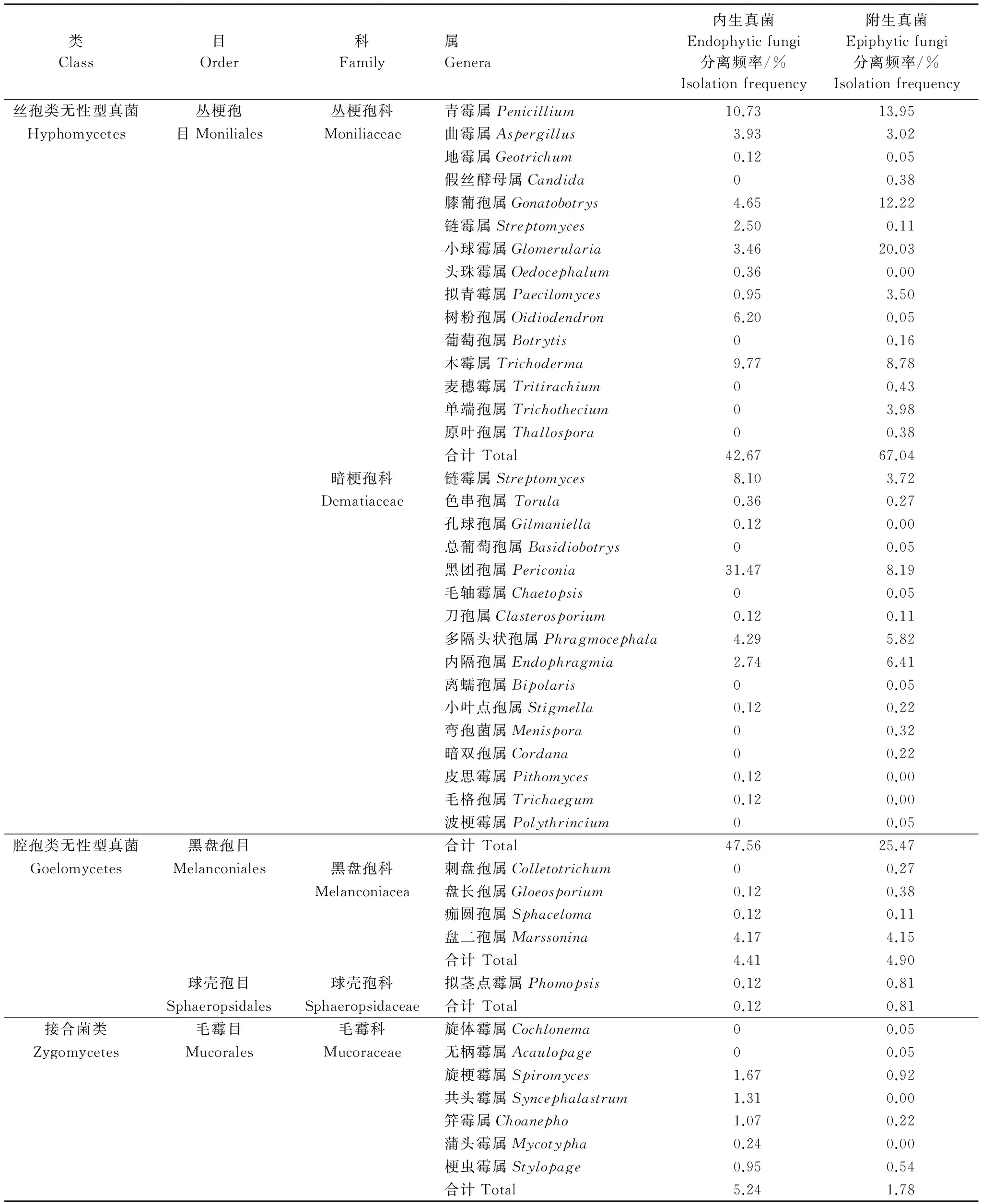
表1 青檀叶片内生和附生真菌菌群组成分析
青檀叶片内生和附生真菌菌群组成既有共性,又存在一定差异。内生真菌和附生真菌均存在的菌群数量达到23属,占到53.49%,分别为青霉属Penicillium、曲霉属Aspergillus、地霉属Geotrichum、膝葡孢属Gonatobotrys、链霉属Streptomyces、小球霉属Glomerularia、拟青霉属Paecilomyces、树粉孢属Oidiodendron、木霉属Trichoderma、交链孢属Alternaria、色串孢属Torula、黑团孢属Periconia、刀孢属Clasterosporium、多隔头状孢属Phragmocephala、内隔孢属Endophragmia、小叶点孢属Stigmella、无柄霉属Acaulopage、旋梗霉属Spiromyces、共头霉属Syncephalastrum、笄霉属Choanephora、拟茎点霉属Phomopsis、盘长孢属Gloeosporium和盘二孢属Marssonina,共分离菌株2557株,占94.84%。青檀叶片内生真菌特有的属有6个,共分离19株,占0.70%,分别为头珠霉属Oedocephalum、孔球孢属Gilmaniella、皮思霉属Pithomyces、毛格孢属Trichaegum、刺盘孢属Colletotrichum和痂圆孢属Sphaceloma。附生真菌特有的属有14个,共分离120株,占4.45%,其分别为假丝酵母属Candida、葡萄孢属Botrytis、麦穗霉属Tritirachium、单端孢属Trichothecium、原叶孢属Thallospora、总葡萄孢属Basidiobotrys、毛轴霉属Chaetopsis、离蠕孢属Bipolaris、弯孢菌属Menispora、暗双孢属Cordana、波梗霉属Polythrincium、旋体霉属Cochlonema、蒲头霉属Mycotypha和梗虫霉属Stylopage。 通过Fisher′s exact test分析显示青檀叶片内生和附生真菌菌群组成无明显差异(P=0.072﹥0.05),这可能暗示着青檀叶片内生和附生真菌菌群之间存在着密切的演化关系。
2.2不同部位青檀叶片内生和附生真菌菌群组成分析
由表2可以看出:青檀不同部位叶片的内生和附生真菌均同时具有的菌群有青霉属Penicillium、曲霉属Aspergillus、膝葡孢属Gonatobotrys、拟青霉属Paecilomyces、木霉属Trichoderma、交链孢属Alternaria、黑团孢属Periconia、多隔头状孢属Phragmocephala和内隔孢属Endophragmia共9个属。青檀叶片内生真菌和附生真菌均是以向阳面的样品分离培养的菌株数量最多,分别达到495株和1382株,占58.88%和74.42%,以阴面样品分离培养的菌株数量为最少,分别为344株和475株,分别占41%和25.58%。
表2不同部位青檀叶片内生和附生真菌菌群的组成及分离频率(IF)
Table 2Composition and isolation frequency of endophytic fungi and epiphytic fungi ofPteroceltistatarinowiifrom different sampling position

属Genera内生真菌Endophyticfungi附生真菌Epiphyticfungi阴面Shade阳面Sunward上部Upper下部Lower阴面Shade阳面Sunward上部Upper下部Lower分离频率IF/%分离频率IF/%分离频率IF/%分离频率IF/%分离频率IF/%分离频率IF/%分离频率IF/%分离频率IF/%青霉属Penicillium5.485.246.793.932.2111.748.945.01曲霉属Aspergillus1.072.862.151.790.972.051.181.83地霉属Geotrichum0.12000.1200.050.050.00假丝酵母属Candida00000.3800.380膝葡孢属Gonatobotrys2.032.621.553.106.575.6510.501.72链霉属Streptomyces2.50002.500.050.050.110.00小球霉属Glomerularia0.722.741.911.55020.031.4018.63头珠霉属Oedocephalum00.360.120.240000拟青霉属Paecilomyces0.600.360.360.600.592.911.132.37树粉孢属Oidiodendron6.20006.2000.050.050.00葡萄孢属Botrytis00000.110.050.110.05木霉属Trichoderma1.078.707.032.742.586.194.584.20麦穗霉属Tritirachium00000.160.270.220.22单端孢属Trichothecium00003.9803.980原叶孢属Thallospora000000.3800.38链霉属Streptomyces2.985.134.173.931.022.690.543.18色串孢属Torula00.360.240.120.050.220.050.22孔球孢属Gilmaniella00.120.1200000总葡萄孢属Basidiobotrys000000.0500.05黑团孢属Periconia11.0820.5017.7613.591.356.841.137.05毛轴霉属Chaetopsis000000.0500.05刀孢属Clasterosporium00.1200.120.050.0500.11多隔头状孢属Phragmoceph-ala2.381.912.501.791.294.524.521.29内隔孢属Endophragmia1.671.072.620.122.753.665.980.43离蠕孢属Bipolaris00000.0500.050小叶点孢属Stigmella00.1200.120.050.160.110.11弯孢菌属Menispora000000.320.320暗双孢属Cordana00000.2200.220皮思霉属Pithomyces00.1200.120000毛格孢属Trichaegum00.1200.120000波梗霉属Polythrincium000000.050.050刺盘孢属Colletotrichum00000.220.050.110.16盘长孢属Gloeosporium0.12000.120.220.160.160.22痂圆孢属Sphaceloma0.12000.1200.110.050.05盘二孢属Marssonina04.174.17004.151.512.64拟茎点霉属Phomopsis0.12000.1200.810.160.65旋体霉属Cochlonema000000.050.050无柄霉属Acaulopage000000.050.050旋梗霉属Spiromyces01.550.721.070.220.700.160.75共头霉属Syncephalastrum0.950.360.480.830000笄霉属Choanepho0.720.360.360.7200.2200.22蒲头霉属Mycotypha0.120.120.120.120000梗虫霉属Stylopage0.95000.950.480.050.270.27合计Total41.0058.8853.1646.9625.5874.4248.1451.86
向阳向阴样品分离的内生真菌和附生真菌的优势菌群(IF≥5%)组成存在一定差异。向阳内生真菌优势属为黑团孢属Periconia(20.5%)、木霉属Trichoderma(8.70%)、青霉属Penicillium(5.24%)、链霉属Streptomyces(5.13%),附生真菌优势属小球霉属Glomerularia(20.03%)、青霉属Penicillium(11.74%)、黑团孢属Periconia(6.84%)、膝葡孢属Gonatobotrys(5.65%)。向阴内生真菌优势属为黑团孢属Periconia(11.08%)、青霉属Penicillium(5.48%)、树粉孢属Oidiodendron(6.20%),附生真菌优势属膝葡孢属Gonatobotrys(6.57%)。由上可见,向阳向阴的内生真菌均是以黑团孢属Periconia为最大优势菌群,分别占20.5%和11.08%;膝葡孢属Gonatobotrys为向阳向阴部位共同具有的附生真菌优势菌群,分别占5.65%和6.57%。
上部和下部青檀叶片样品分离内生真菌和附生真菌的优势菌群组成亦表现出一定的差异。上部内生真菌优势属为黑团孢属Periconia(17.76%)、木霉属Trichoderma(7.03%)、青霉属Penicillium(6.79%);附生真菌优势属有膝葡孢属Gonatobotrys(10.50%)、青霉属Penicillium(8.94%)和内隔孢属Endophragmia(5.98%)。下部内生真菌优势属为黑团孢属Periconia(13.59%)、树粉孢属Oidiodendron(6.20%),附生真菌优势属为小球霉属Glomerularia(18.63%)、黑团孢属Periconia(7.05%)、青霉属Penicillium(5.01%)。由此可见,上部和下部的内生真菌亦均是以黑团孢属Periconia为最大优势菌群,分别占17.76%和13.59%;青霉属Penicillium为上部和下部共同具有的附生真菌优势菌群,分别占8.94%和5.01%。
通过Fisher′s exact test分析,结果表明(表3):(1)青檀叶片内生真菌菌群组成除了阴面和上部样品中存在显著差异之外(P=0.029),在来自其它部位的样本之中的菌群组成均无明显差异(P=0.083—0.758);(2)青檀叶片附生真菌菌群组成除了阴面和上部样品存在显著差异之外(P=0.032),在来自其它部位的样本之中的菌群组成均无明显差异(P=0.08—0.996);(3)来自青檀同一部位(阴面、阳面、上部和下部)的样品分离获得的相应内生真菌和附生真菌菌群的组成均无明显差异(P=0.074, 0.098, 0.052, 0.535)。以上结果再次暗示着青檀叶片内生和附生真菌菌群之间存在着密切的演化关系,真菌与宿主植物在长期的发展过程中已经形成了较为稳定的协同进化关系。
表3不同部位青檀叶片内生和附生真菌菌群组成的差异性分析(P)
Table 3Analysis the difference (P) composition of endophytic fungi and epiphytic fungi ofPteroceltistatarinowiifrom different sampling position
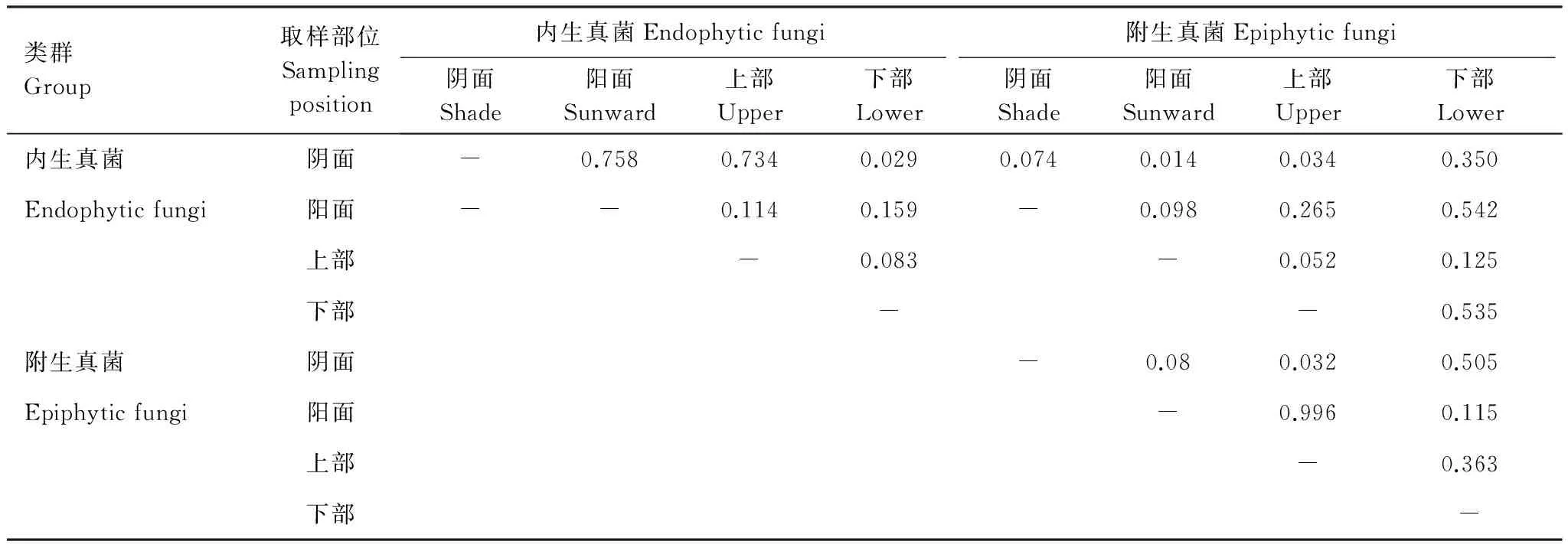
类群Group取样部位Samplingposition内生真菌Endophyticfungi附生真菌Epiphyticfungi阴面Shade阳面Sunward上部Upper下部Lower阴面Shade阳面Sunward上部Upper下部Lower内生真菌阴面-0.7580.7340.0290.0740.0140.0340.350Endophyticfungi阳面--0.1140.159-0.0980.2650.542上部-0.083-0.0520.125下部--0.535附生真菌阴面-0.080.0320.505Epiphyticfungi阳面-0.9960.115上部-0.363下部-
2.3青檀叶片内生和附生真菌菌群多样性分析
由表4可知,青檀叶片内生真菌共分离菌株839株,占31.12, 29属,占67.44%,而青檀叶片附生真菌共分离菌株1857株,占68.88%,37属,占86.05%。内生真菌以阳面样品分离的菌株数量为最多(495株),以阴面分离的菌株数量为最少(344株),附生真菌分离的菌株数量亦表现出了类似的规律。青檀叶片内生真菌以下部分离的菌群数量为最多(27属),以上部分离的菌群数量为最少(18属),而青檀叶片附生真菌菌群数量表现的规律恰好与之相反。青檀内生真菌的Shannon-Wiener index (H′) 多样性指数(2.44)和Margalef index (R) 丰富度指数(2.88)均分别小于青檀附生真菌Shannon-Wiener index (H′) 多样性指数(2.57)和Margalef index (R) 丰富度指数(3.32),但两者的Evenness index (E) 均匀度指数几乎相等,说明菌群在青檀叶片内、叶片外分布的均匀程度基本一致。

表4 青檀内生真菌和附生真菌菌群多样性指数的计算
来自向阴和向阳青檀叶片样品分离的内生真菌的菌株数量、属数、Shannon-Wiener index (H′) 多样性指数和Margalef index (R) 丰富度指数均分别小于青檀附生真菌相应的菌株数量、属数、Shannon-Wiener index (H′) 多样性指数和Margalef index (R) 丰富度指数,而均匀度指数Evenness index (E)恰相反。以下部叶片的内生真菌的多样性为最高(2.46),丰富度为最大(3.02),上部的内生真菌的多样性和丰富度为最小。附生真菌以上部叶片分离的真菌的多样性最高(2.41),丰富度为最大(3.16)。
2.4青檀叶片内生和附生真菌菌群组成相似性分析
实验结果表明(表5),青檀叶片内生和附生真菌菌群组成具有较高的相似性,相似性系数达0.70。从不同采样部位青檀叶片样本中分离的内生真菌菌群的相似性系数(Cs)在0.62—0.90之间,来自青檀向阳的样品和上部的样品分离的内生真菌菌群的相似性系数为最高(Cs=0.90),菌群组成相似性最低的存在于来自青檀向阳与向阴的样品之间,但相似性系数仍达0.62。青檀叶片样本分离的附生真菌菌群的相似性系数在0.68—0.88之间,菌群组成相似性最大的存在于来自下部和向阳的样品之间,相似性系数为0.88,菌群组成相似性最低的亦存在于来自青檀向阳与向阴的样品之间,但相似性系数至0.68。该结果与上述通过Fisher′s exact test分析的结果是吻合的,即青檀叶片内生和附生真菌菌群组成差异不明显,相似度较高。

表5 青檀内生和附生真菌菌群相似性系数(Cs)的计算
3 讨论
研究结果显示,青檀叶片内生真菌以阳面样品分离的菌株数量为最多(495株),以阴面分离的菌株数量为最少(344株),青檀叶片附生真菌分离的菌株数量亦表现出了类似的规律。青檀内生真菌的Shannon-Wiener index (H′) 多样性指数(2.44)和Margalef index (R) 丰富度指数(2.88)均分别小于青檀附生真菌Shannon-Wiener index (H′) 多样性指数(2.57)和Margalef index (R) 丰富度指数(3.32),但两者的Evenness index (E) 均匀度指数几乎相等,说明菌群在青檀叶片内和叶片外分布的均匀程度基本一致。青檀叶片内生真菌菌群组成阴面和上部样品中存在显著差异 (P=0.029),这些现象暗示青檀叶片内生真菌和附生真菌菌群之间存在着密切的演化联系,内生真菌可能除了本身固有的种类以外,可能有些是来源于附生真菌侵染定殖的结果,与附生真菌的种类和数量多寡有关,也与植物叶片的生理状态、营养状况、空气的湿度、光照、紫外线、降水、风、温度和温差等诸多因素有关,同样某些内生真菌在合适的条件下亦可以跨过叶片细胞间隙在叶片的表面生长繁殖而成为叶片的附生真菌。本研究仅在夏季首次探究青檀叶片内生和附生真菌菌群的可能联系,其他季节和其它种类的植物中是否会表现出同样的现象,尚需要更多的深入研究。
青檀叶片内生真菌以下部分离的菌群数量为最多(27属),以上部分离的菌群数量为最少(18属),而青檀叶片附生真菌菌群数量表现的规律恰好与此相反。内生真菌以下部叶片的内生真菌的多样性为最高(2.46),丰富度为最大(3.02),而以上部的内生真菌的多样性和丰富度为最小。附生真菌以上部叶片分离的真菌的多样性为最高(2.41),丰富度为最大(3.16)。来自向阴和向阳青檀叶片样品分离的内生真菌的菌株数量、属数、Shannon-Wiener index (H′) 多样性指数和Margalef index (R) 丰富度指数均分别小于青檀附生真菌的菌株数量、属数、Shannon-Wiener index (H′) 多样性指数和Margalef index (R) 丰富度指数,而均匀度指数Evenness index (E)恰相反。这种结果可能说明外界环境因素(光照、温度、湿度、自然风、雨水、昼夜温差、其他动物等)对青檀叶围区域的附生真菌的影响是较大的。内生真菌生长在植物组织内部,微环境相对比较稳定,受外界因素的影响相对较小,菌群亦趋稳定,这也是“菌植”长期协同进化的结果。
青檀叶片内生和附生真菌菌群组成具有较高的相似性,相似性系数达0.70,这一结果再次暗示着青檀内生真菌与附生真菌之间存在着密切的演化关系,通过Fisher′s exact test分析也证实了这一结论。研究结果可为进一步探讨内生真菌与宿主附生真菌的协同演化和相互作用机制提供借鉴材料。从不同采样部位青檀叶片样本中分离的内生真菌菌群的相似性系数(Cs)在0.62—0.90之间,来自青檀向阳的样品和上部的样品分离的内生真菌菌群的相似性系数为最高(Cs=0.90),菌群组成相似性最低的存在于来自青檀向阳与向阴的样品之间。青檀叶片样本分离的附生真菌菌群的相似性系数在0.68—0.88之间,菌群组成相似性最大的存在于来自下部和向阳的样品之间,相似性系数达0.88,菌群组成相似性最低的亦存在于来自青檀向阳与向阴的样品之间。不同取样部位青檀叶片内生和附生真菌菌群相似性差异的原因可能较为复杂,真菌的组成既与宿主及其中附生和内生真菌的自然保存状态有关,也会与所处的生境条件有关,生境条件的变化是否有利于外界非专性内生真菌的侵入和增殖、专性和非专性真菌的竞争结果如何等[16]。
[1]Petrini O. Fungal endophytes of tree leaves // Andrews J H, Hirano S S, eds. Microbial Ecology of Leaves. New York: Springer-Verlag, 1991: 179- 197.
[2]Stone J K, Bacon C W, White J F Jr. An overview of endophytic microbes: endophytism defined // Bacon C W, White J F Jr, eds. Microbial Endophytes. New York: Marcel Dekker, 2000: 3- 29.
[3]Banerjee D. Endophytic fungal diversity in tropical and subtropical plants. Research Journal of Microbiology, 2011, 6(1): 54- 62.
[4]Sieber T N. Endophytic fungi in forest trees: are they mutualists?. Fungal Biology Reviews, 2007, 21(2/3): 75- 89.
[5]Verma V C, Gond S K, Kumar A, Kharwar R N, Strobel G. The endophytic mycoflora of bark, leaf, and stem tissues ofAzadirachtaindicaA. Juss (Neem) from Varanasi (India). Microbial Ecology, 2007, 54(1): 119- 125.
[6]Joshee S, Paulus B C, Park D, Johnston P R. Diversity and distribution of fungal foliar endophytes in New Zealand Podocarpaceae. Mycological Research, 2009, 113(9): 1003- 1015.
[7]Xuan Q C, Huang R, Miao C P, Chen Y W, Zhai Y Z, Song F, Wang T, Wu S H. Secondary metabolites of endophytic fungusTrichodermasp. YM311505 ofAzadirachtaindica. Chemistry of Natural Compounds, 2014, 50(1): 139- 141.
[8]Flores A C, Pamphile J A, Szrragiotto M H, Clemente E. Erratum to: Production of 3-nitropropionic acid by endophytic fungusPhomopsislongicollaisolated fromTrichiliaelegansA. JUSS ssp.elegansand evaluation of biological activity. World Journal of Microbiology and Biotechnology, 2014, 30(4): 1431- 1431, doi: 10.1007/s11274-013- 1567-y.
[9]Zeng Y B, Gu H G, Zuo W J, Zhang L L, Bai H J, Guo Z K, Proksch P, Mei W L, Dai H F. Two new sesquiterpenoids from endophytic fungus J3 isolated from Mangrove PlantCeriopstagal. Archives of Pharmacal Research, 2015, 38(5): 673- 676.
[10]Clay K, Cheplick G P, Marks S. Impact of the fungusBalansinhenningsianaonPanicumAgrostoides: frequency of infection, plant growth and reproduction and resistance to pests. Oecologia, 1989, 80(3): 374- 380.
[11]Ravel C, Courty C, Coudret A, Charmet G. Beneficial effects ofNeotyphodiumloliion the growth and the Water status in perennial ryegrass cultivated under nitrogen deficiency or drought stress. Agronomie, 1997, 17(3): 173- 181.
[12]Malinowski D P, Belesky D P. Tall fescue aluminum tolerance is affected byNeotyphodiumcoenophyiahumendophyte. Journal of Plant Nutrition, 1999, 22(8): 1335- 1349.
[13]戴传超, 谢慧, 王兴祥, 李培栋, 李奕林, 张桃林. 间作药材与接种内生真菌对连作花生土壤微生物区系及产量的影响. 生态学报, 2010, 30(8): 2105- 2111.
[14]周佳宇, 贾永, 王宏伟, 戴传超. 茅苍术叶片可培养内生细菌多样性及其促生潜力. 生态学报, 2013, 33(4): 1106- 1117.
[15]应俊生, 张玉龙. 中国种子植物特有属. 北京: 科学出版社, 1994: 1- 588.
[16]柴新义, 陈双林. 青檀内生真菌菌群多样性的研究. 菌物学报, 2011, 30(1): 18- 26.
[17]Barnett H L, Hunter B B. Illustrated Genera of Imperfect Fungi. 4th ed. St. Paul.: APS Press, 1998: 1- 218.
[18]Sutton B C. The Coelomycetes. London: Commonwealth Mycological Institute, 1980: 1- 696.
[19]Kirk P M, Cannon P F, Minter D W, Stalpers J A. Ainsworth & Bisby′s Dictionary of the Fungi. 10th ed. Egham: CAB International, 2008: 1- 771.
[20]魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979: 1- 802.
Composition and ecological distribution of endophytic and epiphytic fungi from the foliage ofPteroceltistatarinowii
CHAI Xinyi*, CHAI Gangqing, XIANG Yuyong, ZHANG Weiwei, YIN Peifeng
SchoolofBiologyandFoodEngineering,ChuzhouUniversity,Chuzhou239000,China
The endophytic and epiphytic fungi from the leaves ofPteroceltistatarinowiiwere studied to understand the composition and evolutionary relationship of endophytic and epiphytic fungal communities on this ancient and peculiar plant. This study provides valuable information about fungal resource conservation and an improved understanding of mutual evolutionary relationships between endophytic and epiphytic fungi and their host plants. Additionally, a rich and sizeable collection of endophytic and epiphytic fungi from this specific plant may provide a unique source of bioactive compounds associated withP.tatarinowii. Healthy plant samples were collected from natural distribution areas ofP.tatarinowiiin Langyashan Natural Reserve, Anhui Province. A total of 2696 isolates of endophytic fungi (839 strains) and epiphytic fungi (1875 strains) were identified and classified into 43 genera, 5 families, and 4 orders. Both species richness and fungal isolation frequency were significantly higher for epiphytic fungi than for endophytic fungi. The dominant order of endophytic (90.23%) and epiphytic fungi (92.51%) was Moniliales. Dematiaceae and Moniliaceae were the dominant families of both endophytic fungi, representing 47.56% and 42.67% of isolates, respectively, and epiphytic fungi, representing 67.04% and 25.47% of isolates, respectively. The dominant genera of endophytic fungi werePericonia(31.47%) andPenicillium(10.73%).Glomerularia(20.03%),Gonatobotrys(13.95%), andPenicillium(12.22%) were the dominant genera of epiphytic fungi. Twenty-three common genera of endophytic and epiphytic fungi were isolated from leaves ofP.tatarinowii, accounting for 53.49% of isolates:Penicillium,Aspergillus,Geotrichum,Gonatobotrys,Streptomyces,Glomerularia,Paecilomyces,Oidiodendron,Trichoderma,Alternaria,Torula,Periconia,Clasterosporium,Phragmocephala,Endophragmia,Stigmella,Acaulopage,Spiromyces,Syncephalastrum,Choanephora,Phomopsis,Gloeosporium, andMarssonina. Six genera (19 strains, 0.70%;Oedocephalum,Gilmaniella,Pithomyces,Trichaegum,Colletotrichum, andSphaceloma) were unique to endophytic fungi, and 14 genera (120 strains, 4.45%;Candida,Botrytis,Tritirachium,Trichothecium,Thallospora,Basidiobotrys,Chaetopsis,Bipolaris,Menispora,Cordana,Polythrincium,Cochlonema,Mycotypha, andStylopage) were unique to epiphytic fungi. Differences in the composition of endophytic and epiphytic fungi existed at different sampling locations.Periconia(20.5%),Penicillium(5.24%),Trichoderma(8.70%), andStreptomyces(5.13%) were the dominant genera of endophytic fungi from the sunward-facing sample leaves, whereas, the dominant genera of epiphytic fungi wereGlomerularia(20.03%),Penicillium(11.74%),Periconia(6.84%), andGonatobotrys(5.65%). The dominant genera of endophytic fungi from the shade sample leaves includedPericonia(11.08%),Penicillium(5.48%), andOidiodendron(6.20%), whereas the dominant genus of epiphytic fungi wasGonatobotrys(6.57%).Periconiawas the dominant genus of endophytic fungi isolated from the upper (17.76%) and lower (13.59%) leaves.Penicilliumwas the dominant genus of epiphytic fungi isolated from the upper (8.94%) and lower (5.01%) leaves. The Shannon-Wiener diversity index (H′=2.44) and Margalef richness index (R=2.88) of endophytic fungi were less than that of epiphytic fungi (H′=2.57,R=3.32). The endophytic and epiphytic fungal communities ofP.tatarinowiihad a similarity coefficient of 0.70. Fisher′s exact test analysis suggested that there was no significant difference (P=0.072) between the composition of endophytic and epiphytic fungi from the foliage ofP.tatarinowii.
Pteroceltistatarinowiifoliage; endophytic fungi; epiphytic fungi; diversity index; similarity coefficient
安徽省教育厅自然科学基金项目(KJ2012Z287);滁州学院生物工程科技创新团队项目(CZTD201104);滁州学院科研启动基金项目(2014qd047)
2015- 01- 29; 网络出版日期:2015- 12- 03
Corresponding author.E-mail: xinyianhui@163.com
10.5846/stxb201501290233
柴新义,柴钢青,向玉勇,张微微,殷培峰.青檀叶片内生和附生真菌组成及生态分布.生态学报,2016,36(16):5163- 5172.
Chai X Y, Chai G Q, Xiang Y Y, Zhang W W, Yin P F.Composition and ecological distribution of endophytic and epiphytic fungi from the foliage ofPteroceltistatarinowii.Acta Ecologica Sinica,2016,36(16):5163- 5172.

