吡嘧磺隆对稻田土壤真菌群落结构及土壤酶活性的影响
曹 焜, 荆瑞勇, 周 颖, 王光华, 郭永霞
(1.黑龙江八一农垦大学, 黑龙江 大庆 163319;2.中国科学院 东北地理与农业生态研究所 黑土区农业生态重点实验室, 哈尔滨 150081)
吡嘧磺隆对稻田土壤真菌群落结构及土壤酶活性的影响
曹 焜1,2, 荆瑞勇1, 周 颖1, 王光华2, 郭永霞1
(1.黑龙江八一农垦大学, 黑龙江 大庆 163319;2.中国科学院 东北地理与农业生态研究所 黑土区农业生态重点实验室, 哈尔滨 150081)
采用PCR-DGGE和比色法,在室内培养条件下研究施用不同浓度吡嘧磺隆(0.4,4,40 mg/kg)对土壤真菌群落结构及土壤酶活性的影响。结果表明:施用吡嘧磺隆7 d时提高了土壤脱氢酶及多酚氧化酶活性,抑制葡聚糖酶活性,真菌多样性指数无明显变化;14 d时,随着施药浓度的增大,脱氢酶活性减弱,多酚氧化酶活性增强,真菌多样性指数逐渐增大。21 d时,随施用吡嘧磺隆浓度增大,土壤脱氢酶和多酚氧化酶活性会降低,而土壤葡聚糖酶恢复至对照水平,真菌多样性指数增大。试验结果为全面了解吡嘧磺隆对土壤微生态环境的影响提供数据依据。
微生物生态学; 真菌群落结构; 土壤酶; 吡嘧磺隆
吡嘧磺隆(pyrazosulfuron-ethyl,NC-311)是一种东北稻田常用磺酰脲类除草剂,它可防治一年生、多年生阔叶杂草。农药的选择与施用剂量对稻田产生影响较大[1-2],土壤微生物和土壤酶活性是土壤微生态环境的指示指标[3]。据报道氯磺隆和砜嘧磺隆会抑制固氮螺菌和假单胞菌的生长[4],甲磺隆,氯磺隆和噻吩磺隆可抑制荧光假单胞菌[5],四唑嘧磺隆可改变土壤细菌的群落结构[6]。目前,国内外对吡嘧磺隆的研究主要集中在药效和消解检测方面,而关于它对稻田环境的毒理研究较少。真菌对环境污染物具有很好的指示作用[7],东北稻田环境中,真菌群落结构是否受到吡嘧磺隆的影响,目前尚未明晰。前人针对不同农药对土壤蔗糖酶、几丁质酶、脱氢酶、脲酶、磷酸酶活性的影响已开展大量研究[8-11],所得结果不尽相同。东北地区土壤肥沃,有机质含量相对较高,与其降解相关的土壤酶显得尤为重要。脱氢酶是土壤中主要酶类之一,其活性与微生物的活性和功能有一定的相关性,也可用于土壤污染物的监测[12]。土壤多酚氧化酶能把土壤中芳香族化合物氧化成醌,参与土壤中芳香族化合物的物质循环[13]。葡聚糖酶是参与有机质降解的重要酶类之一,它可将大分子纤维素降解成纤维二糖,参与碳元素的生物地球化学循环[13-14]。这三种酶是否会受到吡嘧磺隆的影响,目前尚未明晰。为此,本研究以此三种土壤酶活性及土壤真菌群落结构的动态变化为指标,探讨吡嘧磺隆对土壤酶及真菌群落结构的影响,从有机质降解和转化角度来分析吡嘧磺隆对土壤健康状况的影响,为全面了解吡嘧磺隆对土壤微生态环境的影响提供数据支持。
1 材料与方法
1.1供试材料
供试土壤来自于中国科学院东北地理与农业生态研究所哈尔滨园区试验场的稻田土壤,其理化性质为:全碳27.4 g/kg,全氮1.67 g/kg,铵态氮34.1 mg/kg,硝态氮2 mg/kg,pH 7.14。吡嘧磺隆产于江苏江南农化公司。
1.2试验设计
土壤样品过0.2 mm筛,称400 g土壤样品分别装入500 ml棕色试剂瓶中,调整土壤含水量的同时将吡嘧磺隆农药稀释至各处理要求的浓度,使其浓度达到0(CK)、0.4 mg/kg(Ⅰ,常规用量)、4 mg/kg(Ⅱ)、40 mg/kg(Ⅲ),土壤含水量控制在25%,其中,不施农药处理用无菌水补充水份,加入水分时用无菌注射器少量滴加,同时滚动培养瓶,使每瓶土壤水分混合均匀。用透气不透水的Parafilm封口,每2 d称重补充水分,每处理3次重复,于25℃恒温培养箱中培养。分别于培养7,14,21 d取样测定土壤酶活性,另取部分土壤于-80℃保藏,待提取其土壤DNA,利用PCR-DGGE方法检测真菌群落结构变化性。
1.3测定指标
土壤多酚氧化酶、脱氢酶及葡聚糖酶分别采用乙醚萃取比色法、TTC比色法及3,5—二硝基水杨酸比色法测定[15]。
1.4土壤DNA的提取和纯化
土壤DNA提取方法按试剂盒FastDNA Spin Kit for soil操作规程进行。
1.5真菌ITS区目的基因的扩增
扩增样品土壤真菌ITS区目的基因,采用扩增真菌ITS区基因的通用引物ITS1f(5′-TCC GTA GGT GAA CCT GCGG-3′)和ITS4(5′-TCCTCC GCT TAT TGA TAT GC-3′)、GC-ITS1 f(5’-CGC CCGCCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGGG TCC GTA GGTGAA CCT GCGG-3′,其中划线序列代表GC夹子)和ITS2(5′-GCT GCG TTC TTCATC GA TGC-3′)进行巢式PCR扩增[16],PCR体系采用25 μl反应体系:其中包含2.5 μl rTaq Buffer,2.5 μl dNTPs,0.25 μl上游和下游引物(50 pmol),0.5 μl rTaq(5 U/μl),1 μl DNA模板,补充灭菌的ddH2O至25 μl。PCR反应条件为:预变性94℃,5 min;35个循环(94℃,1 min;55℃,1 min;72℃,1 min);最终72D延伸10 min。
1.6扩增产物的DGGE分析
变性梯度凝胶电泳(DGGE)使用8%的聚丙烯酰胺凝胶,变性剂浓度梯度为:25%~55%(100%变性剂指7 M尿素和40%去离子甲酰胺),电泳条件为:1×TAE电泳缓冲液,75 V,60℃,16 h。电泳结束后采用SYBR-Green I染料染色、拍照,获得DGGE图谱。
1.7DGGE图谱分析
用QuantityOne-1-D(Version 4.5)软件对DGGE条带进行数字化分析,由于DGGE条带的DNA含量与其灰度(范围0~255,0:灰度最小,255:灰度最大)呈比例关系,用条带灰度值代替每个DGGE条带的扩增量(Ni)进行计算[17]。根据Pi值计算稻田蓝藻群落结构香农指数(H)和均匀度指数(E),并对其进行主成分分析(Principal Component Analysis,PCA)。计算公式如下:
H=-∑(Pi×lnPi)
(1)
式中:Pi=Ni/N;Ni——样品上单各个条带的灰度值;N——每个泳道中条带灰度值的总和。
E=H/lnS
(2)
式中:S——丰富度,即每个泳道的条带数目。
PCA分析方法:将每个条带的灰度值进行标准化,用于减小不同样品间DNA上样量的影响。标准化后的数据用Excel 97软件进行主成分分析,分析结果用SigmaPlot 2000作图。
1.8土壤酶数据分析
土壤酶活性数据采用Excel软件及SPSS 20.0软件进行ANOVA方差分析、多重比较(LSD,p≤0.05)。
2 结果与分析
2.1吡嘧磺隆对稻田土壤酶活性的影响
土壤脱氢酶可催化有机物质脱氢,作为微生物氧化还原系统的指标,可表征土壤微生物的氧化能力。从表1可见,当施入吡嘧磺隆7 d时,施药处理脱氢酶活性均高于对照,其中处理I和处理Ⅲ的脱氢酶活性最高,显著高于对照处理。14 d时,处理I脱氢酶活性最高,而处理Ⅲ最低。21 d时,处理I土壤脱氢酶活性最高,而处理Ⅲ仍最低。表明过量施用吡嘧磺隆农药降低了土壤氧化能力。
土壤多酚氧化酶主要是促进土壤酚类物质氧化成醌,在土壤芳香族有机化合物转化成腐殖质的过程中起重要作用,在一定程度上可表征土壤腐殖化的程度。由表1可以看出,施药7 d时,处理Ⅱ和处理Ⅲ均可提高土壤多酚氧化酶活性,而处理I则降低了土壤多酚氧化酶活性;14 d时,各处理的酶活均呈降低趋势;21 d时,处理CK,I和Ⅱ间多酚氧化酶活性无显著差异,而处理Ⅲ降低了酶活性。表明过量施用吡嘧磺隆农药降低了土壤酚类物质氧化成醌的能力。
土壤葡聚糖酶是水解葡聚糖至葡萄糖的一类酶,而葡聚糖可对土壤团聚有一定作用。当施药7 d时,各处理的土壤葡聚糖酶活性显著低于对照,其中活性最低的是处理Ⅲ,低于对照6倍多。14 d时,处理I和处理Ⅱ的葡聚糖酶活性最高,显著高于对照处理。21 d时,各处理葡聚糖酶活性无显著差异。表明吡嘧磺隆在施药初期会抑制葡聚糖酶的活性,随着培养时间的延长抑制作用逐渐消失。
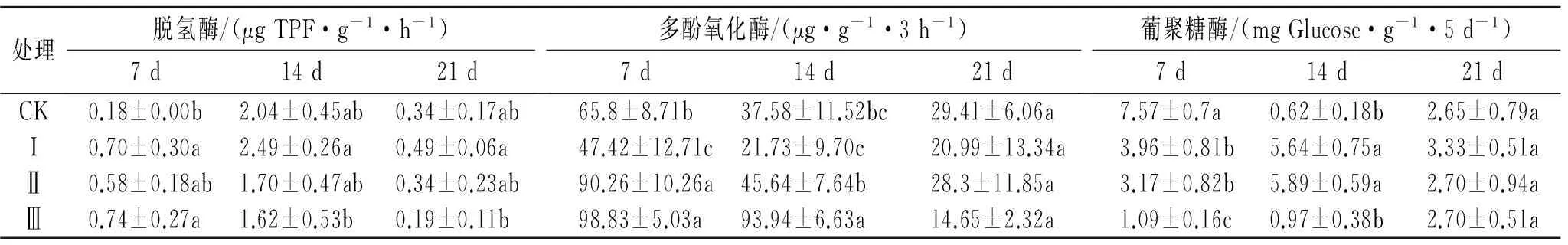
表1 吡嘧磺隆对三种土壤酶活性的影响
2.2吡嘧磺隆对真菌群落结构的影响
对样品真菌ITS基因DGGE图谱分析发现(图1),不同样点土壤的条带数差别不大,在27~33条之间,所有处理中都检测到了条带3,7,8,9,12,20,23,24,25,29,表明这10个条带指示菌可能是样品土壤真菌群落中普遍存在的优势菌群。同时,每个泳道中也存在着少量的亮度不同特异的条带,表明吡嘧磺隆添加对土壤真菌群落结构产生了影响。
不同处理的香农指数(H)、丰富度(S)和均匀度(E)结果发现(表2),这些指数在不同处理间变化不大,香农指数在3.28~3.44,均匀度指数在0.98~0.99。在施药7 d时,真菌的条带数、香农指数和均匀度均无明显变化;施药14 d时,真菌的条带数、香农指数和均匀度都随施药浓度的增加呈现出递增的趋势;施药21 d时,DGGE图谱条带数与香农指数随着浓度增大而增加(100倍处理除外),但100倍处理的香农指数明显减少而均匀度指数明显增加,在吡嘧磺隆的选择压力下,对其不敏感真菌大量富集。可能与吡嘧磺隆耐受菌或降解菌的富集有关。


图1 真菌ITS基因的DGGE图谱
对土壤真菌群落结构DGGE图谱进行主成分分析(图2)。箭头表示真菌群落结构随时期的演替趋势,鉴于主成分1和主成分2的变异率之和为37.69%,且群落结构没有明显的聚集现象,因此认为是培养时期和吡嘧磺隆共同作用导致真菌群落结构发生改变。对比同一采样时期土壤真菌群落结构变化结果表明,培养7 d和21 d时不同浓度吡嘧磺隆处理真菌群落分散较广,受到吡嘧磺隆浓度的影响产生较大;培养14 d时不同浓度吡嘧磺隆处理真菌群落相对集中,受吡嘧磺隆浓度影响程度较小。表明吡嘧磺隆对土壤真菌群落结构的作用逐渐减小,至14 d时,影响作用达到最小。
3 讨论与结论
在土壤生态系统中,土壤酶是土壤代谢循环的重要因素[15,18],能催化土壤中大部分生化反应。土壤酶活性能用于分析外源物质对土壤健康的影响[19-20]。目前,关于农药对土壤酶活性的研究很多,主要集中在不同类型农药对农田N,P循环相关土壤酶的影响,而对有机物降解相关的土壤酶研究较少。本研究发现过量吡嘧磺隆处理的土壤中,脱氢酶活性显著降低。类似的磺酰脲类除草剂如苄嘧磺隆,也会对土壤电子运输系统/脱氢酶活度在一定时期内产生抑制作用[21],与本结论相一致。参与碳循环的多酚氧化酶和葡聚糖酶是土壤中的重要降解酶类,据报道石油污染的土壤中,多酚氧化酶活性降低[22];Cu污染的土壤中,多酚氧化酶和葡聚糖酶的活性均降低[23]。类似报道还有很多,而很少有人关注农药对其活性的影响,至今未报道吡嘧磺隆对这两种酶的影响。而本研究发现初期高浓度的吡嘧磺隆提高了多酚氧化酶活性,随着培养时间的延长,转为抑制作用;初期吡嘧磺隆会抑制葡聚糖酶的活性,随着培养时间的延长抑制作用逐渐消失。通过对这三种土壤酶活性检测分析,认为在常规用量下,吡嘧磺隆未对这些土壤酶产生影响,从有机质降解和转化角度分析,常规用量的吡嘧磺隆对黑土区稻田环境是安全的。

图2不同吡嘧磺隆浓度处理对土壤真菌群落结构影响的主成分分析
20世纪70年代,人们注意到土壤酶与土壤微生物间存在一定相关性[24]。这些酶主要来自土壤中的微生物、植物和动物残体。不同类型的农药可能会对土壤微生物产生一定的毒害作用,如抑制其活性或降低其数量。DGGE图谱显示,条带1,5,10,11,29仅在0倍和1倍常规用量处理的土壤中较亮,而高浓度吡嘧磺隆处理的土壤中较暗;说明其对应真菌类群的在低浓度处理时丰度较高,而高浓度处理时丰度较小,即高浓度的吡嘧磺隆抑制了它们的生长。条带12,16,17,18,19,26仅在10倍和100倍常规用量处理的土壤中丰度较大,说明吡嘧磺隆促进了这类真菌的生长。
三唑酮和多菌灵对稻田土壤真菌种群的影响表现为抑制作用,且与药剂质量分数呈正相关[25],氯嘧磺隆抑制土壤真菌数量[11]。虽然许迪[26]认为秧苗期施用吡嘧磺隆对收获期水稻是安全的,且不会对后茬水稻植株产生影响。但其仅分析了吡嘧磺隆的消解动态和残留问题,尚未从微观角度分析吡嘧磺隆是否对稻田环境产生影响。PCA分析显示培养时期和吡嘧磺隆共同作用导致真菌群落结构发生改变。据报道吡嘧磺隆的半衰期很短,且其降解产物种类很多[27-28],而这些降解产物是否会对真菌群落结构产生影响,目前尚未确定。因此认为这可能是造成PCA图谱规律性不强的原因之一。DGGE图谱中无明显的条带增加或缺失现象,多样性数据也比较稳定,因此认为吡嘧磺隆对真菌群落结构影响较小。
综上所述,采用瓶培养试验,通过监测土壤酶活性及真菌群落结构的变化情况,探讨了不同浓度吡嘧磺隆对稻田土壤的影响。结果发现,施用吡嘧磺隆7 d时提高了土壤脱氢酶和多酚氧化酶活性,抑制葡聚糖酶活性,提高土壤的氧化能力,但真菌多样性指数无明显变化;14 d时,随着施药浓度的增大,脱氢酶活性变小,多酚氧化酶活性变大,真菌多样性指数及种类逐渐增多;21 d时,随着施药浓度增大,土壤脱氢酶和多酚氧化酶活降低,而土壤葡聚糖酶恢复至对照水平,真菌多样性指数增大。说明过量施用吡嘧磺隆会降低土壤的氧化能力。以上试验结果为合理施用吡嘧磺隆提供理论依据。
[1]Min H, Ye Y, Chen Z, et al. Effects of butachlor on microbial populations and enzyme activities in paddy soil[J]. Journal of Environmental Science and Health, Part B, 2001,36(5):581-595.
[2]Cai Z, Li S, Zhang W, et al. Effects of the novel pyrimidynyloxybenzoic herbicide ZJ0273 on enzyme activities, microorganisms and its degradation in Chinese soils[J]. Environmental Science and Pollution Research, 2015,22(6):4425-4433.
[3]García-Ruiz R, Ochoa V, Hinojosa M B, et al. Suitability of enzyme activities for the monitoring of soil quality improvement in organic agricultural systems[J]. Soil Biology and Biochemistry, 2008,40(9):2137-2145.
[4]Forlani G, Mantelli M, Branzoni M, et al. Differential sensitivity of plant-associated bacteria to sulfonylurea and imidazolinone herbicides[J]. Plant and Soil, 1995,176(2):243-253.
[5]Boldt T S, Jacobsen C S. Different toxic effects of the sulfonylurea herbicides metsulfuron methyl, chlorsulfuron and thifensulfuron methyl on fluorescent pseudomonads isolated from an agricultural soil[J]. FEMS Microbiology Letters, 1998,161(1):29-35.
[6]Valle A, Boschin G, Negri M, et al. The microbial degradation of azimsulfuron and its effect on the soil bacterial community[J]. Journal of Applied Microbiology, 2006,101(2):443-452.
[7]张晶,张惠文,李新宇,等.土壤真菌多样性及分子生态学研究进展[J].应用生态学报,2004,15(10):1958-1962.
[8]付艳艳.苄嘧磺隆和烟嘧磺隆对土壤中微生物活性的影响[D].重庆:西南大学,2013.
[9]Gianfreda L, Sannino F, Violante A. Pesticide effects on the activity of free, immobilized and soil invertase[J]. Soil Biology and Biochemistry, 1995,27(9):1201-1208.
[10]Niemi R M, Heiskanen I, Ahtiainen J H, et al. Microbial toxicity and impacts on soil enzyme activities of pesticides used in potato cultivation[J]. Applied Soil Ecology, 2009,41(3):293-304.
[11]荆瑞勇,王丽艳.氯嘧磺隆对土壤微生物数量、酶活性及土壤呼吸强度的影响[J].水土保持研究,2013,20(3):60-64.
[12]Moreno J L, Garcla C, Landi L, et al. The ecological dose value (ED50) for assessing Cd toxicity on ATP content and dehydrogenase and urease activities of soil[J]. Soil Biology and Biochemistry, 2001,33(4):483-489.
[13]Trasar-Cepeda C, Leiros M C, Seoane S, et al. Limitations of soil enzymes as indicators of soil pollution[J]. Soil Biology and Biochemistry, 2000,32(13):1867-1875.
[14]Taylor J P, Wilson B, Mills M S, et al. Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques [J]. Soil Biology and Biochemistry, 2002,34(3):387-401.
[15]关松荫,张德生,张志明.土壤酶及其研究法[M].北京:中国农业出版社,1986.
[16]Gardes M, Bruns T D. ITS primers with enhanced specificity for basidiomycetes-application to the identification of mycorrhizae and rusts[J]. Molecular Ecology, 1993,2(2):113-118.
[17]王光华,刘俊杰,齐晓宁,等.Biolog和PCR-DGGE技术解析施肥对德惠黑土细菌群落结构和功能的影响[J].生态学报,2008,28(1):220-226.
[18]解媛媛,谷洁,高华,等.微生物菌剂酶制剂化肥不同配比对秸秆还田后土壤酶活性的影响[J].水土保持研究,2010,17(2):233-238.
[19]Dick R P, Pankhurst C, Doube B M, et al. Soil enzyme activities as integrative indicators of soil health[J]. Biological indicators of soil health, 1997:121-156.
[20]Khan S, Hesham A E L, Qiao M, et al. Effects of Cd and Pb on soil microbial community structure and activities [J]. Environmental Science and Pollution Research, 2010,17(2):288-296.
[21]谢晓梅,廖敏,黄昌勇.除草剂苄嘧磺隆对稻田土壤微生物活性和生物化学特性的影响[J].中国水稻科学,2004,18(1):69-74.
[22]蔺昕,李培军,孙铁珩,等.石油污染土壤的生物修复与土壤酶活性关系[J].生态学杂志,2005,24(10):1226-1229.
[23]刘永卓.重金属污染稻田土壤温室气体产生相关的微生物群落结构及活性变化[D].南京:南京农业大学,2012.
[24]Voets J P, Meerschm P, Verstrae W. Soil Microbiological and Biochemical Effects of Long-Term Atrazine Applications [J]. Soil Biology and Biochemistry, 1974,6(3):149-152.
[25]张赫琼.三唑酮等常用农药对稻田土壤真菌的群落效应及敏感性基线初探[D].杭州:浙江大学,2014.
[26]许迪,于丁一,田国芳,等.吡嘧磺隆在水稻、土壤和田水中的消解和残留[J].环境化学,2013,32(1):150-155.
[27]Sondhia S, Wasee U, Varma R K. Fungal degradation of an acetolactate synthase (ALS) inhibitor pyrazosulfuron-ethyl in soil[J]. Chemosphere, 2013,93(9):2140-2147.
[28]Singh N, Singh S B. Translocation and degradation of pyrazosulfuron-ethyl in rice soil [J]. Pest Management Science, 2011,67(11):1451-1456.
Effects of Pyrazosulfuron-ethyl on Soil Fungal Community Structure and Enzyme Activity
CAO Kun1,2, JING Ruiyong1, ZHOU Ying1, WANG Guanghua2, GUO Yongxia1
(1.Heilongjiang Bayi Agricultural University, Daqing, Heilongjiang 163319, China; 2.Key Laboratory of MollisolsAgroecology,NortheastInstituteofGeographyandAgroecology,ChineseAcademyofSciences,Harbin150081,China)
Effects of different concentrations of pyrazosulfuron-ethyl (0.4, 4, 40 mg/kg) on fungal community structure and soil enzyme activity were investigated by PCR-DGGE and colorimetric methods. The results showed that pyrazosulfuron-ethyl can promote the activities of soil dehydrogenase and polyphenol oxide, inhibit the activity of glucanase and have no influence on fungal community structure at 7 th day At 14 th day, the activity of dehydrogenase decreased and activity of polyphenol oxide increased, and the diversity index of fungal community increased gradually with increase of pyrazosulfuron-ethyl concentration. At 21 th day, the activities of dehydrogenase and polyphenol oxide become smaller, but the activity of glucanase recover to the level of control and diversity index of fungal community structure increases gradually with increase of the pyrazosulfuron-ethyl concentration. The above results offered the data support for entirely investigating the effect of pyrazosulfuron-ethyl on soil micro-ecology environment.
microbial ecology; diversity of fungi; soil enzyme; pyrazosulfuron-ethyl
2015-03-30
2015-04-23
校研究生创新基金“东北稻田微生物多样性及土壤酶活性对吡嘧磺隆的响应”(YJSCX2014-Y08)
曹焜(1989—),男,黑龙江鹤岗人,硕士研究生,研究方向为农药生物技术研究。E-mail:caokun3383@sina.com
郭永霞(1970—),女,山东省胶南市人,教授,博士,主要从事农药生物技术教学与科研。E-mail:gyxia@163.com
S154.3
A
1005-3409(2016)02-0073-05

