不同放牧强度下短花针茅荒漠草原植被-土壤系统有机碳组分储量特征
王合云,董 智,,郭建英,李红丽,,*,李锦荣,韩国栋,陈新闯
1 山东农业大学林学院,山东省土壤侵蚀与生态修复重点实验室,泰山森林生态站, 泰安 271018 2 内蒙古农业大学生态环境学院, 呼和浩特 010019 3 水利部牧区水利科学研究所, 呼和浩特 010020
不同放牧强度下短花针茅荒漠草原植被-土壤系统有机碳组分储量特征
王合云1,董智1,2,郭建英3,李红丽1,2,*,李锦荣3,韩国栋2,陈新闯1
1 山东农业大学林学院,山东省土壤侵蚀与生态修复重点实验室,泰山森林生态站, 泰安271018 2 内蒙古农业大学生态环境学院, 呼和浩特010019 3 水利部牧区水利科学研究所, 呼和浩特010020
草地生态系统作为陆地生态系统的重要组成部分,在全球碳循环中发挥着重要作用。以内蒙古短花针茅荒漠草原不同放牧强度样地为研究对象,通过分析地上植物、凋落物、根系、土壤中有机碳和土壤轻组有机碳,研究草原植被-土壤系统有机碳组分储量的变化特征,从碳储量角度为合理利用草原提供指导。研究结果表明:(1)不同放牧强度荒漠草原地上植物碳储量为11.98—44.51 g/m2,凋落物碳储量10.43—36.12 g/m2,根系(0—40cm)碳储量502.30—804.31 g/m2,且对照区(CK)均显著高于中度放牧区(MG)、重度放牧区(HG);(2)0—40cm土壤碳储量为7817.43—9694.16 g/m2,其中轻度放牧区(LG)碳储量为9694.16 g/m2,显著高于CK、HG(P<0.05);(3)植被—土壤系统的碳储量为8342.14—10494.80 g/m2,LG>MG>CK>HG,有机碳主要储存于土壤当中,占比约90.54%—93.71%,适度放牧利用有利于发挥草地生态系统的碳汇功能;(4)土壤轻组有机碳储量为484.20—654.62 g/m2,LG储量最高,表明适度放牧有助于草原土壤营养物质的循环和积累。
荒漠草原;放牧强度;碳储量;土壤轻组有机碳
随着全球变暖等环境问题日益突出,生态系统的碳循环成为人们研究的热点[1-2]。草地生态系统是陆地生态系统的主体类型,贮存的碳总量约为266.3 Pg,占陆地生态系统的12.7%,其中90%贮存在土壤中[3]。受气候变化及长期不合理的人为活动干扰,我国 90%的可利用草原处于不同程度的退化状态,其中20%以上是由于过度放牧造成的[4]。放牧导致的土地退化会使草地生态系统功能发生衰退,影响植被生产力及土壤有机质的分解和积累速率,进而影响土壤碳储量和生态系统的碳循环[5]。因此,开展放牧草地植被-土壤碳储量的研究,不仅可以揭示放牧强度对草地植被-土壤碳储量变化的影响,而且可以阐明放牧草地碳储量各组分间的比例及其转化关系,进而从维护碳汇的角度制定可持续利用的放牧制度,开展草地生态系统的适应性管理。
土壤有机碳是指示土壤健康的关键指标[6],但放牧对草原土壤碳储量的影响受草地类型、土壤性质和放牧牲畜种类、强度以及研究方法等因素的不同,研究结果不尽一致。多数的研究均表明过度放牧会显著降低草原土壤碳储量[7-12];Reeder等的研究表明适度放牧有助于草原土壤碳积累[13];Keller认为,放牧对有机碳没有显著影响[14];Milchunas等对比了世界 236 个研究点的围栏封育和放牧资料,结果发现放牧和土壤有机碳之间存在复杂的相互关系,有时呈正相关,有时呈负相关[15]。然而,关于放牧条件下荒漠草原的土壤与植被有机碳的变化研究较少[10]。荒漠草原是内蒙古草原的重要组成部分,属于草原区向荒漠区过渡的旱生化草原生态系统,群落结构较单一化,种群密度和群落结构容易发生改变[16]。已有研究表明,在不同的放牧强度下或连续过度放牧下,荒漠草原草地植物种类组成改变,地表植被的生物量、生物多样性和丰富度下降[17- 19];土壤容重增加,孔隙度减小,入渗速率降低,土壤质量退化[20- 24]。土地与植被的退化必然会引起草原有机碳含量的变化,那么,荒漠草原不同放牧强度下土壤、植物的有机碳含量是否存在显著差异,二者的相互关系如何?有机碳含量在地上与地下间如何分配?加强这些问题的研究有助于揭示放牧对荒漠草原碳汇的影响机制。
随着对土壤碳循环过程和有机质各组分重要性认识的加深及研究技术的不断改进,土壤有机质的内涵变得更为广泛,研究的重点更多地集中在对生态系统干扰和管理更为敏感的易变有机质组分上[25]。轻组有机质碳和氮含量高,周转时间短,代表着易变土壤有机质的主要部分,在碳和氮循环中具有显著的作用,被认为是土壤生物调节过程的重要基质和土壤肥力的指标,具有很强的生物学活性,是土壤碳动态更精确的指示物,因此有关土壤轻组有机质的研究倍受重视[26]。有鉴于此,本研究以内蒙古中部的希拉穆仁短花针茅荒漠草原为研究对象,研究不同放牧强度下植被-土壤系统有机碳储量及轻组有机碳储量,旨在对比不同放牧强度荒漠草原有机碳含量与储量的变化及其差异性;探讨放牧强度对有机碳储量及轻组有机碳储量的影响,确定放牧强度对生态系统碳循环的影响,以期为科学保护草原,维持与提高草原生态生产功能的适应性管理提供科学依据。
1 材料与方法
1.1研究区概况
研究区位于内蒙古自治区中部的包头市达尔罕茂明安联合旗希拉穆仁镇,地貌属阴山北麓低山丘陵草原区。地理坐标在41°20′—42°40′N, 109°16′—111°25′E之间,地处中温带半干旱大陆性气候区。年平均日照时数3100—3300 h,年平均气温3.4 ℃,≥ 10℃积温1985 ℃,无霜期为85—125 d,年平均降雨量为281 mm,主要集中在7、8、9月份,年湿润度为0.31,多年平均蒸发量2227.3 mm,是降水量的7.9倍。多年平均风速5.2 m/s,年大风日数为63 d,主要风向为北风和西北风。主体土类是栗钙土和棕钙土。植被为以短花针茅(StipabrevifloraGriseb.)为主的荒漠草原植被,主要植物有短花针茅、羊草(Leymuschinensis(Trin.) Tzvel.)、糙隐子草(Cleistogenessquarrosa(Trin.) Keng) 、冰草(Agropyroncristatum(Linn.) Gaertn.)、银灰旋花(ConvolvulusammanniiDesr.)、冷蒿(ArtemisiafrigidaWilld.Sp.Pl.)、细叶韭(AlliumtenuissimumL.)、阿尔泰狗娃花(Heteropappusaltaicus(Willd) Novopokr)等,群落结构简单,草层低矮、稀疏。
1.2野外调查与样地选择
选取自由放牧6a的3块草地为研究对象,参照李博草地退化分级方法,以牧户为起点,按距牧户的距离、植被种类组成、群落特征等指标向外辐射划分出由重到轻的放牧梯度[27],各放牧梯度分别为重度放牧(HG)、中度放牧(MG)、轻度放牧(LG) 3个等级,并选择围栏封育6a的草场为对照样地(CK)。

表1 样地基本情况描述
小写字母表示不同放牧强度的差异性(P<0.05);CK: no grazing; HG: heavy grazing; MG: moderate grazing; LG: light grazing
2014年7月,在上述4类梯度样地内,每类样地以“S”形均匀设置10个1 m×1 m的样方,总样本量共计40个,调查样方内植物群落组成与结构,记录每种植物的种名、高度、密度、盖度。群落的地上生物量采用刈割法测定,刈割后采集凋落物样品,装入袋中编号,带回实验室,在80℃恒温箱烘干至恒重,计算其平均生物量和凋落物干重(g/m2)[28]。各放牧梯度及对照样地的植物种类组成,群落高度、盖度、密度和地上生物量等指标如表1所示,各样地植被高度、盖度与生物量间差异显著。
在刈割后的10个样方内,采用直径7 cm的土钻,在每个样方以对角线5点取样法分层钻取土柱,钻取土层为0—10 cm、10—20 cm、20—30 cm、30—40 cm。将采集的土柱过100目筛冲洗后获取地下根系,在80℃的恒温箱烘干至恒重称重,计算其平均地下生物量干重(g/m2)。土壤样品亦在上述10个样方处按0—10 cm、10—20 cm、20—30 cm、30—40 cm分层取样500 g左右,带回实验室风干、过筛,测试相关指标。
1.3 测定方法
(1)将植物有机干物质中碳占的比重转换为碳量,尽管不同的植被其转换率不同,但由于获取各种植被类型的转换率十分有限,所以在本文中采用国际上通用的植物碳转换率 0.45将生物量统一以碳(g/m2)的形式表示[29]。
(2)土壤有机碳含量采用重铬酸钾外加热法测定,有机碳储量采用公式(1)计算。
SOCi=Ci×Di×Hi×(1-Gi)×100
(1)
砾石含量Gi=(>2mm砾石干重/总土干重)×100%
(2)
(3)土壤轻组有机碳采用Janzen所描述的方法[30],利用1.8 g/cm3NaI重液获得土壤轻组组分,提取出的轻组组分烘干后研细过60目筛,使用元素分析仪(Elementar Vario Macro Cube,德国)测定轻组有机碳含量。
土壤轻组组分比例=土壤轻组组分质量/供试土样质量×100%
(3)
土壤轻组有机碳含量=土壤轻组组分有机碳含量×土壤轻组组分比例
(4)
土壤轻组有机碳分配比例=土壤轻组有机碳含量/土壤有机碳含量×100%
(5)
LFOCi=Zi×Di×Hi×(1-Gi)×100
(6)
式中,i代表不同土层;SOCi为i土层土壤有机碳储量(g/m2);LFOCi为i土层土壤轻组有机碳储量(g/m2);Ci为i土层土壤有机碳含量(%);Zi为i土层土壤轻组有机碳含量(%);Di为i土层土壤容重(g/cm3);Hi为i土层厚度(cm);Gi为i土层土壤砾石含量。
1.4数据分析
所有数据均采用Microsoft Excel、SPSS 17.0软件处理分析。采用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)分析不同放牧强度各变量的差异显著性(α=0.05)。

图1 地上植物和凋落物有机碳储量Fig.1 Aboveground vegetation and litter organic carbon storage 小写字母表示不同放牧强度的差异性(P<0.05)
2 结果与分析
2.1不同放牧强度植被有机碳储量2.1.1不同放牧强度植被地上部分有机碳储量
放牧显著降低了群落植被的平均高度、盖度与地上生物量,使得不同放牧强度地上植被高度与生物量干重不同(表1),导致地上植物有机碳储量差异显著(图1)。由图可知,CK区最高,其大小依次为CK (44.51 g/m2)>LG (30.77 g/m2)>MG (19.83 g/m2)>HG (11.98 g/m2),放牧显著降低了群落的地上植物有机碳储量(P<0.05),除MG与HG之间差异不显著外,其余放牧梯度间差异显著。
对照区凋落物有机碳储量显著高于放牧区(P<0.05)。随着放牧强度的增加,凋落物有机碳储量降低,但不同牧压间差异不显著(P>0.05)。
2.1.2不同放牧强度植物根系有机碳储量
短花针茅荒漠草原植物地下部分(根系)有机碳储量明显高于地上部分有机碳储量(表2),其比值为9.97—22.41;随着土壤深度的增加,根系有机碳储量呈现减少的趋势,均以0—10 cm到10—20 cm下降的量最多。从地下0—40 cm根系有机碳储量来看,大小序列仍为CK (804.31 g/m2)>LG (748.44 g/m2)>MG (599.63 g/m2)>HG (502.30 g/m2),CK和LG差异不明显,但显著高于MG和HG (P<0.05)。0—10 cm根系有机碳储量占到0—40 cm根系总有机碳储量的50.18%—58.11%,0—20 cm根系有机碳储量占到 0—40 cm 根系总有机碳储量的73.83%—87.19%,因此根系总有机碳储量在不同放牧强度间的变化主要受 0—20 cm 根系有机碳储量的影响,信息量可达 70%以上,0—20 cm根系有机碳储量仍以CK最高,HG最低。

表2 根系有机碳储量
小写和大写字母分别表示不同放牧强度和同一放牧强度不同土层深度的差异性(P<0.05),字母相同为不显著
2.2不同放牧强度土壤有机碳储量
土壤有机碳含量随放牧强度的增加呈先增加后减少趋势,并在轻度或中度放牧样地达到最大。不同放牧强度只对0—10 cm和10—20 cm土层有机碳含量影响差异显著。土壤有机碳含量均随土层深度的增加呈降低趋势,其中10—20 cm、20—30 cm和30—40 cm土层有机碳含量差异不显著。土壤有机碳储量均随着土层深度的增加而呈降低趋势,且不同土层间差异显著(P<0.05)(表3)。表层0—10 cm土壤有机碳储量最高,可以达到2247—2811 g/m2,已远远大于植被有机碳储量(524.71—884.94 g/m2)。从0—40 cm土壤总有机碳储量来看,大小序列为LG (9694.16 g/m2)>MG (9389.86 g/m2)>CK (8473.74 g/m2)>HG (7817.43 g/m2),LG和MG相对于CK土壤有机碳储量显著增加,增幅为14.40%、10.81%,表现出较强的固碳能力,HG相对于CK土壤有机碳储量显著减少,降幅为7.75%。由此可以看出,适度放牧有助于土壤有机碳的积累。
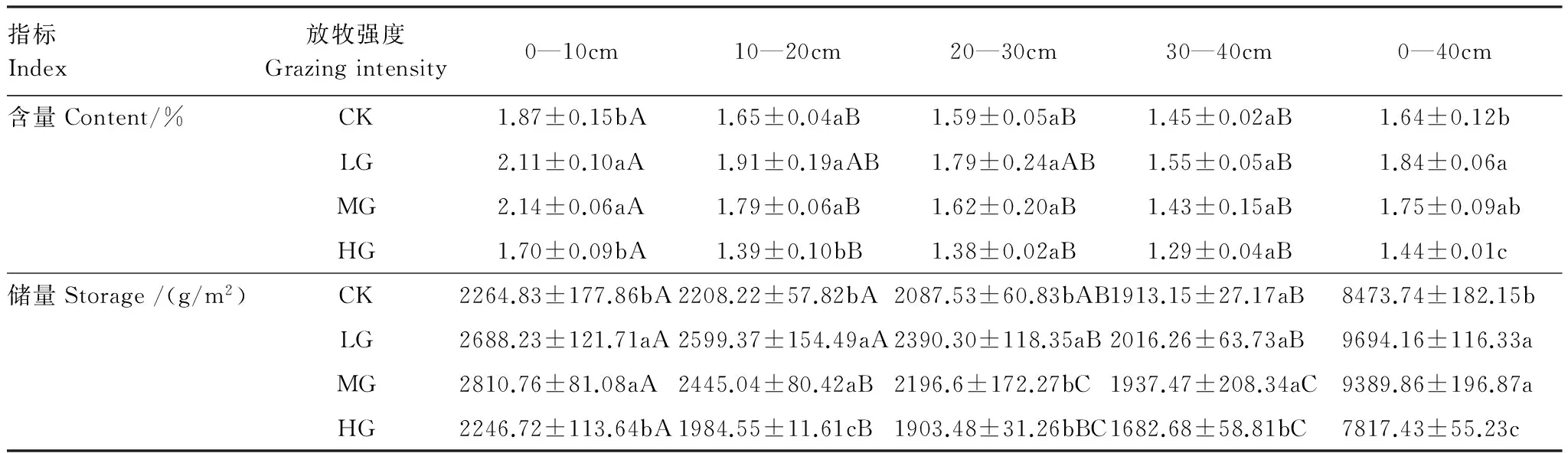
表3 土壤有机碳含量及储量
小写和大写字母分别表示不同放牧强度和同一放牧强度不同土层深度的差异性(P<0.05),字母相同为不显著
2.3不同放牧强度生态系统有机碳储量

图2 荒漠草原生态系统有机碳储量Fig.2 Ecosystem organic carbon storage of desert steppe 小写字母表示不同放牧强度的差异性(P<0.05)
由图2可知,不同放牧强度荒漠草原植被-土壤系统有机碳储量大小序列为LG (10494.80 g/m2)>MG (10027.98 g/m2)>CK (9358.68 g/m2)>HG (8342.14 g/m2)。轻度和中度放牧有助于生态系统有机碳储量的积累,而重度放牧草地生态系统有机碳储量显著降低。随着放牧强度的增加,地上植物碳储量占生态系统有机碳储量比例分别为0.48%、0.29%、0.20%、0.14%;凋落物碳储量所占比例分别为0.39%、0.20%、0.19%、0.13%;根系碳储量所占比例分别为8.59%、7.13%、5.98%、6.02%;土壤碳储量所占比例分别为90.54%、92.37%、93.64%、93.71%。草原土壤的碳贮量占总碳贮量的90%以上,是草原碳储量的主体部分,影响着整个生态系统有机碳储量的变化。各样地各部分所占生态系统有机碳储量比例均表现为土壤>根系>地上植物>凋落物。
2.4不同放牧强度土壤轻组有机碳储量
轻组有机碳是土壤养分循环的驱动力,对土壤肥力保持、碳收支具有重要意义。土壤轻组有机碳含量随放牧强度呈先增加后减少趋势,并在轻度或中度放牧强度达到最大。轻组有机碳含量沿土壤剖面均呈逐渐递减的趋势,且各土层之间差异显著(P<0.05)。不同放牧强度样地轻组有机碳储量呈先增加后减少的趋势,其大小序列为LG (654.62 g/m2)>MG (560.62 g/m2)>CK (536.61 g/m2)>HG (484.20 g/m2),LG相对于CK轻组有机碳储量显著增加,增幅为21.99%,MG、HG与CK之间轻组有机碳储量差异并不显著,变化幅度为+4.47%、-9.77%。相对于土壤有机碳储量,土壤轻组有机碳对放牧强度的响应更敏感。0—10 cm层CK的轻组有机碳储量占土壤有机碳储量的比例最高,MG次之,随着土壤深度的增加,轻组有机碳含量及储量迅速下降,且轻组有机碳储量占土壤有机碳储量有机碳的比例由8.80%—9.72%下降到2.00%—3.10%。从0—40 cm轻组有机碳储量占土壤总有机碳储量比例来看,LG比例最高,MG和HG比例较低,可见轻度放牧有助于土壤轻组有机碳的积累,随着放牧强度的增大,不仅土壤总有机碳储量下降,而且土壤总有机碳储量在轻组中的分配比例也受到影响。

表4 轻组有机碳含量、储量及其占土壤有机碳储量比例
小写和大写字母分别表示不同放牧强度和同一放牧强度不同土层深度的差异性(P<0.05),字母相同为不显著
3 讨论
3.1不同放牧强度对土壤有机碳储量的影响
植被通过光合作用将大气中的 CO2转变为有机碳,是生态系统中主要的碳来源,不同干扰强度主要是通过家畜采食改变地上部分,降低植物地上生物量[31];长期的连续的高强度放牧,使植物叶面积降低,草地初级生产固定碳素的能力下降,光合作用向地下的能量输入减弱,导致植物地下根系的生产力和现存量降低[32];草地生物量降低使凋落物的积累和输入降低,减少了碳素由植物凋落物向土壤的输入,降低土壤有机碳含量,使土壤碳储量降低。过度放牧对土壤理化性质的干扰将会加速土壤呼吸作用,引起土壤有机碳输出,降低土壤碳来源和草原植被固碳能力,最终导致草原变成一个净碳源[33]。而适度放牧有利于草原有机碳的蓄积,因为它可以减少凋落物的积累,促进其分解并加速碳向土壤的输送[34],本研究与此结果一致。不同放牧强度草地土壤有机碳储量大小序列为LG (9694.16 g/m2)>MG (9389.86 g/m2)>CK (8473.74 g/m2)>HG (7817.43 g/m2)。特别地,不同放牧强度草地0—10 cm土壤有机碳储量均为最高,这一方面是由于地上植物的枯萎、凋落物沉积在土壤表层,促进了表层土壤有机碳的输入,另一方面归因于草地地下生物量大部分集中于表层土壤中,随着深度增加,数量急剧降低[35]。随着放牧强度的增加,0—10 cm土壤有机碳储量所占比例大体呈增加趋势,分别为26.73%、27.73%、29.93%、28.74%。
3.2不同放牧强度对生态系统有机碳储量的影响
地上植物、凋落物、根系和土壤碳库四部分共同组成草地生态系统碳库,不同放牧强度短花针茅荒漠草原各部分碳储量所占生态系统碳储量的比例存在差别,但各部分碳储量分布比例是相似的。在生态系统碳储量中,有机碳储量从大到小依次为:土壤有机碳储量(90.54%—93.71%)、根系有机碳储量(5.98%—8.59%)、地上植物有机碳储量(0.14%—0.48%)和凋落物有机碳储量(0.13%—0.39%),由此可以看出,不同放牧强度短花针茅荒漠草地生态系统有机碳储量中土壤有机碳储量占居主导地位,这一结果与对典型草原和草甸草地生态系统碳储量研究所得到的结果相似[36-37]。随着放牧强度的增加,地上植物、凋落物、根系有机碳储量所占生态系统有机碳储量比例呈现降低趋势,而土壤有机碳储量所占比例呈递增趋势。针茅草原地上植被碳储量仅占生态系统总碳储量的2%—5%,其余大部分碳储存在土壤当中[38]。而本研究表明,在不同放牧强度各样地地上植物和凋落物有机碳储量之和只占到生态系统碳储量的0.27%—0.86%,远小于2%—5%,这可能与调查当年降水量少于多年平均降水有关,从气象局获得的数据分析,2014 年为极度干旱年份,前7个月降水量仅为143.6 mm,比近 30 年来降水量低16.02%(171.0 mm),水分的缺乏限制了绿色植物的生长,导致植被覆盖率降低,生物量下降。不同放牧强度草地生态系统有机碳储量大小序列为LG (10494.80 g/m2)>MG (10027.98 g/m2)>CK (9358.68 g/m2)>HG (8342.14 g/m2),轻度和中度放牧提高了生态系统有机碳水平。导致这一变化的原因可能归因于不同放牧强度下根冠比、凋落物分解及地上生物量的差异。一方面,放牧强度的加大导致植物地下生物量增加,使得植物根冠比率增加,不同强度植物根冠比为HG (41.94)>MG (30.24)>LG (24.33)>CK (18.07),增加了有机碳向地下的分配量;另一方面,动物的践踏使凋落物破碎并与土壤充分接触,促进凋落物的分解,有助于碳和养分元素转移到土壤中[39]。而重度放牧促使草原植被叶面积和储藏物质严重减少,净初级生产力降低,物质的输入小于输出,导致生态系统碳储量降低。
3.3不同放牧强度对土壤轻组有机碳的影响
土壤轻组仅占土壤质量的一小部分,而轻组碳浓度明显高于全土碳浓度,因而土壤轻组碳分配比例较高。土壤轻组能够在全土碳变化之前反映因管理措施等人为活动或自然变化所引起的土壤的微小变化[40]。轻组有机碳组分较易于降解,并缺乏土壤矿物的保护,所以其周转速率较快,是促使物质循环的腐生生物的有效的能量来源,有助于营养物质的循环。许多研究者的研究结果表明轻组有机碳含量总体上随土层加深而下降[41-42]。轻组有机碳的大小和组成主要取决于有机物的输入和分解速率[43],由于土壤表层积累了较多的凋落物与细根,所以土壤表层与下层相比含有更多的轻组有机碳,并在土壤剖面呈逐渐递减的趋势,这与土壤总有机碳在土壤剖面的分布规律一致。武天云等研究表明,土壤轻组有机碳占有机碳总量的2%—18%[44]。谢锦升等研究结果表明,草地轻组有机碳占总有机碳的比例为5%—48%[45]。本研究表明,不同放牧强度草地轻组有机碳储量占土壤有机碳储量比例随土层深度的加深由8.80%—9.72%下降到2.00%—3.10%。土壤有机碳储量在不同土层间下降的幅度分别为7.62%、6.94%、11.85%,轻组有机碳储量下降的幅度分别为22.18%、39.73%、54.70%。土壤轻组碳随土壤深度下降的幅度大于全土碳。轻度放牧样地相对于对照轻组有机碳含量、储量及其占土壤有机碳储量比例显著增加,有助于土壤营养物质的循环和积累。
4 结论
(1)不同放牧强度样地各组成部分有机碳碳储量占生态系统有机碳储量比例均表现为土壤>根系>地上植物>凋落物,土壤和根系有机碳储量占短花针茅荒漠草原碳储量主导地位,对草地生态系统碳汇功能有重要的作用。
(2)植被有机碳储量具有短期效应,而土壤有机碳蓄积却是相对缓慢的积累过程。随放牧强度的增加,地上植物、凋落物、根系有机碳储量均呈降低趋势,而土壤有机碳储量呈先增加后减少趋势,适度放牧有利于土壤有机碳储量的累积。
(3)随放牧强度的增加,土壤轻组有机碳含量、储量及其占土壤有机碳储量比例均呈先增加后减少趋势,在轻度放牧强度最高,适度放牧有助于土壤营养物质的循环和积累。
[1]Ojima D S, DirkB O M, Gleovn E P, Owensby C E, Scurlock J O. Assessment of C budget for grasslands and drylands of the world. Water, Air, and Soil Pollution, 1993, 70(1/4): 95- 109.
[2]张金霞, 曹广民, 周党卫, 赵新全. 放牧强度对高寒灌丛草甸土壤CO2释放速率的影响. 草地学报, 2001, 9(3): 183- 190.
[3]Raich J W, Schlesinger W H. The global carbon dioxide fluxin soil respiration and its relationship to vegetation and climate. Tellus B, 1992, 44(2): 81- 99.
[4]蒲宁宁. 放牧强度对昭苏草甸草原土壤有机碳组分及其碳、氮特征的影响[D]. 乌鲁木齐: 新疆农业大学, 2013.
[5]Lal R, Fausey N R, Eckert D J. Land use and soil management effects on emissions of radiatively active gases from two soils in Ohio // Lal R, Kimble J, Levine E, Stewart B A, eds. Soil Management and Greenhouse Effect. Boca Raton, Florida: CRC Press, 1995: 41- 59.
[6]Percival H J, Parfitt R L, Scott N A. Factors controlling soil carbon levels in New Zealand grassland: Is clay content important? Soil Science Society of America Journal, 2000, 64(5): 1623- 1630.
[7]Eldridge D J, Val J, James A I. Abiotic effects predominate under prolonged livestock induced disturbance. Austral Ecology, 2011, 36(4): 367- 377.
[8]闫瑞瑞, 辛晓平, 王旭, 闫玉春, 邓钰, 杨桂霞. 不同放牧梯度下呼伦贝尔草甸草原土壤碳氮变化及固碳效应. 生态学报, 2014, 34(6): 1587- 1595.
[9]陈芙蓉, 程积民, 刘伟, 李媛, 陈奥, 赵新宇. 不同干扰对黄土高原典型草原土壤有机碳的影响. 草地学报, 2012, 20(2): 298- 304,
[10]李春莉, 赵萌莉, 韩国栋, 红梅. 不同放牧压力下荒漠草原土壤有机碳特征及其与植被之间关系的研究. 干旱区资源与环境, 2008, 22(5): 134- 138.
[11]Han G D, Hao X Y, Zhao M L, Wang M J, Ellert B H, Willms W, Wang M J. Effect of grazing intensity on carbon and nitrogen in soil and vegetation in a meadow steppe in Inner Mongolia. Agriculture, Ecosystems & Environment, 2008, 125(1/4): 21- 32.
[12]Elmore A J, Asner G P. Effects of grazing intensity on soil carbon stocks following deforestation of a Hawaiian dry tropical forest. Global Change Biology, 2006, 12(9): 1761- 1772.
[13]Reeder J D, Schuman G E. Influence of livestock grazing on C sequestration in semi-arid mixed-grass and short-grass rangelands. Environmental Pollution, 2002, 116(3): 457- 463.
[14]Keller A A, Goldstein R A. Impact of carbon storage through restoration of drylands on the global carbon cycle. Environmental Management, 1998, 22(5): 757- 766.
[15]Milchunas D G, Laurenroth W K. Quantitative effects of grazing on vegetation and soils over a global range of environments. Ecological Monographs, 1993, 63(4): 327- 366.
[16]吴永胜, 马万里, 李浩, 吕桂芬, 卢萍. 内蒙古退化荒漠草原土壤有机碳和微生物生物量碳含量的季节变化. 应用生态学报, 2010, 21(2): 312- 316.
[17]黄琛, 张宇, 赵萌莉, 韩国栋. 放牧强度对荒漠草原植被特征的影响. 草业科学, 2013, 30(11): 1814- 1818.
[18]丁海君, 韩国栋, 王忠武, 王春霞, 张睿洋, 胡吉亚. 短花针茅荒漠草原不同载畜率对植物群落特征的影响. 中国草地学报, 2014, 36(2): 55- 59.
[19]焦树英, 韩国栋, 李永强, 窦红举. 不同载畜率对荒漠草原群落结构和功能群生产力的影响. 西北植物学报, 2006, 26(3): 564- 571
[20]卫智军, 乌日图, 达布希拉图, 苏吉安, 杨尚明. 荒漠草原不同放牧制度对土壤理化性质的影响. 中国草地, 2005, 27(5): 6- 10.
[21]Taddese G, Saleem M A M, Abyie A, Wagnew A. Impact of grazing on plant species richness, plant biomass, plant attribute and soil physical and hydrological properties of vertisol in East African Highlands. Environmental Management, 2002, 29(2): 279- 289.
[22]Greenwood K L, MacLeod D A, Hutchinson K J. Long-term stocking rate effects on soil physical properties. Australian Journal of Experimental Agriculture, 1997, 37(4): 413- 419.
[23]Wheeler M A, Trlica M J, Frasier G W, Reeder J D. Seasonal grazing affects soil physical properties of a montane riparian community. Journal of Range Management, 2002, 55(1): 49- 56.
[24]Hiernaux P, Bielders C L, Valentin C, Bationo A, Fernandez-Rivera S. Effects of livestock grazing on physical and chemical properties of sandy soils in Sahelian rangelands. Journal of Arid Environments, 1999, 41(3): 231- 245.
[25]Haynes R J. Labile organic matter fractions as central components of the quality of agricultural soils: an overview. Advances in Agronomy, 2005, 85: 221- 268.
[26]Gregorich E G, Beare M H, Mckim U F, Skjemstad J O. Chemical and biological characteristics of physically uncomplexed organic matter. Soil Science Society of America Journal, 2006, 70(3): 975- 985.
[27]李博. 我国草地资源现状问题及对策. 中国科学院院刊, 1997, (1): 49- 50.
[28]王长庭, 王启基, 龙瑞军, 景增春, 史惠兰. 高寒草甸群落植物多样性和初级生产力沿海拔梯度变化的研究. 植物生态学报, 2004, 28(2): 240- 245.
[29]王绍强, 周成虎, 罗承文. 中国陆地自然植被碳量空间分布特征探讨. 地理科学进展, 1999, 18(3): 238- 244.
[30]Janzen H H, Campbell C A, Brandt S A, Lafond G P, Townley-Smith L. Light-fraction organic matter in soils from long-term crop rotations. Soil Science Society of America Journal, 1992, 56(6): 1799- 1806.
[31]阿穆拉, 赵萌莉, 韩国栋, 贾乐, 董亭. 放牧强度对荒漠草原地区土壤有机碳及全氮含量的影响. 中国草地学报, 2011, 33(3): 115- 118.
[32]Ryan M G, Law B E. Interpreting, measuring, and modeling soil respiration. Biogeochemistry, 2005, 73(1): 3- 27.
[33]齐玉春, 董云社, 耿元波, 杨小红, 耿会立. 我国草地生态系统碳循环研究进展. 地理科学进展, 2003, 22(4): 342- 352.
[34]Shariff A R, Biondini M E, Grygiel C E. Grazing intensity effects on litter decomposition and soil nitrogen mineralization. Journal of Range Management, 1994, 47(6): 444- 449.
[35]耿浩林. 克氏针茅群落地上/地下生物量分配及其对水热因子响应研究[D]. 北京: 中国科学院植物研究所, 2006.
[36]何念鹏, 韩兴国, 于贵瑞. 长期封育对不同类型草地碳贮量及其固持速率的影响. 生态学报, 2011, 31(15): 4270- 4276.
[37]希吉勒. 围封对草地生态系统碳储量影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2012.
[38]李怡. 放牧对大针茅草原碳储量的影响[D]. 呼和浩特: 内蒙古农业大学, 2011.
[39]张成霞, 南志标. 放牧对草地土壤理化特性影响的研究进展. 草业学报, 2010, 19(4): 204- 211.
[40]王清奎, 汪思龙, 冯宗炜. 杉木纯林与常绿阔叶林土壤活性有机碳库的比较. 北京林业大学学报, 2006, 28(5): 1- 6.
[41]吴建国, 张小全, 王彦辉, 徐德应. 土地利用变化对土壤物理组分中有机碳分配的影响. 林业科学, 2002, 38(4): 19- 29.
[42]韩会阁. 土壤有机碳组分对土地利用方式的响应[D]. 兰州: 兰州大学, 2011.
[43]王清奎, 汪思龙, 冯宗炜, 黄宇. 土壤活性有机质及其与土壤质量的关系. 生态学报, 2005, 25(3): 513- 519.
[44]武天云, Schoenau J J, 李凤民, 钱佩源, Malhi S S. 耕作对黄土高原和北美大草原3种典型农业土壤有机碳的影响. 应用生态学报, 2003, 14(12): 2213- 2218.
[45]谢锦升, 杨玉盛, 解明曙, 杨少红, 杨智杰. 土壤轻组有机质研究进展. 福建林学院学报, 2006, 26(3): 281- 288.
Organic carbon storage properties inStipabrevifloradesert steppe vegetation soil systems under different grazing intensities
WANG Heyun1, DONG Zhi1,2, GUO Jianying3, LI Hongli1,2,*, LI Jinrong3, HAN Guodong2, CHEN Xinchuang1
1ForestryCollegeofShandongAgriculturalUniversity,ShandongProvincialKeyLaboratoryofSoilErosionandEcologicalRestoration,TaishanForestEcosystemResearchStation,Tai′an271018,China2CollegeofEcologyandEnvironmentalScience,InnerMongoliaAgriculturalUniversity,Hohhot010019,China3GrasslandHydraulicResearchInstituteoftheMinistryofWaterResources,Hohhot010020,China
Grassland ecosystem, an important component of terrestrial ecosystem, plays an essential role in global carbon cycle and balance. TheStipabrevifloradesert steppe of Inner Mongolia is a transitional ecosystem from grassland to desert, which has infertile soil, weak stability, but high sensitivity to climate and environmental changes. Study on organic carbon storage of the steppe under different grazing intensities is very important for revealing the mechanism of grazing impact on carbon process of the desert steppe and can provide theoretical basis for reasonable conservation and utilization of grassland resources. According to the grassland plant species composition, community height, coverage, aboveground biomass, and density index, the steppe was divided into plots that were subjected to three grazing intensities, heavy grazing (HG), moderate grazing (MG), and light grazing (LG), and the experimental grassland which was fenced to exclude livestock grazing in 2008 was selected as the control sample (CK). The analyses of the aboveground biomass, litter, belowground biomass, soil organic carbon, and soil light fraction organic carbon were utilized to study the organic carbon storage properties inStipabrevifloradesert steppe vegetation soil systems under different grazing intensities. The results showed the following. The carbon storage was 11.98—44.51 g/m2in aboveground biomass, 10.43—36.12 g/m2in litter, and 502.30—804.31 g/m2in belowground biomass (0—40 cm); it was significantly higher in CK than in MG and HG. The carbon storage in the soil at a depth of 0—40 cm was 7817.43—9694.16 g/m2, and it was significantly higher in LG than in CK and HG. The total carbon storage in the vegetation-soil system was 8342.14—10494.80 g/m2under different grazing intensities; it was the largest in LG, followed by MG, CK, and HG. About 90.54%—93.71% of the total carbon was reserved in soil. Light and moderate grazing intensities increased organic carbon level of the ecosystem due to the increase in the root:shoot ratio. The grazing intensities of plant root:shoot ratios decreased from HD (41.94) to MD (30.24), LD (24.33), and CK (18.07), thereby increasing the allocation of carbon amount into the ground. Increased organic carbon content in the ecosystem may also be due to animals trampling and breaking the litter and thus promoting litter decomposition and carbon and nutrients release into the soil. However, heavy grazing severely reduced the grassland vegetation leaf area and storage material, decreased plant net primary production, lowered material input to levels below the output, and decreased the ecosystem carbon storage. Each component of the system accounted for the percentage of ecosystem organic carbon storage in the following order: soil > root > aboveground vegetation > litter in different grazing intensities. Organic carbon storage accumulation in the vegetation had a short-term effect, while its accumulation in the soil was relatively slow. With increasing grazing intensity, aboveground vegetation, litter, and root organic carbon storage showed a decreasing trend, while soil organic carbon storage first increased and then decreased; MG was beneficial to the accumulation of soil organic carbon storage. The soil light fraction organic carbon storage was 484.20—654.62 g/m2, and it was the highest in LG. With increasing grazing intensity, the soil light fraction organic carbon content, storage, and percentage of soil organic carbon storage first increased and then decreased, reaching the highest value in LG. MG intensity was beneficial to soil nutrient accumulation in the desert steppe.
desert steppe; grazing intensity; carbon storage; soil light fraction organic carbon
国家自然科学基金项目(41301302);教育部科技创新团队项目(IRT1259)
2015- 07- 01; 网络出版日期:2015- 09- 28
Corresponding author.E-mail: lhl@sdau.edu.cn
10.5846/stxb201507011399
王合云,董智,郭建英,李红丽,李锦荣,韩国栋,陈新闯.不同放牧强度下短花针茅荒漠草原植被-土壤系统有机碳组分储量特征.生态学报,2016,36(15):4617- 4625.
Wang H Y, Dong Z, Guo J Y, Li H L, Li J R, Han G D, Chen X C.Organic carbon storage properties inStipabrevifloradesert steppe vegetation soil systems under different grazing intensities.Acta Ecologica Sinica,2016,36(15):4617- 4625.

