左氧氟沙星对大鼠气管黏膜和肺组织的损伤及氨溴索的保护作用
文 文,刘 玮,胡顺振,赖国祥
左氧氟沙星对大鼠气管黏膜和肺组织的损伤及氨溴索的保护作用
文文,刘玮,胡顺振,赖国祥*
目的研究盐酸氨溴索对左氧氟沙星经气管内局部使用所致大鼠气管黏膜和肺组织损伤的保护作用。方法将雄性SD大鼠随机分为正常对照组(对照组)、左氧氟沙星组(左氧组)、盐酸氨溴索干预组(干预组),每组30只。对照组仅给予气管穿刺,不注入任何药物。左氧组及干预组大鼠气管均注入左氧氟沙星注射液(28 mg/kg),干预组大鼠则在使用左氧氟沙星前6 h,经腹腔注入盐酸氨溴索注射液(70 mg/kg)。分别于气管穿刺后2、24、48、72、120、168 h 6个时间点分别处死大鼠(每组每个时间点各5只),观察大鼠肺组织的病理改变,并应用扫描电镜观察气管纤毛形态改变情况。结果与对照组相比,左氧组大鼠气道黏膜纤毛上皮及肺组织均存在不同程度损伤(168 h除外),差异有统计学意义(P<0.05)。在第2、48、72、120小时时间点,干预组气管黏膜纤毛及肺组织损伤程度较左氧组均有改善(P<0.05)。结论盐酸氨溴索可保护气管内局部使用左氧氟沙星注射液所致的气管黏膜和肺组织的损伤。
左氧氟沙星;气管内注药;盐酸氨溴索
0 引言
气管内给药是直接将药物注入到气管内的给药方法,是经气管肺给药的方式之一;另一种经气管肺给药的方式是直接吸入。经气管肺给药的方式具有局部浓度高,生物利用度高,全身不良反应小等优点[1]。左氧氟沙星通过气管内给药在肺组织中具有很好的渗透性[2],临床上可将左氧氟沙星作为气管镜诊疗时气管内给药的药物,治疗肺结核尤其是耐药性肺结核[3],亦可尝试使用在无法耐受全身使用左氧氟沙星的肺部感染性疾病患者。但其是否会损伤气道黏膜纤毛上皮和肺组织,损伤是否具有可逆性尚不清楚。本实验拟以左氧氟沙星注射液作为气管内给药的研究药物,观察其对大鼠气管黏膜上皮和肺组织的影响,以及盐酸氨溴索是否可减轻该损伤,为临床上气管内给药的安全性、合理性提供新的理论依据。
1 材料与方法
1.1实验动物90只健康清洁级雄性SD大鼠[购于福建医科大学,批号:SCXK(闽) 2012-0001],体重(240±10)g。饲养环境:所有大鼠均置于饲养室普通环境下,光照、通风良好,室温在24~26 ℃左右,湿度40%~60%。基础饲料喂养。
1.2实验药物左氧氟沙星注射液(江苏扬子江制药有限公司,批号:596438);盐酸氨溴索注射液(上海勃林格殷格翰制药有限公司,批号:428300)。
1.3方法
1.3.1动物分组大鼠随机分为对照组、左氧组和干预组(各30只)。各组在6个不同时间点处理大鼠,每个时间点共5只大鼠。
1.3.2动物造模临床上行纤维支气管镜检查时,左氧氟沙星注射液的常用给药剂量为4 mL(0.2 g),大鼠的给药剂量按人的7倍(/kg)[4],按照此比值,假设以人为50 kg,大鼠为X kg,换算为大鼠气管内左氧氟沙星注射液的给药剂量则应为0.56 X mL(即0.028 X mg),干预组大鼠按体重70 mg/kg腹腔注射盐酸氨溴索注射液[5]。
大鼠麻醉生效后,对照组大鼠仅给予环甲膜穿刺而气管内不注射任何液体,左氧组及干预组大鼠气管均注入左氧氟沙星注射液(28 mg/kg),同时干预组在使用左氧氟沙星前6 h,腹腔注入盐酸氨溴索注射液(70 mg/kg)。
1.3.3标本制备气管内注药后6个不同时间点(2 h、24 h、48 h、72 h、120 h、168 h)分别处死各组的5只大鼠,留取其中下段气管和右肺的后叶。气管用2.5%戊二醛固定,然后在磷酸盐缓冲液中漂洗。取后1/3腹侧段气管,经固定、漂洗、脱水、置换、干燥,IB-3型离子溅射仪真空喷金JSM-6380型扫描电镜观察和摄片,电镜观察中下段气管纤毛形态。肺组织经福尔马林固定后切片染色(HE),观察肺组织的病理改变。
1.3.4气管黏膜上皮细胞超微结构变化在9 000倍扫描电镜下,随机选取5个视野,每个视野均观察气管黏膜纤毛形态,评估纤毛损伤面积占视野内总纤毛面积的百分比以及受损形态类型(包括倒伏、水肿、坏死脱落)。①纤毛损伤面积占视野内总纤毛面积的百分比:0分:<5%,1分:6%~25%,2分:26%~50%,3分:51%~75%,4分:76%~100%[6];②形态受损类型:纤毛排列致密、整齐记为0分;纤毛出现倒伏记为1分;纤毛出现水肿记为2分;纤毛出现坏死、脱落记为3分。两者积分相乘为纤毛损伤程度,0分定为正常(-),1~4分定为轻度损伤(+),5~8分定为中度损伤(++),9~12分定为重度损伤(+++)。应用Imagepro Plus 6.0图像分析系统处理图片并综合2个电镜室医师观察后判断得出数据,结果以积分形式表示[7]。
1.3.5肺组织病理图像分析在100倍光学显微镜下,随机选取5个视野,观察肺组织病理切片,光镜下肺组织病理损伤程度采用如下评判标准:①肺组织中中性粒细胞的浸润面积。0分:0%,1分:1%~25%,2分:26%~50%,3分:5l%~75%,4分:76%~100%。②中性粒细胞渗出量(肺泡内)。0分:无,1分:少量,2分:大量,3分:肺泡腔几乎被充满,4分:肺泡腔充满并出现扩张。③肺泡腔内渗出物量,包括纤维素、水肿液、透明膜、上皮坏死脱落物。0分:无渗出物,1分:少量,2分:大量,3分:肺泡腔几乎充满,4分:肺泡腔充满并扩张[6]。④肺实质、空肺泡所占面积(%)。0分:肺实质面积<15%,空肺泡面积>85%;1分:15%≤肺实质面积<25%,75%<空肺泡面积≤85%;2分:25%≤肺实质面积<50%,50%<空肺泡面积≤75%;3分:50%≤肺实质面积<75%,25%<空肺泡面积≤50%;4分:75%≤肺实质面积<100%,0%<空肺泡面积≤25%。四者积分相加评估病理损伤程度,应用IPP 6.0图像分析软件对每张病理图片进行分析,算出肺实质和空肺泡分别所占面积的百分比,3位经验丰富的病理医师在双盲情况下阅片,评估肺组织中中性粒细胞的浸润面积、肺泡腔内中性粒细胞渗出量和肺泡腔内渗出物量,结果以积分形式表示[8]。

2 结果
2.1气管黏膜上皮细胞超微结构变化①对照组:大鼠气管黏膜纤毛朝向一致、整齐,呈麦浪样起伏的“绒毯状”外观,纤毛朝向一致、整齐。结果见图1。②左氧组:大鼠气管黏膜在第2小时可见部分纤毛排列不齐,第24小时纤毛排列紊乱,部分纤毛倒伏聚集并融合,第48小时纤毛受损数量增加,受损程度加重,大量纤毛倒伏、水肿,呈“蚯蚓”状,第72小时大量纤毛坏死、脱落,呈“虫蚀”状,第120小时坏死、脱落的纤毛吸收消失,部分水肿、未坏死纤毛水肿减轻,第168小时坏死、脱落的纤毛尚未再生,纤毛相对稀疏,水肿、未坏死的纤毛形态恢复正常,排列整齐。结果见图2。③干预组:大鼠气管黏膜纤毛受损程度和左氧组相比有所减轻,倒伏和水肿纤毛数量减少,第48小时纤毛排列稍不齐,纤毛无明显水肿及倒伏,第72小时纤毛排列紊乱,末端水肿、相互融合,但纤毛结构仍完整,无坏死、脱落,第168 h时大部分纤毛形态恢复正常,排列整齐、致密。结果见图3。三组大鼠气管黏膜上皮细胞受损情况见表1。

图1 对照组大鼠气管黏膜纤毛电镜检查像(×9 000)

表1 三组大鼠气管黏膜纤毛受损程度评分比较[中位数(四分位间距)]
注:1.除2 h和24 h外,左氧组其余相邻时间点间比较,P<0.05。2.干预组2 h和24 h时比较,P=0.051,24 h和84 h时比较,P=0.667,其余时间点两两比较,P<0.05。左氧组与对照组比较,168 h时P=0.134,其余各时间点P<0.05;干预组与左氧组比较,24 h时P=0.511,168 h时P=0.513,其余各时间点P<0.05

图2 左氧组大鼠气管黏膜纤毛电镜检查像(×9 000)

图3 干预组大鼠气管黏膜纤毛电镜检查像(×9 000)
2.2肺组织病理检查结果①对照组大鼠肺组织病理结果:支气管上皮完整、排列整齐。结果见图4。②左氧组第2小时少量支气管上皮细胞排列紊乱,无脱落,第24小时排列紊乱的支气管上皮细胞数目增多,支气管腔内可见少量炎症细胞渗出,第48小时支气管上皮细胞排列极其紊乱,肺间质毛细血管扩张充血,大量炎症细胞浸润,支气管腔增宽,其内含有大量红细胞、炎症细胞、纤维蛋白,第72小时部分支气管上皮细胞、杯状细胞崩解,纤毛坏死脱落,第120小时支气管腔内坏死物及红细胞、炎症细胞减少,第168小时尚未坏死脱落的纤毛排列恢复正常,支气管腔内坏死脱落物、炎症细胞基本吸收。结果见图5。③干预组在第2小时和第24小时少量上皮细胞排列紊乱,第48小时与左氧组比较,支气管上皮细胞排列仍较整齐,管腔黏液分泌量及红细胞、炎症细胞量减少,第72小时部分支气管上皮细胞紊乱,未出现上皮细胞崩解、坏死,大部分坏死物吸收消失,第168小时支气管上皮细胞恢复正常,管腔内坏死物及红细胞、渗出物完全吸收,肺实质减少,空肺泡所占面积增加。结果见图6。三组大鼠肺组织病理受损程度评分比较见表2。

图4 对照组大鼠肺组织病理检查像(HE×100)
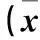
表2 三组大鼠肺组织病理受损程度评分比较±s)
注:干预组各时间点间两两比较,除24 h和48 h比较P=0.483外,其他P<0.01。左氧组与对照组比较,除168 h时P=0.670外,其余时间点P<0.05。干预组与左氧组比较,除24 h时P=0.665外,168 h时P=0.394外,其余各时间点P<0.05
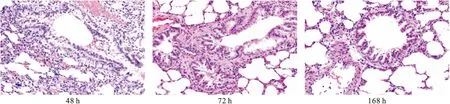
图5 左氧组大鼠肺组织病理检查像(HE×100)

图6 干预组大鼠肺组织病理检查像(HE×100)
3 讨论
从上个世纪开始,国内外学者就经气管肺给药的安全性和有效性进行了有益的探索。上世纪70年代,国外学者就尝试雾化吸入抗生素治疗呼吸机相关性肺炎[9]。随着对气管内抗生素应用的认识逐步深入,美国胸科学会(ATS)将其写入指南指导临床[10]。近年来,经纤维支气管镜支气管肺泡灌洗、气管内置管注药已广泛应用于重症肺部感染、肺结核、肺真菌感染、肺脓肿等患者,临床疗效好[11-13]。目前业界一致认为其是一种有效的用药途径,广泛用于肺部感染、慢性气道炎症性疾病[14-15]甚至恶性肿瘤[16-17]的治疗,相关研究受到重视并不断取得进展。目前,多项吸入性抗生素治疗气道炎症性疾病的国际多中心药物临床试验已经开展,结果值得期待[18-19]。进一步的基础及临床研究将有助于深入气管内局部用药的开展。
通过动物实验研究气管内使用不同药物的安全性为临床气管内局部药物的使用提供了很好的理论基础。我们前期研究发现,气管内局部注射生理盐水、利多卡因和丁胺卡那霉素,可造成大鼠气管黏膜上皮细胞、细支气管和肺泡组织急性、可逆性损伤,不同药物所造成的肺组织损伤程度及修复的时间亦不同[20]。本实验沿用前期实验的研究方法,经过预实验观察,在观察时间点上去除了96 h这个时间点,增加了120 h和168 h两个时间点。实验观察到左氧组在给药后2 h电镜下纤毛即出现倒伏现象,后逐渐加重,至72 h时受损最严重,后逐渐减轻至基本恢复正常(168 h)。同时肺组织亦出现不同程度的病理损伤,但至168 h时基本恢复正常。因此,本研究结果显示,气管内注射左氧氟沙星注射液,可损伤大鼠气管黏膜和肺组织,但该损伤在7 d内可自行修复至正常。
然而,临床上是否可通过使用肺保护药物来减轻该损伤具有非常重要的意义。盐酸氨溴索可溶解黏液,促进排痰[21];还具有抗炎、抗氧化[22]、抗纤维化等作用。本实验中干预组各时间点中除给药第168小时外,气管黏膜受损程度均较左氧组减轻,同时肺组织损伤在2 h、48 h、72 h、120 h时也明显减轻,表明氨溴索可减轻甚至预防经气管内局部使用左氧氟沙星所致的大鼠气管黏膜和肺组织损伤。但并未缩短损伤的恢复时间。
然而,本研究仅观察了左氧氟沙星气管内局部使用后气管黏膜超微结构和肺组织病理的改变,并在不同时间点观察损伤的变化情况,同时观察使用氨溴索干预后的损伤改变情况,但并未对不同剂量氨溴索的保护作用进行观察,同时目前气管内给药造成的气管黏膜和肺组织的损伤机制尚未完全清楚,与增加炎症因子如IL-6、IL-8、结缔组织生长因子、TNF-α的表达和其他机制是否有关尚需明确。盐酸氨溴索是否通过干预细胞因子的表达而对气管黏膜纤毛和肺组织的损伤起保护作用,将是我们今后研究的方向。
[1]Sobukawa E,Sakimura K,Hoshino S,et al.Hepatic myelopathy:an unusual neurological complication of advanced hepatic disease[J].Intern Med,1994,33:718-722.
[2]Zimmermann ES,Laureano JV,Dos Santos CN,et al.Simultaneous semimechanistic population analysis of levofloxacin in plasma,lung and prostrate to describe the influence of efflux transporters on drug distribution following intravenous and intratracheal administration[J].Antimicrob Agents Chemother,2015,60(2):946-954.
[3]王静.左氧氟沙星和阿米卡星联合纤维支气管镜介入治疗肺结核的临床效果观察[J].中国医药,2015,10(4):479-481.
[4]徐叔云,卞如濂,陈修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:202-204.
[5]Nowak D,Pierscinski G,Drzewoski J.Ambroxol inhibits doxorubicin-induced lipid peroxidation in heart of mice[J].Free Radic Biol Med,1995,19(5):659-663.
[6]廖燕如 贺大桥,李荣江,等.超声引导下空芯针穿刺活检对乳腺导管扩张症诊断的临床价值[J].安徽医学,2011,32(5):655-657.
[7]Ota H,Igarashi S,Sassaki M,et al.Distribution of cyclooxygenase-2 in eutopic and endometrim in endometriosis and adenomyosis[J].Hum Reprod,2001,16(3):561-566.
[8]He X,Han B,Mura M,et al.Angiotensin-converting enzyme inhibitor captopril prevents oleic acid-induced severe acute lung injury in rats[J].Shock,2007,28(1):106-111.
[9]Feeley TW,Du Moulin GC,Hedley-Whyte J,et al.Aerosol polymyxin and pneumonia in seriously ill patients[J].N Engl J Med,1975,293(10):471-475.
[10]American Thoracic Society,Infectious Diseases Society of America.Guidelines for the management of adults with hospital-acquired,ventilator-associated,and healthcare-associated pneumonia[J].Am J Respir Crit Care Med,2005,171(4):388-416.
[11]茅尧生,周蕾,应利君,等.支气管肺泡灌洗结合病灶局部给药治疗高龄呼吸机相关肺炎的疗效观察[J].中国内镜杂志,2006,12(8):809-811.
[12]王巍,王安生,林明贵,等.耐多药空洞肺结核凝胶介入疗法的远期疗效观察[J].军医进修学院学报,2005,26(2):128-129.
[13]张忠德,张文青,李建华.纤维支气管镜吸痰和灌注后注药对胸外术后并发肺部感染的治疗作用[J].中国内镜杂志,2005,11(7):724-725.
[14]Global Strategy for Diagnosis,Management,and Prevention of COPD-2016.http://www.goldcopd.org/guidelines-global-strategy-for-diagnosis-management.html.
[15]GINA Report,Global Strategy for Asthma Management and Revention.http://www.ginasthma.org/.
[16]Knight V,Kleinerman ES,Waldrep JC,et al.9-Nitrocamptothecin liposome aerosol treatment of human cancer subcutaneous xenografts and pulmonary cancer metastases in mice[J].Ann NY Acad Sci,2000,922:151-163.
[17]Otterson GA,Villalona-Calero MA,Sharma S,et al.Phase I study of inhaled doxorubicin for patients with metastatic tumors to the lungs[J].Clin Cancer Res,2007,13(4):1246-1252.
[18]Adi H,Young PM,Chan HK,et al.Co-spray-dried mannitol-ciprofloxacin dry powder inhaler formulation for cystic fibrosis and chronic obstructive pulmonary disease[J].Eur J Pharm Sci,2010,40(3):239-247.
[19]Dorkin HL,Staab D,Operschall E,et al.Ciprofloxacin DPI:a randomised,placebo-controlled,phase IIb efficacy and safety study on cystic fibrosis[J].BMJ Open Resp Res,2015,2(1):e000100.
[20]文文,赖国祥,姚丽青,等.气管内给药对大鼠气管粘膜和肺组织影响的研究[J].中国内镜杂志,2011,17(10):1028-1031.
[21]谢基灵.盐酸氨溴索支气管内给药的临床研究[J].中国实用医药,2013,8(19):259-260.
[22]Chlubek D,Zawierta J,Olszewska M,et al.Effect of ambroxol on lipid peroxidation in homogenates of the human placenta[J].Ginekol Pol,2001,72(10):804-808.
Damage of levofloxacin to airway mucosa and lung tissues in rats and the protection effect of ambroxol
WEN Wen,LIU Wei,HU Shun-zhen,LAI Guo-xiang*
(Department of Respiratory and Critical Care Medicine,Fuzhou General Hospital of Nanjing Command, Dongfang Hospital of Xiamen University,Fuzhou 350025,China)
ObjectiveTo study the protection effect of ambroxol hydrochloride on the injury of rat airway mucosa and lung tissue induced by intratracheal instillation of levofloxacin.MethodsNinety male SD rats were divided into three groups randomly:normal control group (n=30),levofloxacin group (n=30) and ambroxol hydrochloride intervention group (n=30).The rats of normal control group were punctured through thyrocricoid without any drug injection.The rats of levofloxacin group and intervention group were both intratracheally injected with levofloxacin slowly through thyrocricoid puncture under intraperitoneal anesthesia (28 mg/kg).The rats of intervention group were intraperitoneally injected with ambroxol hydrochloride at 6 h before intratracheal instillation of levofloxacin(70 mg/kg).The rats were killed respectively at the time points of 2 h,24 h,48 h,72 h,120 h and 168 h after intratracheal instillation in each group (5 rats at each time point in each group).The middle-low segment of the trachea and the posterior lobe of right lung were collected for pathological observation under electron microscope.ResultsThe mucosa cilia and lung tissues were damaged in different degree in levofloxacin group(except 168 h),as compared to normal control group (P<0.05).Compared with levofloxacin group,the damage to the mucosa cilia and lung tissues in intervention group were alleviated at 2 h,48 h,72 h and 120 h (P<0.05).ConclusionAmbroxol can attenuate the damage to airway mucosa and lung tissues caused by intratracheal instillation of levofloxacin.
Levofloxacin;Intratracheal instillation of drugs;Ambroxol hydrochloride
2016-06-27
南京军区福州总医院,厦门大学附属东方医院呼吸与危重症医学科,福州 350025
福建省自然科学基金面上项目(2013J01348)
10.14053/j.cnki.ppcr.201609005

