左归降糖益肾方含药血浆对高糖培养小鼠足细胞凋亡的影响
陈聪,罗文娟,喻嵘*,刘慧萍,杨胜辉,唐元,曾婧,张翔
(1.贵阳中医学院,贵州贵阳550000;2.湖南中医药大学,湖南长沙410208)
·方药研究·
左归降糖益肾方含药血浆对高糖培养小鼠足细胞凋亡的影响
陈聪1,罗文娟2,喻嵘2*,刘慧萍2,杨胜辉2,唐元2,曾婧2,张翔2
(1.贵阳中医学院,贵州贵阳550000;2.湖南中医药大学,湖南长沙410208)
目的探讨在高糖作用下,体外培养的小鼠足细胞凋亡及bax、bcl-2表达水平的变化,及左归降糖益肾方含药血浆的调控作用。方法将体外培养的小鼠足细胞随机分为空白组(A组,25 mmoL/L葡萄糖,10%空白血浆)、高糖组(B组,200 mmoL/L葡萄糖,10%空白血浆)、左归降糖益肾方含药血浆组(C组,200 mmoL/L葡萄糖,10%含药血浆),4-苯基丁酸(4-PBA)含药血浆组(D组,200 mmoL/L葡萄糖,10%含药血浆)。采用间接免疫荧光细胞化学法检测足细胞凋亡情况;MTT自动比色法检测足细胞活力,蛋白质印迹法和逆转录-聚合酶链反应法分别检测bax及bcl-2蛋白或mRNA表达水平的变化。结果与A组相比,B组足细胞活力降低,bax及bcl-2蛋白或mRNA的表达水平均升高(P<0.01);与B组相比,C组、D组足细胞活力升高,bax蛋白或mRNA的表达水平均降低(P<0.05或P<0.01),bcl-2蛋白或mRNA的表达水平均升高(P<0.01);与C组比,D组足细胞活力升高(P<0.05),但bax及bcl-2蛋白或mRNA的表达水平,差异均无统计学意义(P>0.05)。结论bax及bcl-2蛋白或mRNA表达水平的升高,是足细胞损伤的分子机制之一;左归降糖益肾方含药血浆可以通过影响bax及bcl-2蛋白或mRNA的表达水平,从而抑制足细胞凋亡。
左归降糖益肾方;高糖;足细胞;bax;bcl-2
〔Abstract〕Objective To investigate the expression levels of bax,bcl-2 and cell apoptosis in podocyte cells cultured in high glucose condition in vitro,and the regulation effects of Zuogui Jiangtang Yishen decoction plasma.M ethods Cultured podocyte cells of mouses were divided into four groups:blank group(group A,25 mmoL/L glucose,10%blank plasma),high glucose group(group B,200 mmoL/L glucose,10%blank plasma),Zuogui Jiangtang Yishen decoction plasma group(Group C,200 mmoL/L glucose,10%containing medicine plasma),and 4-Phenylbutyric acid(4-PBA)group(group D,200 mmoL/L glucose,10%containing medicine plasma).The cell apoptosis were observed by immunofluorescence stainings.The cell viability was detected by MTT colorimetry assay.The protein and mRNA expressions of bax and bcl-2 were analyzed by Western blot or reverse transcription-polymerase chain reaction,respectively.Results Compared withthe group A,the viability of podocyte cells was significantly decreased of group B,and their expressions of bax and bcl-2 protein or mRNA were upregulated(P<0.01).Compared with group B,the expressions of bax protein or mRNA of podocyte cells were downregulated(P<0.05 or P<0.01),but the protein or mRNA of bcl-2 were upregulated(P<0.01).Compared with group C,the cell viability of group D was significantly upcreased(P<0.05),but there was no statistical significance of their expressions of bax and bcl-2 protein or mRNA(P>0.05).Conclusion The higher level expressions of bax and bcl-2 protein or mRNA were the molecular mechanisms of podocyte injury.ZJYD plasma can repair the damaged podocyte by regulateing the protein or mRNA expressions of bax and bcl-2.
〔Keywords〕Zuogui Jiangtang Yishen decoction;high glucose;podocyte;bax;bcl-2
足细胞位于肾小球基底膜外侧,是终末分化的上皮细胞,几乎没有再生能力,是肾小球滤过的最后一道屏障。足细胞的损伤和剥脱,与糖尿病肾病(diabetic nephropathy,DN)早期发病相关[1-3]。细胞凋亡是导致足细胞损伤和丢失的重要原因之一。bax、bcl-2是调节细胞凋亡的关键蛋白质,其动态平衡维持着细胞的存活[4-5]。
课题组前期研究发现左归降糖益肾方可改善糖尿病肾病MKR鼠肾功能,保护足细胞结构[6]。在前期研究基础上,本文进一步探讨左归降糖益肾方含药血浆对高糖诱导足细胞凋亡及bax、bcl-2表达的影响,为糖尿病肾病的靶向治疗提供实验依据。
1 材料与方法
1.1材料
1.1.1细胞及动物小鼠足细胞购自北京协和细胞中心(mouse podocyte;3111C0001CCC000230)。培养及传代方法参见文献[7]。实验场地主要由湖南中医药大学医学基础教学实验中心提供。8周龄SD大鼠购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2011-0003,体质量约220 g,饲养于湖南中医药大学SPF级实验动物中心。
1.1.2主要试剂总RNA提取试剂盒,购自天根生化科技有限公司;逆转录试剂盒,购自Fermentas公司;PCR引物,由上海生工公司合成;RIPA裂解液,购自北京百泰克生物技术有限公司;Mouse GAPDH antibody购自SANTA公司;兔抗小鼠bax、bcl-2多克隆抗体,辣根过氧化物酶山羊抗兔二抗,均购自上海碧云天生物技术有限公司;Hoechst 33258荧光染料,购自合肥博美生物科技有限责任公司;葡萄糖(分析纯),购自上海国药集团化学试剂有限公司;4-苯基丁酸(4-PBA)购自Sigma公司。
1.1.3主要仪器TG16W型台式离心机,购自长沙平凡仪器仪表有限公司;WD-9402 A型PCR扩增仪,购自北京六一仪器厂;F1-F2 Fuses Type T2A型化学发光凝胶成像分析系统,购自Bio-Rad公司;BioPhotometer plus型核酸蛋白分析仪,购自Eppendorf公司;A1型激光共聚焦显微镜,购自尼康公司。
1.1.4含药血浆制备左归降糖益肾方由熟地黄、黄芪、山药等9味药组成(中药汤剂制备:饮片经水浸泡30 min后,经水煎煮2次,混合滤过后的滤液,浓缩成含生药浓度为2 g/mL的药液,灭菌后置4℃冰箱中保存备用)。SD大鼠24只,随机分为3组:空白组、全方组、4-PBA组,每组8只。按临床常用剂量的3倍给药,给药剂量按人与大鼠体表面积换算法计算。全方组药物浓度为2 g/mL,给药量29.21 g/kg,灌胃容量14.6 mL/kg;4-PBA组药物浓度0.2 g/mL,给药量3 g/kg,灌胃容量15 mL/kg;采用连续7 d灌胃给药,每天1次。空白组予等量蒸馏水灌胃,体积同全方组。末次给药1 h后,腹主动脉插管取血,7.5%EDTA·Na2抗凝,收集血浆,0.22μm滤膜滤过,56℃水浴灭活30 min,分装,放置于-20℃冰箱备用。临用时,均采用不含FBS的DMEM培养液配制至所需浓度用于实验[7]。
1.2方法
1.2.1细胞培养、分组及给药小鼠足细胞以含10%胎牛血清,90%DMEM完全培养基(含100 U/mL青霉素、100μg/mL链霉素、25 mmol/L葡萄糖)在细胞培养室5%CO2,37℃培养箱中培养。期间2~3 d更换培养液一次,倒置显微镜观察细胞形态,待细胞体积明显增大,向四周伸出足突分化成熟后用于实验。
用完全培养基调细胞密度为1×105/mL的细胞悬液,然后转种培养瓶中,加入完全培养基总体积5 mL,放入CO2培养箱中培养至贴壁。用不含胎牛血清的DMEM培养液同步化处理12 h后,分为空白组(A组,10%空白血浆的DMEM培养基,终浓度25 mmol/L葡萄糖),高糖组(B组,含10%空白血浆的DMEM培养基,终浓度200 mmol/L葡萄糖),左归降糖益肾方含药血浆组(C组,10%含药血浆的DMEM培养基,终浓度200 mmol/L葡萄糖),4-PBA含药血浆组(D组,10%含药血浆的DMEM培养基,终浓度200 mmol/L葡萄糖)。根据课题组预实验结果,选择在48 h后收集细胞。用0.25%胰蛋白酶-0.02%EDTA消化细胞,加入完全培养基终止消化,离心管收集细胞悬液,1000 r/pm,5 min离心,弃上清;用PBS洗涤细胞沉淀2~3次,1000 r/pm,5 min离心,弃上清;置冰上,用于逆转录-聚合酶链反应、蛋白质印迹法等相关检测。
1.2.2MTT比色法将细胞悬液接种于96孔培养板,每孔约10000个,每组各5复孔,贴壁后,分别加入相应培养基,孵育48 h后,终止反应,吸除多余培养液,PBS洗2次后,每孔加入含MTT(0.5 mg/mL)的DMEM培养液(不含胎牛血清)150μL,37℃继续孵育4 h后,终止培养,吸弃废液,不洗,每孔加入100μL DMSO,避光置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪上570 nm波长检测各孔吸光值。
1.2.3间接免疫荧光细胞化学法在无菌状态下,将防脱盖玻片分别放入6孔培养板中。每孔均匀加入含细胞1×105/mL的完全培养基悬液1 mL,放入CO2培养箱中培养至贴壁。用不含胎牛血清的DMEM培养基同步化处理12 h后,分为A组、B组、C组、D组。分别加入相应培养基,48 h后收集细胞,用PBS洗涤5 min,3次,加入4%多聚甲醛固定(25~30 min),PBS洗涤5~10 min,3次。用1%曲拉通X-100(PBS配制)打孔,2~5 min,PBS洗3次,每次5~10 min。Hoechst 33258染核(1∶400,PBS稀释),室温,15 min,PBS洗3次,每次10 min,等水晾干,抗荧光淬灭封片剂封片,激光共聚焦显微镜下拍片[7]。
1.2.4蛋白质印迹法按试剂盒操作提取总蛋白,蛋白样品100℃变性10 min后,用50μg蛋白样品电泳,浓缩胶电压80 V,分离胶电压120 V。电泳结束后转膜90 min,将转有蛋白的膜置于5%脱脂奶粉中封闭(用TBST稀释奶粉),4℃过夜,不洗,置于兔抗小鼠多克隆一抗,按试剂盒说明书,TBST稀释,孵育2 h,TBST洗3次,每次10 min,加入辣根过氧化物酶山羊抗兔二抗,按试剂盒说明书,TBST稀释,室温孵育1~2 h,TBST洗3次,每次10 min。加入ECL化学发光试剂,Bio-Rad化学发光凝胶成像分析系统以目的条带灰度值与同个样品的GAPDH(按试剂盒说明书,TBST稀释)灰度值的比值表示目的基因蛋白表达水平[8]。
1.2.5逆转录-聚合酶链反应用总RNA提取试剂盒抽提其总RNA,采用核酸蛋白分析仪测定其浓度。取1μg总RNA,随后用逆转录试剂盒以Oligo(dT)为引物进行逆转录反应。以GAPDH为内参基因。应用Primer 5.0软件,根据GenBank中小鼠的序列设计引物。bax:上游5’-CCAGGATGCGTCCACCAAGAA-3’下游5’-CAAAGTAGAAGAGGGCAAC CAC-3’,产物大小197 bp。bcl-2:上游5’-GGTAC CGGAGAGCGTTCAGT-3’下游5’-CTGCTGCATTG TTCCCGTAG-3’,产物大小303bp。GAPDH,上游5’-GCTCACTTGAAGGGTGG-3’,下游5’-CCATTCGTT GTCGTACCA-3’,产物大小500 bp。
选择最适条件分别对目的基因和GAPDH进行PCR扩增,PCR产物选择琼脂糖凝胶电泳,Bio-Rad化学发光凝胶成像分析系统分析电泳条带灰度值,以目的基因和GAPDH电泳条带灰度值比值计算mRNA相对表达量。
1.2.6统计学处理使用SPSS 19.0统计软件处理,结果以“±s”表示。数据满足正态性及方差齐性检验,采用单因素方差分析,组间比较采用LSD检验;若不满足,则采用非参数检验,P<0.05示差异有统计学意义。
2 结果
2.1足细胞活力检测结果
与A组相比,B组足细胞活力降低;与B组相比,C组、D组足细胞活力升高;与C组比,D组足细胞活力升高;差异均有统计学意义(P<0.05或P<0.01)。见表1。
2.2足细胞细胞核凋亡检测结果
A组细胞核呈较均匀的蓝色荧光,核仁较清晰;B组凋亡细胞核呈致密浓染,或呈碎块状致密浓染。C组与D组细胞核凋亡情况较B组改善。见图1。
表1 各组足细胞活力的比较(±s,n=5)

表1 各组足细胞活力的比较(±s,n=5)
注:与A组比,**P<0.01;与B组比,##P<0.01;与C组比,★P<0.05。
组别A B C D OD值0.77±0.01 0.46±0.03** 0.61±0.01**##0.67±0.01**##★

图1 足细胞凋亡检测激光共聚焦显微镜图(×600)
2.3足细胞bax及bcl-2蛋白检测结果
与A组相比,B组bax及bcl-2蛋白表达水平均升高(P<0.01);与B组相比,C组、D组bax蛋白表达水平均降低(P<0.01),bcl-2蛋白表达水平均升高(P<0.01);与C组比,D组bax及bcl-2蛋白的表达水平,差异均无统计学意义(P>0.05)。见表2。
表2 各组足细胞bax及bcl-2蛋白表达水平的比较(±s,n=5)
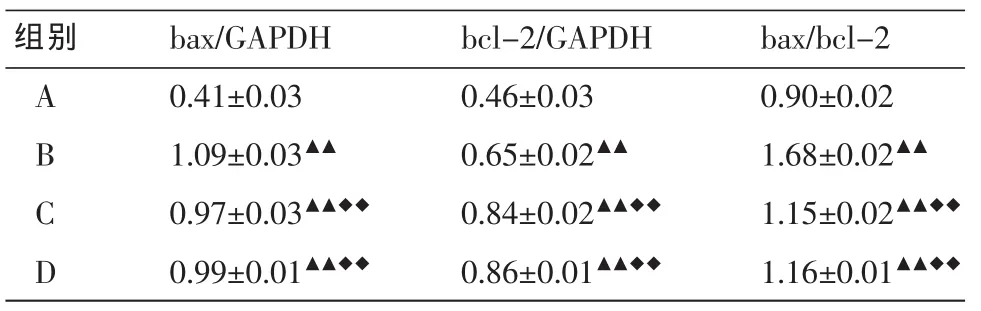
表2 各组足细胞bax及bcl-2蛋白表达水平的比较(±s,n=5)
注:与A组比,▲▲P<0.01;与B组比,◆◆P<0.01。
组别A B C D bax/GAPDH 0.41±0.03 1.09±0.03▲▲0.97±0.03▲▲◆◆0.99±0.01▲▲◆◆bcl-2/GAPDH 0.46±0.03 0.65±0.02▲▲0.84±0.02▲▲◆◆0.86±0.01▲▲◆◆bax/bcl-2 0.90±0.02 1.68±0.02▲▲1.15±0.02▲▲◆◆1.16±0.01▲▲◆◆
2.4足细胞bax及bcl-2的mRNA检测结果
与A组相比,B组bax及bcl-2 mRNA表达水平均升高(P<0.01);与B组相比,C组、D组bax mRNA表达水平均降低(P<0.05或P<0.01),bcl-2 mRNA表达水平均升高(P<0.01);与C组比,D组bax及bcl-2的mRNA表达水平,差异均无统计学意义(P>0.05)。见表3。
表3 各组足细胞bax及bcl-2mRNA表达水平的比较(±s,n=5)

表3 各组足细胞bax及bcl-2mRNA表达水平的比较(±s,n=5)
注:与A组比,▲▲P<0.01;与B组比,◆P<0.05,◆◆P<0.01。
组别A B C D bax/GAPDH 0.65±0.06 1.26±0.03▲▲1.17±0.04▲▲◆◆1.19±0.03▲▲◆bcl-2/GAPDH 0.63±0.04 0.84±0.02▲▲0.94±0.02▲▲◆◆0.97±0.03▲▲◆◆bax/bcl-2 1.04±0.06 1.49±0.02▲▲1.25±0.03▲▲◆◆1.23±0.02▲▲◆◆

图2 各组bax、bcl-2的mRNA及蛋白的表达电泳图
3 讨论
DN的发生发展机制复杂,目前研究认为DN是多种危险因素作用于不同环节所导致的慢性疾病。足细胞受损、凋亡致其数目的减少是导致DN蛋白尿发生的关键因素,也是导致肾小球硬化的重要因素之一[9-10]。当足细胞数量和密度减少时,残存的足细胞为覆盖裸露的肾小球基底膜(GBM)而出现代偿性肥大、足突增宽、融合,从而使肾小球滤过屏障的通透性增加,导致蛋白尿的发生。过多丢失足细胞还会导致GBM外露,失去了足细胞支撑的GBM会在毛细血管静水压的作用下突向肾小囊,进而与肾小球壁层上皮细胞黏连,从而形成肾小球硬化。因而,抑制足细胞凋亡具有重要意义。
bcl-2和bax是目前公认的一对调节细胞凋亡的关键基因。bcl-2是Tsujimoto等人于1984年首次在研究滤泡性非霍奇金B细胞淋巴瘤中分离出来的一种原癌基因,根据其家族成员功能和结构的不同可分为两大类,即抑制凋亡的家族成员(包括bcl-2、bcl-xl等)和促凋亡家族成员(包括bax、bclxs、bak等)。bcl-2、bax二者主要通过同源或者异源二聚体的形成来完成对细胞凋亡的调节。当bax形成同源二聚体时则发挥其诱导细胞凋亡的作用,而当bax与bcl-2形成异源二聚体时则发挥对细胞凋亡的抑制作用。有研究发现,bcl-2与bax之间的动态平衡决定着细胞的存亡[11],主要以bax/bcl-2的比率来表示。桂定坤等[12]通过实验研究表明bax/bcl-2动态失衡是引起足细胞凋亡的重要原因,而因bcl-2表达下降所致足细胞凋亡,则是加速肾小球硬化、加重肾损伤的关键。
课题组前期研究选择高糖浓度200 mmol/L作为实验浓度。本实验通过高糖200 mmol/L诱导足细胞凋亡,48 h后收集细胞,通过对足细胞凋亡因子bcl-2、bax的mRNA和蛋白的检测,发现在足细胞损伤模型组中,与空白组相比,bax、bcl-2及bax/ bcl-2的表达升高(P<0.01),提示bcl-2、bax、bax/ bcl-2在调控足细胞凋亡方面起着重要的作用。同时与模型组比较,左归降糖益肾方含药血浆组bax和bax/bcl-2比值的表达下调,而抑制凋亡的bcl-2 mRNA和蛋白的表达上调;足细胞活力升高;激光共聚焦显微镜图显示足细胞细胞核凋亡状况明显改善。提示左归降糖益肾方含药血浆可通过调节bax/ bcl-2比值从而调控足细胞凋亡。
[1]Reddy GR,Kotlyarevska K,Ransom RF,et al.The podocyte and diabetes mellitus:is the podocyte the key to the origins of diabetic nephropathy?[J].Curr Opin Nephrol Hypertens,2008,17(1):32-36.
[2]Gao P,Meng XF,Su H,et al.Thioredoxin-interacting protein mediates NALP3 inflammasome activation in podocytes duri n diabetic nephropathy[J].Biochim Biophys Acta,2014,1843(11):2448-2460.
[3]Baelde HJ,Eikmans M,Lappin DW,et al.Reduction of VEGF-A and CTGF expression in diabetic nephropathy is associated with podocyte loss[J].Kidney Int,2007,71(7):637-645.
[4]Zhang ZG,Zou J,Huang Y,et al.Kinetin inhibits proliferation of hepatic stellate cells by interrupting cell cycle and induces apoptosis by down-regulating ratio of Bcl-2/Bax[J].J Huazhong Univ Sci Technolog Med Sci,2015,35(5):672-678.
[5]Yin XM,Oltvai ZN,Korsmeyer SJ.BH1 and BH2 domains of Bcl-2 are required for inhibition of apoptosis and heterodimerization with Bax[J].Nature,1994,369(6478):321-323.
[6]印红爱,吴勇军,喻嵘,等.左归降糖益肾方对2型糖尿病肾病小鼠足细胞nephrin与podocin表达的影响[J].中国中医药信息杂志,2014,21(3):53-57.
[7]陈聪,吴勇军,喻嵘,等.左归降糖益肾方含药血浆对高糖培养小鼠足细胞凋亡及Caspase-12表达的影响[J].湖南中医药大学学报,2015,35(3):64-68.
[8]罗文娟,喻嵘,唐元,等.左归降糖益肾方对2型糖尿病肾病小鼠足细胞凋亡的影响[J].中医杂志,2015,56(6):511-514.
[9]张瑜珊,汪年松,王筱霞.内质网应激在糖尿病肾病中的研究进展[J].中国中西医结合肾病杂志,2014,15(9):840-842.
[10]Xu J,Li Z,Xu P,et al.Protective effects of leukemia inhibitory factor against oxidative stress during high Glucose-induced apoptosis in podocytes[J].Cell Stress and Chaperones,2012,17(1):32-36.
[11]Queiroz EA,Puukila S,Eichler R,et al.Metrormin induces apoptosis and cell cycle arrest mediated by oxidative stress,AMPK and FOXO3a in MCF-breast cancer cells[J].PLoS One,2014,9(5):e98207.
[12]桂定坤,陈建国,陈宜方,等.黄芪甲苷对高糖所致小鼠足细胞凋亡及其相关基因表达的影响[J].浙江医学,2010,32(2):180-184.
(本文编辑杨瑛)
Effects of Zuogui Jiangtang Yishen Decoction Plasma on Apoptosis of Podocyte Cells Cultured in High G lucose Condition
CHEN Cong1,LUO Wenjuan2,YU Rong2*,LIU Huiping2,YANG Shenghui2,TANG Yuan2,ZENG Jing2,ZHANG Xiang2
(1 Guiyang College of Traditional Chinese Medicine,Guiyang,Guizhou 550000,China;2.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
R256.5;Q71;R587.1
A
doi:10.3969/j.issn.1674-070X.2016.09.002
2016-02-19
国家自然科学基金面上项目(81273753);湖南省自然科学基金(12JJ2048,12JJ9031);湖南省高校创新平台开放基金(14K069);细胞生物学与分子技术湖南高校重点实验室;“心脑疾病中西医结合防治研究”湖南省高校科技创新团队资助;贵阳中医学院2015年院内博士启动基金资助。
陈聪,女,硕士,研究方向:内分泌疾病的中医辨证规律及其防治研究。
〔通迅作者〕*喻嵘,女,教授,博士研究生导师,E-mail:yuron@21cn.com。

