β-葡萄糖苷酶冻干保护剂的研究
陈 艺,陶治玮,陈文清*
(四川大学 建筑与环境学院,四川 成都 610065)
β-葡萄糖苷酶冻干保护剂的研究
陈艺,陶治玮,陈文清*
(四川大学 建筑与环境学院,四川 成都 610065)
β-葡萄糖苷酶参与生物体的糖代谢,对维持生物体正常生理功能起着重要作用。采用单因素试验和正交试验,对β-葡萄糖苷酶真空冷冻干燥保护剂配方进行筛选和优化。得到冻干保护剂最佳配方为乳糖6%、蔗糖7%、海藻糖7%,甘露醇2%。在此条件下,经过真空冷冻干燥,β-葡萄糖苷酶的残余酶活可达80.25%。
β-葡萄糖苷酶;保护剂;正交试验;真空冷冻干燥
β-葡萄糖苷酶,属于水解酶类,又称β-D-葡萄糖苷水解酶,别名龙胆二糖酶、纤维二糖酶和苦杏仁苷酶,是纤维素分解酶系中重要组成成分之一。它属于纤维素酶类,能催化水解芳基或烃基与糖基原子团之间的糖苷键生成葡萄糖[1-2]。1837年,Liebig和Wohler首次在苦杏仁中发现。后来的研究发现,β-D-葡萄糖苷酶存在于自然界许多动植物、微生物及细菌体内,参与生物体的糖代谢,对维持生物体正常生理功能起着重要作用[3]。因此对β-葡萄糖苷酶的研究具有重要的理论和实用价值。
真空冷冻干燥技术广泛应用于食品、医药、生物等各个领域[4]。为了使酶或其他一些生物活性材料得以稳定的保存。冻干是人们常用的一种方法。酶经过冷冻干燥后不易变质、可长期储存;易复水再生;有利于活性的保持[5]。但冻干过程牵涉到冷冻和脱水两个过程[6],不可避免地会带来酶活性的损失及酶的损伤、变性。多羟基化合物,糖类,聚合物等具有独特的保护生物活性材料的功能,在冷冻干燥时加入适宜的保护剂,可以在很大程度上减轻或避免冷冻干燥对细胞及酶等生物大分子带来的损伤[7]。SOUILLAC P O等[8]研究表明糖类对阻止蛋白质二级结构改变,冻干处理过程中及贮藏期内蛋白质的伸展和聚集起显著作用。O′FAGIAN C[9]研究发现聚合物可提高蛋白质玻璃化温度、抑制赋形剂结晶,从而起到保护作用。李宁等[10]研究表明,甘露醇、乳糖、可溶性淀粉对乳糖酶真空冷冻干燥过程中的保护具有协同作用。本试验研究了不同保护剂对降低酶活损失的效果,采用单因素试验及正交试验对冻干保护剂的组成及添加量进行了探讨,以期最大限度地发挥保护剂的作用,减少β-葡萄糖苷酶在冷冻干燥过程中的活力损失,为β-葡萄糖苷酶制剂的商品化生产和工业化应用提供理论依据。
1 材料与方法
1.1材料与试剂
D-水杨苷(分析纯):美国Amresco公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):成都润泽试剂有限公司;甘露醇、乳糖、明胶、聚乙二醇、海藻糖和蔗糖(均为分析纯):成都科龙化工试剂厂;血清白蛋白(纯度98%):英国Abcam公司;其余试剂均为国产分析纯。
1.2仪器与设备
TGL-16高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;UV-6100双光束紫外可见光光度计:上海美谱达仪器有限公司;HH-2恒温水浴锅:金坛市精达仪器制造厂;真空LyoQuest-85冻干机:西班牙泰事达Telstar公司;UPH-11-20T超纯水机:四川优普超纯科技有限公司。
1.3实验方法
1.3.1β-葡萄糖苷酶粗酶液的制备
β-葡萄糖苷酶产生菌黑曲霉(Aspregillus niger)的发酵液在14 000 r/min转速下离心8 min后,取离心液加入一定量的硫酸铵(1.6 g硫酸铵/1 mL离心液),4℃条件下静置24 h,然后在4℃、14 000 r/min的转速下离心8 min,弃上清液,取沉淀融入一定量的缓冲液,所得溶液即为β-葡萄糖苷酶粗酶液。
1.3.2β-葡萄糖苷酶活性的测定
采用DNS法测定β-葡萄糖苷酶活性[11]。
取1 mL适当稀释倍数的酶液于具塞试管中,加入0.5 mL、0.5%水杨苷(溶于0.1 mol/L、pH 4.8的醋酸-醋酸钠缓冲溶液中),50℃保温20 min,再加入1.5 mL DNS试剂,充分混合后沸水中煮沸5 min,立刻冷却,用蒸馏水稀释至10 mL,于波长540 nm处测OD540nm值。以加热灭活(100℃、5 min)的酶液按照同样方法处理空白。在上述条件下定义1 mL酶液1 min水解产生1 μmol葡萄糖的酶活力为1个酶活单位(U/mL)。β-葡萄糖苷酶酶活计算公式如下:
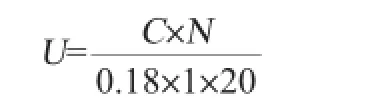
式中:U为酶活力,U/mL;N为原酶液稀释倍数;C为葡萄糖含量,mg/mL;0.18为1 μmol的葡萄糖的质量(1 mg);20为反应时间,min。
1.3.3保护剂筛选
在粗酶液中分别加入0、1%、2%、3%、4%、5%、6%、7%、8%的不同的保护剂(甘露醇、乳糖、明胶、聚乙二醇、海藻糖、蔗糖、血清白蛋白),设置预冻温度为-20℃;预冻时间8 h,置于真空冷冻干燥机内真空冷冻24 h,使样品中残余水分含量<5%。冻干样定量水化后测定残余酶活。其计算公式如下:

以平均残余酶活和最高残余酶活为评价指标以及冻干产品质量来对保护剂进行筛选。
1.3.4保护剂筛选单因素试验
以残余酶活作为评价指标,考察各种保护剂(甘露醇、乳糖、海藻糖、蔗糖,血清白蛋白,聚乙二醇)在不同添加量(0、1%、2%、3%、4%、5%、6%、7%、8%)条件下对β-葡萄糖苷酶活力的保护程度,确定保护剂最佳添加量。
1.3.5保护剂配方优化正交试验
在单因素试验基础上,选出影响β-葡萄糖苷酶活力较大的因素甘露醇、乳糖、海藻糖、蔗糖,以残余酶活作为评价指标,采用L9(34)正交试验设计,确定冻干保护剂最佳配方,正交试验因素与水平见表1。

表1 保护剂配方优化正交试验因素与水平Table1 Factors and levels of orthogonal experiments for optimization of protective agent formula
2 结果与分析
2.1保护剂的筛选
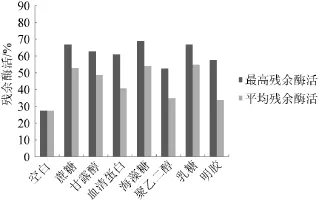
图1 不同保护剂对β-葡萄糖苷酶冻干过程中的保护作用Fig.1 Protection effect of different protective agent on β-glucosidase in the freeze-drying process
由图1可知,7种保护剂对β-葡萄糖苷酶活力的保存都具有积极的作用,其中以海藻糖,乳糖、蔗糖、甘露醇的保护效果显著,最高残余酶活可达60%以上,平均残余酶活可达50%。且冻干产品结构似海绵状疏松多孔,颜色均一,易于剥离,加水后速溶完全,几乎立即性状复原。因此,选择海藻糖、乳糖、蔗糖和甘露醇作为冻干保护剂,进行单因素试验。
2.2冻干保护剂优化单因素试验
2.2.1蔗糖添加量对β-葡萄糖苷酶的冻干保护作用
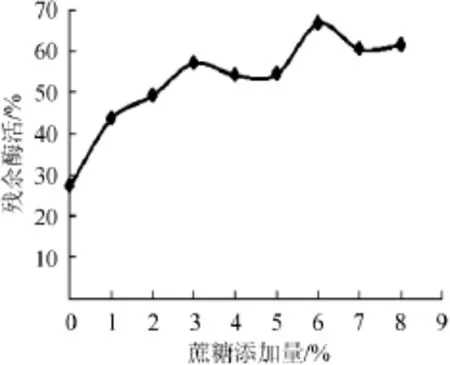
图2 不同蔗糖添加量对β-葡萄糖苷酶冻干的影响Fig.2 Effect of different sucrose addition on β-glucosidase freeze-drying
由图2可知,当蔗糖添加量<3%时,残余酶活与蔗糖添加量正相关,且趋势明显;当蔗糖添加量3%~5%时,残余酶活变化不大;当蔗糖添加量为6%时,残余酶活达到最高(66.65%);当蔗糖添加量>6%时,残余酶活略有下降且变化不大。由于蔗糖具有大量羟基,脱水过程中可替代水分子,与蛋白质分子的极性残基结合,起到保护高分子结构的作用;另外,蔗糖可参与酶蛋白玻璃态形成,使酶蛋白分子保持不移动,从而保持稳定干燥的状态[12]。因此,蔗糖最佳添加量为6%。
2.2.2乳糖添加量对β-葡萄糖苷酶的冻干保护作用
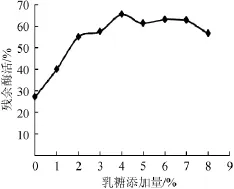
图3 不同乳糖添加量对β-葡萄糖苷酶冻干的影响Fig.3 Effect of different lactose addition on β-glucosidase freeze-drying
由图3可知,乳糖对β-葡萄糖苷酶在真空冷冻过程中具有保护作用,当乳糖添加量在1%~4%时,残余酶活随乳糖添加量增加而增大;当乳糖添加量为4%时,β-葡萄糖苷酶的残余酶活(65.47%)较不加保护剂的对照组增大2.3倍,随着乳糖添加量的增大,β-葡萄糖苷酶的残余酶活维持在60%左右,没有明显的下降趋势。这可能是由于在冷冻过程中,乳糖通过“水置换作用”抑制酶蛋白脱水,阻止糖链间的范德华力增强,阻碍酶蛋白结构的变化,从而保护菌体不被损伤[13]。因此,乳糖最佳添加量为4%。
2.2.3海藻糖添加量对β-葡萄糖苷酶的冻干保护作用

图4 不同海藻糖添加量对β-葡萄糖苷酶冻干的影响Fig.4 Effect of different trehalose addition on β-glucosidase freeze-drying
由图4可知,当海藻糖添加量为0~1%时,β-葡萄糖苷酶的残余酶活随海藻糖添加量的增大而升高;当海藻糖添加量为1%~2%、3%~5%时,海藻糖添加量对残余酶活的影响程度基本一致;当海藻糖添加量2%~3%时,残余酶活略有增加;当海藻糖添加量达到6%时,β-葡萄糖苷酶的残留酶活达到最高值(68.81%);当海藻糖添加量>6%时,β-葡萄糖苷酶的残留酶活有所降低。海藻糖对β-葡萄糖苷酶具有良好的冻干保护效果,是因为外源性海藻糖具有对生物大分子良好的非特异性保护功能[14-15],海藻糖分子较小,易于以分子形式填充到蛋白质分子的空隙中,有效限制蛋白质分子内部结构的变化,从而避免蛋白质变性失活。并且当蛋白质处于干燥脱水或高渗环境时,海藻糖可以在酶蛋白分子外形成一种玻璃状的防护层,提高了物质的渗透压耐受性或耐干燥性,从而在干燥状态下保护蛋白质组分不受破坏,使酶继续保持活性[16-17]。因此,海藻糖最佳添加量为6%。
2.2.4甘露醇添加量对β-葡萄糖苷酶的冻干保护作用

图5 不同甘露醇添加量对β-葡萄糖苷酶冻干的影响Fig.5 Effect of different mannitol addition on β-glucosidase freeze-drying
由图5可知,当甘露醇添加量<3%时,β-葡萄糖苷酶的残余酶活随甘露醇添加量的增大而增大,可能是因为甘露醇对酶蛋白的保护作用与其浓度、形态结构有关,而其浓度与结晶形态有关,通常认为无定型甘露醇能使酶蛋白稳定,阻止细胞膜蛋白质分子的聚集,从而保护酶蛋白结构不被破坏;当甘露醇含量为3%时,β-葡萄糖苷酶的残留酶活达到最高值(62.58%);当甘露醇添加量3%~5%,残留酶活便开始明显下降,当甘露醇添加量>5%后,残留酶活基本保持稳定。其原因可能是甘露醇在此浓度时形成了结晶,促进了酶蛋白质的聚集,不仅起不到保护酶蛋白质结构稳定的作用,反而更有利于酶结构骨架的损坏[4,10,18]。因此,甘露醇最佳添加量为3%。
2.2.5正交试验优化冻干保护剂配方
4种单因素添加保护剂的保护效果(最高残余酶活)均高于60%。表明这类保护剂能减轻酶蛋白损伤,平衡物质外压力,缓减脱水收缩程度和速度,减少了酶活的损失。但是单一的保护成分对酶冻干的保护效果还远远不够,因此结合4种保护剂各自单因素试验中表现出对β-葡萄糖苷酶的冻干保护效果,确定了4因素3水平,同时以残余酶活力为评价指标,进行L9(34)正交试验,结果与分析见表2。

表2 保护剂配方优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for optimization of protective agent formula
由表2可知,根据极差值R可判断,影响因素最大的是乳糖,其次是蔗糖,影响最小的因素是甘露醇。根据k1、k2、k3值的大小,可以确定各因素较优的水平组合为A3B3C3D2,即乳糖6%、蔗糖7%、海藻糖7%、甘露醇2%。在此最佳条件进行验证试验,得到β-葡萄糖苷酶残余酶活为80.25%。
3 结论
试验表明,添加保护剂能够有效地减少或阻止冷冻和干燥对β-葡萄糖苷酶带来的影响,通过单因素试验筛选出4种β-葡萄糖苷酶的有效冷冻保护剂:蔗糖、乳糖、海藻糖、甘露醇。通过正交试验得到β-葡萄糖苷酶冻干保护剂的最佳配比为乳糖6%、蔗糖7%、海藻糖7%,甘露醇2%。在此最佳条件下,残余酶活可达80.25%,明显优于使用单一保护剂的效果。糖类的冻干保护效果明显优于其他几种醇类和蛋白质类保护剂,可能是由于类保护剂中含有的羟基,可以与酶(蛋白质)形成氢键以取代水,保证了蛋白质的稳定性,减缓酶蛋白的损伤程度,达到保护酶活力的目的。一般而言,冻干保护剂的保护作用与其化学结构有密切关系,同时,不同的保护剂之间对β-葡萄糖苷酶真空冻干过程中的保护会产生协同效应,能在一定程度上提高对酶活力的保护效果。
[1]李华,高丽.β-葡萄糖苷酶活性测定方法的研究进展[J].食品与生物技术学报,2007,26(2):107-119.
[2]李远华.β-葡萄糖苷酶的研究进展[J].安徽农业大学学报,2002,29(4):421-425.
[3]王志江,魏红福.β-葡萄糖苷酶的研究[J].饲料工业,2006,27(22):20-22.
[4]GARCIA-AMEZQUITA L E,WELTI-CHANES J,VERGARABALDERASFT,et al.Freeze-drying:The basic process[J].Encycl Food Health,2016,54(12):104-109.
[5]张敬如,黄复生,王昆.蛋白质药品的真空冷冻干燥技术及研究进展[J].中国药业,2006,15(13):25-27.
[6]初英尧.简析生物制药方面冻干技术的应用[J].中国西部科技,2015(4):44-45.
[7]弓玉红,田晶.纳豆制备及冷冻干燥保护剂的筛选和优化研究[J].食品研究与开发,2015,36(23):98-103.
[8]SOUILLAC P O,MIDDAUGH C R,RYTTING J H.Investigation of protein/carbohydrate interactions in the dried state.2.Diffuse reflectance FTIR studies[J].Int J Pharm,2002,235(1-2):207-218.
[9]MATEJTSCHUK P.Lyophilization of proteins[J].Method Mol Biol,2001,244:309-321.
[10]李宁,赵珊,贾英民.黑曲霉乳糖酶冻干保护剂的研究[J].中国酿造,2010,29(12):101-104.
[11]江昌俊,李叶云.茶叶中β-D-葡萄糖苷酶活性测定条件的研究[J].安徽农业大学学报,1999,26(2):212-215.
[12]WIATER M K,WAS′KO A,BERECKA M P,et al.Spirulina enhances the viability ofLactobacillus rhamnosusE/N after freeze-drying in a protective medium of sucrose and lactulose[J].Letter Appl Microbiol,2011,53(1):79-83.
[13]杜磊,杜杨,席菁聆.纳豆菌冷冻保护剂的研究[J].河南工业大学学报:自然科学版,2015,36(5):88-92.
[14]SUNDARAMURTHI P,SURYANARAYANAN R.Trehalose crystallization during freeze-drying:Implications on lyoprotection[J].J Phys Chem Lett,2010,1(2):510-514.
[15]尤新.功能性发酵制品[M].第1版,北京:中国轻工业出版社,2000:92-100.
[16]SANTAGAPITA P R,MAZZOBRE M F,CRUZ A G,et al.Polyethylene glycol-based low generation dendrimers functionalized with β-cyclodextrin as cryo-and dehydro-protectant of catalase formulations[J]. Biotechnol Progress,2013,29(3):786-795.
[17]刘景汉,周俊,欧阳锡林,等.人血小板冷冻干燥前海藻糖负载技术的优化[J].中国实验血液学杂志,2005,13(4):698-702.
[18]武华丽,胡一桥.冷冻干燥制剂的稳定性研究进展[J].中国药学杂志,2001,36(7):436-438.
Research on freeze-drying protective agent of β-glucosidase
CHEN Yi,TAO Zhiwei,CHEN Wenqing*
(College of Architecture&Environment,Sichuan University,Chengdu 610065,China)
β-glucosidase involves in the glucose metabolism of the organism,and plays an important role for organisms to maintain normal physiological function.By single factor experiments and orthogonal experiments,the vacuum freeze-drying protective agent formulas of β-glucosidase were screened and optimized.The optimum formulas of freeze-drying protective agent were obtained as follows:lactose 6%,sucrose 7%,trehalose 7%and mannitol 2%.Under these conditions,after vacuum freeze-drying,the remnant enzyme activity of β-glucosidase could be up to 80.25%.
β-glucosidase;protective agent;orthogonal experiments;vacuum freeze-drying
Q814
0254-5071(2016)09-0109-04doi:10.11882/j.issn.0254-5071.2016.09.025
2016-04-27
陈艺(1992-),女,硕士研究生,研究方向为水污染控制与及生物修复。
陈文清(1969-),女,教授,博士,研究方向为环境材料开发及应用、环境分子生物技术开发、水体及土壤污染风险评估与生态修复技术研发。

