单头肿腿蜂DNA提取方法及多个基因片段PCR反应体系建立
姜嫄 李志强 吴晓云等
摘要[目的]采用分子生物学技术研究肿腿蜂类天敌昆虫近缘种关系。[方法]利用SDS法和试剂盒法2种方法对8种肿腿蜂的单头个体进行基因组DNA提取。[结果]琼脂糖凝胶电泳结果表明,试剂盒法提取的单头肿腿蜂基因组DNA虽成本较高,但提取总量大、提取成功率高、单位浓度高。且利用试剂盒法提取的基因组DNA进行多个基因片段PCR扩增,均得到正确的扩增产物。[结论]该研究为进一步分析肿腿蜂种类及遗传进化关系奠定基础。
关键词肿腿蜂;DNA提取;基因片段;PCR
中图分类号S476文献标识码A文章编号0517-6611(2016)04-186-04
DNA Extraction Method of Sclerodermus and Establishment of Gene Segment PCR Reaction System
JIANG Yuan, LI Zhiqiang, WU Xiaoyun, ZHANG Yinan* et al(Department of Horticulture, Beijing Vocational College of Agriculture, Institute of Biological Control, Beijing 102442)
Abstract[Objective] To research the sibling species relationship of natural enemy insects of Sclerodermus. [Method] Genome DNA extraction of eight species of Sclerodermus was carried out by SDS method and kit method. [Result] Results of agarose gel electrophoresis showed that genome DNA extraction costed relatively high by kit method with the characteristics of large extraction amount, high successful extraction rate and high concentration per unit milliliter. PCR amplification of multiple genes could obtain correct products. [Conclusion] This research provides basis for the further analysis of the types and genetic evolution of Sclerodermus.
Key wordsSclerodermus; DNA extraction; Gene sequences;PCR
腫腿蜂(Sclerodermus)是用于蛀干害虫生物防治的一类重要寄生性天敌昆虫,目前我国已发现多种具有生物防治应用潜能的肿腿蜂,其中管氏肿腿蜂(S.guani)、川硬皮肿腿蜂(S.sichuanensis)和白蜡吉丁肿腿蜂(S.pupariae)已有较多的研究和应用[1-11]。研究表明,用松脊吉丁肿腿蜂寄生马尾松木段中的松褐天牛,其寄生率较高[12]。苹小吉丁肿腿蜂和落叶松吉丁肿腿蜂被用来防治新疆苹小吉丁,具有一定的防治成果[13]。昆虫分子标记技术的不断发展,为肿腿蜂的分子鉴定提供了研究基础。然而,肿腿蜂单头个体体积较小,雌蜂体长3~4 mm,如何提取单头肿腿蜂的基因组DNA成为首要解决的问题。不同肿腿蜂在形态上十分相近,很难鉴别,利用分子生物学手段对不同寄主肿腿蜂的分子鉴定研究,有利于生物防治过程中有针对性地释放天敌,从而达到更好的控制效果。因此,笔者参考小型昆虫和寄生蜂的DNA提取方法[14-16],对我国已发表的种和北京农业职业学院生物防治研究所采集保存的肿腿蜂进行基因序列研究,以明确其特定基因的异同,为确定其亲缘关系、明确种类奠定基础。
1材料与方法
1.1材料试验于2013年在中国农业大学理学院农药分子生物学实验室进行。8种肿腿蜂取自中国林业科学研究院生物防治中心,为在室内用替代寄主人工繁育多代后的活体雌虫,8种肿腿蜂包括管氏肿腿蜂,川硬皮肿腿蜂,白蜡吉丁肿腿蜂,苹小吉丁肿腿蜂寄生苹小吉丁Agrilus mali幼虫和蛹,松脊吉丁肿腿蜂寄生日本松脊吉丁Chalcophora japonica Gory幼虫,落叶松吉丁肿腿蜂寄生落叶松吉丁Chrysobothris sp.幼虫,沙蒿吉丁肿腿蜂寄生沙蒿吉丁Sphenoptera sp.幼虫,松褐天牛肿腿蜂寄生松褐天牛Monochamus alternatus幼虫和蛹。每种肿腿蜂提取15头单头个体以备用。
1.2主要试剂及仪器蛋白酶K,提取裂解液(STE),酚/氯仿/异戊醇(25∶24∶1),氯仿/异戊醇(24∶1),RNA酶,无水乙醇,琼脂糖,溴化乙锭10 mg/mL(EB)(100 mg溴化乙锭溶于10 mL水中,1 mL每管分装,于4 ℃棕色瓶中保存),电泳缓冲液:10×TAE(48.4 g Tris碱,3.27 g EDTA(pH 8.0),11.42 mL冰醋酸,灭菌水定容至1 000 mL),10×Loading buffer,Marker:2000bp ladder marker。
TW2水浴锅(Julabo公司),DYY6C电泳仪(北京六一厂),水平电泳槽,高压灭菌锅,sartorius电子天平,UVI凝胶成像系统(UNITEC),CT15RE离心机(Hitachi公司),微波炉(SAMSUNG公司),涡旋仪(QILINBEIER公司),-86 ℃超低温冰箱(Thermo公司),fiveeasy pH计,冰箱(容声公司),Eppendorf移液枪若干。1.5 mL离心管,试剂瓶等。
1.3方法
1.3.1SDS法。①在1.5 mL离心管内加入10 μL STE(0.1 mmol/L NaCl,10 mmol/L TrisHCl,1 mmol/L EDTA,灭菌后使用)。②将单头肿腿蜂雌虫活体装入离心管中,再将离心管放入液氮5~10 s后夹出,用塑料研杵快速研碎成虫,再加入90 μL STE、9 μL 10%SDS和5 μL蛋白酶K,摇匀10 min。③65 ℃水浴3.5 h,期间多次摇匀。④抽提:加入100 μL酚/氯仿/异戊醇(25∶24∶1)混匀10 min,12 000 r/min离心10 min,取上清液;加入100 μL氯仿/异戊醇(24∶1)与上清液混匀10 min,12 000 r/min离心10 min,取上清液。⑤重复步骤④1次。⑥在上清液中加入2倍体积冰冻的无水乙醇,于-20 ℃沉淀过夜。⑦ 4 ℃,12 000 r/min离心10 min,弃上清液。⑧漂洗:加入100 μL 75%乙醇,摇匀,以除去残留的盐,4 ℃,12 000 r/min离心5 min,吸去上清液。⑨重复步骤⑧1次(漂洗2次)。⑩风干:在室温下放置20 min左右至乙醇完全挥发或在通风厨放5~8 min。DNA溶解:加入10~13 μL ddH2O,室温放置溶解20 min。
1.3.2试剂盒法。选用TianGen公司的血液/细胞/组织基因组DNA提取试剂盒(DP30402),方法步骤参照说明书并稍作改动。①将单头肿腿蜂雌虫活体装入离心管中,再将离心管放入液氮5~10 s后夹出,用塑料研杵快速研碎成虫,加入200 μL缓冲液GA,振荡至彻底悬浮。加入40 μL 10 mg/mL RNaseA溶液振荡15 s,室温放置5 min。②加入20 μL Proteinase K溶液(20 mg/mL),混匀。在56 ℃水浴锅中放置2 h,每30 min颠倒混合样品1次。③加入200 μL缓冲液GB,充分颠倒混匀,70 ℃水浴锅中放置10 min,简短离心以去除管盖内壁的水珠。④加入200 μL无水乙醇,充分振荡混匀15 s,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。⑤将上一步骤④所得溶液和絮状沉淀均加入一个吸附柱CB3中,12 000 r/min离心30 s,倒掉廢液,将吸附柱CB3放回收集管中。⑥向吸附柱CB3中加入500 μL缓冲液GD,12 000 r/min离心30 s,倒掉废液,将吸附柱CB3放入收集管中。⑦向吸附柱CB3中加入700 μL漂洗液PW,12 000 r/min离心30 s,倒掉废液,将吸附柱CB3放入收集管中。⑧重复步骤⑦1次。⑨将吸附柱CB3放回收集管中,12 000 r/min离心2 min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。⑩将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加60~80 μL洗脱缓冲液TE,室温放置2~5 min,12 000 r/min离心2 min,将溶液收集到离心管中。
1.3.3基因组DNA样品检测。利用琼脂糖凝胶电泳对提取出的基因组DNA样品进行检测,配制1%的琼脂糖凝胶溶液(0.3 g琼脂糖,30 mL 1×TAE,1 μL EB),取3 μL基因组DNA样品,与10×Loading buffer 混匀后点样,电压100 V,电泳30 min,在凝胶成像系统下观察并拍照保存。
1.3.4肿腿蜂多个基因片段PCR反应体系与反应程序。反应引物参考Simon等[17]的通用引物。反应体系参考天根试剂盒TaqDNA聚合酶说明书中的体系,线粒体COI、12S、16S、cytb,核糖体28S基因片段以及核糖体间隔区ITS序列的扩增反应体系相同(25.0 μL):1.5 μL模板DNA,3.0 μL 10×Taq buffer,2.0 μL dNTP mixture(2.5 mmol/L),正反向引物各1.0 μL(10 pmol/μL),0.5 μL TaqDNA聚合酶(2.5 U/μL),16.0 μL二次灭菌水。
反应程序参考试剂盒中所列出的反应程序并结合其他研究人员[17-21]扩增相近物种相同基因片段反应程序,若扩增不成功再稍降低退火温度及增加循环次数,最终扩增出所需片段。PCR引物信息见表1。
COI基因片段反应程序:95 ℃预变性5 min;95 ℃变性45 s,50 ℃退火45 s,72 ℃延伸30 s,循环35次;72 ℃延伸3 min。
线粒体12S基因序列反应程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环30次;72 ℃延伸5 min。
线粒体cytb基因序列反应程序:94 ℃预变性2 min;94 ℃变性30 s,48 ℃退火1 min,72 ℃延伸1.5 min,循环35次;72 ℃延伸10 min。
线粒体16S基因序列反应程序:94 ℃预变性3 min;94 ℃变性45 s,48 ℃退火50 s,72 ℃延伸1.5 min,循环35次;72 ℃延伸5 min。
28S基因片段的反应程序:94 ℃预变性2 min;94 ℃变性30 s,50 ℃退火45 s,72 ℃延伸90 s,循环30次;72 ℃延伸10 min。
核糖体ITS基因序列反应程序:94 ℃预变性2 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,循环35次;72 ℃延伸5 min。
2结果与分析
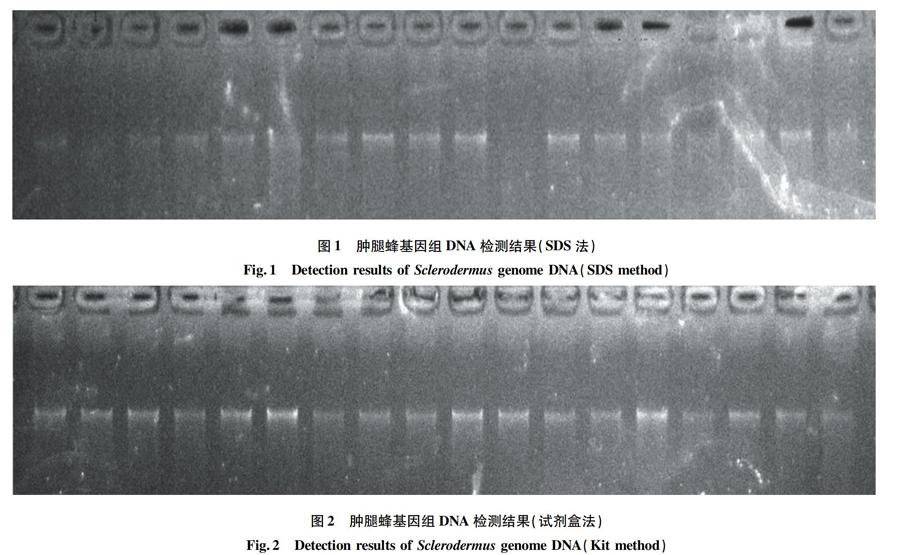
2.1SDS法提取的单头肿腿蜂基因组DNA结果SDS法提取肿腿蜂的基因组DNA检测结果见图1。由图1可知,并非所有的肿腿蜂个体基因组DNA都被成功地提取出来,且有个别肿腿蜂提取出的DNA有拖尾现象。
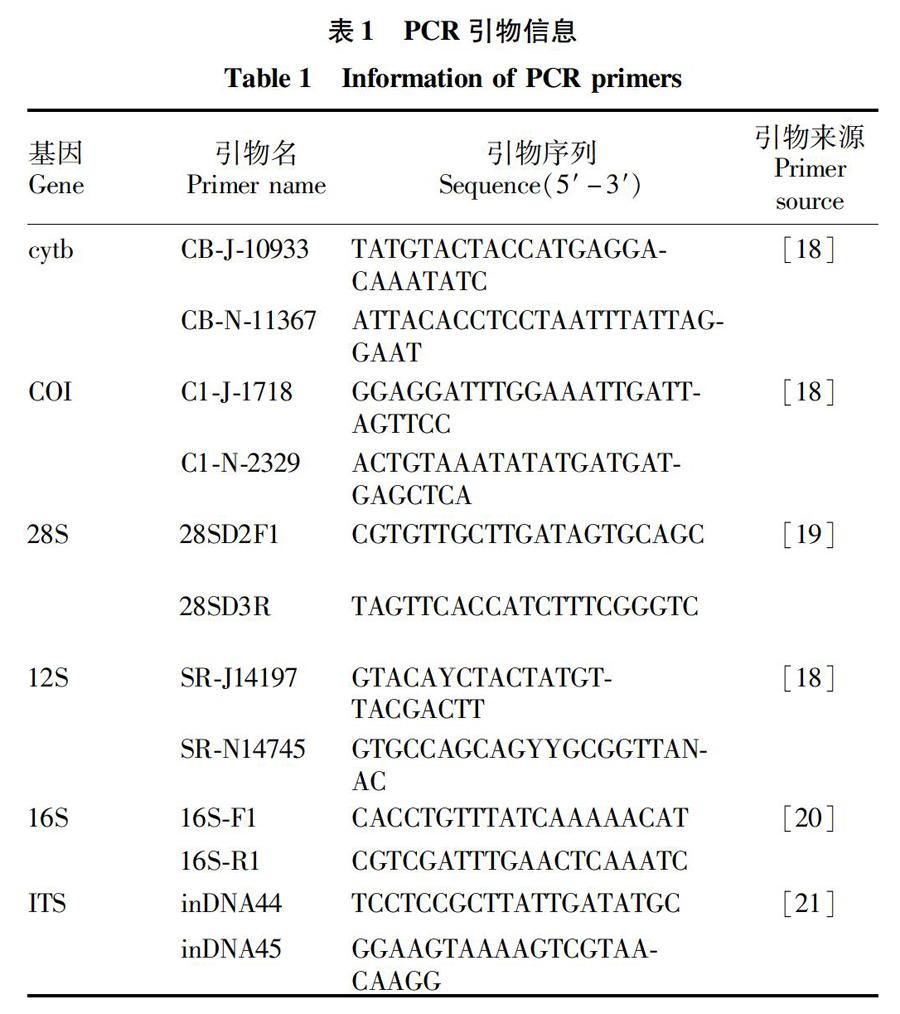
2.2试剂盒法提取的单头肿腿蜂基因组DNA结果试剂盒法提取肿腿蜂的基因组DNA检测结果见图2。由图2可知,所有的肿腿蜂个体基因组DNA都可被成功地提取出来,且无拖尾现象。试剂盒法最后溶解DNA的总量为75 μL,而SDS法仅有13 μL所得到的电泳图谱亮度与试剂盒法提取的DNA电泳图谱亮度相当,所以试剂盒法优于SDS法。该研究要扩增多个基因序列,且為首次扩增,故使用试剂盒提取出的基因组DNA为模板。
2.3PCR检测结果线粒体基因COI片段和28S核糖体基因片段的扩增结果见图3。由图3可知,线粒体基因COI片段大小为620 bp左右,28S核糖体基因片段大小为770 bp左右。其中泳道16未能成功扩增出目标产物,可能是由于基因组浓度较低所致。
8种肿腿蜂的部分个体核糖体间隔区ITS全序列的扩增结果见图4。由图4可知,每个个体均能扩增出2 000左右的目的条带。
3结论与讨论
该研究分别利用SDS法和试剂盒法提取肿腿蜂基因组DNA,结果表明,利用试剂盒法提取出的基因组DNA条带清晰,无拖尾现象。试剂盒法提取DNA的成功率为100%,明显高于SDS法,且最终获得的DNA量大,为SDS法的6~7倍,可满足多个基因的PCR扩增及测序分析,能够用于类似肿腿蜂这种小的昆虫。并且试剂盒法提取基因组DNA所用时间较短,省时省力。但试剂盒法价格较贵,仅测序分析单个基因时,可考虑用SDS方法。
该研究参考其他相近物种的基因扩增体系与程序,当扩增效果差时稍加改动反应程序,而保持反应体系不变,最终均能成功扩增出所需要的基因片段,这些基因片段序列增加了NCBI数据库的物种基因信息,便于其他学者进行比较。
参考文献
[1] 哈米提,唐桦,杨忠岐,等.四种寄生性天敌昆虫对山杨楔天牛的室内寄生效果[J].植物保护,2013(6):176-179.
[2] 黄琼,周祖基,杨伟,等.繁育川硬皮肿腿蜂替代寄主的筛选[J].昆虫学报,2005,48(3):375-379.
[3] 唐艳龙,杨忠岐,王小艺,等.释放花绒寄甲成虫和卵防治栗山天牛[J].林业科学,2012,48(7):186-191.
[4] 唐艳龙,王小艺,杨忠岐,等.白蜡吉丁肿腿蜂过冷却点和其防治栗山天牛幼龄幼虫研究[J].中国生物防治学报,2014(3):293-299.
[5] 王晓红,杨忠岐,王小艺,等.利用3种寄生性天敌防治锈色粒肩天牛[J].林业科学,2014(1):103-108.
[6] 王智勇,杨忠岐,张彦龙,等.利用4种肿腿蜂(膜翅目:肿腿蜂科)防治危害新疆野苹果林的苹小吉丁(鞘翅目:吉丁甲科)[J].林业科学,2014(8):97-101.
[7] 武辉,王小艺,李孟楼,等.白蜡吉丁肿腿蜂的生物学和生态学特性及繁殖技术研究[J].昆虫学报,2008(5):9-10.
[8] 姚万军,杨忠岐.利用管氏肿腿蜂防治光肩星天牛技术研究[J].环境昆虫学报,2008,30(2):127-134.
[9] 姚万军,杨忠岐.人工繁育管氏肿腿蜂的替代寄主研究[J].中国生物防治学报,2008(2):220-226.
[10] 杨伟,周祖基.我国天牛类害虫生物防治概况[J].四川林业科技,2001,22(3):49-53.
[11] 周祖基,杨伟,曾垂惠,等.川硬皮肿腿蜂生物学特性的研究(膜翅目:肿腿蜂科)[J].林业科学,1997,33(5):475-479.
[12] 展茂魁,杨忠岐,王小艺,等.肿腿蜂类寄生蜂室内控害效能评价:以松脊吉丁肿腿蜂为例[J].生态学报,2014(9):2411-2421.
[13] 王智勇.新疆野苹果林苹小吉丁生物防治技术研究[D].北京:中国林业科学研究院,2013.
[14] 安瑞生,谭声江,陈晓峰,等.小型昆虫DNA提取时匀浆方法的改进[J].昆虫知识,2002(4):311-312.
[15] 柳晓利,董辉,丛斌,等.单头赤眼蜂DNA提取方法比较及PCR反应体系优化[J].沈阳农业大学学报,2011(2):170-174.
[16] JIANG Y,YANG Z Q,WANG X Y,et al.Molecular identification of sibling species of sclerodermus(Hymenoptera:Bethylidae)that parasitize buprestid and cerambycid beetles by using partial sequences of mitochondrial DNA cytochrome oxidase subunit 1 and 28S ribosomal RNA gene [J].Plos,2015,10(3):119573.
[17] SIMON C,FRATI F,BECKENBACH A,et al.Evolution,weighting,and phylogenetic utility of mitochondrial gene sequences and a compilation of conserved PCR primers [J].Ann Entomol Soc Am,1994,87:651-701.
[18] JEREMY S A,NICHOLAS K B.Noncompetitive gametic isolation between sibling species of cricket:A hypothesized link between within-population incompatibility and reproductive isolation between species[J].Int J Evol Biol,2012,2012:593438.
[19] MARDULYN P,WHITFIELD J B.Phylogenetic signal in the COI,16S and 28S genes for inferring relationships among the genera of Microgastrinae(Hymenoptera;Braconidae):Evidence of a high diversification rate in this group of parasitoids [J].Mol Phylogenet Evol,1999,12:282-294.
[20] DOWTON M,AUSTIN A D.Molecular phylogeny of the insect order Hymenoptera:Apocritan relationships [J].Proceedings of the national academy of sciences of the USA,1994,91:9911-9915.
[21] VIOLAINE J,EDUARDO V,HENRY M,et al.Phylogeography of Chelonus insularis(Hymenoptera:Braconidae)and Campoletis sonorensis(Hymenoptera:Ichneumonidae),two primary neotropical parasitoids of the fall armyworm(Lepidoptera:Noctuidae)[J].Annals of the entomological society of america,2010,103(5):742-749.

