大曲中高产糖化酶菌株的筛选及环境耐受性分析
张琳,张也,王如福,霍乃蕊
(1.山西农业大学 食品科学与工程学院,山西 太谷 030801; 2.山西农业大学 动物科技学院,山西 太谷 030801)
大曲中高产糖化酶菌株的筛选及环境耐受性分析
张琳1,张也1,王如福1,霍乃蕊2*
(1.山西农业大学 食品科学与工程学院,山西 太谷 030801; 2.山西农业大学 动物科技学院,山西 太谷 030801)
[目的]分离适应酿造环境的高产糖化酶大曲土著菌株,用于大曲强化,以减少山西老陈醋酿造过程中的大曲用量,提高原料利用率并改善醋品品质。[方法]以酒精发酵24 h的酒醅为样品,用Martin培养基对大曲中的霉菌进行分离,分别以透明圈和酶活大小进行初筛和复筛获得高产糖化酶菌株,以生长量为指标进行环境耐受性分析。[结果]初筛获得的10株产糖化酶菌株中M2、M5、M6、M8、M15的产酶能力(U·mL-1)高于公认的糖化酶高产菌株AS3.4309(M0),依次为M6(3912.08(32.1)>M5(1413.16(13.92)>M8(1233.63(71.07)>M15(1152.47(21.96)>M2(923.86(22.42)>M0(828.88(22.23)。环境耐受性分析结果表明,5株霉菌均能耐受6%的乙醇浓度,在pH3.5生长良好,有的甚至能耐受pH2.0,在15~30 ℃范围内均可生长。[结论]获得的5株霉菌,不仅产糖化酶能力高于公认且应用广泛的AS3.4309,还能耐受山西老陈醋的整个酿造过程。
山西老陈醋; 酒醅; 高产糖化酶菌株; 环境耐受性
位于四大名醋之首的山西老陈醋,是以高粱为原料,麸皮、谷糠为辅料,经过前处理、加曲、糖化及酒精发酵,再经过固态醋酸发酵,淋醋熏醅陈酿等工艺酿造制成,有着悠久的历史和“绵酸香甜鲜”的独特风味[1]。酿造过程则是通过生产大曲,最大限度地富集对生产有益的微生物及其代谢产物,是多种微生物的混合体系。其中霉菌是主要的糖化菌,是前期发酵原料中淀粉等大分子物质降解的主要动力,大曲中的霉菌主要有根霉、曲霉、毛霉、青霉、头霉等,其中曲霉和根霉糖化力较强,对生产有积极作用[2]。霉菌的代谢产物中有一些风味物质的前体,对产品风味也有一定的贡献。由于特殊的酿造工艺及长期的酿造驯化筛选,能适应酿造环境的微生物更能发挥作用[3]。
生产大曲是传统工艺自然接种,生产周期长、糖化力低、质量不稳定,并且成本高[4],且山西老陈醋传统酿造工艺以曲代梁,大曲用量用到40%以上,有的高达70%。发酵结束后,醋糟中的残糖还很高,所以原料利用率有待提高。AS3.4309是公认的高产糖化酶菌株,已广泛应用于酿酒和酿醋工业。本研究旨在从酒醅中对大曲中的霉菌进行分离,并从中筛选产糖化酶能力高于AS3.4309的菌株,并对其环境耐受性进行分析。这些菌株的获得,用于大曲强化,有望提高原料利用率,减少山西老陈醋酿造过程中的大曲用量,降低生产成本,并缩短生产周期,提高产品质量,改善风味。此外,这些优良菌株还可用于其他发酵工业以及酶制剂的生产。
1 材料与方法
1.1菌种与培养基
M0为山西省某醋厂生产快曲的菌种AS3.4309。
Martin培养基[5]:孟加拉红(1 g·L-1)0.33 mL,琼脂粉1.2 g,葡萄糖7 g,蛋白胨0.5 g,KH2PO40.1 g,MgSO40.05 g,水100 mL,自然pH(6.4±0.2),112 ℃灭菌25 min。临用前再加入预先灭菌的2 mL 2%的去氧胆酸钠溶液和0.33 mL链霉素溶液(1万单位·mL-1)。
产淀粉酶筛选培养基[6]:可溶性淀粉10 g,酵母膏1.5 g,NaNO31.5 g,K2HPO41 g,NaCl 0.5 g,MgSO40.5 g,FeSO40.01 g,琼脂15 g,链霉素0.000 5 g,蒸馏水1 000 mL,pH 7,121 ℃灭菌20 min。
改良的摇瓶发酵培养基:生玉米高粱粉(质量比9∶1)40 g、KCl 0.5 g、MgSO40.5 g、FeSO40.01 g、水1 L,自然pH,121 ℃灭菌20 min,备用。
霉菌培养基,奥博星生物技术有限公司。
1.2原料与试剂
酒醅:山西省某醋厂酒精发酵24 h的酒醅。
DNS试剂;1 g·L-1的葡萄糖标准溶液;0.2%刚果红染液;1 mol·L-1NaCl溶液;5%醋酸溶液;0.1 mol·L-1和1 mol·L-1盐酸溶液。
1.3方法
1.3.1酒醅中霉菌的分离
取10 g酒精发酵24 h的酒醅于90 mL蒸馏水,振荡洗涤20 min,梯度稀释制成10-1~10-7的梯度菌悬液,涂布于Martin培养基平板,30 ℃培养3 d。选取有典型霉菌菌落特征的菌株纯化,保藏备用。
1.3.2产糖化酶菌株的筛选
初筛:将大曲中分离纯化得到的菌株点接于产淀粉酶筛选培养基,30 ℃培养3 d,2 mL卢戈氏碘液染色5 min,观察透明圈[7],初步筛选产糖化酶菌株。
复筛:将初筛得到的菌株接种于改良的摇瓶发酵培养基,30 ℃,150 r·min-1摇床发酵培养3 d,菌液4 000 r·min-1离心10 min,取上清即为粗酶液。适当稀释后,采用DNS法[8]测定糖化酶活力,即25 mL比色试管中各加入1 mL 1%淀粉溶液和1 mL柠檬酸缓冲溶液,混匀,40 ℃水浴3 min,加入1 mL适当稀释酶液,混匀,40 ℃水浴3 min,加入2 mL DNS试剂,混匀,沸水浴5 min,反应结束后立即冷却,定容至刻度,用分光光度计在540 nm处测OD值。具体按表1添加试剂并测定。并以葡萄糖为标准品,配制浓度为0、0.2、0.4、0.6、0.8、1.0、1.2 g·L-1的葡萄糖标准溶液[9],绘制标准曲线。
酶活力定义为:温度40 ℃、pH 5.6条件下,1 min产生1 μg葡萄糖所需要的酶量为1个酶活,用U·mL-1表示。
糖化酶活力=(OD-C)/(K×t×v)×1000×n
式中,C为葡萄糖溶液标准曲线截距;K为葡萄糖溶液标准曲线斜率;t为酶反应时间/min;v为所取粗酶液体积;n为粗酶液稀释倍数;1 000为1 mg转化为1 μg的因子。
1.3.3高产糖化酶菌株环境耐受性分析
耐乙醇能力分析:按4%、6%、8%(v/v)的比例调整霉菌培养基乙醇浓度,分别装50 mL培养基于150 mL三角瓶,分别取一环菌活化,按1%的接种量接种,30 ℃,150 r·min-1培养3 d,过滤并烘干至恒重,称菌体干重[10]。

表1 样品及葡萄糖标准溶液糖化酶活性测定方法
耐酸能力分析:霉菌培养基调整pH为1.5、2.0、2.5、3.0、3.5,分别装50 mL培养基于150 mL三角瓶中,各取一环菌种活化,按1%的接种量接种,30 ℃,150 r·min-1摇床培养3 d,称菌体干重。
不同温度的生长情况分析:取一环菌活化,按1%接种量接种于自然pH(6.0±0.2)的霉菌培养基,分别在温度为15 ℃、20 ℃、25 ℃、30 ℃条件下,150 r·min-1摇床培养3 d,称菌体干重。
2 结果与分析
2.1霉菌分离与产糖化酶菌株初筛
用Martin培养基分离,并通过菌落和个体形态初步鉴定,选出15株霉菌,编号为M1~M15。将其点接于产淀粉酶筛选培养基,结果如图1,观察透明圈筛选出10株产糖化酶菌株,即M1、M2、M3、M4、M5、M6、M7、M8、M14、M15,M0为对照菌株。

图1 所选产糖化酶菌株的透明圈平板Fig.1 Trasparent circle plate for amyloglucosidase producing strains
2.2糖化酶活力测定
根据不同浓度葡萄糖标准溶液的OD540值绘制标准曲线(图2),在该试验条件下,葡萄糖溶液浓度在0.2~1.2 g·L-1范围内有很好的线性相关性。
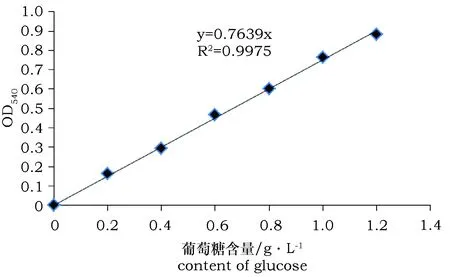
图2 DNS法制作的葡萄糖标准曲线Fig.2 Glucose standard curve made by DNS method

图3 分离菌株的糖化酶活力Fig.3 Glucoamylase activities of separent strains
测定筛选出的10株产糖化酶菌株的糖化酶活力,用软件SigmaPlot12.0作柱形图,并用软件Statistix8.1进行显著性分析,结果见图3。所选菌株均有一定的产糖化酶能力,与初筛结果一致。其中菌株M5、M6、M8和M15的产糖化酶能力显著高于对照菌株M0,菌株M6的产糖化酶能力远高于M0,约达到M0的4.7倍。菌株M2的产糖化酶能力也高于M0,但差异还未达到显著水平。因此,筛选出5株高产糖化酶菌株,其产酶能力大小依次为M6(3 912.08±32.11)U·mL-1>M5(1 413.16±13.92)U·mL-1>M8(1 233.63±71.07)U·mL-1>M15(1 152.47±21.96)U·mL-1>M2(923.86±22.42)U·mL-1>M0(828.88±22.23)U·mL-1。
2.3高产糖化酶菌株的环境耐受性分析
2.3.1耐乙醇能力分析
根据山西老陈醋传统工艺,通过测菌体干重,考察各高产糖化酶菌株对4%、6%、8%(v/v)乙醇浓度的耐受能力,并与对照菌株M0进行比较。由图4可知,M2、M5、M6、M8在乙醇浓度4%的培养基中,菌体干重均高于对照菌株M0,且生长良好。当乙醇浓度的升高至6%时,M0、M2、M5、M6和M15菌体干重减小,而M8的生长速率比反而有所升高。随着乙醇浓度升高至8%,M5停止生长,M2、M6、M15比乙醇浓度6%略有降低,M0仍保持在6%乙醇浓度生长水平,而M8菌体干重明显高于其他菌株,且生长良好。因此,分离得到的5株高产糖化酶均可耐受6%的乙醇浓度,除M5外的4株均对8%的乙醇浓度也具有很好的耐受能力,耐乙醇能力较强。

图4 高产糖化酶菌株在不同乙醇浓度培养基的菌体干重Fig.4 Dry weight of high glucoamylase-producing strains at different ethanol concentration
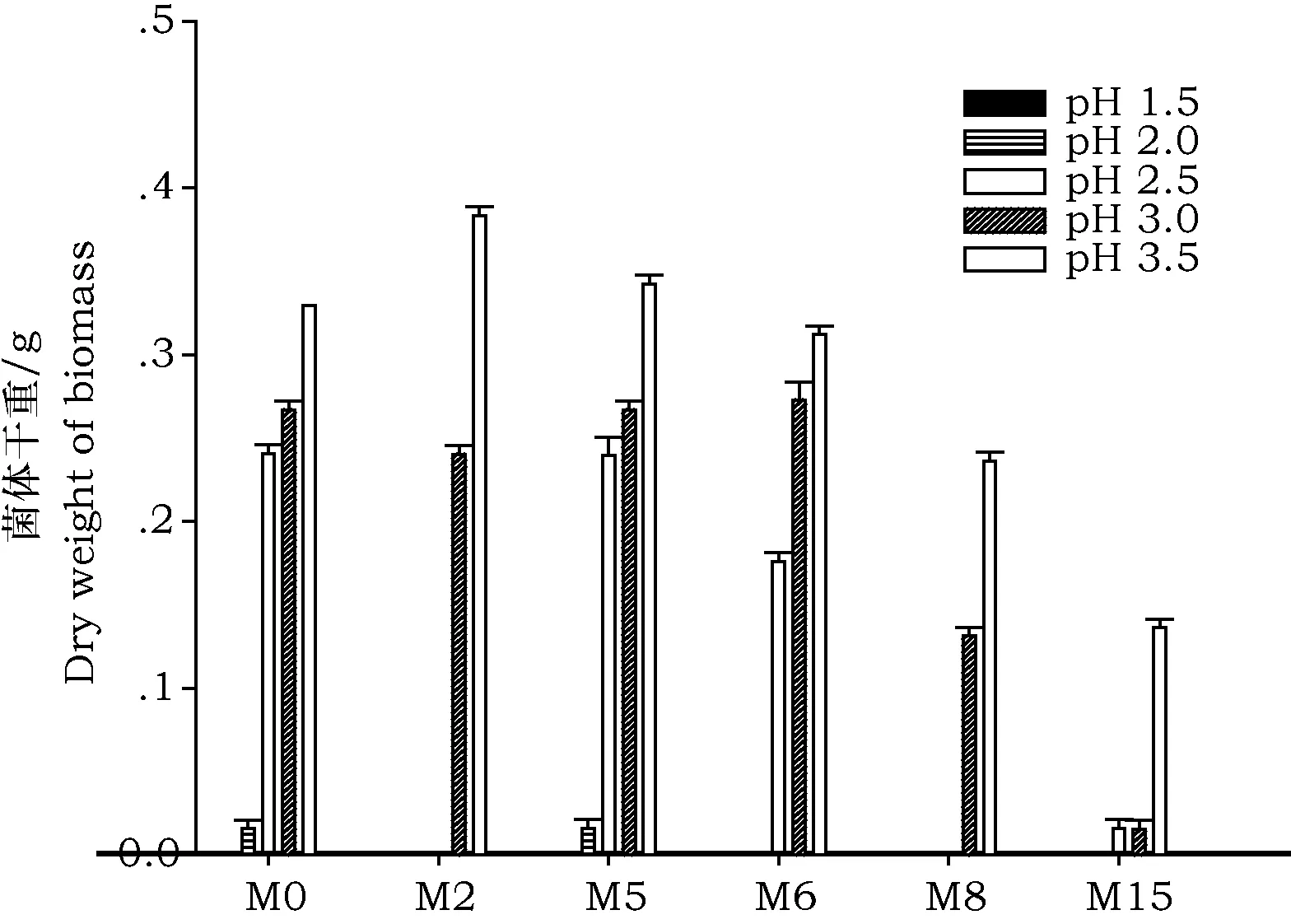
图5 高产糖化酶菌株在pH 1.5~3.5培养基中的菌体干重Fig.5 Dry weight of high glucoamylase-producing strains under pH 1.5~3.5
2.3.2耐酸能力分析
用不同pH培养基摇床培养各高产糖化酶菌株,考察pH 1.5~3.5范围内各菌株的生长情况。如图5所示,随着pH的降低,高产糖化酶菌株生长状况受到不同程度的抑制。pH 3.5时,各菌株均可较好的生长,并且M2和M5的生长速率高于M0。pH下降至3时,M15生长受到很大程度的抑制,而M0、M2、M5、M6、M8仍能较好的生长。pH2.5时,M2和M8停止生长,M15生长仍处于明显抑制状态,M0、M5和M6耐受能力较强,仍可以较好生长。pH 2.0时各菌株几乎不生长,pH 1.5所有菌株完全停止生长。因此,可知该5株均可以耐受pH 3.5的酸性环境,有的甚至可以耐受pH 2.0,耐酸能力较强。
2.3.3不同温度的生长状况分析
根据醋厂的实际生产条件,分别在15 ℃、20 ℃、25 ℃和30 ℃温度下培养高产糖化酶菌株,考察温度对菌株生长状况的影响。结果如图6所示,高产糖化酶菌株均在15 ℃生长良好,在此温度范围内菌体干重最大,尤其是对照菌株M0,15 ℃下生长速率远高于其他菌株,与自身相比,15 ℃下生长速率远高于其20~30 ℃,符合实际生产要求,入发酵池后就能迅速生长繁殖。M5与M0生长状况一致,培养温度上升至20 ℃,菌体干重下降,而25~30 ℃范围内菌体干重基本相同。M2、M6和M8在15~25 ℃菌体干重下降缓慢,M6在20 ℃反而略有升高,M8在15℃和25℃生长状况基本一致。培养温度升高至30 ℃时,所有菌株的菌体干重均有所下降,但菌体干重依然较高,生长状况良好。所以,筛选出的5株高产糖化酶菌株在15~25 ℃的实际生产温度范围内生长良好。
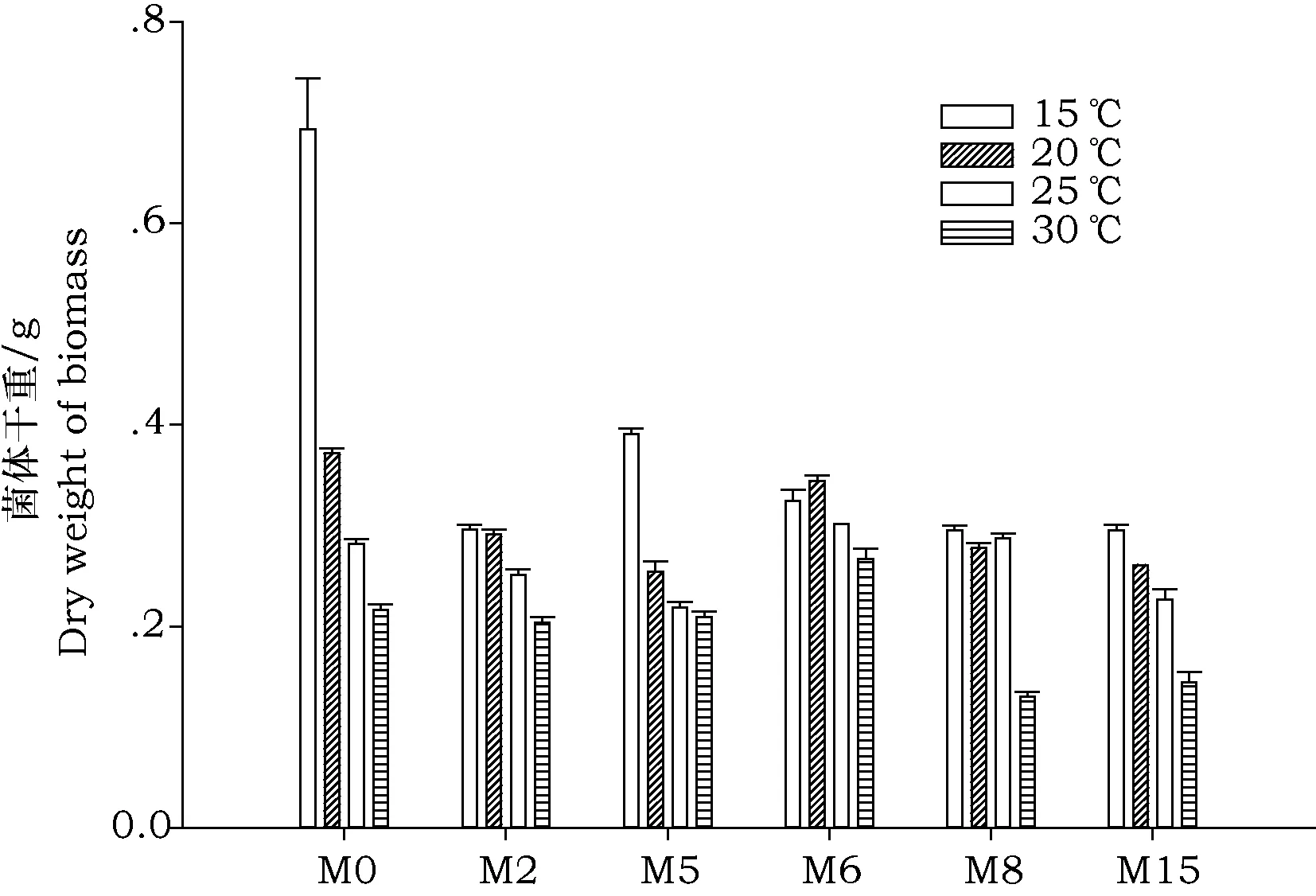
图6 高产糖化酶菌株在15~30 ℃培养的菌体干重Fig.6 Dry weight of high glucoamylase-producing strains at 15~30 ℃
总之,分离筛选出的5株高产糖化酶菌株M2、M5、M6、M8和M15均可耐受6%的乙醇浓度,在pH 3.5酸性环境中生长良好,有的甚至能耐受pH 2.0,在15~30 ℃范围内均可生长。
3 讨论与结论
老陈醋的发酵是多种微生物的混合作用,其中
霉菌是主要糖化菌[2],为得到高产糖化酶菌株,使用Martin培养基平板,分离筛选醋厂发酵24 h的酒醅中的霉菌,进而进行产糖化酶筛选,分离出5株霉菌产糖化酶能力高于公认且应用广泛的AS3.4309。
为了使分离出的菌株能更好的适应生产,根据老陈醋的实际生产条件,考察该菌株对生产环境的耐受能力。其中耐乙醇浓度以及耐酸能力是两个考察耐受力的重要指标,分离出的5株霉菌不仅产糖化酶能力高于公认且应用广泛的AS3.4309,并且耐6%的乙醇浓度和pH 3.5的酸性环境。
此外,实际生产发酵过程存在温度变化,因此温度也是一个考察的因素。根据醋厂生产工艺参数可知,酒精发酵室室温为20~25 ℃,而酒精发酵阶段的实测温度范围15~30 ℃,因此考察该温度范围高产糖化酶菌株的生长状况,发酵初期品温较低,分离得到5株高产糖化酶菌株均在15 ℃培养条件下生长速率最快,符合实际生产要求,菌种入发酵池即可快速生长。糖化发酵阶段产生一定的生物热,短时间使品温升高,可达25~30 ℃,为了适应生产,选择30 ℃下培养筛选高产糖化酶菌株,考察菌株在30 ℃下的产酶能力,作用于发酵中后期。并且考察5株高产菌株在15~30 ℃范围内的生长状况,其在该温度范围均可生长,可耐受老陈醋整个发酵过程。
本研究成功从酒精发酵24 h的酒醅中分离得到5株高产糖化酶且耐受性强的菌株,可适应山西老陈醋整个酿造环境,符合实际生产要求,为强化大曲,提高原料利用率奠定基础,也可用于其他发酵工业和酶制剂生产。
[1]严蕊,王晓云.山西老陈醋传统酿造工艺写实记录[J].食品工程,2015(2):55-59.
[2]邢钢,敖宗华,邓波.大曲中微生物研究和检测进展[J].酿酒技术,2012(12):86-89.
[3]徐佳,邱树毅,胡宝东,等.酱香型白酒酿造过程中霉菌的功能性研究[J].酿酒,2015,42(5):32-37.
[4]武晋海,郝林,白瑞华.山西老陈醋大曲微生物生态分布[J].山西农业大学学学报(自然科学版),2004,24(3):279-282.
[5]杨叶,王萌,马晓燕,等.感染瓜实蝇的曲霉菌及其生物学特性[J].菌物学报,2016,35(1):20-28.
[6]刘杰雄,陈号,陆雯,等.淀粉酶高产菌株的筛选及其酶活的测定[J]. 食品工程, 2010 (1): 45-47.
[7]鲁珍,魏姜勉,谌馥佳,等.高温大曲中高产α-淀粉酶菌株分离鉴定及其产酶性能研究[J].农业研究与应用,2016(2):5-11.
[8]邹艳玲,徐美娟,饶志明.耐热β-淀粉酶高产菌株的筛选及其产酶条件优化[J].应用与环境生物学报,2013,19(5):845-850.
[9]李环,陆佳平,王登进.DNS法测定山楂片中还原糖含量的研究[J].食品工业科技,2013,34(18):75-77.
[10]张李阳. 固体发酵红曲霉菌生物量测定方法的研究[J].南京晓庄学院学报,2002,18(4):6-8.
(编辑:马荣博)
Isolation of high amyloglucosidase-producing strains from Daqu and their environmental tolerance abilities
Zhang Lin1, Zhang Ye1, Wang Rufu1, Huo Nairui2*
(1.CollegeofFoodScience,ShanxiAgriculturalUniversity,Taigu030801,China, 2.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective] Aboriginal mould strains with high ability to produce amyloglucosidase isolated from Daqu can be reinforced into Daqu again to lower Daqu consumption and increase the utilization rate of the material during vinegar fermentation and and improve the product quality. [Methods]The alcoholic fermenting matrix fermented for 24 hours was treated and cultured on Martin medium for mould isolation. Preliminary and second-time screening work was carried out according to the size of the transparent circle on the medium and the measured enzymatic activity. Environmental tolerant ability were evaluated through growth mass.[Results] Preliminary screening obtained 10 mould strains that can produce amyloglucosidase. The results of enzyme activity suggested that M2、M5、M6、M8 and M15 were superior to the well-known high amyloglucosidase producing strain AS3.4309(M0). Their enzyme activity(U·mL-1) were M6 (3912.08(32.11)> M5 (1413.16 ( 13.92)>M8(1233.63(71.07)>M15(1152.47(21.96)>M2(923.86(22.421)>M0(828.88(22.23). Tolerant ability analysis showed that all the 5 strains were tolerant to 6% ethanol concentration, grew well at pH3.5,some even survived pH2.0, could grow at 15~30 ℃.[Conclusion] The obtained 5 mould strains has higher ability to produce amyloglucosidase than the well-known and widely used AS3.4309 and can survive the wholeprocess of Shanxi aged vinegar fermentation.
Shanxi Aged Vinegar; Fermented matrix; High glucoamylase-producing strains; Environmental tolerance
2016-06-11
2016-07-27
张琳(1991-),女(汉),山西闻喜人,硕士研究生,研究方向:食品生物技术
霍乃蕊,教授,博士。Tel:13935452616; E-mail: tgnrhuo@163.com
山西省科技重点研发(指南)项目(2015-TN-10-2);863计划项目(2011AA1009040102)
Q939.97
A
1671-8151(2016)10-0740-05

