玻璃化冷冻的卵母细胞在卵母细胞捐赠中的应用
林玉婷,马翔,蔡令波,曾桥,吴畏,刁飞扬,刘嘉茵,千日成
玻璃化冷冻的卵母细胞在卵母细胞捐赠中的应用
林玉婷,马翔,蔡令波,曾桥,吴畏,刁飞扬,刘嘉茵,千日成
目的:分析玻璃化冷冻的卵母细胞在供卵周期中的临床结局,以期为卵母细胞捐献的临床应用提供参考。方法:回顾性分析2006年2月—2014年10月南京医科大学第一附属医院临床生殖医学中心216个供卵周期的玻璃化冷冻的卵母细胞,比较解冻后的复苏率、行体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)的正常受精率、累计临床妊娠率、种植率和累计活产率等临床结局。结果:解冻玻璃化冻存的卵母细胞的复苏率为82.0%(899/1 097),二原核(2PN)受精率76.9%(691/899)。在216个周期中,胚胎种植率为21.4%(84/393),累计临床妊娠率为33.3%(72/216),累计活产率达27.3%(59/216)。每解冻1枚卵母细胞获得活产儿的概率为6.5%(71/1 097)。结论:卵母细胞玻璃化冻融技术在卵母细胞捐赠的临床应用上可以获得较好的临床结局。
卵母细胞;低温保存;受精,体外;胚胎移植;妊娠结局
【Abstract】Objective:To analyse the clinical outcomes of the ovum donation cycles conducted with the vitrified oocytes,so as to provide the predictive information for the clinical application of this technique.M ethods: The clinical outcomes of 216 ovum donation cycles,which conducted with the vitrified-thawed oocytes undergoing IVF-ET in our reproductive center from February 2006 to October 2014,were retrospective analyzed.The main outcome parameterswere the survival rate of the freezen-thawed oocytes,the normal fertilization(2PN)rate of in vitro fertilization,the cumulative clinical pregnancy rate,the implantation rate and the cumulative live birth rate. Results:The survival rate of the freezen-thawed oocytes was 82.0%(899/1 097).The normal fertilization(2PN)rate was 76.9%(691/899).The rates of implantation,cumulative clinical pregnancy and live birth were 21.4%(84/393),33.3%(72/216)and 27.3%(59/216),respectively.The oocyte-to-baby rate was 6.5%(71/1 097).Conclusions: There is relatively good clinical outcomes of the freezen-thawed oocyteswhen applied in the ovum donation.
【Keywords】Oocytes;Cryopreservation;Fertilization in vitro;Embryo transfer;Pregnancyoutcome
(JInt Reprod Health/Fam Plan,2016,35:362-364)
自1986年世界上第1例冻卵试管婴儿诞生以来[1],人卵母细胞冷冻保存技术取得了极大进步。截止2008年文献报道的全球出生的冻卵试管婴儿有900多例[2]。目前,玻璃化冷冻技术已成为冷冻保存卵母细胞的金标准[3]。卵母细胞的捐献为卵巢功能早衰、卵巢功能不全或遗传疾病妇女获得赠卵诞生新生命带来了希望[1]。南京医科大学第一附属医院生殖中心在国内率先开展了卵母细胞玻璃化冷冻-捐赠分享技术[4-5]。本研究回顾性分析了该技术开展之初的216个供卵周期的临床数据,以期为今后更好地改善供卵周期的临床结局提供参考依据。
1 对象与方法
1.1研究对象选择2006年2月—2014年10月本院临床生殖医学中心的216个供卵周期。供卵来源为在本院临床生殖医学中心接受体外受精-胚胎移植/胞浆内单精子注射(IVFET/ICSI)治疗、年龄≤35岁、获卵数≥15~20枚并获得活产儿女性的剩余冷冻卵子。卵母细胞受者平均年龄(38.3±7.0)岁,不孕时间中位数和四分位数为5(3,9)年,平均体质量指数(BMI)为(22.2±2.6)kg/m2。临床资料由本院不孕不育数据库系统(CCRM)收录。受者不孕原因包括卵巢功能减退、染色体异常、子宫内膜异位症等。根据解冻卵母细胞数目的不同,对216个供卵周期进行分组(解冻卵母细胞数目≤4枚、5~6枚、7~8枚、≥9枚),比较每组供卵周期的临床结局,包括累计临床妊娠率、种植率和累计活产率。
1.2方法
1.2.1玻璃化冷冻方法成熟的卵母细胞用玻璃化冷冻试剂盒(Jieying Laboratory,Canada)冷冻。首先,在室温下将成熟卵母细胞置于1号液(7.5%乙二醇+7.5%丙二醇)平衡10min,然后转入2号液(15%乙二醇+15%丙二醇+0.5mol/L蔗糖)2 min,再装载于JY冷冻载杆(Jieying Laboratory,Canada)上,最后投入液氮中保存。
1.2.2冻卵复苏方法卵母细胞复苏前,将复苏液(Jieying Laboratory,Canada)升温至室温,将载有卵母细胞的冷冻载杆从液氮中取出,前端置于T1(含1mol/L蔗糖)液中使卵母细胞脱落至液体中,平衡1~3min后,将卵母细胞依次转移至T2液(含0.5mol/L蔗糖)、T3液(含0.25mol/L蔗糖)、T4液(不含蔗糖)中各3min,最后将卵母细胞转移至受精液中,在37℃、6%CO2下培养2 h后行ICSI受精。
1.2.3复苏后胚胎移植时机自然周期卵泡监测,排卵日复苏冷冻卵母细胞并行ICSI受精,第3天行ET。排卵障碍的患者采用人工周期准备子宫内膜,自月经周期的第3天开始口服戊酸雌二醇或17β-雌二醇4mg/d,定期B超监测子宫内膜变化,调整雌激素用量,内膜厚度达8mm时开始给予黄体支持。次日复苏冷冻卵母细胞并行ICSI受精,第3天行胚胎移植,移植后继续使用黄体支持。
1.2.4临床结局判断和计算移植后第14天测血人绒毛膜促性腺激素β亚单位(β-hCG)>5.3 IU/L,移植28 d后超声检查见孕囊及胎心搏动确定为临床妊娠,随访到婴儿出生为活产。临床指标的计算如下。卵母细胞复苏率=解冻后存活卵母细胞数/解冻卵母细胞总数×100%;二原核(2PN)受精率=2PN卵子数/ICSI卵子数×100%;累计临床妊娠率=临床妊娠周期数/供卵周期数×100%;种植率=超声见孕囊数/移植胚胎数× 100%;流产率=流产周期数/临床妊娠周期数×100%;累计活产率=活产周期数/供卵周期数×100%。
1.3统计学方法应用SPSS 17.0软件进行数据分析,率的比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1卵母细胞冻融结果和胚胎移植后的临床结局共解冻玻璃化冻存的卵母细胞1 097枚,复苏率82.0%(899/1 097),2PN受精率76.9%(691/899)。216个供卵周期中,有194个周期有可移植胚胎,占89.8%,平均移植胚胎(1.8±0.6)个,累计临床妊娠率为33.3%(72/216),种植率为21.4%(84/393),流产率为12.5%(9/72),累计活产率为27.3%(59/216)。
59例患者共分娩71个活产儿,随访均未发现新生儿出生缺陷。每解冻1枚卵母细胞获得活产儿的概率为6.5%(71/1 097),即获得1个活产儿所需冷冻卵母细胞数目约为15.5(1 097/71)个。
2.2解冻不同数目卵母细胞的各供卵周期的临床结局比较本研究结果显示,4组的累计临床妊娠率、种植率和累计活产率的差异均无统计学意义(P>0.05),见表1。
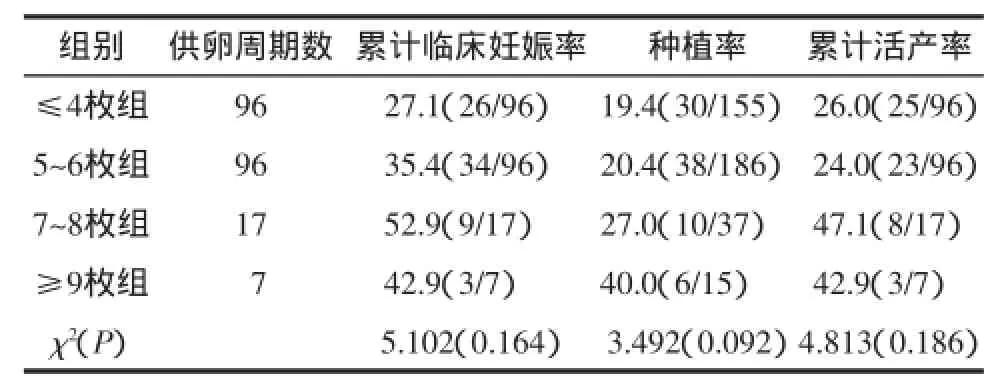
表1 解冻不同数目卵母细胞的各供卵周期的临床结局比较%(n/n)
3 讨论
目前,人卵母细胞冷冻技术主要有慢速程序化冷冻和玻璃化冷冻2种。研究表明,玻璃化冷冻技术优于慢速程序化冷冻技术,采用玻璃化冷冻的卵母细胞复苏成活率更高[6]。玻璃化冻融卵母细胞,能在减数分裂中使纺锤体更快恢复[7],对卵母细胞线粒体DNA(mtDNA)缺失及拷贝数影响较小,可较好地实现保存卵母细胞的目的[8]。2013年美国生殖学会颁布的指南中表明,成熟卵母细胞的冷冻已不再局限于实验阶段,正式将卵母细胞冻融技术纳入人类辅助生殖技术的临床应用[3]。
本研究的216个供卵周期共解冻玻璃化冻存的卵母细胞1 097枚。其中22个周期无可移植胚胎,周期取消率为10.1%,平均移植胚胎(1.8±0.6)个,最终成功获得71例活产儿。相关研究报道的卵母细胞复苏率在70%~88%[9],复苏后行ICSI的正常受精率为71%~79%[10-14],移植后种植率为17.1%~20.4%[12-13],每解冻1枚卵母细胞获得活产儿的概率为6.5%[14],均与本研究结果相似。
本研究根据解冻卵母细胞数目的不同,对216个供卵周期进行分组,比较每组供卵周期的临床结局,4组的临床结局差异均无统计学意义。西班牙的一项研究报道显示,解冻卵子数目在25个以内,随着解冻数目的增加,累计活产率升高的趋势越快;而解冻卵子数目在25~40个,累计活产率升高的趋势较慢,直至接近于100%[14]。由于我国供卵来源限制严格,卵源稀缺,本院临床生殖医学中心的每个供卵周期解冻卵子数目主要集中在6个以内,所以比较解冻不同卵子数目的临床结局还需要更多的样本。
本研究的卵子来源均为在本院临床生殖医学中心接受IVF/ICSI治疗、年龄≤35岁、获卵数≥15~20枚并已成功分娩的女性的剩余冷冻卵子。在目前供卵来源困难的情况下,对IVF-ET获卵较多的患者进行冷冻部分卵母细胞,待分娩后进行冷冻卵子捐赠的方法是可行的,且累计活产率达27.3%,临床结局尚可;卵子来源均为较年轻且有成功分娩史的女性,既保障了供受双方的利益,又避免多余的卵子因形成了剩余胚胎无法捐献而造成的资源浪费。
本研究对采用卵母细胞玻璃化冻融技术的供卵周期中分娩的59例新生儿进行随访,并未发现新生儿出生缺陷。2009年,Noyes等[2]统计了从1986—2008年全球出生的936例“冻卵宝宝”健康情况,结果发现,通过冻卵出生的新生儿出生缺陷率仅为1.3%(12例),与美国自然出生的新生儿相比,冻卵并未增加新生儿出生缺陷的风险,与本研究随访结果一致。
随着卵母细胞玻璃化冻融技术的应用和发展,卵母细胞的冷冻复苏率较以前有了明显的提高,但是冷冻损伤不可避免,又因卵母细胞的特殊性,与胚胎冷冻相比冷冻复苏率仍较低,面对我国卵源紧张的局面,卵母细胞冷冻技术的进一步改进显得尤为重要。另外该技术临床应用时间较短,对子代远期的影响仍需持续关注。
[1]Chen C.Pregnancy after human oocyte cryopreservation[J]. Lancet,1986,1(8486):884-886.
[2]Noyes N,Porcu E,Borini A.Over 900 oocyte cryopreservation babies born with no apparent increase in congenital anomalies[J]. Reprod Biomed Online,2009,18(6):769-776.
[3]Practice Committees of American Society for Reproductive Medicine,Society for Assisted Reproductive Technology.Mature oocyte cryopreservation:a guideline[J].Fertil Steril,2013,99(1):37-43.
[4]Cai LB,Qian XQ,Wang W,et al.Oocyte vitrification technology hasmade egg-sharing donation easier in China[J].Reprod Biomed Online,2012,24(2):186-190.
[5]王媁,严正杰,蔡令波,等.卵子冷冻技术的临床应用[J].中华医学杂志,2008,88(39):2755-2758.
[6]Smith GD,Serafini PC,Fioravanti J,et al.Prospective randomized comparison of human oocyte cryopreservation with slow-rate freezing orvitrification[J].Fertil Steril,2010,94(6):2088-2095.
[7]CiottiPM,Porcu E,Notarangelo L,etal.Meiotic spindle recovery is faster in vitrification of human oocytes compared to slow freezing[J].Fertil Steril,2009,91(6):2399-2407.
[8]蔡学泳,彭南妮,刁瑞英,等.冷冻保存对人类卵母细胞线粒体DNA缺失和能量代谢的影响[J].国际生殖健康/计划生育杂志,2015,34(5):357-360,363.
[9]Avraham S,Machtinger R,Cahan T,et al.What is the quality of information on social oocyte cryopreservation provided bywebsites of Society for Assisted Reproductive Technology member fertility clinics?[J].Fertil Steril,2014,101(1):222-226.
[10]Parmegiani L,Cognigni GE,Bernardi S,etal.Efficiency of aseptic open vitrification and hermetical cryostorage of human oocytes[J]. Reprod Biomed Online,2011,23(4):505-512.
[11]Cobo A,Kuwayama M,Pérez S,et al.Comparison of concomitant outcome achieved with fresh and cryopreserved donor oocytes vitrified by the Cryotop method[J].Fertil Steril,2008,89(6):1657-1664.
[12]Cobo A,Meseguer M,RemohíJ,et al.Use of cryo-banked oocytes in an ovum donation programme:a prospective,randomized,controlled,clinical trial[J].Hum Reprod,2010,25(9):2239-2246.
[13]Rienzi L,Romano S,Albricci L,etal.Embryo developmentof fresh′versus′vitrified metaphase II oocytes after ICSI:a prospective randomized sibling-oocyte study[J].Hum Reprod,2010,25(1):66-73.
[14]Cobo A,Garrido N,Pellicer A,etal.Six years′experience in ovum donation using vitrified oocytes:report of cumulative outcomes,impactof storage time,and development of a predictivemodel for oocyte survival rate[J].Fertil Steril,2015,104(6):1426-1434. e1-e8.
Application of Human Vitrified Oocytes in Ovum Donation
LINYu-ting,MAXiang,CAILing-bo,ZENG Qiao,WUWei,DIAOFei-yang,LIUJia-yin,CHIANRi-cheng.
TheClinicalCenterforReproductiveMedicine,The State Key Laboratory of Reproductive Medicine,The First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China
Corresponding author:CHIAN Ri-cheng,E-mail:rchian@126.com
2016-06-20)
[本文编辑秦娟]
国家自然科学基金(81270746、81200444);江苏省妇幼保健重点学科(FXK201221)
210029南京医科大学第一附属医院生殖医学科(林玉婷,马翔,蔡令波,曾桥,吴畏,刁飞扬,刘嘉茵,千日成);南京医科大学生殖医学国家重点实验室(刘嘉茵,千日成)
千日成,E-mail:rchian@126.com

