添加秸秆生物质炭对酸化茶园土壤N2O和CO2排放的短期影响研究
何志龙,夏文建,周维,田亚男,柳维扬,林杉*
添加秸秆生物质炭对酸化茶园土壤N2O和CO2排放的短期影响研究
何志龙1,夏文建2,周维1,田亚男1,柳维扬3,林杉1*
1. 华中农业大学资源与环境学院//农业部长江中下游耕地保育重点实验室,湖北 武汉 430070;2. 江西省农业科学院土壤肥料与资源环境研究所,江西 南昌 330200;3. 塔里木大学植物科学学院,新疆 阿拉尔 843300
为明确秸秆生物质炭对酸化茶园土壤改良及温室气体排放的影响,采用室内培养试验方法,研究了小麦秸秆生物质炭添加(对照CK:0 g·kg-1;低生物质炭B1:8 g·kg-1;中生物质炭B2:24 g·kg-1;高生物质炭B3:48 g·kg-1)对茶园土壤pH值和温室气体排放的影响。结果表明,与对照组CK相比,添加生物质炭显著抑制了酸性茶园土壤N2O的排放(P=0.000),但抑制效应并未随生物质炭添加量的增加而加强,培养期间各处理N2O累积排放量分别为:CK 2.366 mg·kg-1,B1 0.444 mg·kg-1,B2 0.142 mg·kg-1,B3 0.207 mg·kg-1。低生物质炭(8 g·kg-1)和中生物质炭(24 g·kg-1)处理的综合增温潜势(GWP)分别比对照组CK降低了33.45%和25.77%,而高生物质炭处理(48 g·kg-1)与对照处理差异不显著。这表明施用中低量生物质炭更有利于茶园土壤的固碳减排。此外,生物质炭显著提高了酸化茶园土壤pH值,生物质炭添加比例越大,pH值越高,故施用作物秸秆生物质炭有利于酸化土壤改良。相关性分析结果表明,土壤N2O排放与pH值之间呈显著负相关关系,土壤pH值的升高可能是引起N2O排放量降低的重要原因。
酸化茶园;小麦秸秆生物质炭;pH值;N2O排放
引用格式:何志龙, 夏文建, 周维, 田亚男, 柳维扬, 林杉. 添加秸秆生物质炭对酸化茶园土壤N2O和CO2排放的短期影响研究[J]. 生态环境学报, 2016, 25(7): 1230-1236.
HE Zhilong, XIA Wenjian, ZHOU Wei, TIAN Yanan, LIU Weiyang, LIN Shan. Effects of Wheat-straw Derived Biochar on Acidified Tea Garden Soil N2O and CO2Em ission in Short-term Laboratory Experiments [J]. Ecology and Environmental Sciences, 2016,25(7): 1230-1236.
生物质炭是指有机物料在缺氧或厌氧环境中经高温热解产生的一种富碳难溶性固态物质(IBI Biochar Standards,2012)。其作为一种土壤改良剂和固碳物质受到国内外科技工作者的广泛关注(何绪生等,2011)。有很多研究表明,在土壤中施用生物质炭,可促进土壤有机碳的固定,增强土壤肥力,降低土壤的酸度,减缓农业面源污染,减少温室气体排放(Asai et al.,2009;Zw ieten et al.,2013;Liu et al.,2011)。但也有不少研究表明添加生物质炭后促进了土壤温室气体的排放(Bruun et al.,2011;Jujjuri et al.,2014)。不同研究者关于生物质炭对土壤N2O和CO2排放作用的研究结果差异较大。一方面,这是由于生物质炭的类型和施用量的不同造成的(Cayuela et al.,2014)10;另一方面,不同实验所用的土壤性质存在差异,这也在一定程度上影响了生物质炭对温室气体排放的作用效果(Ling et al.,2013)。
茶园是我国南方红壤丘陵区主要土地利用类型之一,而红壤区茶园土壤普遍存在酸化现象(张永利等,2011;杨向德等,2015)。茶园土壤pH值较低,不仅影响了茶叶的产量和品质,还促进了土壤N2O的排放(韩文炎,2006)。小麦秸秆是农业生产中常见的生物质材料,把小麦秸秆制成生物质炭添加到土壤中后,不仅能缓解茶园土壤酸化的问题,还能促进资源的可持续利用并减少农田土壤温室气体的排放(刘玉学等,2013)。目前,关于生物质炭施用的研究多集中在其对农业土壤改良方面(Sui et al.,2016;Case et al.,2014;Garland et al.,2011;Suddick et al.,2013),但关于生物质炭对酸化茶园土壤改良及温室气体排放影响的研究较少。为此,本研究利用室内培养试验,通过向茶园土壤中添加不同量的生物质炭,研究生物质炭对酸性茶园土壤pH值和温室气体排放的影响,试图寻找适宜的生物质炭添加比例,以期为酸性土壤改良及温室气体减排提供理论依据。
1 材料与方法
1.1土壤和生物质炭
供试土壤取自湖北省咸宁市(29°02′~30°18′N,133°31′~144°58′E)贺胜桥镇茶园,植茶年限10年左右。当地年平均气温16.8 ℃,年平均降水量1577.4 mm,气候温和,降水充沛,属于中亚热带向北亚热带过渡的气候区,呈较明显的半湿性季风气候特点。按照对角线多点混合采集茶园0~20 cm表层土壤,同时取环刀土用于测土壤容重。将土样带回实验室,剔除可见有机物残体和根系后,取部分鲜样用于测定土壤铵态氮和硝态氮等指标,其余土壤风干后研磨过2 mm筛,用于室内培养试验。供试土壤基本理化性质为:有机碳9.78 g·kg-1,总氮1.10 g·kg-1,容重1.31 g·cm-3,pH 4.50。
生物质炭由小麦秸秆在缺氧环境中600 ℃热裂解制备而成,过2 mm筛。生物质炭基本理化性质:总氮11.801 g·kg-1,有机碳415.270 g·kg-1,铵态氮35.504 mg·kg-1,硝态氮37.011 mg·kg-1,pH 8.63。
1.2试验设计
室内培养试验于2015年3月份进行。试验共设置4个处理:(1)不施生物质炭(CK);(2)低生物质炭(B1,8 g·kg-1);(3)中生物质炭(B2,24 g·kg-1);(4)高生物质炭(B3,48 g·kg-1),分别相当于田间施用量0、18、54、108 t·hm-2。试验培养温度设置为(25±1)℃,土壤水分含量为65%土壤孔隙含水量(WFPS)。
称500 g风干过筛土样,分别置于一组规格为1000 m L培养瓶中,并调节土壤含水量至40% WFPS后置于恒温培养箱预培养7 d,以激活土壤微生物和消除干湿效应(Dick et al.,2001)。预培养结束后生物质炭按照设计比例与活化土壤充分混合,调节土壤含水量至65% WFPS。用中间带有两个小孔的硅橡胶塞塞住瓶口,其中一孔中插入套有三通阀软管的玻璃管,作为气体取样口和交换口;另一孔中插入绑有气球的玻璃管,用于平衡采气样时培养瓶中的压强。检查密封性后将培养瓶放入恒温培养箱中培养22 d,每隔2 d用称重法补充因蒸发损失的水分,以保持土壤含水量的恒定。每个处理设6个重复,3个用于温室气体浓度的测定,3个用于土壤NH4+-N、NO3--N和pH值的动态变化分析,并分别于第0、5、10、16天采集土样,最大程度上保证称样后培养瓶中剩余土壤质量相当。
分别于培养的第0.5、1、2、3、4、5、6、8、 11、16、22天采集气体样品。采样前,反复抽气并通入大气使瓶内气体浓度与瓶外大气浓度平衡,采集培养瓶上部空间气体样本,作为初始气体浓度,记录采样时间,密闭静置培养2 h后,反复推拉注射器3次以混匀培养瓶中气体,然后立即抽气至预真空的集气瓶中,再次记录采样时间。
1.3气体及土壤样品分析
N2O和CO2浓度由气相色谱仪(Agilent 7890A)测定;硝态氮、铵态氮采用1 mol·L-1KCl振荡浸提1 h,过滤,德国Seal Analytical AA3流动分析仪测定;土壤pH采用1∶2.5土水比悬液,酸度计电位法测定;容重采用环刀法(鲍士旦,2000)测定。
1.4数据计算与统计
N2O和CO2排放通量按下式计算:
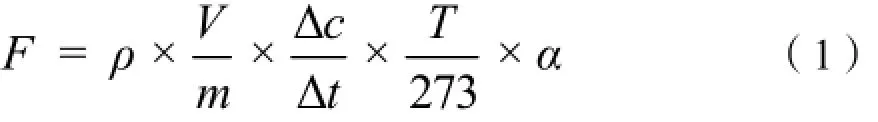
式中,F为N2O和CO2排放通量(μg·kg-1·h-1或mg·kg-1·h-1),正值为排放,负值为吸收;ρ为标准状况下气体的密度;V是培养瓶上部有效空间体积(L);m为土样干质量(g);△c/△t为在一特定时间内的气体浓度变化速率;T为绝对温度;α为N2O换算为N(28/44)、CO2换算为C(12/44)的转换因子。
N2O和CO2累积排放量按下式计算:
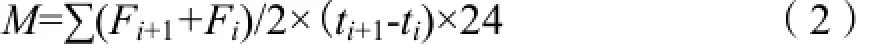
式中,M为土壤气体累计排放量(μg·kg-1或mg·kg-1);F为气体排放通量(μg·kg-1·h-1或mg·kg-1·h-1),i为采样次数,t为采样时间(d)。
全球增温潜势(global warm ing potential,GWP)是一个用来表征温室气体对全球温室效应总影响的指标,该指标以给定时间尺度的CO2质量当量计(CO2-eq)。对于100 a时间尺度的气候变化,CO2、 CH4和N2O气体的GWP分别为1、21和310(IPCC, 2013)。100 a时间尺度的CO2、CH4和N2O综合增温潜势按下式计算:
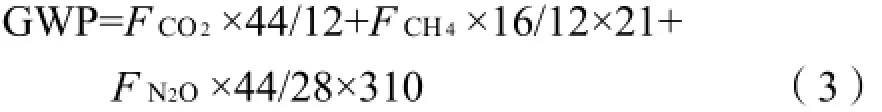
式中,GWP单位为mg·kg-1(以CO2-eq计);F2CO为CO2的排放量(mg·kg-1);F4CH为CH4的排放量(mg·kg-1);F ON2为N2O的排放量(mg·kg-1)。
所有试验结果均以3次重复的平均值±标准误来表示,试验数据用Excel软件进行处理后,使用SPSS 16.0软件进行相关分析,采用Pearson方法分析生物质炭添加量与N2O、CO2排放通量,以及N2O排放通量与NH4+-N、土壤pH之间的相关性,显著性水平P=0.05,并用Origin 8.0软件进行图形绘制。
2 结果与分析
2.1土壤矿质态氮含量和氮素矿化量变化
培养期间,添加小麦秸秆生物质炭后,土壤中NO3--N含量均逐渐提高(图1)。培养末期添加生物质炭处理(B1、B2和B3处理)的NO3--N含量均显著高于对照处理(CK),不同生物质炭处理之间NO3--N含量无显著差异。对照处理土壤NO3--N含量于培养的第5天达到峰值,之后逐渐下降,并在试验结束时达到最低值且低于初始含量。不同处理下土壤NH4+-N含量在培养期间均呈逐渐下降趋势,且随着生物质炭添加量的增加土壤中NH4+-N含量下降幅度逐渐增大(图1)。试验结束时对照组CK,处理组B1、B2和B3土壤中NH4+-N含量较初始值分别减少了10.278%,51.650%、81.048%和83.541%。
2.2土壤pH变化
所有处理组土壤pH值在培养过程中均表现出先升高后下降趋势(图2)。其中以B2和B3处理组土壤pH值变化较大,且在试验结束时土壤pH值高于初始值;而CK和B1处理组土壤pH值波动较小,试验结束时对照组CK和B1处理组土壤pH值基本与初始值持平。
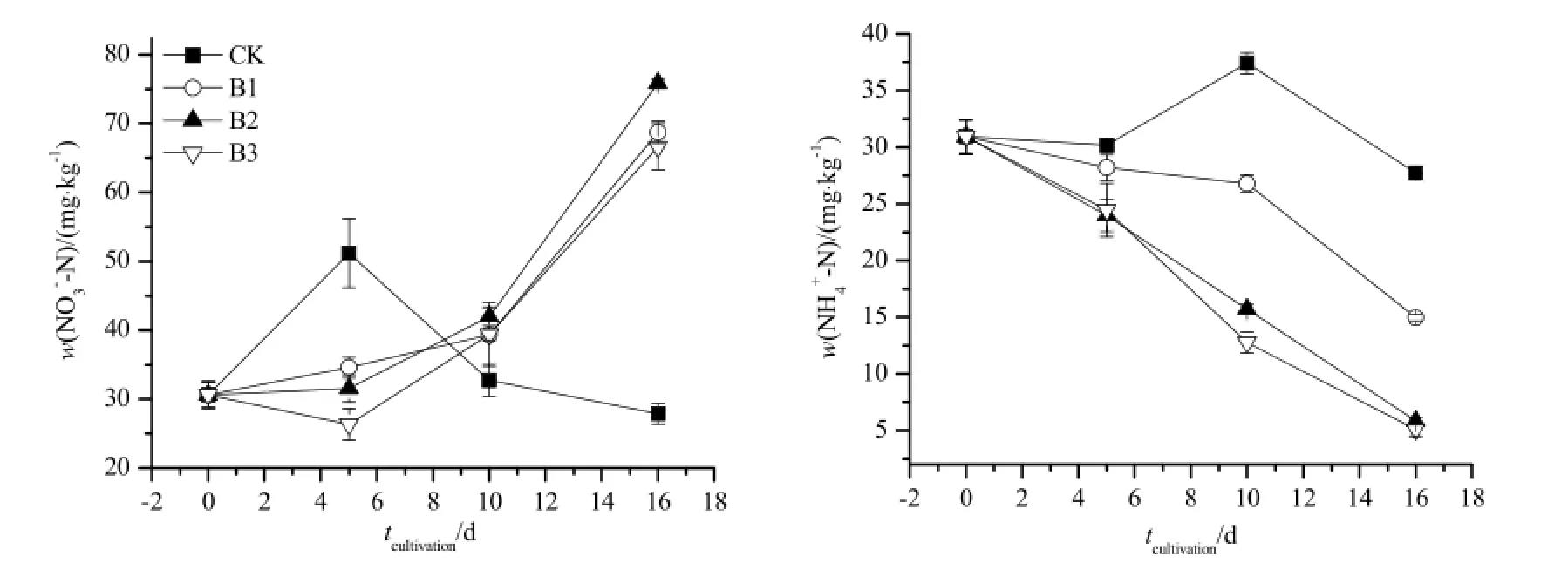
图1 土壤NH4+-N和NO3--N含量动态变化Fig. 1 Temporal dynam ics of soil NH4+-N and NO3--N contents

图2 土壤pH动态变化Fig. 2 Temporal dynam ics of soil pH value
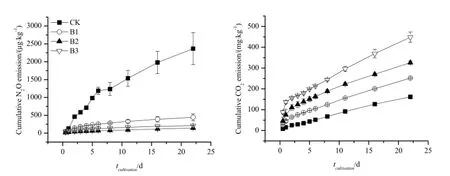
图3 土壤N2O和CO2累积排放量动态变化Fig. 3 Temporal dynamics of soil N2O and CO2cumulative emission
2.3土壤N2O和CO2的排放
为研究添加生物质炭对茶园土壤N2O排放的影响,培养试验中测定的N2O累积排放量如图3所示。对照组CK和生物质炭处理组之间差异较大,对照组N2O累积排放量显著高于添加生物质炭处理组。不同量生物质炭处理之间也存在差异,在一定范围内,随着生物质炭添加量的增加,N2O平均排放通量总体呈降低趋势(图4)。生物质炭添加比例(x)与N2O平均排放通量(y)之间满足方程:y=0.516+6.104exp(-x/3.146)(r=-0.651,P=0.022,n=12)。然而,添加生物质炭显著增加了土壤CO2累积排放量,并随着生物质炭添加量的增加而增加,两者呈较好的线性关系(图4),生物质炭添加比例(x)与CO2平均排放通量(y)之间满足线性方程:y=0.352x+0.0215(r=0.951,P=0.000,n=12)。试验结束时B1、B2和B3处理组CO2累积排放量分别为对照组CK的1.56、2.02和2.78倍。
2.4N2O排放与土壤矿质氮的关系
土壤矿质态氮含量是影响土壤氧化亚氮排放的主要因素之一。相关性分析结果表明(图5),茶园土壤氧化亚氮排放通量与铵态氮含量之间呈极显著正相关关系(P=0.005),表明铵态氮含量越高,N2O排放的越多;而N2O排放通量与茶园土壤硝态氮之间不存在显著相关性。
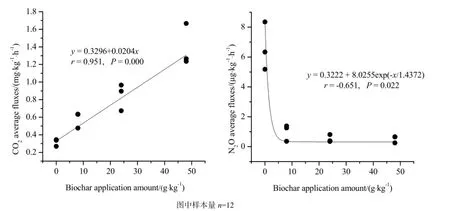
图4 CO2和N2O排放通量与生物质炭添加量之间的关系Fig. 4 The relationship between N2O and CO2fluxes and the biochar application amount

图5 N2O排放通量与NH4+-N之间的关系Fig. 5 The relationship between N2O fluxes and NH4+-N content

图6 土壤pH与N2O排放通量之间的关系Fig. 6 The relationship between pH and N2O emission
2.5N2O排放与土壤pH的关系
土壤pH值对茶园土壤N2O排放有显著性影响(P=0.046),随着pH值的升高,N2O排放通量逐渐降低(图6),表明提高茶园土壤pH值,可减少N2O排放。
2.6土壤综合增温潜势估算
试验期间,添加生物质炭后土壤N2O排放被抑制但土壤CO2的排放却得到促进。为进一步明确添加生物质炭后的综合温室效应(GWP),对所有处理组的N2O和CO2在100 a尺度上的综合增温潜势进行了估算。如表1所示,B1和B2处理的综合温室效应均显著低于CK处理,B1和B2处理的GWP较对照组CK分别减少604.874和480.033 mg·kg-1,降幅分别为34.667%和27.512%。
3 讨论
添加生物质炭后,土壤pH值的变化主要是土壤中氮素的转化过程和生物质炭中碱性物质释放综合作用的结果。开始阶段,土壤中有机氮的矿化、有机阴离子的脱羧作用和生物质炭中碱性物质的释放,造成生物质炭处理组土壤pH值显著升高,之后由于硝化作用释放H+(王磊等,2013;W rageet al.,2001)以及土壤本身的缓冲作用,pH值逐渐下降。试验结束时,生物质炭处理组土壤pH值高于对照组,特别是在B2和B3处理组中生物质炭的添加显著提高了土壤pH值,这与张祥等(2013)的研究结果一致,随着生物质炭添加比例的增加,土壤pH升高效果愈明显。试验过程中,各处理组N2O排放速率均逐渐降低,最终趋于平缓(图3),这与很多学者的研究结果一致(张祥等,2015;陈玉真等,2015)。
随着培养试验的进行,土壤中的碳源和氮源不断被消耗,硝化和反硝化作用的底物浓度逐渐降低,试验结束时N2O排放量降至很低的水平,CK、B1、B2和B3处理组N2O排放通量分别为2.374、0.337、0.245和0.068 μg·kg-1·h-1。添加生物质炭显著降低了土壤N2O的累积排放量,B1、B2和B3处理组N2O的累积排放量分别比对照组减少81.234%、94.006%和91.252%,这与Wang et al.(2011)得出的生物质炭显著降低水稻土N2O排放速率的研究结果相似。生物质炭在热解过程中会产生灰化碱等碱性物质,加入到酸性茶园土壤中有利于pH的提高。土壤N2O排放通量与pH之间的相关性表明(图6),提高pH值有助于减少N2O的排放量。虽然pH的升高可促进硝化作用,但同时也将增强反硝化菌氧化亚氮还原酶的活性(Yanai et al.,2007)。另外,在生物质炭的内部可能存在局部厌氧的微环境,比起N2O的产生有更多的N2O被还原为N2。加之生物质炭具有大量的孔隙结构和巨大的比表面积,NO3-被大量吸附在土壤中(Cheng et al.,2008),从而使得N2O排放量显著降低。

表1 不同比例生物质炭处理对土壤N2O、CO2排放总量及100年尺度全球增温潜势(GWP-100)的影响Table 1 Cumulative emissions of N2O and CO2from the soil and global warming potential as affected by different biochar rate
本研究与大部分室内培养试验和短期田间试验得出的生物质炭减少了土壤N2O排放的结果一致(Liu et al.,2012;Taghizadehtoosi et al.,2011),生物质炭在缓解土壤酸化问题的同时降低了土壤N2O气体的排放量。也有一些试验得出添加生物质炭对N2O排放无影响或促进了N2O排放的结论(Scheer et al.,2011;Saarnio et al.,2013;Suddick et al.,2013),试验结果不同主要是因为生物质炭的原材料、热解温度、C/N、pH和施加比例等不同造成的(Cayuela et al.,2013)10-11。
有研究表明,生物质炭添加到土壤中可有效提高土壤有机碳含量(柯跃进等,201497-98;Woolf et al.,2010)。但生物质炭会影响土壤有机碳组分和微生物活性(陈心想等,2014),进而对土壤中有机碳的分解产生影响。目前关于生物质炭对CO2排放的影响存在较大争议。柯跃进等(2014)98的研究表明施用生物质炭能降低CO2的排放,陈玉真等(2015)的研究则得出添加低量生物质炭对土壤CO2排放无显著影响,高量生物质炭显著促进CO2排放。本试验中生物质炭显著促进了CO2的排放,施用生物质炭增加土壤CO2排放量一方面可能是由于生物质炭可以提高土壤pH值,从而引起土壤呼吸速率的改变(范分良等,2012);另一方面可能是由于较强的化学分解造成的(Bird et al.,1997)。一般认为低温下(350~550 ℃)制备的生物质炭芳香性差,不稳定强,更容易分解(Laird et al.,2010)。本试验所用生物质炭是在中温(600 ℃)条件下制备而来,生物质炭含有较多的易分解有机碳及磷、钾和钙等速效养分,施加到土壤中会增强土壤中微生物的活性,进而促进土壤中碳的矿化(张祥等,2015;Cross et al.,2011),使土壤CO2累积排放量显著增加。
为进一步明确本试验中生物质炭的综合减排效果,对各处理组N2O和CO2的全球增温潜势GWP进行了估算。数据表明,添加生物质炭后,B1(18 t·hm-2)和B2(54 t·hm-2)处理的综合增温潜势较对照组CK均出现了显著下降,降幅分别为34.667%和27.512%,高德才等(2015)的研究也得出,当生物质炭施用量为20 t·hm-2时可显著减弱综合温室效应。可见,施用生物质炭是一种能实现碳封存和减缓气候变暖的有效措施。
4 结论
(1)添加作物秸秆生物质炭显著提高了酸化茶园土壤pH值,且生物质炭施加比例越大土壤pH值升幅越大,表明作物秸秆生物质炭具有改良酸化茶园土壤质量的潜力。
(2)室内模拟试验表明,茶园土壤pH值对N2O排放通量有显著影响,二者之间呈显著负相关关系,土壤pH值的升高可能是引起N2O排放量降低的重要原因。
(3)添加秸秆生物质炭短期内显著降低了中亚热带丘陵区酸化茶园土壤N2O的排放,但会促进土壤CO2的排放,100年尺度的综合增温潜势(GWP)数据表明,添加中低量(8 g·kg-1和24 g·kg-1)生物质炭能显著降低土壤增温潜势,其中B1(8 g·kg-1)处理组降幅达34.667%,固碳减排效果较明显。
ASAI H, SAMSON B K, STEPHAN H M, et al. 2009. Biochar amendment techniques for upland rice production in Northern Laos: 1. Soil physical properties, leaf SPAD and grain yield [J]. Field Crops Research, 111(1-2): 81-84.
BAKKEN L R, LINDA B, BINBIN L, et al. 2012. Regulation of denitrification at the cellular level: a clue to the understanding of N2O emissions from soils [J]. Philosophical Transactions of the Royal Society of London, 367(1593): 1226-1234.
BIRD M I, GRÖCKE D R. 1997. Determination of the abundance and carbon isotope composition of elemental carbon in sediments [J]. Geochimica Et Cosmochimica Acta, 61(16): 3413-3423.
BRUUN E W, MÜLLER-STÖVER D, AMBUS P, et al. 2011. Application of biochar to soil and N2O emissions: potential effects of blending fast-pyrolysis biochar with anaerobically digested slurry [J]. European Journal of Soil Science, 62(4): 581-589.
CASE S D C, MCNAMARA N P, REAY D S, et al. 2014. Can biochar reduce soil greenhouse gas emissions from a Miscanthus bioenergy crop? [J]. Global Change Biology Bioenergy, 6(1): 76-89.
CAYUELA M L, ZWIETEN L V, SINGH B P, et al. 2014. Biochar's role in mitigating soil nitrous oxide emissions: A review and meta-analysis [J]. Agriculture Ecosystems & Environment, 191: 5-16.
CHENG C H, LEHMANN J, ENGELHARD M H. 2008. Natural oxidation of black carbon in soils: Changes in molecular form and surface charge along a climosequence [J]. Geochimica Et Cosmochimica Acta, 72(6):1598-1610.
CROSS A, SOHI S P. 2011. The priming potential of biochar products in relation to labile carbon contents and soil organic matter status [J]. Soil Biology and Biochemistry, 43: 2127-2134.
DICK J, SKIBA U, WILSON J. 2001. The effect of rainfall on NO and N2O emissions from Ugandan agroforest soils [J]. Phyton, 41(3):73-80.
GARLAND G M, SUDDICK E, BURGER M, et al. 2011. Direct N2O emissions following transition from conventional till to no-till in a cover cropped Mediterranean vineyard (Vitis vinifera) [J]. Agriculture Ecosystems & Environment, 141(1-2): 234-239.
GUNDALE M J, DELUCA T H. 2006. Temperature and source material influence ecological attributes of ponderosa pine and Douglas-fir charcoal [J]. Forest Ecology & Management, 231(1):86-93.
IPCC. 2013. Climate Change 2013: The Physical Science Basis: Working groupⅠcontribution to the fifth assessment report of the intergovernmental panel on climate change[M]. Cambridge:Cambridge University Press.
LAIRD D A, FLEMING P, DAVIS D D, et al. 2010. Impact of biochar amendments on the quality of a typical Midwestern agricultural soil [J]. Geoderma, 158 (3-4): 443-449.
LEHMANN J, CZIMCZIK C I, LAIRD D, et al. 2009. “Stability of Biochar in the Soil”, in Biochar for Environmental Mangement [M]. London:Earthscan: 183.
LING Z, CAO X, MAŠEK O, et al. 2013. Heterogeneity of biochar properties as a function of feedstock sources and production temperatures [J]. John Wiley & Sons Ltd, 256-257(1): 1-9.
LIU X Y, QU J J, LI L Q, et al. 2012. Can biochar amendment be an ecological engineering technology to depress N2O emission in rice paddies?—A cross site field experiment from South China [J]. Ecological Engineering, 42(9): 168-173.
LIU Y, YANG M, WU Y, et al. 2011. Reducing CH4and CO2emissions from waterlogged paddy soil with biochar [J]. Journal of Soils & Sediments, 11(6): 930-939.
ROGOVSKA N, LAIRD D, CRUSE R, et al. 2011. Impact of Biochar on Manure Carbon Stabilization and Greenhouse Gas Emissions [J]. Soil Science Society of America Journal, 75(3): 871-879.
SAARNIO S, HEIMONEN K, KETTUNEN R. 2013. Biochar addition indirectly affects N2O emissions via soil moisture and plant N uptake[J]. Soil Biology & Biochemistry, 58(2): 99-106.
SCHEER C, GRACE P R, ROWLINGS D W, et al. 2011. Effect of biochar amendment on the soil-atmosphere exchange of greenhouse gases from an intensive subtropical pasture in northern New South Wales,Australia [J]. Plant & Soil, 345(1): 47-58.
IBI. 2012. Standardized product definition and product testing guidelines for biochar that is used in soil [S].
SUDDICK E C, SIX J. 2013. An estimation of annual nitrous oxide emissions and soil quality following the amendment of high temperature walnut shell biochar and compost to a small scale vegetable crop rotation [J]. Science of the Total Environment, 465(6):298-307.
SUDDICK E C, SIX J. 2013. An estimation of annual nitrous oxide emissions and soil quality following the amendment of high temperature walnut shell biochar and compost to a small scale vegetable crop rotation [J]. Science of the Total Environment, 465(6):298-307.
SUI Y, GAO J, LIU C, et al. 2016. Interactive effects of straw-derived biochar and N fertilization on soil C storage and rice productivity in rice paddies of Northeast China [J]. Science of The Total Environment,544: 203-210.
TAGHIZADEHTOOSI A, CLOUGH T J, CONDRON L M, et al. 2011. Biochar incorporation into pasture soil suppresses in situ nitrous oxide emissions from ruminant urine patches [J]. Journal of Environmental Quality, 40(2): 468-76.
VERHOEVEN E, SIX J. 2014. Biochar does not mitigate field-scale N2O emissions in a Northern California vineyard: An assessment across two years [J]. Agriculture Ecosystems & Environment, 191(15): 27-38.
WANG J, ZHANG M, XIONG Z, et al. 2011. Effects of biochar addition on N2O and CO2emissions from two paddy soils [J]. Biology & Fertility of Soils, 47(8): 887-896.
WOOLF D, AMONETTE J E, STREETPERROTT F A, et al. 2010. Sustainable biochar to mitigate global climate change [J]. Nature Communications, 1(3): 118-124.
WRAGE N, VELTHOF G L, BEUSICHEM M L V, et al. 2001. Role of nitrifier denitrification in the production of nitrous oxide[J]. Soil Biology & Biochemistry, 33(1): 1723-1732.
YANAI Y, TOYOTA K, OKAZAKI M. 2007. Effects of charcoal addition on N2O emissions from soil resulting from rewetting air-dried soil in short-term laboratory experiments [J]. Soil Science & Plant Nutrition,53(2): 181-188.
ZWIETEN L V, KIMBER S W L, MORRIS S G, et al. 2013. Pyrolysing poultry litter reduces N2O and CO2fluxes [J]. Science of the Total Environment, 465(6): 279-287.
鲍士旦. 2000. 土壤农化分析[M]. 北京: 中国农业出版社: 25-109.
陈心想, 耿增超, 王森, 等. 2014. 施用生物炭后塿土土壤微生物及酶活性变化特征[J]. 农业环境科学学报, 33(4): 751-758.
陈玉真, 王峰, 尤志明, 等. 2015. 添加生物黑炭对茶园土壤CO2、N2O排放的影响[J]. 农业环境科学学报, 34(5): 1009-1016.
范分良, 黄平容, 唐勇军, 等. 2012. 微生物群落对土壤微生物呼吸速率及其温度敏感性的影响[J]. 环境科学, 33(3): 932-937.
高德才, 张蕾, 刘强, 等. 2015. 生物黑炭对旱地土壤CO2、CH4、N2O排放及其环境效益的影响[J]. 生态学报, 35(11): 3615-3624.
韩文炎(译). 2006. 茶园土壤N2O释放量的动态变化及其与环境因子的关系[J]. 中国茶叶, (3): 46-47.
何绪生, 耿增超, 佘雕, 等. 2011. 生物炭生产与农用的意义及国内外动态[J]. 农业工程学报, 27(2): 1-7.
胡雲飞, 李荣林, 杨亦扬. 2015. 生物质炭对茶园土壤CO2和N2O排放量及微生物特性的影响[J]. 应用生态学报, 26(7): 1954-1960.
柯跃进, 胡学玉, 易卿, 等. 2014. 水稻秸秆生物炭对耕地土壤有机碳及其CO2释放的影响[J]. 环境科学, 35(1): 93-99.
刘玉学, 王耀锋, 吕豪豪, 等. 2013. 生物质炭化还田对稻田温室气体排放及土壤理化性质的影响[J]. 应用生态学报, 24(8): 2166-2172.
王磊, 汪玉, 杨兴伦, 等. 2013. 有机物料对强酸性茶园土壤的酸度调控研究[J]. 土壤, 45(3): 430-436.
杨向德, 石元值, 伊晓云, 等. 2015. 茶园土壤酸化研究现状和展望[J].茶叶学报, , 56(4): 189-197.
张祥, 王典, 姜存仓, 等. 2013. 生物质炭对我国南方红壤和黄棕壤理化性质的影响[J]. 中国生态农业学报, 21(8): 979-984.
张永利, 孙力. 2011. 茶园土壤酸化及其改良措施[J]. 茶业通报, (4):158-161.
Effects of Wheat-straw Derived Biochar on Acidified Tea Garden Soil N2O and CO2Emission in Short-term Laboratory Experiments
HE Zhilong1, XIA Wenjian2, ZHOU Wei1, TIAN Yanan1, LIU Weiyang3, LIN Shan1*
1. College of Recourses and Environment, Huazhong Agricultural University//Key Laboratory of Arable Land Conservation in Middle and Lower Reaches of Yangtze River, Ministry of Agriculture, Wuhan 430070, China;2. Institute of Soil Fertilizer and Resource Environment, Jiangxi Academy of Agricultural Sciences, Nanchang 330200, China;3. College of Plant Science and Technology, Tarim University, Alar 843300, China
Laboratory experiments were conducted to examine the effect of straw biochar addition on acidified tea garden soil amelioration and greenhouse gas emissions, different amounts of wheat-straw derived biochar (Control: 0 g·kg-1; Low biochar: 8 g·kg-1; Medium biochar: 24 g·kg-1; High biochar: 48 g·kg-1) were added to tea garden soil. The results indicated that the adding of biochar significantly reduced acidified tea garden soil N2O emissions compared with CK (no wheat-straw derived biochar).But the effect did not increase with increasing application rate of the straw biochar, with the 24 g·kg-1rate had the largest prominent effect. The cumulative N2O fluxes were 2.366, 0.444, 0.142 and 0.207 mg·kg-1for CK, B1,B2 and B3, respectively. Compared with CK treatment, the global warming potential of low biochar and medium biochar treatments decreased by 33.45% and 25.77%,respectively, while there was no significant difference between the high biochar treatment and control treatment. The result indicated that the low and medium biochar applied was more beneficial to carbon sequestration and reduce greenhouse gases emission in tea garden soil than the high biochar applied. Additionally, the biochar could significantly increase the pH value in acidified tea garden soil, indicating that the higher biochar addition with the higher soil pH value. Therefore, the straw biochar addition had better effect on acidic soil amelioration. The result showed that soil N2O flux was significantly correlated with soil pH, indicating that the increasing of soil pH may be an important factor to decrease N2O emission.
acidification of tea garden; wheat-straw derived biochar; pH values; N2O emissions
10.16258/j.cnki.1674-5906.2016.07.020
X144
A
1674-5906(2016)07-1230-07
国家自然科学基金项目(41201255;41171212;41561068);河南省科技攻关项目(162102110010)
何志龙(1991年生),男,硕士研究生,主要从事农田温室气体研究。E-mail:hzlfaogeiing@163.com
,林杉,E-mail: linshan@mail.hzau.edu.cn
2016-06-30

