诱导多能干细胞与心脏再生
胡士军,虞游,方星,雷伟,赵振奥
(1.苏州大学心血管病研究所,江苏苏州215000;2.苏州大学附属第一医院心血管外科,江苏苏州215006)
诱导多能干细胞与心脏再生
胡士军1,2,虞游1,2,方星1,2,雷伟1,2,赵振奥1,2
(1.苏州大学心血管病研究所,江苏苏州215000;2.苏州大学附属第一医院心血管外科,江苏苏州215006)
诱导多能干细胞(induced pluripotent stem cells,iPSCs)研究的快速发展为心血管转化医学研究领域提供了新的策略.诱导多能干细胞不仅具有与胚胎干细胞类似的多能性,且巧妙地回避了胚胎干细胞面临的伦理学问题和免疫排斥反应.心肌细胞等成体心血管细胞在发生心血管疾病后增殖能力有限,而iPSCs来源的心血管细胞在心脏再生治疗中颇具应用前景,是理想的细胞来源,因此在基础医学和转化医学研究领域受到广泛关注.就iPSCs的发展过程及其在心脏再生中的应用作一综述,并探讨目前iPSCs在心脏再生临床转化中亟待解决的问题.
诱导多能干细胞;心脏再生;转化医学;重编程
2016年美国心脏学会发布的《心脏病与卒中统计数据》[1]表明,心血管疾病已经成为世界性的危及人类健康的头号疾病,全球每年死于心肌梗死后心力衰竭的病人就有740万之多.与心瓣膜或血管不同,心肌受损后仍缺乏可替换的组织或生物材料.伴随着再生医学的兴起,通过再生心肌和血管修复有缺陷的心脏组织,成为众多科学家努力的目标.目前,成体干细胞是临床试验中使用最多的细胞类型,包括间充质干细胞、造血干细胞、内皮祖细胞和心脏干细胞等,主要通过分化成心血管细胞或通过旁分泌作用促进心肌再生[2].这些成体干细胞或祖细胞虽具有心肌再生的潜能,但由于分化效率低,自我更新能力有限,体外分离和维持困难,使得临床应用及疗效受到很大限制.
诱导多能干细胞(induced pluripotent stem cells,iPSCs)和胚胎干细胞(embryonic stem cells,ESCs)均属于多能干细胞(pluripotent stem cells,PSCs),具有无限增殖的能力,能够在体外和体内分化成3个胚层的各种类型细胞.尤其是iPSCs可来源于患者自体细胞,能够在一定程度上克服ESCs的免疫排斥和伦理道德等问题,为再生医学的细胞移植治疗、疾病模型构建以及哺乳动物发育等研究提供新的方法和手段[3].本工作将综述iPSCs的诱导生成、心血管细胞分化、心脏再生转化应用的研究进展及亟待解决的问题.
1 iPSCs的诱导生成
自20世纪兴起的动物体细胞核移植技术和细胞融合技术证明了终端分化细胞核含有生物体向所有器官组织分化和生长的完整遗传信息,从而使科学家们相信通过激活终端分化细胞中某些关键性转录调节因子可以改变“细胞命运”,实现细胞类型的转变[4].2006年Takahashi等[5]通过导入4种多能性相关转录因子(Oct4,Sox2,Klf4和c-Myc),首次成功地将小鼠成纤维细胞重编程为胚胎干细胞样的细胞,即诱导多能干细胞(iPSCs).2007年,人的iPSCs系也分别由Yamanaka研究团队[6]和Thomson研究团队[7]成功建立.随后,中国科学家利用四倍体胚胎补偿实验证实小鼠iPSCs具有与ESCs细胞相同的全能性和发育能力[8-9].目前,其他种属如猴、猪和兔等大动物的iPSCs系也已被成功建立[10].
经典的iPSCs生成途径是采用逆转录病毒载体将Yamanaka因子导入受体细胞,置于ESCs特异培养基中进行培养,在此过程中加入必要的生长因子促进受体细胞重编程的发生.这种方法操作简单、重复性好,已成为细胞重编程机理研究中的常见手段.但这种由逆转录病毒介导生成iPSCs的方法存在两方面较为突出的问题:①外源基因会随机整合基因组,可能破坏受体细胞关键基因的表达;②c-Myc和Klf4等致癌基因的引入,有可能导致受体细胞的癌变.为了突破这些局限性,科学家们又开发了非整合病毒(腺病毒和仙台病毒等)、非病毒DNA载体(如质粒和微环等)、可切除的整合载体(Cre-LoxP重组酶方法和PiggyBac转座子方法)、重编程因子的mRNAs和蛋白直接导入等方法,这些方法已经被证明是诱导iPSCs生成的安全有效的方法[11].对重编程方法的选择依赖于iPSCs的下游应用,必须衡量重编程效率、基因整合与否和成本等因素.尽管非病毒方法得到的iPSCs更安全,但生成iPSCs的效率会更低.此外,在重编程过程中,通过添加小分子化合物可以缩短重编程时长,并且显著提高重编程的效率,甚至可以用小分子物质直接替代某些转录因子的使用[12].
不论应用何种方法进行重编程,都有可能导致基因组的改变,体细胞来源的初始表观遗传记忆也使得iPSCs系之间存在表观遗传的差异.最初,Yamanaka研究组采用了原代成纤维细胞作为初始体细胞,后续的研究尝试了多种其他类型的体细胞重编程.目前,通过皮肤成纤维细胞、脂肪干细胞、外周血细胞、神经干细胞、造血干细胞、羊水等细胞均可成功获得iPSCs系[13].从临床转化应用来看,易得初始体细胞包括皮肤成纤维细胞、血液中分离的细胞和尿液中分离的肾上皮细胞等,将成为iPSCs疾病治疗中理想的用于重编程的体细胞.
2 心血管细胞诱导分化
心血管细胞主要包括心肌细胞、内皮细胞和平滑肌细胞等,最初的心血管细胞分化方法主要通过拟胚体(embryoid bodies,EBs)方法起始细胞自发分化或利用细胞因子调控相应细胞信号通路(BMP,TGF-β,Wnt和bFGF等),定向诱导分化.利用SIRPA等细胞表面标志分子或基因敲入心肌标志基因启动子(NKX2.5等)驱动GFP等方法对分化后的细胞进行分选,能够获得具有肌纤维结构、自发跳动的心肌细胞[14].由于EBs分化心肌细胞的方法存在操作繁琐、EBs大小难控制等因素,会导致分化的心肌细胞不均一.近年来,单层细胞定向诱导心肌分化逐渐成为心肌细胞分化的主要方法.Murry实验室最先利用单层人ESCs进行心肌诱导,通过调控心肌分化关键信号通路,使得心肌细胞分化效率约为30%[15].尽管研究者们已建立了多种有效的人PSCs定向诱导心肌分化方法,但诱导培养基中存在一些动物源成分,不利于人PSCs来源心肌细胞的临床应用.最近,Burridge等[16]和Lian等[17]分别建立了成分明确、无细胞因子的心肌细胞诱导方法,采用GSK3β抑制剂和Wnt抑制剂等化学小分子进行时间特异性调控经典Wnt信号通路,获得的心肌细胞纯度达到90%以上.心肌细胞与非心肌细胞对葡萄糖和乳酸代谢存在显著差异,因此PSCs分化的心肌细胞后期可经葡萄糖缺乏但富含乳酸的培养基培养筛选纯化,心肌细胞纯度可达到99%以上[18].上述研究为多能干细胞来源心肌细胞的临床应用奠定了基础.
Orlova等[19]建立了分化内皮细胞和周细胞(pericytes)的单层细胞分化方法,两种细胞的分化效率都能达到30%左右,并且共培养能够形成血管丛.经流式细胞分选仪等设备筛选分化13~15 d后,CD31或CD144阳性的内皮细胞与人原代内皮细胞HUVEC具有类似的表型[20-21].近期研究表明,人PSCs通过与OP9基质细胞共培养,在VEGF,FGF2和BMP4等细胞生长因子的诱导下,可生成CD31+,CD34+的血管祖细胞,这些细胞能进一步分化成内皮细胞和平滑肌细胞,并且移植到小鼠体内能形成功能性的微血管结构[22].Gu等[23]利用单层细胞方法,在化学小分子和细胞生长因子的协同诱导下高效获得了内皮细胞.
在无血清、成分可控的培养基中,利用化学小分子定向分化心肌细胞、内皮细胞和平滑肌细胞,具有简单方便、成本低廉等优点,已成为目前诱导分化多种心血管细胞的主要方法.
3 iPSCs细胞与心脏再生
包括人类在内的大多数哺乳动物在出生后不久心肌细胞就停止增殖,心脏的生长主要是心肌细胞体积的增大.尽管近年来有研究发现,哺乳动物出生后心肌细胞还是会发生更新的现象,但心肌细胞更新的效率极低,年均不到1%,并且随着人年龄的增长而逐渐下降.因此,心脏类疾病造成的心肌细胞数量的减少和功能丧失的细胞群比例远远大于自我更新的比例,难以自我修复[24].
iPSCs等干细胞技术的迅猛发展让心脏再生变得更具可能性和操控性.借助于iPSCs技术可以对不同患者进行个性化治疗:通过简单地分离患者的体细胞,将其转化成为该患者特异iPSCs,再定向分化成为心血管细胞,经过一系列的筛选和评估之后,结合生物医学材料等介质,可以将体外分化的高纯度心血管细胞重新注入患者体内,从而达到修复受损心脏组织的目的.与体内分离成体干细胞相比,iPSCs作为心脏再生的细胞来源具有明显的优势:体外扩增能力强,易定向分化获得足够的功能细胞.iPSCs及其分化的心脏前体细胞、心肌细胞、内皮细胞和平滑肌细胞已经被尝试应用于动物模型中的心脏再生治疗.
Nelson等[25]首先报道了iPSCs修复心脏的研究成果,未分化的iPSCs移植后可在心脏内分化成心肌细胞、内皮细胞和平滑肌细胞等主要心血管细胞,同时显著改善缺血后的心脏功能.这种方法的主要缺陷在于移植后的iPSCs因具有全能型,易在受体心脏中生成肿瘤.iPSCs也可先在体外分化成为心脏前体细胞(cardiac progenitor cells,CPCs),从而避免了iPSCs的致瘤性问题,同时使其具有更好的可塑性,在移植后能分化成心肌细胞、内皮细胞和平滑肌细胞.Mauritz等[26]利用Flk1+细胞表面标志分子得到iPSCs分化的CPCs细胞,用于治疗心肌梗死模型,可以显著改善心脏功能.在大动物猪心肌梗死模型中,Kawamura等[27]将人iPSCs分化心肌细胞片层移植到猪受损心脏,能够显著提升心脏功能,降低纤维化程度,增加梗死周边区域的毛细血管密度.近期研究表明,与其他时期细胞相比,iPSCs分化第20 d的心肌细胞能够呈现更好的再生修复能力[28].此外,iPSCs分化的内皮细胞也被证实可以通过旁分泌机制促进受损心脏功能的恢复[29].将含有人iPSCs分化内皮细胞和平滑肌细胞的纤维蛋白片层贴敷到梗死心脏表面可促进梗死区血管发生,显著改善心脏功能[30].Dai等[31]将iPSCs来源的心肌细胞、内皮细胞以及小鼠胚胎成纤维细胞制成混合细胞修复补片移植到小鼠心梗区域,发现这种3类细胞混合的修复材料能够显著降低心脏组织纤维化程度,改善小鼠的心脏功能.Masumoto等[32]在体外将iPSCs同时诱导分化成包括心肌细胞、平滑肌细胞和内皮细胞的心血管细胞群,利用组织工程方法制作成细胞片层用于恢复大鼠心脏功能,并于移植治疗后第4周在受体心脏中检测到>40%的移植心肌细胞.Zhang实验室采用组织工程方法提高人iPSCs分化的心肌细胞、内皮细胞和平滑肌细胞组合在移植后的存活率,显著恢复心脏功能和代谢,增加新生血管密度,降低梗死面积,并且没有发现任何副作用[33].
综上所述,iPSCs来源的多种心血管细胞已应用于多种动物的心脏再生治疗.不同细胞群以及组织工程学技术的完美结合能够在一定程度上提高移植细胞的驻留和存活率,从而提升细胞治疗效果.
4 机遇与挑战
体细胞重编程技术的快速发展不仅为医学领域提供了极具吸引力的新治疗方案,也为进一步深入研究心血管疾病提供了新工具.iPSCs定向分化的心血管细胞为人类心肌再生、心血管疾病模型的建立和药物筛选提供了新的技术手段和研究策略.同时,该方法的建立还为医疗诊断以及个体化精准医学治疗策略的定制奠定了基础.尽管iPSCs作为再生心脏的应用前景很好,但仍有很多未解决的问题.
4.1细胞异质性
由于iPSCs可以来自不同的初始体细胞,并且具有克隆生长特性,因此iPSCs系异质性是不容忽视的问题.不同iPSCs克隆之间可能存在遗传或者表观遗传的差异,并最终可能造成细胞治疗效果的差异[34].此外,分化心血管细胞的异质性也是影响再生治疗的主要因素之一,如iPSCs可以生成心室肌细胞、心房肌细胞和窦房结细胞,而内皮细胞分化也可以生成动脉内皮细胞、静脉内皮细胞和淋巴管内皮细胞等[35].因此,通过优化重编程策略,挑取健康的、一致性好的iPSCs,从而获得更类似于ESCs的高质量细胞克隆,进一步阐明心血管细胞的定向分化机制,精准调控细胞定向分化,将有助于iPSCs应用于心血管疾病的再生治疗.
4.2分化细胞的不成熟性
iPSCs分化来源的心血管细胞还呈现不够成熟的状态.如iPSCs分化心肌细胞与成熟心肌细胞相比呈现圆形,具有线粒体较少、肌丝排列不整齐等缺陷,表达谱更类似于胎儿的心肌细胞[36].一些刺激成熟的方法,如电刺激和组织工程等方法能够在一定程度上促进心肌细胞的成熟.在未来的工作中,需要通过各种手段将分化的心血管细胞维持在与成熟细胞更接近的状态.
4.3细胞制备的规模化和标准化
iPSCs和相关分化细胞的生产需要遵循《药品生产质量管理规范(GMP)》标准,建立可重复的生产流程,降低生产细胞的潜在危害并建立规范化的质量控制方法[37].此外,心肌梗死后,超过10亿个心肌细胞死亡,为了能够有效地再生心脏,需要体外注入至少亿数量级的心肌细胞以修复受损心脏.如何大规模培养iPSCs并分化成为心血管细胞,是其在临床应用前急需解决的关键问题.建立标准化的、临床级别的iPSCs培养和心血管细胞分化体系是iPSCs心血管转化医学的必经之路.
5 结束语
培育出iPSCs后的10年间,该技术已经被证明能够用于细胞治疗修复受损心肌,并寄希望于最终用于临床治疗心脏病(见图1).然而iPSCs在临床应用前还存在很多需要解决的问题:①如何获得更优质的种子细胞;②阐明自体异体治疗的差别;③建立充分和有效的iPSCs治疗心脏病的副作用(致瘤型、免疫原性、致心律失常等)评估方案和体系;④如何选择细胞移植途径(冠状动脉输注、心外膜以及心内注射方式等)及生物材料等.随着二代、三代测序技术的完善和成熟,利用精准医学理念,结合患者基因表型,优化细胞再生治疗心脏病将成为可能;基因组编辑技术(TALENs,CRISPR/Cas9等)还可以对致病基因进行定点修饰,从而得到健康的iPSCs用于心脏病治疗;前沿影像学技术可以示踪治疗细胞并评估心脏功能的恢复情况.因此,结合多种先进技术,系统评估iPSCs治疗心脏病的安全性和有效性,并建立伦理评价的临床转化示范体系,将加速iPSCs治疗心脏病的临床应用.
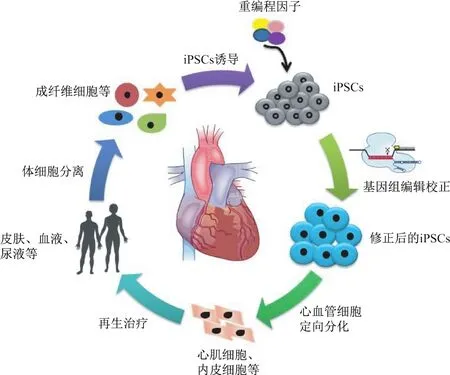
图1 iPSCs技术在心脏再生中的应用模式Fig.1 iPSCs potential application in cardiac regeneration
[1]MOZAFFARIAN D,BENJAMIN E J,GO A S,et al.Heart disease and stroke statistics—2016 update:a report from the American Heart Association[J].Circulation,2016,133:e38-e360.
[2]BROUGHTON K M,SUSSMAN M A.Empowering adult stem cells for myocardial regeneration V2.0:success in small steps[J].Circulation Research,2016,118:867-880.
[3]TABAR V,STUDER L.Pluripotent stem cells in regenerative medicine:challenges and recent progress[J].Nature Reviews Genetics,2014,15:82-92.
[4]YAMANAKA S.Induced pluripotent stem cells:past,present,and future[J].Cell Stem Cell,2012,10:678-684.
[5]TAKAHASHI K,YAMANAKA S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126:663-676.
[6]TAKAHASHI K,TANABE K,OHNUKI M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131:861-872.
[7]YU J,VODYANIK M A,SMUGA-OTTO K,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318:1917-1920.
[8]ZHAO X Y,LI W,L¨U Z,et al.Ips cells produce viable mice through tetraploid complementation[J].Nature,2009,461:86-90.
[9]KANG L,WANG J,ZHANG Y,et al.Ips cells can support full-term development of tetraploid blastocyst-complemented embryos[J].Cell Stem Cell,2009,5:135-138.
[10]HARDING J,ROBERTS R M,MIROCHNITCHENKO O.Large animal models for stem cell therapy[J].Stem Cell Research&Therapy,2013,4:23.
[11]HOCHEDLINGER K,JAENISCH R.Induced pluripotency and epigenetic reprogramming[J].Cold Spring Harb Perspect Bio,2015,7(12):a019448.
[12]HOU P,LI Y,ZHANG X,et al.Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds[J].Science,2013,341:651-654.
[13]RAAB S,KLINGENSTEIN M,LIEBAU S,et al.A comparative view on human somatic cell sources for ipsc generation[J].Stem Cells International,2014,2014:768391.
[14]DUBOIS N C,CRAFT A M,SHARMA P,et al.Sirpa is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells[J].Nature Biotechnology,2011,29:1011-1018.
[15]LAFLAMME M A,CHEN K Y,NAUMOVA A V,et al.Cardiomyocytes derived from human embryonic stem cells in pro-survival factors enhance function of infarcted rat hearts[J].Nature Biotechnology,2007,25:1015-1024.
[16]BURRIDGE P W,MATSA E,SHUKLA P,et al.Chemically defined generation of human cardiomyocytes[J].Nature Methods,2014,11:855-860.
[17]LIAN X,BAO X,ZILBERTER M,et al.Chemically defined,albumin-free human cardiomyocyte generation[J].Nature Methods,2015,12:595-596.
[18]TOHYAMA S,HATTORI F,SANO M,et al.Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes[J].Cell Stem Cell,2013,12:127-137.
[19]ORLOVA V V,VAN DEN HIL F E,PETRUS-REURER S,et al.Generation,expansion and functional analysis of endothelial cells and pericytes derived from human pluripotent stem cells[J].Nature Protocols,2014,9:1514-1531.
[20]HU S,WILSON K D,GHOSH Z,et al.Microrna-302 increases reprogramming efficiency via repression of nr2f2[J].Stem Cells,2013,31:259-268.
[21]LI Z,HU S,GHOSH Z,et al.Functional characterization and expression profiling of human induced pluripotent stem cell-and embryonic stem cell-derived endothelial cells[J].Stem Cells and Development,2011,20:1701-1710.
[22]MARCHAND M,ANDERSON E K,PHADNIS S M,et al.Concurrent generation of functional smooth muscle and endothelial cells via a vascular progenitor[J].Stem Cells Translational Medicine,2014,3:91-97.
[23]GU M,MORDWINKIN N M,KOOREMAN N G,et al.Pravastatin reverses obesity-induced dysfunction of induced pluripotent stem cell-derived endothelial cells via a nitric oxide-dependent mechanism[J].European Heart Journal,2015,36:806-816.
[24]UYGUR A,LEE R T.Mechanisms of cardiac regeneration[J].Developmental Cell,2016,36:362-374.
[25]NELSON T J,MARTINEZ-FERNANDEZ A,YAMADA S,et al.Repair of acute myocardial infarction by human stemness factors induced pluripotent stem cells[J].Circulation,2009,120:408-416.
[26]MAURITZ C,MARTENS A,ROJAS S V,et al.Induced pluripotent stem cell(ipsc)-derived flk-1 progenitor cells engraft,differentiate,and improve heart function in a mouse model of acute myocardial infarction[J].European Heart Journal,2011,32:2634-2641.
[27]KAWAMURA M,MIYAGAWA S,MIKI K,et al.Feasibility,safety,and therapeutic efficacy of human induced pluripotent stem cell-derived cardiomyocyte sheets in a porcine ischemic cardiomyopathy model[J].Circulation,2012,126:S29-S37.
[28]FUNAKOSHI S,MIKI K,TAKAKI T,et al.Enhanced engraftment,proliferation,and therapeutic potential in heart using optimized human ipsc-derived cardiomyocytes[J].Scientific Reports,2016,6:19111.
[29]GUM,NGUYENPK,LEEAS,etal.Microfluidicsingle-cellanalysisshowsthat porcine induced pluripotent stem cell-derived endothelial cells improve myocardial function by paracrine activation[J].Circulation Research,2012,111:882-893.
[30]XIONG Q,YE L,ZHANG P,et al.Functional consequences of human induced pluripotent stem cell therapy:myocardial ATP turnover rate in the in vivo swine heart with postinfarction remodeling[J].Circulation,2013,127:997-1008.
[31]DAI B,HUANG W,XU M,et al.Reduced collagen deposition in infarcted myocardium facilitates induced pluripotent stem cell engraftment and angiomyogenesis for improvement of left ventricular function[J].Journal of the American College of Cardiology,2011,58:2118-2127.
[32]MASUMOTO H,IKUNO T,TAKEDA M,et al.Human iPS cell-engineered cardiac tissue sheets with cardiomyocytes and vascular cells for cardiac regeneration[J].Scientific Reports,2014,4:6716.
[33]YE L,CHANG Y H,XIONG Q,et al.Cardiac repair in a porcine model of acute myocardial infarction with human induced pluripotent stem cell-derived cardiovascular cells[J].Cell Stem Cell,2014,15:750-761.
[34]SANCHEZ-FREIRE V,LEE A S,HU S,et al.Effect of human donor cell source on differentiation and function of cardiac induced pluripotent stem cells[J].Journal of the American College of Cardiology,2014,64:436-448.
[35]BIRKET M J,MUMMERY C L.Pluripotent stem cell derived cardiovascular progenitors—a developmental perspective[J].Developmental Biology,2015,400:169-179.
[36]LUNDY S D,ZHU W Z,REGNIER M,et al.Structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells[J].Stem Cells and Development,2013,22:1991-2002.
[37]ANDREWS P W,BAKER D,BENVINISTY N,et al.Points to consider in the development of seed stocks of pluripotent stem cells for clinical applications:international stem cell banking initiative(iscbi)[J].Regenerative Medicine,2015,10:1-44.
Induced pluripotent stem cells in cardiac regeneration
HU Shijun1,2,YU You1,2,FANG Xing1,2,LEI Wei1,2,ZHAO Zhen'ao1,2
(1.Institute for Cardiovascular Science,Soochow University,Suzhou 215000,Jiangsu,China;2.Department of Cardiovascular Surgery,First Affiliated Hospital of Soochow University,Suzhou 215006,Jiangsu,China)
Induced pluripotent stem cells(iPSCs)have emerged as a novel tool for cell therapy for cardiovascular diseases.iPSCs are functionally similar to embryonic stem cells(ESCs)while avoiding ethical issues and immune rejection.Given limited regenerative ability of human heart following cardiovascular diseases cardiovascular cells derived from iPSCs have been considered as a promising cell source in cardiovascular regenerative therapy.This paper summarizes and discusses the iPSCs technology and its potential regenerative applications in cardiac regeneration.
induced pluripotent stem cell(iPSCs);cardiac regeneration;translational medicine;reprogramming
R 541
A
1007-2861(2016)03-0285-08
10.3969/j.issn.1007-2861.2016.04.001
2016-04-22
国家自然科学基金资助项目(81500277)
胡士军(1980—),男,教授,博士生导师,研究方向为干细胞与心血管转化医学. E-mail:shijunhu@suda.edu.cn

