盐分胁迫对骆驼刺幼苗叶片性状的影响
赵生龙,曾凡江,张 波,刘 波,高欢欢,罗瀚林
(1.中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室,新疆 乌鲁木齐 830011;2.新疆策勒荒漠草地生态系统国家野外科学观测实验站,新疆 策勒 848300;3.中国科学院干旱区生物地理与生物资源重点实验室,新疆 乌鲁木齐 830011; 4.中国科学院大学,北京 100049)
盐分胁迫对骆驼刺幼苗叶片性状的影响
赵生龙1,2,3,4,曾凡江1,2,3,张 波1,2,3,4,刘 波1,2,3,高欢欢1,2,3,4,罗瀚林1,2,3,4
(1.中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室,新疆 乌鲁木齐 830011;2.新疆策勒荒漠草地生态系统国家野外科学观测实验站,新疆 策勒 848300;3.中国科学院干旱区生物地理与生物资源重点实验室,新疆 乌鲁木齐 830011; 4.中国科学院大学,北京 100049)
气候变化与人为干扰使得干旱区盐渍化加剧,引发了严重的生态问题。因此,研究干旱区植物叶片性状对盐胁迫的响应具有重要意义。本研究以当年生的骆驼刺(Alhagisparsifolia)为研究对象,采用盆栽控制试验,设置不同浓度(50、100、200、400 mmol·L-1)的盐处理,分析盐胁迫对骆驼刺叶片性状的影响。结果表明,1)盐胁迫降低了骆驼刺的光合能力,其净光合速率和蒸腾速率显著减小,而水分利用效率则显著增大(P<0.05);其荧光参数Fv/F0和Fv/Fm在盐处理下均低于对照处理;2)随盐浓度的增大,叶片的比叶面积逐渐减小,其干物质含量则是先减小后增大,且均低于对照;3)随盐浓度增大,单位质量叶片氮含量(Nmass)和单位面积叶片氮含量(Narea)先降低后升高再降低,单位质量叶片磷含量(Pmass)先降低后升高,单位面积叶片磷含量(Parea)则是先不变后升高,说明骆驼刺对盐分环境有一定的适应性。
荒漠区;盐胁迫;骆驼刺;叶片性状;适应策略
随着气候的变化和土地的不合理利用,土壤盐渍化不断加深扩大,已成为一个世界性的问题[1]。全世界的盐碱地面积近10亿hm2,我国盐渍土面积约3.6×107hm2,占全国可利用土地面积的4.88%[2]。盐渍化不仅减少了全球可耕种的土地面积[3],而且限制了植物生长与产量[4],是当今干旱区农业发展的重要制约条件之一[5],已成为极其重要的农业与环境问题。
骆驼刺(Alhagisparsifolia)作为荒漠半荒漠地区多年生的豆科草本植物,在塔克拉玛干沙漠南缘绿洲过渡带具有防风固沙、改善生态与环境、维护绿洲生态安全的重要作用[6]。此外,骆驼刺具有良好的耐盐性[7]。策勒绿洲土壤盐渍化严重,地下水矿化度高[8],长期不合理的利用和破坏,使得绿洲外围的骆驼刺植被遭到严重破坏[6]。人工培育骆驼刺可用来加快塔克拉玛干沙漠南缘地区的植被恢复,因此,掌握骆驼刺对盐胁迫的适应机理对加快塔南地区植被恢复具有重要的意义。叶片性状作为反映植物对环境的高度适应能力及其在复杂生境下的自我调控能力,不仅能解释植物在不同环境梯度下的分布特征和适应环境的机制[9],而且能够预测生态系统对环境变化的重要响应,且其本身对生态系统过程也具有显著的影响[10]。因此,本研究以人工培育的当年生骆驼刺幼苗为研究对象,模拟策勒绿洲外围地下水及土壤盐分状况,通过比较不同盐浓度处理下骆驼刺幼苗叶片的相关性状,揭示骆驼刺在盐分胁迫下的叶片性状特征,以期为塔克拉玛干沙漠南缘植被恢复与重建提供理论依据。
1 研究区域与研究方法
1.1研究区概况
本研究在中国科学院策勒国家野外实验研究站进行。该区位于塔克拉玛干沙漠南缘、昆仑山北麓的策勒绿洲(80°03′24″-82°10′34″ E,35°17′55″-39°30′00″ N),海拔1 371 m,属于暖温带极端干旱荒漠气候,夏季炎热,干旱少雨,风沙灾害颇为严重,年均温11.9 ℃,年均降水量35.1 mm,且主要集中在5月和7月。蒸发量高达2 595.3 mm,干燥度为20.8。绿洲外围地下水盐分含量基本为中等浓度(Na+含量为40~50 mmol·L-1)。绿洲内植被资源贫乏,种类成分单调且数量稀少,受人为活动破坏严重;绿洲外围植被覆盖度多在5%以下,主要植物种有骆驼刺、多枝柽柳(Tamarixramosissima)等草本和灌木。
1.2研究方法
1.2.1种子处理供试骆驼刺种子采自策勒绿洲外围荒漠区骆驼刺群落。挑选饱满、大小适中且成熟度均致的种子,用98%的浓硫酸浸种10 min,破除其休眠。并用自来水和去离子水反复冲洗破除休眠后的种子,室温环境晾干,以备用于萌发试验。
1.2.2试验设计试验选用直径20 cm、高12 cm的花盆,装有取自骆驼刺群落生长地段的地表0-30 cm的风沙土。土壤质地均匀,肥力较低,装盆前过2 mm筛子去除石块等。为减少外界气温对种子出苗的影响,开挖深度为10 cm左右的小沟,将装好土壤的花盆置于其中。根据前人的研究结果[11],每盆均匀播种10粒种子,埋深为1.0 cm。出苗后待植株生长约60 d后,开始盐分处理。设置4个盐处理浓度:50、100、200、400 mmol·L-1,每个处理12个重复,共48盆。盐分处理液:策勒绿洲外围地下水+NaCl(分析纯)。试验所用水为策勒站地下水,矿化度在1.0 g·L-1左右。因此,将50 mmol·L-1处理作为对照。为了平衡水分蒸发,保证幼苗生长的正常水分条件,采用称重法,每天对幼苗进行灌水。
1.3采样与指标测定
2015年8月,对不同盐处理下的骆驼刺幼苗进行了测定和采样。首先,采用便携式光合测定仪(LI-6400XT,Li-COR,Lincoln,NE,USA)进行光合气体交换参数的测定。在骆驼刺幼苗向阳面选择叶片较多的同化枝进行测定,每个处理3个重复,每个样枝读取5个测量数据。依据前期对骆驼刺光合日变化的研究结果,以11:00所测的光合速率作为最大净光合速率(Pn)。用Image Plus Pro 6.0测定叶面积并计算净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。其次,对相同的叶片采用连续激发式荧光仪(PEA,Hansatech)进行荧光参数的测定。叶片暗适应20 min后,用3 000 μmol·(m2·s)-1饱和红闪光照射,记录荧光信号。参考Appenroth[12]的方法计算叶绿素荧光参数。最后,叶绿素含量的测定。在每个处理下的骆驼刺枝条上采集足够数量的叶子作为一个混合样,将所采集的叶片擦净污物,剪碎去脉混匀。叶绿素含量和类胡萝卜素含量测定采用95%乙醇提取法[13],每个指标测量3个重复。
将从野外采集回的叶片,在水下先剪去叶柄,然后将叶片完全浸没于去离子水中,在5 ℃的黑暗环境中储藏12 h,取出后迅速用吸水纸吸取叶片表面的水分,在万分之一电子天平上称重(饱和鲜重,kg),然后再用A3平板型扫描仪(Microtek FileScan,200 dpi)进行叶面积的扫描,然后用Image Plus Pro 6.0进行叶面积(m2)的计算。测定完叶面积的叶片,在105 ℃杀青15 min,75 ℃烘干至恒重,称其叶片干重(g)。将烘干至恒重的植物样品用植物粉碎机粉碎后,过1 mm筛制成供试样品。按照国家有关标准分析方法[14],叶片氮含量采用凯氏定氮仪法测定,叶片磷含量采用高氯酸、硫酸消化,钼锑抗比色法测定。
叶片干物质含量=叶片干重/叶片饱和鲜重;
比叶面积=叶片面积/叶片干重。
1.4数据处理
数据的处理用Excel 2007软件完成,并使用Origin 8.0软件作图。所有的数据均采用SPSS 19.0统计软件进行处理与分析,显著水平为0.05。不同盐处理下的骆驼刺幼苗叶性状差异性分析采用单因素方差分析法,用Pearson相关系数(two tailed)检验各性状间的相关显著性。
2 结果与分析
2.1不同浓度盐分处理对骆驼刺幼苗光合参数的影响
随着盐浓度的增加,骆驼刺幼苗Pn显著减小(P<0.05);Gs和Ci在低浓度(≤100 mmol·L-1)处理下无差异(P>0.05),在高浓度(>100 mmol·L-1)处理下显著减小(P<0.05);Tr则是先增大后减小,并且在100 mmol·L-1处理时达到最高;WUE先减小后增大,在100 mmol·L-1盐处理下最小;光合氮素利用效率(PNUE)先增大后减小,在100 mmol·L-1盐处理时达到最大(表1)。
2.2不同浓度盐分处理对骆驼刺幼苗叶绿素荧光特性的影响
随着盐浓度的增大,最小荧光(F0)先增大后减小再增大(图1);最大荧光(Fm)在200 mmol·L-1盐处理下最小,显著低于其它处理(P<0.05),且其它处理之间无显著差异(P>0.05);PSⅡ潜在活性(Fv/F0)和最大光化学效应(Fv/Fm)均随盐浓度的增大先减小后增大,并在200 mmol·L-1盐处理下降为最小。
2.3不同浓度盐分处理对骆驼刺幼苗叶绿素含量的影响
随着盐浓度的增大,叶绿素a和类胡萝卜素及叶绿素a/b均是先增大后减小,并在100 mmol·L-1盐处理下达到最大(表2);叶绿素b在不同浓度盐处理之间无差异(P>0.05);总叶绿素含量在各浓度处理下无差异(P>0.05),当浓度达到400 mmol·L-1时略有降低。
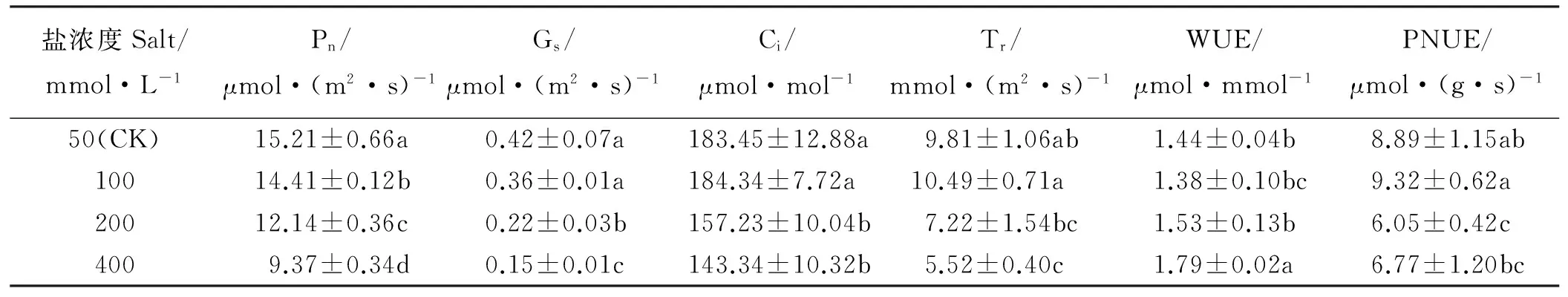
表1 不同浓度盐分处理对骆驼刺叶片光合的影响Table 1 Effects of salt concentration on photosynthetic parameters of A. sparsifolia
注:Pn,净光合速率;Gs,气孔导度;Ci,胞间CO2浓度;Tr,蒸腾速率;WUE,瞬时水分利用效率;PNUE,光合氮素利用效率。同列不同小写字母表示不同处理间差异显著(P<0.05)。下同。
Note:Pn, net photosynthetic rate on area basis; Gs, stomatal conductance; Ci, intercellular CO2concentration; Tr, transpiration rate; WUE, instantaneous water use efficiency; PNUE, photosynthetic nitrogen use efficiency. Different lower case letters within the same column mean significant difference among the different treatments at 0.05 level. The same below.

图1 不同浓度盐分处理下骆驼刺幼苗F0,Fm,Fv/F0和Fv/Fm值的变化Fig.1 Effect of different salt concentration on F0, Fm, Fv/F0 and Fv/Fm of A. sparsifolia
注:F0,最小荧光;Fm,最大荧光;Fv/F0,PSⅡ潜在活性;Fv/Fm,最大光化学效应。不同小写字母表示不同处理之间差异显著(P<0.05)。下同。
Note:F0, minimal fluorescence; Fm, maximum fluorescence; Fv/F0, potential activity of PSⅡ; Fv/Fm, maximum photo-chemical efficiency of PSⅡ. Different lower case letters indicate significant difference among different treatments at 0.05 level. The same below.
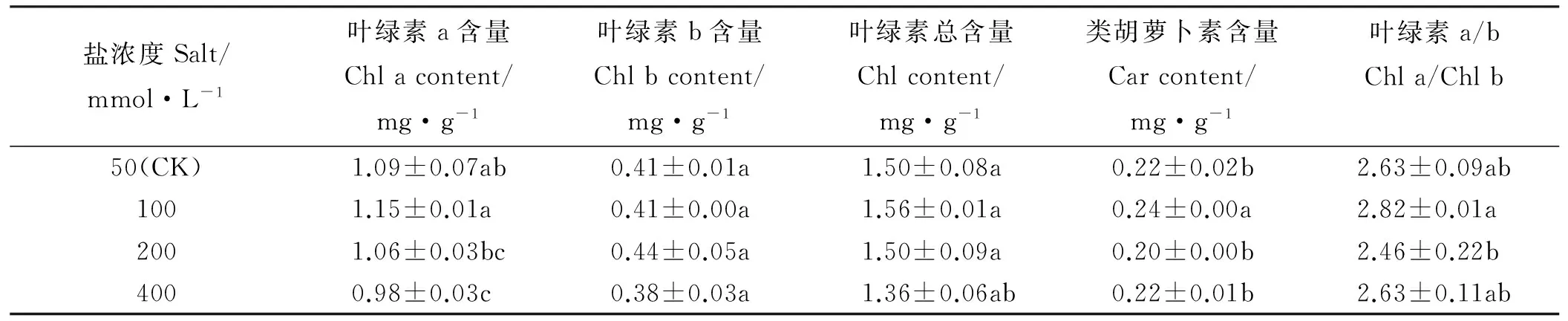
表2 不同浓度盐分处理对骆驼刺叶片光合色素含量的影响Table 2 Effects of different salt levels on photosynthetic pigments contents of A. sparsifolia
2.4不同浓度盐分处理对骆驼刺幼苗比叶面积和叶片干物质含量的影响
比叶面积随着盐浓度的增大逐渐减小,相比于对照50 mmol·L-1,比叶面积在高浓度(400 mmol·L-1)处理下减小了16.4%(P<0.05)(图2);叶片干物质含量随着盐浓度的增大先减小后增大,并在200 mmol·L-1处理下达到最小,相比于对照(50 mmol·L-1)减小了6.9%(P<0.05)。
2.5不同浓度盐分处理对骆驼刺幼苗叶片N、P含量及N∶P比的影响
随着盐浓度的增大,单位质量叶片氮含量(Nmass)先降低后升高再降低,并在200 mmol·L-1处理下达到最大,100和400 mmol·L-1处理下均低于对照(50 mmol·L-1)(P>0.05);单位质量叶片磷含量(Pmass)随着盐浓度增大先降低后升高,并在200 mmol·L-1处理下降为最小,较对照(50 mmol·L-1)显著降低了14.6%(P<0.05)。与Nmass相似,叶片N∶P随着盐浓度增大先降低后升高再降低,并在200 mmol·L-1处理下达到最大,较对照(50mmol·L-1)增大了17.8%(P>0.05)(图3)。
随着盐浓度增大,单位面积叶氮含量(Narea)先降低后升高再降低,并在200mmol·L-1处理下达到最大,100和400 mmol·L-1处理下均低于对照(50 mmol·L-1)(P>0.05);单位面积叶磷含量(Parea)在浓度(≤200 mmol·L-1)处理下,处理之间差异不显著(P>0.05),在400 mmol·L-1处理下显著增大,相比于对照(50 mmol·L-1)增加了17.8%(P<0.05)(图4)。

图2 不同浓度盐分处理对骆驼刺幼苗比叶面积和叶片干物质含量的影响Fig.2 Effects of different salt concentration on SLA and LDMC of A. sparsifolia

图3 不同浓度盐分处理对骆驼刺 幼苗Nmass,Pmass和N∶P的影响Fig.3 Effects of different salt concentration on Nmass, Pmass and N∶P of A. sparsifolia
注:Nmass,单位质量叶片氮含量;Pmass,单位质量叶片磷含量。
Note:Nmass, nitrogen concentration on mass basis; Pmass, phosphorus concentration on mass basis.
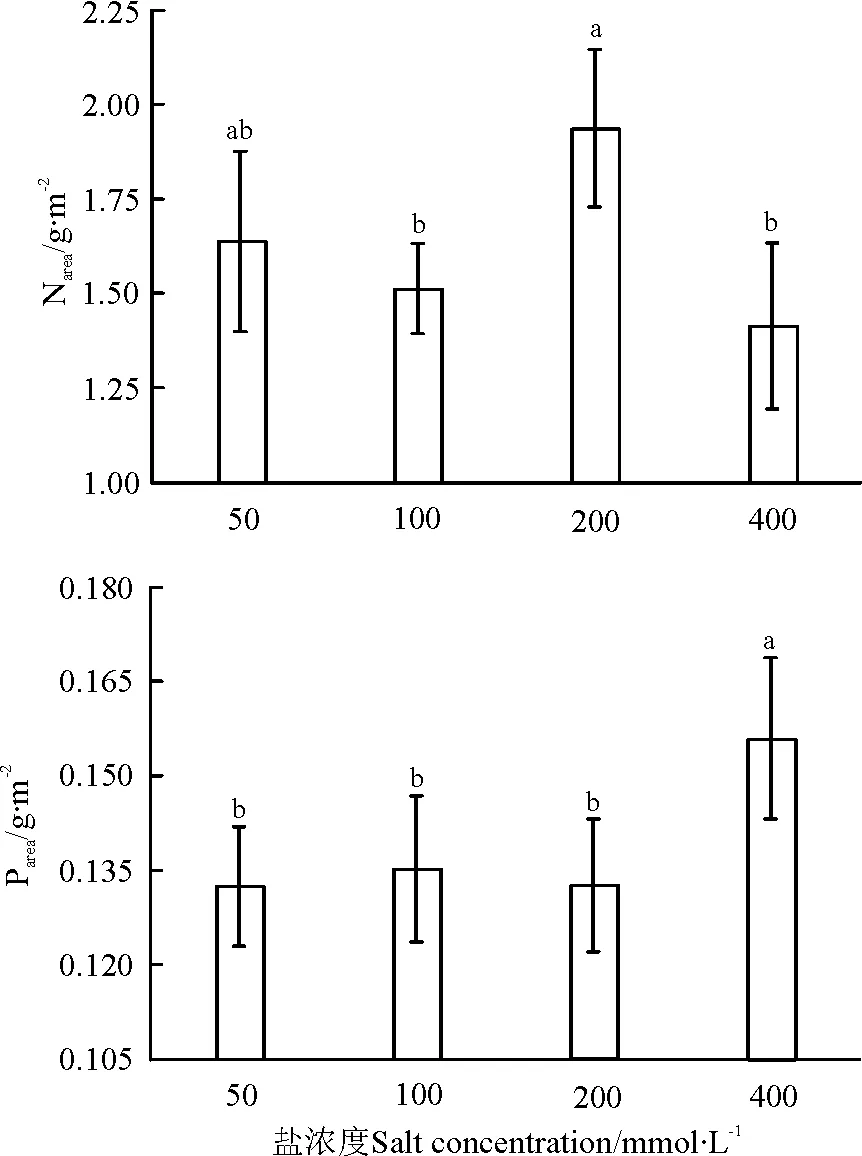
图4 不同浓度盐分处理对骆驼刺幼苗Narea和Parea的影响Fig.4 Effects of different salt concentration on Narea and Parea of A. sparsifolia
注:Narea,单位面积叶氮含量;Parea,单位面积叶磷含量。
Note:Narea, nitrogen concentration on area basis; Parea, phosphorus concentration on area basis.
2.6不同浓度盐分处理下骆驼刺幼苗叶片性状间的关系
分析结果表明,Pn与SLA呈极显著的正相关关系(R2=0.695 87,P<0.001);Pn与LDMC呈显著的正相关关系(R2=0.374 44,P<0.05);LDMC与SLA呈显著正相关(R2=0.311 89,P<0.05);PNUE与LDMC呈极显著正相关(R2=0.729 06,P<0.001)(图5)。

图5 不同浓度盐分处理下骆驼刺幼苗叶片比叶面积(SLA),光合速率(Pn), 干物质含量(LDMC)和光合氮素利用效率(PNUE)之间的关系Fig.5 Relationship of specific leaf area, net photosynthetic rate on area basis, leaf dry matter content and photosynthetic nitrogen use efficiency of A. sparsifolia under different salt treatments
3 讨论
叶片性状能够反映植物适应环境变化所形成的生存对策[15],是植物基本行为和功能的具体体现,它们共同体现了植物为了获得最大化碳收获所釆取的生存适应策略[16-17],具有重要的生态学和生物进化意义[18-20]。盐分胁迫对植物的影响是多方面的,一方面表现为对植物器官的毒害作用,另一方面则表现为抑制植物的生长发育及生理代谢,其中很重要的是影响光合作用。本研究中,随着盐浓度的增大,骆驼刺的Pn、Gs、Ci与Tr整体呈降低趋势。瞬时水分利用效率在盐浓度小于200 mmol·L-1时,处理之间差异不显著(P>0.05),当盐浓度达到400 mmol·L-1时,显著增大(P<0.05),说明骆驼刺通过提高水分利用效率来适应盐胁迫环境。光合氮利用效率是衡量植物利用氮营养、合理分配氮素的能力的重要指标[21],本研究显示:在盐浓度<100 mmol·L-1时,氮素利用效率在处理之间无差异;但当浓度大于200 mmol·L-1时,氮素利用效率较对照显著降低,说明盐胁迫降低了骆驼刺氮素利用效率。
叶绿素含量的升高代表植物光合能力增强,相反,叶绿素含量的降低代表植物光合能力的减弱[22]。本研究中,不同盐浓度处理对骆驼刺叶片Chl a、类胡萝卜素和Chl a/b的影响一致,在100 mmol·L-1处理下含量最大,说明低浓度盐分处理对骆驼刺叶片潜在光合能力有促进作用。苜蓿(Medicagosativa)在胁迫条件下也会发生一系列生理生化的变化来提高它对胁迫环境的抵抗能力[23],相反的,高浓度盐分处理则对苜蓿有明显抑制作用。植物叶片叶绿素荧光的变化情况在一定程度上可以反映外界环境对植物的影响[24]。本研究显示,在盐胁迫下初始荧光F0较对照大;最大荧光产量Fm仅在200 mmol·L-1处理下最小,其它处理之间无差异;PSⅡ潜在活性Fv/F0与最大光化学效应Fv/Fm均随盐浓度增大先降低后升高。最大光化学量子产量Fv/Fm反映了PSⅡ的最大光能转化效率,在一般生长条件下变化极小,基本不受物种和生长条件的影响,但是在逆境下该参数呈明显下降趋势[25],本研究结果基本符合该结论。
作为植物功能生态学研究中最常用的性状[26],比叶面积和叶片干物质含量在植物叶片功能中发挥着重要作用,它不仅能反映光捕获能力和碳构建成本,而且能反映植物对资源获取和利用情况[10],研究表明,叶片干物质含量高,比叶面积小的植物资源获取能力强,更能在逆境中占优势[27]。本研究中,比叶面积随着盐浓度的增大逐渐减小,而叶片干物质含量则是先减小后增大。在400 mmol·L-1处理下骆驼刺比叶面积显著低于对照,导致骆驼刺叶片变厚,使叶片内部水分向叶片传导距离增加,进而降低植物体内水分散失[28],使得蒸腾速率显著降低,水分利用效率上升。最终导致骆驼刺获取光能的能力减弱,生物量积累显著减小[29]。进一步分析发现,盐胁迫改变了叶片的比叶面积,进而影响叶片的光合作用,光合能力的下降,使得碳同化减少,又反过来影响叶片的生长。
植物叶片营养元素含量的变化,不仅表明了它与环境因子之间的耦合关系,而且从另一个方面反映了植物对环境的适应性[30]。氮是植物重要的生命元素,它对叶绿素、蛋白质等物质的合成和能量传递过程至关重要[31],并且其含量的变化能够直接影响叶片中光合酶的含量,从而进一步影响植物的光合能力[18]。本研究表明,随着盐浓度的增大,Nmass先降低后升高再降低,并在200 mmol·L-1处理下达到最大,这是因为低浓度盐处理促进骆驼刺生长,氮素在植物体内被稀释。随着盐浓度增大,骆驼刺积累大量盐离子产生离子毒害,生长受到抑制。研究表明,水分供应状况对植物的N、P含量有一定影响[30],本研究中由于外界盐分引起土壤水分中的可利用水下降,产生水分胁迫,进而也会造成Nmass降低。随着盐浓度的增大,Pmass则是先降低后升高,并在200 mmol·L-1处理下降为最小。单位面积氮、磷含量(Narea、Parea)综合反映了Nmass、Pmass和比叶面积的变化,本研究中,Narea随盐浓度的增大先减小后增大再减小,在200 mmol·L-1处理下达到最大。较高的单位面积叶氮含量反映了植物对水分胁迫的一种适应策略,本研究结果说明骆驼刺对该浓度有一定的适应性。Parea在浓度小于200 mmol·L-1盐处理之间无显著差异,在400 mmol·L-1处理下,相比于对照上升了17.8%。
4 结论
1)盐胁迫降低了骆驼刺的光合能力,其净光合速率与蒸腾速率均显著减小,而水分利用效率则显著增大;荧光参数Fv/F0和Fv/Fm在盐处理下均低于对照;比叶面积和叶片干物质含量显著减小;其Nmass和Narea在400 mmol·L-1处理下均低于对照,而Parea则是显著增大。
2)在盐胁迫环境下,骆驼刺叶片由较薄、具有较高光合速率的开拓性策略转变为叶片较厚、具有较低光合速率的保守性策略,并通过提高水分利用效率和单位面积叶氮含量等方式来适应盐胁迫环境,体现了骆驼刺为生存在严酷条件下所采取的适应策略。这对指导在极端环境条件下减缓荒漠化,加快塔克拉玛干沙漠南缘植被恢复与重建具有重要的理论和现实意义。
References:
[1]张其德.盐胁迫对植物及其光合作用的影响(下).植物杂志,1999(2):32-33.
[2]杨劲松.中国盐渍土研究的发展历程与展望.土壤学报,2008,45(5):837-845.
Yang J S.Development and prospect of the research on salt-affected soils in China.Acta Pedologica Sinica,2008,45(5):837-845.(in Chinese)
[3]Munns R,Tester M.Mechanisms of salinity tolerance.Annual Review of Plant Biology,2008,59:651-81.
[4]Kennedy B F,Filippis L F D.Physiological and oxidative response to NaCl of the salt tolerantGrevilleailicifoliaand the salt sensitiveGrevilleaarenaria.Journal of Plant Physiology,1999,155(6):746-754.
[5]李雁博,张蕴薇,哈依夏,杜金鸿,刘源,陈果,王佺珍.须芒草、虉草和柳枝稷对干旱和盐胁迫的生理响应.草业科学,2014,31(5):905-914.
Li Y B,Zhang Y W,Hayixia,Du J H,Liu Y,Chen G,Wang Q Z.Physiological responses of bluestem,reed canary grass and switch grass under drought and sanility stress.Pratacultural Science,2014,31(5):905-914.(in Chinese)
[6]曾凡江,张希明,李小明.骆驼刺植被及其资源保护与开发的意义.干旱区地理,2002,25(3):286-288.
Zeng F J,Zhang X M,Li X M.Study on the characteristics ofAlhagiand its impact on resource protection and development.Arid Land Geography,2002,25(3):286-288.(in Chinese)
[7]Arndt S K,Arampatsis C,Foetzki A,Li X Y,Zeng F J,Zhang X M.Contrasting patterns of leaf solute accumulation and salt adaptation in four phreatophytic desert plants in a hyperarid desert with saline groundwater.Journal of Arid Environments,2004,59(2):259-270.
[8]张希明,Runge M.塔克拉玛干沙漠边缘植被可持续管理的生态学基础.北京:科学出版社,2006:53-84,129-130.
Zhang X M,Runge M.Ecological Basis of the Edge of the Taklimakan Desert Vegetation Sustainable Management.Beijing:Science Press,2006:53-84,129-130.(in Chinese)
[9]Kazakou E,Navas M L.Variation in intensity of competition along a mediterranean successional gradient.In:Arianoutsou M,Papanastasis V P.(eds).Ecology,Conservation and Management of Mediterranean Climate Ecosystems.Rotterdam,The Netherlands:Millpress,2004:25-51.
[10]Cornelissen J H C,Lavorel S,Garnier E,Diza S,Buchmann N,Gurvich D E,Reich P B,Steege H,Morgan H D,Heijden M G A,Pausas J G,Poorter H.A handbook of protocols for standardised and easy measurement of plant functional traits worldwide.Australian Journal of Botany,2003,51(4):335-380.
[11]张占江,徐海量,石书兵,李吉玫.水分、盐分和埋深对铃铛刺和疏叶骆驼刺种子萌发的影响.干旱区地理,2008,31(5):687-692.
Zhang Z J,Xu H L,Shi S B,Li J M.Effect of water supply,salinity and buried depth on the seed germination ofHalimodendronhalodendronandAlhagisparsifolia.Arid Land Geography,2008,31(5):687-692.(in Chinese)
[12]Appenroth K J,Stockel J,Srivastava A,Strasser R J.Multiple effects of chromate on the photosynthetic apparatus ofSpirodelapolyrhizaas probed by OJIP chlorophyll a fluorescence measurements.Environment Pollution,2001,115:49-64.
[13]李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:34-178.
[14]鲍士旦.土壤农化分析.第3版.北京:中国农业出版社,2005:216-218.
[15]Vendramini F,Diaz S,Gurvich D E,Wilson P J,Thompson K A.Leaf traits as indicators of resource-use strategy in floras with succulent species.New Phytologist,2002,154(1):147-157.
[16]Kikuzawa K.A cost-benefit analysis of leaf habit and leaf longevity of trees and their geographical pattern.American Naturalist,1991,138(5):1250-1263.
[17]Cordell S,Goldstein G,Meinzer F C,Vitousek P M.Regulation of leaf life-span and nutrient-use efficiency ofMetrosiderospolymorphatrees at two extremes of a long chronosequence in Hawaii.Oecologia,2001,127(2):198-206.
[18]Chapin F S,Bloom A J,Field C B,Waring R H.Plant responses to multiple environmental factors.Bioscience,1987,37(1):49-57.
[19]Wright I J,Groom P K,Lamont B B,Poot P,Prior L D,Reich P B,Schulze E D,Veneklaas E J,Westoby M.Leaf trait relationships in Australian plant species.Functional Plant Biology,2004,31(5):551-558.
[20]张林,罗天祥.植物叶寿命及其相关叶性状的生态学研究进展.植物生态学报,2004,28(6):844-852.
Zhang L,Luo T X.Advances in ecological studies on leaf life span and associated leaf traits.Chinese Journal of Plant Ecology,2004,28(6):844-852.(in Chinese)
[21]朱军涛,李向义,张希明,林丽莎,杨尚功.塔克拉玛干沙漠南缘豆科与非豆科植物的氮分配.植物生态学报,2010,34(9):1025-1032.
Zhu J T,Li X Y,Zhang X M,Lin L S,Yang S G.Nitrogen allocation and partitioning within a leguminous and two non-leguminous plant species growing at the southern fringe of China’s Taklamakan desert.Chinese Journal of Plant Ecology,2010,34(9):1025-1032.(in Chinese)
[22]罗维成,曾凡江,刘波,张利刚,刘镇,宋聪,彭守兰,彭慧清.绿洲-沙漠过渡带引种植物光合生理特征研究.草业学报,2013,22(4):273-280.
Luo W C,Zeng F J,Liu B,Zhang L G,Liu Z,Song C,Peng S L,Peng H Q.Photosynthetic and physiological characteristics of introduced plants at the desert-oasis ecotone.Acta Prataculturae Sinica,2013,22(4):273-280.(in Chinese)
[23]王玉祥,张博,王涛.盐胁迫对苜蓿叶绿素、甜菜碱含量和细胞膜透性的影响.草业科学,2009,26(3):53-56.
Wang Y X,Zhang B,Wang T.Effect of salt stress on the contents of chlorophyll and betaine and its membrane permeability ofMedicagosativa.Pratacultural Science,2009,26(3):53-56.(in Chinese)
[24]Jiang C D,Gao H Y,Zou Q.Changes of donor and acceptor side in photosystem Ⅱ complex induced by iron deficiency in attached soybean and maize leaves.Photosynthetica,2003,41(2):267-271.
[25]许大全,张玉忠,张荣铣.植物光合作用的光抑制.植物生理学通讯,1992,28(4):237-243.
Xu D Q,Zhang Y Z,Zhang R X.Photoinhibition of photosynthesis in plants.Plant Physiology Communications,1992,28(4):237-243.(in Chinese)
[26]周道玮.植物功能生态学研究进展.生态学报,2009,29(10):5644-5655.
Zhou D W.Aphylogenic approach to comparative functional plant ecology.Acta Ecologica Sinica,2009,29(10):5644-5655.(in Chinese)
[27]Wilson P J,Ken T,Hodgson J G.Specific leaf area and leaf dry matter content as alternative predictors of plant strategies.New Phytologist,2002,143(1):155-162.
[28]祁建,马克明,张育新.北京东灵山不同坡位辽东栎(Quercusliaotungensis)叶属性的比较.生态学报,2008,1(1):122-128.
Qi J,Ma K M,Zhang Y X.Comparisonson leaf traits ofQuercusliaotungensison different slope positions in Dongling Moutain of Beijing.Acta Ecologica Sinica,2008,1(1):122-128.(in Chinese)
[29]曾杰,曾凡江,Arndt S K,郭海峰,闫海龙,邢文娟,刘波.NaCl对骆驼刺幼苗生长、生理和离子分布特性的影响.科学通报,2008,53(2):151-158.
Zeng J,Zeng F J,Arndt S K,Guo H F,Yan H L,Xing W J,Liu B.The effect of NaCl on seedling growth,physiological characteristics and ion distribution ofAlhagisparsifolia.Chinese Science Bulletin,2008,53(2):151-158.(in Chinese)
[30]王振南,杨惠敏.植物碳氮磷生态化学计量对非生物因子的响应.草业科学,2013,30(6):927-934.
Wang Z N,Yang H M.Response of ecological stoichiometry of carbon,nitrogen and phosphorus in plants to abiotic environmental factors.Pratacultural Science,2013,30(6):927-934.(in Chinese)
[31]吴能表,李琳琳,杨卫星,周忆堂.光强对长春花叶片碳氮及次生代谢产物积累的影响.草业科学,2014,31(8):1508-1514.
Wu N B,Li L L,Yang W X,Zhou Y T.Effects of light in tensity on carbon-nitrogen metabolism and secondary metabolite ofCatharanthusroseusleaves.Pratacultural Science,2014,31(8):1508-1514.(in Chinese)
(责任编辑武艳培)
Effects of salt stress on leaf traits ofAlhagisparsifolia
Zhao Sheng-long1,2,3,4, Zeng Fan-jiang1,2,3, Zhang Bo1,2,3,4,Liu Bo1,2,3, Gao Huan-huan1,2,3,4, Luo Han-lin1,2,3,4
(1.State Key Laboratory of Desert and Oasis Ecology, Xinjiang Institute of Ecology and Geography,Chinese Academy of Sciences, Urumqi 830011, China;2.Cele National Station of Observation and Research for Desert-Grassland Ecosystems, Cele 848300, China;3.Key Laboratory of Biogeography and Bioresource in Arid Zone, Chinese Academy of Sciences, Urumqi 830011, China;4.University of Chinese Academy of Sciences, Beijing 100049, China)
Desert region salinization is being accelerated because of climate change and anthropogenic disturbance, resulting in major ecological problems. Studying the leaf traits response of desert species to salt stress is of great importance to understand its adaptation to salinization. A pot experiment were applied to study the effect of different salt concentrations (50, 100, 200, 400 mmol·L-1) on leaf traits ofAlhagisparsifoliain the first growing season. The results showed that: (1) Salt stress reduces the photosynthetic capacity ofA.sparsifolia, the net photosynthetic rate and transpiration rate were significantly decreased, while water use efficiency is on the rise as salt stress increasing. The fluorescence parameters of Fv/F0and Fv/Fmin the salt treatment were lower than the control. (2) With the increase of salt stress, the specific leaf area ofA.sparsifoliagradually reduced, the leaf dry matter content reduced first and then increased, and all of them were lower than the control. (3) With the increase of salt stress, Nmassand Nareain leaves declined first and then ascended, and reduced again. Pmassdecreased first and then increased. However, Parea showed less change first and increased later. These results showed that theA.sparsifoliacould adapt to saline environment morphologically and physiologically.
Lysimachiadavurica; drought stress; rewatering; morphological indicators; physiological indices
Zeng Fan-jiangE-mail:zengfj@ms.xjb.ac.cn
10.11829/j.issn.1001-0629.2015-0643
2015-11-17接受日期:2016-05-30
新疆维吾尔族自治区科技支撑计划项目(201433114);国家基金委-新疆联合基金重点项目(U1203201);国家自然科学基金项目(41371516)
赵生龙(1989-),男,甘肃兰州人,在读硕士生,主要从事荒漠植物生理生态研究。E-mail:13619398146@163.com
曾凡江(1966-),男,河南镇平人,研究员,博导,博士,主要从事荒漠植物生理生态研究。E-mail:zengfj@ms.xjb.ac.cn
Q945.34
A
1001-0629(2016)9-1770-09*
赵生龙,曾凡江,张波,刘波,高欢欢,罗瀚林.盐分胁迫对骆驼刺幼苗叶片性状的影响.草业科学,2016,33(9):1770-1778.
Zhao S L,Zeng F J,Zhang B,Liu B,Gao H H,Luo H L.Effects of salt stress on leaf traits ofAlhagisparsifolia.Pratacultural Science,2016,33(9):1770-1778.

