苜蓿-根瘤菌复合盐高效抗性共生体系构建
陈利云,王弋博,李三相,汪之波
(天水师范学院生物工程与技术学院, 甘肃省农业微生物重点实验室,甘肃 天水 741001)
苜蓿-根瘤菌复合盐高效抗性共生体系构建
陈利云,王弋博,李三相,汪之波
(天水师范学院生物工程与技术学院, 甘肃省农业微生物重点实验室,甘肃 天水 741001)
为构建具有盐渍土环境竞争力与遗传稳定性的苜蓿(Medicago)-根瘤菌高效共生体系,以12个苜蓿品种为材料,进行了复合盐种子萌发、种子内生根瘤菌抗盐碱筛选及接种试验。结果表明,不同品种间种子复合盐抗性差异较大,成活率以中苜1号最高,甘农7号、新疆大叶次之,但三者间无显著差异;种子内生根瘤菌复合盐抗性以甘农1号最强,菌株数目最丰,为2.58×106,中苜1号次之,为2.49×106,根瘤菌固氮酶活性以中苜1号最高;以新疆大叶种子接种中苜1号根瘤菌匹配度为最佳,共生体系地上生物量、茎叶粗蛋白含量以及固氮酶活性均为最高。
苜蓿;内生根瘤菌;复合盐;固氮酶活性;共生体系
土壤盐渍化是世界各国高度关注的生态问题,近年来,随着人类活动对自然环境影响的不断加剧,土壤盐渍化已成为制约现代农业可持续发展的重要因素[1]。实践证明,土壤盐渍化无法根治,但耐盐植物对盐渍土有明显的改良作用,是盐渍土治理中最具潜力的措施[2]。苜蓿(Medicago)是中等耐盐性豆科牧草,固氮量大、产量高、抗逆性强,被广泛应用于盐渍土改良[3-4],根瘤菌是能与豆科植物共生的一类植物内生菌,除能固氮外,还能通过分泌生长素、溶解有机磷等多种促生作用促进宿主植物生长并增强抗逆性[5]。目前,利用植物内生菌的这种生物强化作用构建植物-微生物体系进行联合修复是盐渍土治理的新方向,苜蓿-根瘤菌共生体系是其中的应用典范。
自然界中盐、碱胁迫通常同时发生,高浓度混合盐碱对生物的损伤强于单盐或单碱,但已有的苜蓿与根瘤菌耐盐性研究大多都在单盐条件下进行,在生产实践中的应用效果往往较差。因此,要使苜蓿、根瘤菌菌株在实际生产中真正发挥作用,耐盐共生体的构建必须紧密结合实际的复合盐碱土壤环境。本研究以12个苜蓿品种及种子内生根瘤菌为材料,采用平板抗性筛选及盆栽试验,在苜蓿与内生根瘤菌复合盐抗性研究的基础上,构建适应实际盐渍土环境的苜蓿-根瘤菌高效共生体系,以期为植物-微生物联合体系在盐渍土改良中的应用奠定基础。
1 材料与方法
1.1试验材料
选取12个苜蓿品种,其中7个为国内育成品种,主要种植地为甘肃、新疆等西部省(区),5个为国外引进的高产优质品种,原产地及种子来源见表1。
表1 12个苜蓿品种产地及来源Table 1 Origin and source of 12 alfalfa cultivars
1.2试验方法
1.2.1土样采集和盐分测定土样来自“甘肃省河西走廊兰州大学草地农业科技学院临泽试验站”中度盐渍土壤,采集时间为2014年7月,主要以硫酸盐-氯化物为主,pH为8.3,呈碱性。土壤采集采用正方形五点取样法,每点取土壤上层0-30 cm土样3份,每份约5 kg,充分混合自然风干碾碎,置4 ℃保存。复合盐由土壤水浸提液熬制结晶而成,取混合土样3 kg于5 L蒸馏水中浸泡24 h,每1 h搅拌1次,8 h取1次上清液,共浸提3次,将浸提液加热蒸发析出晶体,采用过氧化氢除去晶体色素得到复合盐,复合盐组成及含量采用原子吸收法和滴定方法进行测定。得出每千克土样离子含量CO32-为4.21%、HCO3-为3.75%、 SO42-为33.72%、Cl-为13.56%、 Na+为17.24%、Mg2+为27.65%、 Ca2+为7.93%、 K+为2.17%,根据土样中各离子浓度配制复合盐溶液以模拟中度盐渍土含盐量,即每千克复合盐溶液含Na2CO342.1 g、KCl 21.7 g、CaCl279.3 g、NaHCO337.5 g、MgSO4276.5 g、Na2SO460.7 g。
1.2.2种子萌发将精选的苜蓿种子先用95%乙醇处理5 min,再用0.1%氯化汞处理5 min,无菌水冲洗7次后,平铺于灭菌培养皿中含有少量复合盐溶液的无菌纱布之上,根据缺水情况加入适量复合盐溶液,28 ℃黑暗培养,观察记录种子发芽情况;相同萌发条件下设置对照,即把复合盐溶液换为蒸馏水,每处理3个重复。
发芽率=种子发芽数/种子总数×100%;
校正发芽率=复合盐的种子发芽率/对照的种子发芽率×100%。
死亡率是指有胚芽活力的种子在萌发过程中的死亡率,计算公式:
死亡率=萌发死亡数/种子总数×100%;
校正死亡率=复合盐的种子死亡率/对照的种子死亡率×100%。
1.2.3种子内生根瘤菌复合盐培养将以上处理好的苜蓿种子0.1 g在灭菌研钵中加2 mL无菌水充分研磨,离心10 min (4 000 r·min-1)后取(上清液1 mL配制浓度为10-6)稀释液80 μL接种于YMA刚果红培养基,培养基中的蒸馏水以复合盐溶液浓度代替,28 ℃培养;相同培养条件下设置对照,即把复合盐溶液换为蒸馏水,每处理3个重复,6 d后记录单菌落数量,进行革兰氏染色及形态学镜检区分,选择菌落均匀、每平板1~30个菌落的稀释度计算每品种种子内生根瘤菌的最大可能的菌株数,初步鉴别确定为根瘤菌后再进行固氮酶活性检测(乙炔还原法)[6],置平板于4 ℃保存。
1.2.4接种与盆栽分别将筛选出的耐复合盐苜蓿种子进行萌发和根瘤菌振荡培养,同时将盐渍土样装入口径10 cm、深13 cm的盆中,种子萌发至芽长1 cm时,用菌液浸泡苜蓿幼苗15 min后,每盆栽植10株,3个重复;相同条件下设置对照,即把盐渍土换为田间土壤,培养温度为(22±3) ℃、光强7 000~8 000 lx,光照时间12 h,根据盆中失水情况适时补充蒸馏水,管理期为60 d。
1.2.5测定方法培养至60 d时开始观测结果,测定项目包括每盆总瘤数及根瘤固氮酶活性(乙炔还原法)、地上和地下部分鲜重(在收获时称重)、地上部分干重(先在烘箱中120 ℃杀青40 min,然后在60 ℃烘干48 h称重)和粗蛋白含量(采用凯氏定氮法测定[7])。
1.3数据处理
采用SPSS 16.0统计软件进行复合盐种子萌发、内生根瘤菌与盆栽处理的单因素方差分析(One-way ANOVA),并对有显著效应的各处理数据进行DUNCAN检验。
2 结果与分析
2.1不同复合盐处理下12个苜蓿品种的发芽率与死亡率
由于种子的产地来源及休眠级别不同,种子发芽率也不同(表2),以阿尔冈金和甘农8号最高(100%),太阳神、甘农1号、中苜1号、三得利和金皇后5个品种较低,金皇后最低(46.7%)。与对照相比,复合盐溶液导致种子发芽率明显下降,其中阿尔冈金最高(76.0%),金皇后最低(20.7%)。校正发芽率以阿尔冈金、甘农8号、陇东苜蓿、太阳神、中苜1号较高,显著高于新疆大叶、牧歌、甘农1号、三得利以及金皇后(P<0.05)。复合盐试验中,已发芽的种子随着生长时间的推移出现死亡现象,对照培养中种子死亡率与复合盐种子死亡率相比,阿尔冈金校正死亡率最高,为69.4%,甘农7号与中苜1号最低,均为8%。
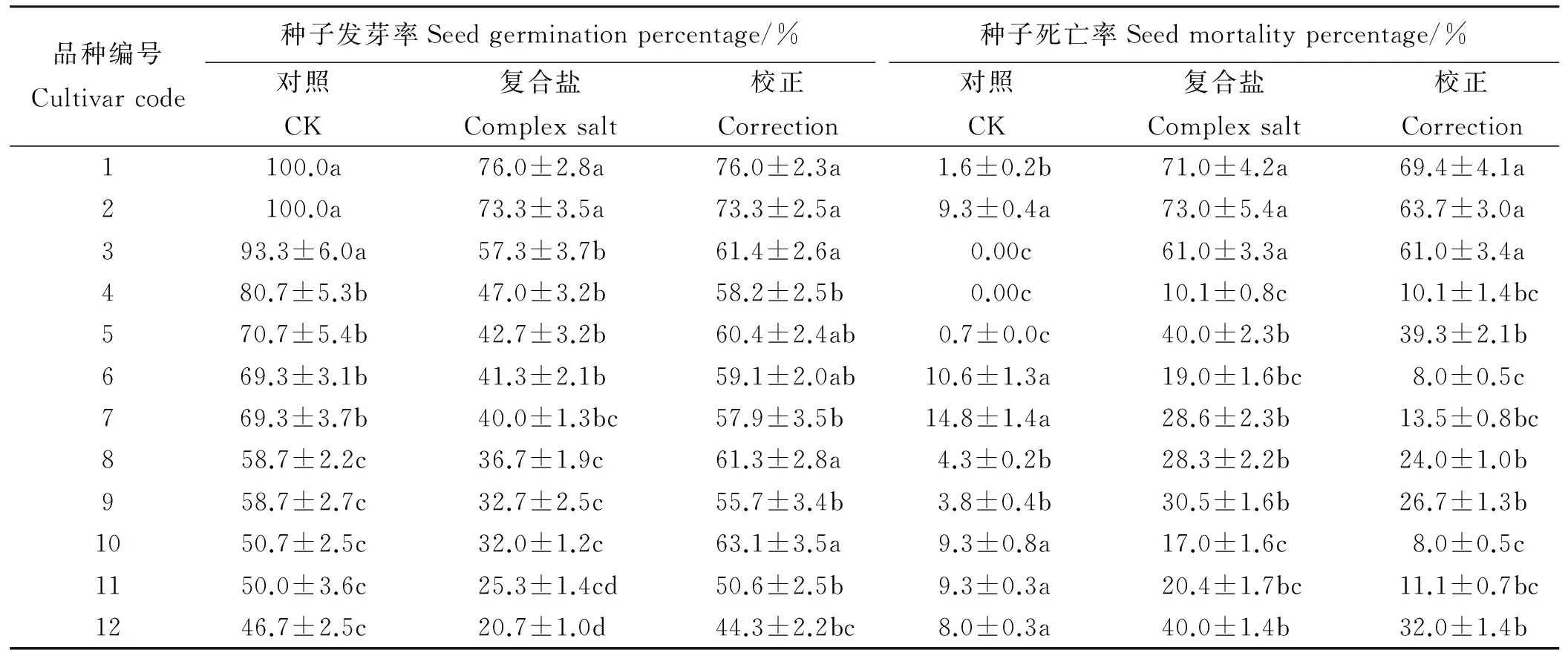
表2 不同品种苜蓿复合盐发芽率与死亡率Table 2 Germination percentage and death rate of 12 alfalfa cultivars under complex salt
注:数据均为均值±标准误差(n=3),同列不同小写字母差异显著(P<0.05)。表3、表4同。
Notes: Data present as mean±standard error. Values with different lower case letters within the same column indicate significant difference at 0.05 level. The same in Table 4 and Table 5.
2.212个苜蓿品种幼苗复合盐存活率
复合盐种子萌发7 d后将其置于光照培养箱中培养,待幼苗长势稳定后,记录不同品种幼苗的存活率(图1),幼苗存活率以中苜1号最高(55.1%),甘农7号(51.1%)次之,与新疆大叶(48.1%)、牧歌(44.4%)和三得利()间无显著差异(P>0.05),与其它品种间有显著差异(P<0.05),甘农3号、太阳神、甘农1号较低,陇东最低,仅为0.4%。

图1 不同品种苜蓿萌发种子复合盐幼苗成活率Fig.1 Survival rate of different alfalfa cultivars combined with salt
注:图中不同小写字母表示差异显著(P<0.05)。
Note: Different lower case letters indicate significant difference among different alfalfa cultivars at 0.05 level.
2.3种子内生根瘤菌复合盐抗性菌株数及固氮酶活性
种子内生根瘤菌复合盐抗性培养根瘤菌菌株数目以甘农1号和中苜1号最高,与其它品种间有显著差异,甘农3号和甘农7号最低,显示出中苜1号种子内生根瘤菌复合盐抗性最强(表3)。根瘤菌固氮酶活性结果表明,中苜1号最高,为3.54 μmol C2H2·(m2·h)-1,阿尔冈金次之,为3.31 μmol C2H2·(m2·h)-1,甘农7号最低,为1.09 μmol C2H2·(m2·h)-1,与新疆大叶、金皇后外的其它品种间差异显著(P<0.05)。
2.4紫花苜蓿-根瘤菌最佳共生体系构建
以中苜1号种子内生根瘤菌接种中苜1号、甘农7号、新疆大叶和牧歌4个苜蓿品种构建共生体系(表4),与对照相比,4个苜蓿品种接种后地上生物量、粗蛋白含量、结瘤数及根瘤固氮酶活性均有明显增加;单株地上生物量干重以新疆大叶最高,为0.453 g,甘农7号次之(0.407 g),且二者间无显著差异(P>0.05),粗蛋白含量以牧歌最低,为18.09%,与新疆大叶、中苜1号及甘农7号间差异显著(P<0.05),单株根系结瘤数以中苜1号最多,为78.13个,根瘤固氮酶活性以新疆大叶最高,为3.921 μmol C2H2·(m2·h)-1。以上结果表明,新疆大叶接种中苜1号种子内生根瘤菌为复合盐条件下的最佳共生体系。

表3 不同品种苜蓿种子内生根瘤菌复合盐 菌株数及固氮酶活性Table 3 Number rhizobia of different alfalfa varieties seeds strains and nitrogenase activity of mixed salt
3 讨论
种子萌发是种子植物生命的起点,是植物生活史中对外界环境最为敏感的阶段,也是决定植物能否在环境中定居的关键时期[8],本研究中12个品种的苜蓿种子复合盐抗性不同,地方品种普遍强于引进品种,这可能与品种自身的进化和对当地自然环境的适应过程有关。研究表明,盐胁迫能加速蛋白质的分解,使脯氨酸含量升高,促进植物对水分的吸收,减轻盐害程度[9]。自然界中盐碱土壤是一种复杂的复合生态环境,与单一的中性盐或碱性盐胁迫不同,在复合盐碱土壤中生长的植物,除了渗透胁迫和离子毒害两个方面的胁迫,还涉及到高pH胁迫,几种中性盐和碱性盐混合在一起后,离子之间具有协同效应与交互作用,要比单纯的某种因素复杂得多,通常碱性盐分胁迫对种子萌发的抑制作用要大于中性盐胁迫[10-11]。如根据东北松嫩草原盐碱土的成分设置的混合盐碱条件对羊草(Leymuschinensis)的胁迫程度强于碱胁迫的[12],单纯的盐度或高pH对紫花苜蓿的危害远不如二者共同作用时严重[13]。本研究中所采土样是以硫酸盐-氯化物为主的复合盐渍土,pH为8.3,虽然陇东、甘农8号在复合盐条件下种子萌发率很高,但萌发种子在复合盐条件下的死亡率同样很高,致使种子成活率极低,可能与这些紫花苜蓿品种对复合盐中少量的碱性盐与高pH环境较为敏感有关。

表4 不同品种苜蓿接种根瘤菌共生体系复合盐构建Table 4 Rhizobia inoculated on alfalfa cultivars of high efficient symbiontic under mixed salt
根瘤菌是生活在植物组织内部较为典型的植物内生菌,经过长期的自然选择与宿主植物间形成了紧密的共生关系,与根际其它微生物相比,在抵御外界生物及非生物环境压力方面都具有较强的生存优势。大量研究表明,根瘤菌与宿主植物共生显示了多方面的促生作用,在增强植物抗逆性方面起到了积极的作用,与宿主植物其它部位相比,种子内生根瘤菌的抗逆性更强[14-15],复合盐环境中碱性盐能使植物根系外环境中的pH升高,而不适宜的pH会影响到根瘤菌的生存繁殖。本研究中,种子内生根瘤菌数量分布与菌株固氮酶活性无相关性,中苜1号的内生根瘤菌与固氮酶活性均较高。高效的紫花苜蓿-根瘤菌共生体系构建中,宿主植物对共生体总变异的贡献约为30%,接种菌株为26%,超过36%的变异是由紫花苜蓿与根瘤菌的互作引起的[16],因此,根据紫花苜蓿品种和根瘤菌菌株的匹配关系,选择相应的菌株接种,或选用匹配的种质材料育种,是保证共生体系高效性的物质基础。本研究在复合盐条件下筛选出了以中苜1号种子内生根瘤接种新疆大叶紫花苜蓿品种的最佳共生体系,但实际生产中影响共生体高效性发挥的因素是复杂多样的[17],许多基础性的问题还需要进一步深入研究,因此,本研究中选出的高效共生体系在实际应用中的对盐渍土的改良效果尚待盐渍地大田试验的进一步验证。
References:
[1]高婷婷,丁建丽,哈学萍,张飞,王飞.基于流域尺度的土壤盐分空间变异特征——以渭干河-库车河流域三角洲绿洲为例.生态学报,2010(10):2695-2705.
Gao T T,Ding J L,Ha X P,Zhang F,Wang F.The spatial variability of salt content based on river basinscale:A case study of the delta oasis in Weigan-Kuqa Watershed.Acta Ecologica Sinica,2010(10):2695-2705.(in Chinese)
[2]Rahil M,Hajjeh H,Qanadillo A.Effect of saline water application through different irrigation intervals on tomato yield and soil properties.Open Journal of Soil Science,2013,3(3):143-147.
[3]魏晓斌,王志峰,于洪柱,徐安凯,孙启忠.不同生长年限苜蓿对盐碱地土壤肥力的影响.草业科学,2013,30(10):1502-1507.
Wei X B,Wang Z F,Yu H Z,Xu A K,Sun Q Z.Effects of alfalfa with different growth years on soil fertility in saline-alkali land.Pratacultural Science,2013,30(10):1502-1507.(in Chinese)
[4]侯振安,李品芳,龚元石.盐渍条件下苜蓿和羊草生长与营养吸收的比较研究.草业学报,2000,9(4):68-73.
Hou Z A,Li P F,Gong Y S.A comparison of growth and nutrient absorption inMedicagosativaandLeymuschinensisunder saline condition.Acta Prataculturae Sinica,2000,9(4):68-73.(in Chinese)
[5]Júlia K S,Welington L A,Rodrigo M,Isaias G,Aline A P K,João L A.Isolation and characterization of soybean-associated bacteria and their potential for plant growth promotion.Environmental Microbiology,2004,6(12):1244-1251.
[6]陈利云,周志宇.紫穗槐种子内生根瘤菌数量分布与种类特征.干旱地区农业研究,2012,30(4):231-235.
Cheng L Y,Zhou Z Y.Amount distribution and category characteristics of endogenousRhizobiuminAmorphafruticosaseeds.Agricultural Research in the Arid Areas,2012,30(4):231-235.(in Chinese)
[7]陈利云,张丽静,周志宇.耐盐根瘤菌对紫花苜蓿接种效果的研究.草业学报,2008,17(5):43-47.
Chen L Y,Zhang L J,Zhou Z Y.Research of salt tolerable rhizobia inoculation effects onMedicagosativa.Acta Prataculturae Sinica,2008,17(5):43-47.(in Chinese)
[8]Hnley M E,Fener M,Whibley H.Early plant growth:Identifying the end point of the seedling phase.New Phytologist,2004,163:61-66.
[9]柴仲平,王雪梅,孙霞,蒋平安,张谦.不同氮磷钾配比滴灌对灰枣产量与品质的影响.果树学报,2011,28(2):229-233.
Chai Z P,Wang X M,Sun X,Jiang P A,Zhang Q.Influence of N,P,K with drip irrigation on yield and fruit quality ofHuizaojujube.Journal of Fruit Science,2011,28(2):229-233.(in Chinese)
[10]Li R,Shi F,Fukudak.Interactive effects of salt and alkali stresses on seed germination recovery,and seedling growth of a halophyteSpartinaalternifora(Poaceae).South African Journal of Botany,2010,76:380-387.
[11]Li X Y,Liu J J,Zhang Y T,Lin J X,Mu C S.Physiological responses and adaptive strategies of wheat seedlings to salt and alkali stresses.Soil Science and Plant Nutrition,2009,55:680-684.
[12]石德成,殷立娟.NaCl、Na2CO3胁迫下星星草根际K+、Na+、Ca2+的生理行为.应用环境生物学报,1997,3(2):112-118.
Shi D C,Yin L J.Physiological behavior of K+,Na+and Ca2+in the rhizosphere of NaCl and Na2CO3stressedPuccinelliatenuiflora.Chinese Journal of Applied & Environmental Biology,1997,3(2):112-118.(in Chinese)
[13]卢静军,李强,多立安.盐胁迫对金牌美达丽和猎狗种子萌发的影响.植物研究,2002,22(3):328-332.
Lu J J,Li Q,Duo L A.Effect of salt stress on seed germination ofLoliumperenneL. andFestucaelataKeng.Bulletin of Botanical Research,2002,22(3):328-332.(in Chinese)
[14]石茂玲,邓波,刘忠宽,刘静,史经昂.5株根瘤菌接种紫花苜蓿的效果.草业科学,2015,32(1):101-106.
Shi M L,Deng B,Liu Z K,Liu J,Shi J A.Inoculaion effects of five rhizobial strains to alfalfa.Pratacultural Science,2015,32(1):101-106.(in Chinese)
[15]郑伟,加娜尔古丽,唐高溶,朱进忠.混播种类与混播比例对豆禾混播草地浅层土壤养分的影响,草业科学,2015,32(3):329-339.
Zheng W,Jianaerguli,Tang G R,Zhu J Z.Effects of mixed species,mixed ratios of legume to grass on soil nutrients in surface soils of legume-grass mixture pasture.Pratacultural Science,2015,32(3):329-339.(in Chinese)
[16]Tan G Y,Tan W K.Interaction between alfalfa cultivar s andRhizobiumstrains for nitrogen fixation.Theoretical and Applied Genetics,1986,71:724-729.
[17]Sultan A K,Gintzburger A G,Obaton B M.Growth and nitrogen fixation of annualMedicago-Rhizobiumassociations duringwinter in Mediterranean region.European Journal of Agronomy,2001,15:221-229.
(责任编辑武艳培)
Establishment of highly efficient and salt tolerance alfalfa rhizobia symbiotia Chen Li-yun, Wang Yi-bo, Li San-xiang, Wang Zhi-bo
(School of Bioengineering and Technology , Tianshui Normal University. Key Laboratory of
Agriculture Microbiology in Gansu Province, Tianshui 741001, China)
In order to establish the high efficient alfalfa-rhizobia symbiotia with competitive ability and genetic stability in saline soil, germination, rhizobia salt tolerance and inoculation experiments were conducted using 12 alfalfa cultivars. The results indicated that the seed salt tolerance varied greatly among cultivars. The highest of seed salt tolerant survival percent was Zhongmu No.1 and second highest of that was Xinjiangdaye and Gannong No.7 although there was no significant difference between these three research group. The highest of rhizobia salt tolerant was Ganonng.1 with the rich strains number of 2.49×106. Zhongmu.1. of Xinjiangdaye symbiotic with rhizobia isolated from zhongmu.1 had highest salt resistance and nitrogenase activity of rhizobia and the highest efficiency with the highest aboveground biomass, stem and leaf crude protein content and nitrogenase activity.
alfalfa; endogenous rhizobia; compound salt; nitrogenase activity
Chen Li-yunE-mail:chenliy06@163.com
10.11829/j.issn.1001-0629.2015-0566
2015-10-19接受日期:2016-04-05
国家自然科学基金资助项目(31560164)
陈利云(1974-),女,甘肃天水人,副教授,硕士,主要从事生态学教学与科研工作。E-mail:chenliy06@163.com
S551+.703.4;Q945.7
A
1001-0629(2016)9-1690-06*
陈利云,王弋博,李三相,汪之波.苜蓿-根瘤菌复合盐高效抗性共生体系构建.草业科学,2016,33(9):1690-1695.
Chen L Y,Wang Y B,Li S X,Wang Z B.Establishment of highly efficient and salt tolerance alfalfa rhizobia symbiotia.Pratacultural Science,2016,33(9):1690-1695.

