八珍汤联合瑞能对结肠癌术后化疗患者免疫增殖的影响
蔡德珺,黎国伟,王唐恩,蒋晓松
广东省中医院珠海医院外一科,广东 珠海 519015
八珍汤联合瑞能对结肠癌术后化疗患者免疫增殖的影响
蔡德珺,黎国伟,王唐恩,蒋晓松
广东省中医院珠海医院外一科,广东 珠海 519015
目的:观察八珍汤联合瑞能对结肠肿瘤术后免疫学指标及营养状态的影响。方法:将结肠癌术后符合纳入标准的化疗患者随机分为2组,对照组予于化疗前一天开始服用瑞能,同时给予生理盐水口服,直至疗程结束(21天);实验组于化疗前一天开始服用瑞能,并服用八珍汤,直至疗程结束(21天),观察比较患者一般情况及化疗药物毒副反应、营养及生化指标、免疫监测水平等情况。结果:化疗后7、21天,实验组Hb、Alb均高于对照组,差异有统计学意义(P<0.05)。化疗后7、21天,实验组免疫球蛋白IgG、IgA、IgM较对照组升高,炎症因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)较对照组降低,差异均有统计学意义(P<0.05)。化疗后21天,实验组淋巴细胞分类CD3+、CD4+、CD8+水平较对照组升高,CD4+/CD8+水平较对照组降低,差异均有统计学意义(P<0.05)。2组患者肝肾功能比较,差异均无统计学意义(P>0.05)。结论:八珍汤联合瑞能可改善结肠癌术后化疗患者营养状况及免疫功能。
结肠癌;围手术期;化疗;八珍汤;瑞能;免疫增殖
结肠癌为全身性疾病,区域淋巴结对肿瘤的屏障作用有限,常发生血行转移,手术清扫淋巴结后,仍进行综合治疗。化疗药物在杀灭肿瘤细胞同时,对机体继续繁殖的正常细胞也有毒害作用,往往导致骨髓抑制、恶心呕吐、肝肾功能损害等副作用,使患者化疗期间生存质量下降,部分患者甚至无法顺利完成化疗。本研究将八珍汤联合瑞能应用于结肠癌术后化疗患者,在保证化疗疗效同时,观察其是否能有效减少化疗毒副作用、改善化疗患者的营养状况及免疫功能,为结肠癌术后辅助化疗患者的营养支持提供一种新的策略。
1 临床资料
1.1一般资料选择2013年1月—2014年12月间广东省中医院珠海医院外科、广东省中医院外科结肠癌术后辅助化疗患者共77例,均经术后病理确诊为结肠癌。所有患者按简单随机数字法将其分为实验组与对照组。实验组38例,男18例,女20例;平均年龄57.45岁。对照组39例,男19例,女20例;平均年龄54.53岁。2组患者性别、年龄构成及实验化疗前体重、摄食情况、化疗药物毒副作用(恶心、呕吐、腹泻)等比较,差异均无统计学意义(P>0.05),具有可比性。
1.2纳入标准①男女不限,20~70岁;②II-III期结肠癌患者;③同意术后辅助化疗患者;④符合气血两虚中医辨证诊断标准者。
1.3排除标准①不符合上述纳入标准者;②代谢性疾病患者或同时伴有感染性疾病者;③严重的胃肠道疾病或严重呕吐不能进行肠道营养者;④重要脏器功能障碍;⑤免疫缺陷病;⑥晚期结肠癌、伴有全身转移的解救化疗患者;⑦围手术期使用其它营养液或其它营养支持方案者。
2 治疗方法
2.1化疗方案2组均以氟尿嘧啶(5-fu)为基础,四氢叶酸(lv)作为调节剂可增强效应剂5-fu的疗效。
2.2临床营养治疗方案2组患者均在正常经口摄食,化疗前一天开始给予清淡饮食或流质。在能量摄入、氮量等力求相同。
2.2.1对照组于化疗前一天开始服用瑞能,每天200 mL,每天1次;同时给予150 mL生理盐水口服,每天1次,直至疗程结束(1疗程为21天)。
2.2.2实验组瑞能治疗同对照组,并服用八珍汤。处方:人参3 g,白术、茯苓、当归、白芍各10 g,熟地黄15 g,川芎、炙甘草各5 g。以上中药购自广东康美制药有限公司,由医院煎药室统一煎制成200 mL药液并密封成袋,每天1剂,每天1袋,口服,疗程同对照组。
3 观察项目与统计学方法
3.1一般情况及化疗药物毒副反应情况术后患者摄食情况、胃肠道反应情况(恶心、呕吐、腹痛、腹泻等),体重变化、患者耐受性等。
3.2营养及生化指标检测于化疗前1天,化疗后3、7、21天检测血清总蛋白(TP)、白蛋白(Alb)、转铁蛋白(TRF)、血红蛋白(Hb)等营养指标;血糖(Glu)、肝功能[谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转肽酶(GGT)、碱性磷酸酶(ALP)]、肾功能[血尿酸(UA)、血肌酐(Cr)、尿素(Urea)]、血常规[红细胞(RBC)、血小板(BPC)]等生化指标。
3.3免疫细胞检测于化疗前1天,化疗后3、7、21天检测细胞免疫指标CD3、CD4和CD4/CD8水平,免疫球蛋白IgG、IgA、IgM、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等指标。
3.4统计学方法采用SPSS17.0统计软件,计量资料均以(±s)表示,符合正态分布及方差齐者,使用独立样本t检验,计数资料用χ2检验。
4 治疗结果
4.1一般情况实验组及治疗组均在化疗后第3天出现轻症状的恶心、呕吐、腹泻,化疗后第7天、第21天记录无明显恶心、呕吐、腹泻等症状。
4.22组营养指标比较见表1。化疗后7、21天,实验组Hb、Alb均高于对照组,差异有统计学意义(P<0.05)。
4.32组肝功指标比较见表2。各时间段2组ALT、AST、GGT、ALP值比较,差异均无统计学意义(P>0.05)。
表1 2组营养指标比较(±s)

表1 2组营养指标比较(±s)
与对照组比较,①P<0.05
指标H b(g/L)n A lb(g/L)TP(g/L)TRF(×102mg/dL)RBC(×1012/L)BPC(×1012/L)38 39 38 39 38 39 38 39 38 39 38 39组别实验组对照组实验组对照组实验组对照组实验组对照组实验组对照组实验组对照组化疗前第1天128.56±4.12 131.35±5.23 53.46±5.41 51.03±3.26 75.08±6.36 81.68±5.36 37.52±4.12 38.15±2.12 7.83±0.93 8.24±0.63 179.52±23.59 188.69±20.36化疗后第3天129.84±4.53 121.44±6.45 43.36±2.01 45.67±5.22 74.36±7.42 70.16±2.22 36.58±5.44 36.49±3.45 6.84±0.68 8.86±0.51 215.54±26.35 220.13±26.48化疗后第7天132.36±10.45①126.08±7.12 49.26±8.10①44.32±6.72 72.98±6.31 72.18±8.12 38.12±7.11 34.98±2.12 7.45±0.49 8.94±0.32 198.58±36.48 251.45±36.48化疗后第21天138.19±7.98①129.32±8.22 54.17±7.12①46.89±8.21 70.54±9.05 76.39±8.01 37.99±6.14 37.21±2.59 9.02±0.91 7.88±0.67 173.17±30.89 183.85±31.78
表2 2组肝功能指标比较(±s)
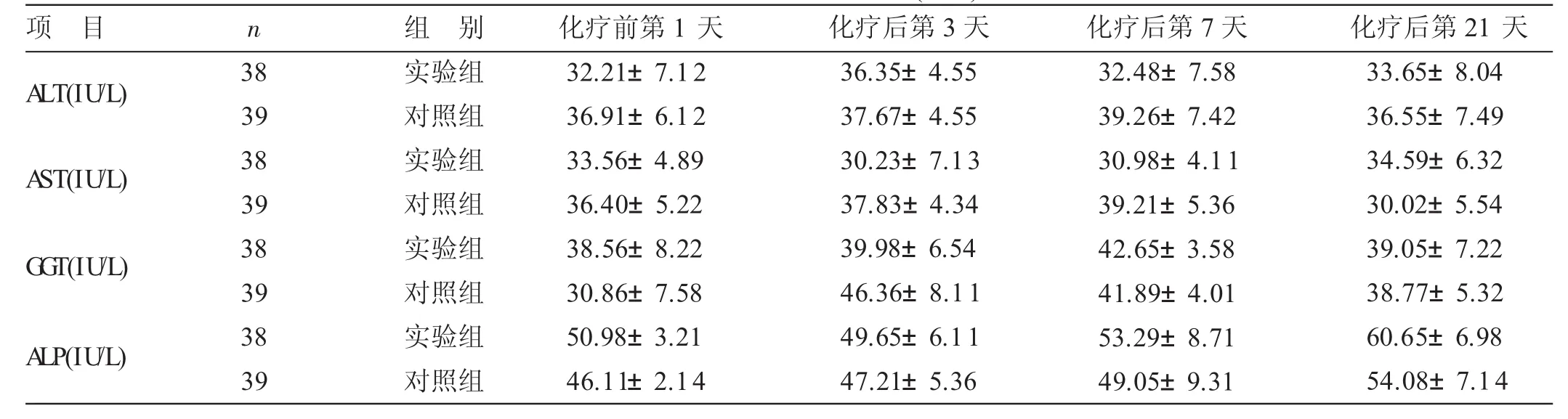
表2 2组肝功能指标比较(±s)
项目A LT(IU/L)n A ST(IU/L)38 39 38 39组别实验组对照组实验组化疗前第1天32.21±7.12 36.91±6.12 33.56±4.89 36.40±5.22化疗后第3天36.35±4.55 37.67±4.55 30.23±7.13 37.83±4.34化疗后第7天32.48±7.58 39.26±7.42 30.98±4.11 39.21±5.36化疗后第21天33.65±8.04 36.55±7.49 34.59±6.32 30.02±5.54 G G T(IU/L)A LP(IU/L)38 39 38 39对照组实验组对照组实验组对照组38.56±8.22 30.86±7.58 50.98±3.21 46.11±2.14 39.98±6.54 46.36±8.11 49.65±6.11 47.21±5.36 42.65±3.58 41.89±4.01 53.29±8.71 49.05±9.31 39.05±7.22 38.77±5.32 60.65±6.98 54.08±7.14
4.42组生化指标比较见表3。各时间段2组UA、Urea、Cr、Glu值比较,差异均无统计学意义(P>0.05)。
4.52组免疫学指标比较见表4。化疗后7、21天,实验组免疫球蛋白IgG、IgA、IgM较对照组升高,IL-6、TNF-α较对照组降低,差异均有统计学意义(P<0.05)。化疗后21天,实验组CD3+、CD4+、CD8+水平较对照组升高,CD4+/ CD8+水平较对照组降低,差异均有统计学意义(P<0.05)。
5 讨论
5.1化疗药物对人体的免疫抑制化疗药物作用于癌细胞的增殖周期的不同环节,抑制DNA的分裂增殖能力,从而起到抑制肿瘤生长或杀伤肿瘤细胞的作用。其在杀灭肿瘤细胞的同时,也损伤正常的组织细胞。化疗对人体的免疫抑制作用使得机体对抗肿瘤治疗耐受性下降,从而使机体的抗感染能力下降以及并发症增多。
表3 2组生化指标比较(±s)

表3 2组生化指标比较(±s)
项目U A(μmol/L)n U rea(mmol/L)Cr(mmol/L)G lu(mmol/L)38 39 38 39 38 39 38 39组别实验组对照组实验组对照组实验组对照组实验组对照组化疗前第1天305.21±18.25 283.47±12.65 4.13±1.06 3.26±1.03 82.36±9.12 84.26±7.43 5.98±1.20 6.13±0.32化疗后第3天308.34±18.96 296.71±15.11 5.22±0.93 5.71±1.33 92.66±8.14 89.34±8.51 5.84±0.84 6.48±0.26化疗后第7天315.36±16.44 306.78±20.33 6.15±1.15 6.92±1.05 89.34±8.25 95.95±9.11 6.31±0.92 7.02±0.81化疗后第21天298.36±23.10 274.56±15.21 4.32±0.68 4.71±0.86 84.38±10.03 80.01±7.45 6.17±0.61 6.23±1.01
表4 2组免疫学指标比较(±s)

表4 2组免疫学指标比较(±s)
与对照组比较,①P<0.05
项目IgG(g/L)n IgA(g/L)IgM(g/L)IL-6(ng/L)TN F-α(mg/mL)38 39 38 39 38 39 38 39 38 39组别实验组对照组实验组对照组实验组对照组实验组对照组实验组对照组化疗前第1天14.81±1.25 15.21±1.22 175.56±16.36 166.35±15.02 1258.64±46.63 1168.47±35.57 73.87±10.65 77.83±13.74 1.36±0.15 1.47±0.12化疗后第3天12.98±2.33 13.33±1.36 201.25±13.64 210.65±14.96 1152.69±20.84 1102.85±82.14 80.56±10.58 78.96±9.60 1.31±0.39 1.52±0.31化疗后第7天16.54±1.30①15.01±2.33 253.14±18.97①225.68±20.33 1287.54±36.91①1125.98±30.63 78.69±9.76①80.23±8.13 1.22±0.42①1.58±0.28 CD 3+(mg/L)CD 4+(mg/L)CD 8+(mg/L)CD 4+/CD 8+38 39 38 39 38 39 38 39实验组对照组实验组对照组实验组对照组实验组对照组1763.65±87.14 1853.88±98.05 835.15±93.96 840.62±83.45 596.46±80.63 635.87±81.36 1.32±0.16 1.36±0.12 1856.97±96.17 2148.70±86.44 986.65±94.78 1153.82±98.46 793.81±81.46 753.75±87.64 1.21±0.34 1.98±0.32 2130.55±87.14 2304.68±92.56 1259.18±86.19 1206.58±89.22 821.15±90.14 863.48±76.08 1.35±0.18 2.03±0.28化疗后第21天12.02±2.36①11.87±1.03 148.36±19.20①120.64±12.35 950.39±55.17①806.69±24.15 72.21±8.44①80.59±5.67 1.02±0.53①1.30±0.39 1897.91±99.19①1796.14±96.14 968.45±94.17①872.46±87.82 786.54±84.33①594.84±67.24 1.46±0.28①1.76±0.18
在机体内各种免疫细胞中,T淋巴细胞不仅是细胞免疫的效应细胞,而且在调节免疫效应中起重要作用,其调节作用是由功能各异的亚群来完成,最重要的是CD4+和CD8+,两者分布相对稳定,维持人体免疫系。淋巴细胞各亚群对机体免疫功能的稳定起着重要的调节作用CD3+为总淋巴细胞,分为两个主要亚群,即CD4+和CD8+细胞。CD4+为辅助/诱导细胞,具有生成抗体和巨噬细胞活化等功能,起辅助诱导细胞及体液免疫的作用;CD8+为抑制/杀伤细胞,具有抑制细胞活化、抑制细胞产生抗体和产生细胞毒作用,起抑制细胞及体液免疫的作用[1]。细胞免疫被认为是抑制术后癌细胞转移残留复发及评估预后的独立因素。在T淋巴细胞网络中,CD4+和CD8+处于调节枢纽地位,其数量和比值变化反映机体免疫功能状态。其比值决定机体免疫功能的中心环节。
张坤等[2]通过实验发现结肠癌术后化疗开始后第3天检测,可见患者外周血免疫细胞数量显著减少,其细胞表面分子表达降低,细胞凋亡、坏死比例显著升高。因此,考虑术后化疗可能会影响机体免疫细胞功能水平,造成免疫细胞的凋亡、坏死增多,对患者抗肿瘤免疫产生一定的抑制性影响效应,表现为患者免疫细胞数量减少,细胞表面分子表达水平降低。
化疗药物在杀灭肿瘤细胞的同时,也损伤正常的组织细胞,特别是快速增殖细胞,除了对骨髓的抑制外,消化道黏膜上皮也是容易受累的组织。化疗药物可阻止胃肠道黏膜上皮细胞DNA的合成,导致胃肠道黏膜上皮细胞的代谢障碍,形成溃疡,加重肝细胞损害,造成口炎、咽喉炎、胃肠道黏膜炎症和肝功能障碍。临床上患者常表现恶心、呕吐、厌食和腹泻等症状,有时甚至出现便血,严重影响患者的摄食和吸收,加重营养不良的发生,据研究,20%以上的肿瘤患者直接死于营养不良[3],许多严重营养不良的患者往往难以承受大剂量的化疗。
5.2免疫营养的影响因素适时采取合理的营养支持、代谢干预和免疫调理治疗,改善和保护器官功能,应成为结肠癌患者术后综合治疗的重要组成部分[4]。
研究表明,结肠癌患者术后早期应用肠内免疫营养在改善免疫功能方面优于常规肠内营养,将免疫营养应用于术后化疗患者同样适用。近年来提出的药理营养学认为,在营养配方中添加特定的营养素,不仅为机体提供能量和底物,而且能以特定方式刺激免疫细胞增强应答功能,维持正常、适度的免疫反应,调控细胞因子的产生和释放,减轻有害或过度的炎症反应。临床营养支持已从单纯供给细胞代谢所需的能量和营养底物,维持组织器官结构和功能,拓展到调控应激状态下的炎症及免疫状态,改善和保护组织器官功能等。
5.3八珍汤改善免疫的机制中医学认为,恶性肿瘤的发病是在正气亏虚的基础上,癌毒内蕴,与痰瘀相搏结而成。化疗对机体造成的损害,最常见的是骨髓抑制,表现为白细胞减少、血小板减少,甚至全血减少并发再障。
中医学虽无有关骨髓抑制病症的记载,但根据患者放、化疗后发生骨髓抑制反应,表现出全血细胞减少及乏力、头晕等临床特点,应归属于气血两虚证候。中医学认为,气为血帅,血为气母,精生血,精血同源,互相资生,互为依存。化疗造成的骨髓抑制是由于机体脾胃失调、肝肾受损及气血两伤所致。主要表现为脾肾亏虚,属虚劳、血虚范畴。“肾为先天之本,主骨生髓”,“脾为后天之本,气血生化之源”。脾气虚则气血生化无源,肾虚则精不化血,骨髓生血无权,临床表现为血细胞减少,并伴有神疲倦怠、头晕乏力、纳差等证候。脏腑亏损、气血不足是结肠癌的重要病因病机,手术后虽然有形之“积”已去,但余毒仍存,化疗药物为热毒之药,与余毒相合,可耗伤正气,损伤脏腑,结肠癌辅助化疗期间患者常有气血不足、气阴两虚、脾胃不和、肝肾不足等证,故本病病机主要是脾肾亏虚、气血生化不足所致,故应采取温运脾胃、益气养血、滋养肝肾、益精填髓等法。
八珍汤源自古方《正体类要》,由人参、熟地黄、白芍、川芎、茯苓、当归、白术、甘草组成,是四君子汤和四物汤的合方。全方具有健脾补肾、益气养血之功效,使阴阳互补,气血互生。诸药合用,重在扶正固本,既能补养先天之本肾脏,又能健壮后天之本脾脏。后天健,则气血生化有源;先天壮,则脏腑功能得以推动和激发,从而促进气血生成。
现代化学研究表明,八珍汤中起主要作用的有效成分主要集中在总苷、多糖以及一些有益于人体的微量元素、氨基酸、磷脂、维生素、叶酸等活性成分中。这些活性成分的药理作用包括改善造血功能、改善血液流变性、提高机体免疫能力、抗氧化抗衰老、抗肿瘤等。祝红焰等[5]、陈玉春等[6]、江南等[7]证实了八珍汤通过保护免疫器官免受损伤,提高淋巴细胞功能及其细胞因子分泌功能,来增强机体的细胞免疫功能、体液免疫功能和非特异性免疫功能,并通过淋巴细胞、细胞分子对造血进行调控,有助于改善术后化疗药物导致的骨髓抑制引起的贫血。张弦[8]通过临床观察发现八珍汤可以减轻放、化疗患者骨髓抑制反应,能明显抑制外周血细胞的下降,对免疫系统、造血系统有保护效应;对患者放、化疗期间出现的乏力、头晕、纳差、失眠、腰酸等不适有预防性治疗作用。
综上,对于结肠癌术后化疗患者,八珍汤联合瑞能对可改善其营养状况及免疫功能,值得临床参考使用。
[1]陈慰峰.医学免疫学[M].4版.北京:人民卫生出版社,2004:106-108.
[2]张坤,高朋芬,江艺,等.结肠癌术后化疗对外周血免疫细胞比例及凋亡的影响[J].中国现代手术学杂志,2006,11(3):186-188.
[3]吴国豪.实用临床营养学[M].上海:复旦大学出版社,209-229.
[4]庄树彤,李群珍,蔡燕娟,等.结直肠癌患者术后早期肠内免疫营养对免疫功能和炎症反应的影响[J].中华临床医师杂志:电子版,2013,16:7561-7563.
[5]祝红焰,吴军,谭允育.八珍汤对辐射损伤小鼠免疫及造血功能的影响[J].北京中医药大学学报,2001,42(6):40-42.
[6]陈玉春,王碧英,高依卿.八珍汤对红细胞生成素影响的动物实验研究[J].上海中医药杂志,2000,34(4):45.
[7]江南,罗霞,陈东辉,等.八珍汤对环磷酰胺所致的低白模型小鼠造血系统的影响[J].中国免疫学杂志,2003,19(9):614-615.
[8]张弦.八珍汤治疗恶性肿瘤放、化疗后骨髓抑制30例临床观察[J].湖南中医杂志,2013,4:51-53.
(责任编辑:冯天保)
R735.3+5
A
0256-7415(2016)09-0156-04
10.13457/j.cnki.jncm.2016.09.070
2016-01-16
蔡德珺(1979-),男,主治医师,研究方向:普外科。

