PNUTS在D-半乳糖诱导老化小鼠耳蜗中的表达
吴喜迪,张俏,李文静,刘双月
PNUTS在D-半乳糖诱导老化小鼠耳蜗中的表达
吴喜迪,张俏,李文静,刘双月△
目的观察D-半乳糖诱导的老化小鼠耳蜗中蛋白磷酸酶1核目标亚基(PNUTS)的表达。方法6周龄清洁级昆明小鼠20只随机分为对照组和D-半乳糖组,每组10只。D-半乳糖组小鼠颈背部皮下注射D-半乳糖800 mg/(kg·d);对照组颈背部注射等量生理盐水,均为每日1次,连续8周。造模完成后,进行听脑干反应(ABR)测试检测小鼠听力变化;取2组小鼠耳蜗,采用Western blot检测PNUTS及p53蛋白表达;免疫组织化学观察PNUTS蛋白在耳蜗毛细胞、螺旋神经节细胞及血管纹中的表达与分布情况。结果D-半乳糖组小鼠在8、12、24 kHz这3个频率下的ABR阈值与对照组差异均无统计学意义。PNUTS蛋白在小鼠耳蜗毛细胞、螺旋神经节细胞及血管纹细胞中有表达,且D-半乳糖组小鼠耳蜗中PNUTS蛋白的阳性表达水平较对照组显著降低(P<0.05);而p53蛋白表达水平则显著升高(P<0.01)。结论PNUTS在小鼠耳蜗中有表达,且D-半乳糖能够诱导老化小鼠耳蜗中PNUTS表达下调。
蛋白质磷酸酶1;半乳糖;老年性聋;耳蜗;蛋白磷酸酶1核目标亚基
老年性耳聋(age-related hearing loss,ARHL)是伴随衰老的过程中主要由内耳的退行性变所引起的自然听力损失。实验动物慢性注射大剂量D-半乳糖可以建立理想的听觉系统自然衰老模型[1]。蛋白磷酸酶1核目标亚基(protein phosphates 1 nuclear targeting subunit,PNUTS)是蛋白磷酸酶1(protein phosphates 1,PP1)结合蛋白。PNUTS这种无催化活性的核定位蛋白具有降低端粒缩短,抑制PP1调节的细胞凋亡,参与DNA修复等生物活性作用[2-4]。已有研究发现,PNUTS在衰老心肌细胞的凋亡过程中发挥重要作用[5],那么PNUTS是否在内耳中表达,PNUTS在老年性耳聋的发生发展中是否起作用,目前鲜见报道。本研究旨在应用D-半乳糖诱导老化模型小鼠,观察PNUTS在内耳的表达,初步探讨PNUTS在老年性耳聋中的作用机制。
1 材料与方法
1.1材料
1.1.1实验动物6周龄清洁级昆明小鼠20只,雌雄不限,体质量18~22 g,耳廓反射灵敏,无中耳炎,由锦州医科大学实验动物中心提供。小鼠于安静状态下饲养,给予常规饮食。建立老年性耳聋动物模型[1]:昆明小鼠随机进行编号,然后令其双数为对照组,单数为D-半乳糖组,每组10只,适应性喂养1周。D-半乳糖组小鼠颈背部皮下注射D-半乳糖[800 mg/(kg·d)];对照组颈背部注射等量生理盐水,每日1次,连续8周。每日监测小鼠体质量以调整药量。
1.1.2主要试剂D-半乳糖(G5388)购自美国Sigma公司;兔抗鼠PNUTS多克隆抗体(bs-11666R)购自博奥森公司;兔抗鼠p53多克隆抗体(ab1431)购于Abcam公司;DAB显色剂及生物素-链霉卵白素免疫组化检测试剂盒(SP-9001)购于北京中杉金桥生物技术有限公司。
1.2方法
1.2.1听脑干反应(auditory brainstem response,ABR)测试分别于给药前和停药后24 h内对2组小鼠进行ABR测试。测听在隔音屏蔽室内进行。1%戊巴比妥钠90 mg/kg对小鼠腹腔麻醉,将电极正极置于小鼠颅顶正中皮下,负极及接地电极分别埋于测声侧及对侧的耳廓后下。听觉诱发电位-耳声发射记录系统给予小鼠短纯音(tone burst)刺激,依次选取8、12、24 kHz 3个频率测试后记录ABR阈值(听阈)。声强从95 dB声压级(sound pressure level,SPL)开始,以5 dB逐次递减,以ABRⅢ波刚出现时判定听阈,并至少重复2次。
1.2.2Western blot检测PNUTS和p53蛋白的表达耳蜗加入RIPA裂解液后,于0℃下超声粉碎,12 000 r/min 4℃低温离心25 min。上清经BCA法测定蛋白含量。上样、电泳,转膜,封闭,4℃下摇床孵育1 h之后,加一抗(1∶1 000稀释),随即4℃冰箱过夜。TBST缓冲液冲洗,5 min×3次。辣根过氧化物酶标记二抗(1∶1 000稀释),4℃摇床孵育1 h。再次TBST缓冲液冲洗5 min×3次。滴加BCIP/NBT显色后,可见成像条带。全自动凝胶成像系统对条带进行半定量分析,βactin为内参照物。
1.2.3免疫组织化学SABC法检测PNUTS蛋白的表达于体视显微镜下充分暴露耳蜗,刺破卵圆窗和圆窗,蜗尖钻孔,用含有4%多聚甲醛的0.01 mol/L PBS缓冲液(pH 7.4)缓慢灌流,于4℃下固定2 h。PBS冲洗后,放入4%EDTA溶液中,4℃下脱钙5~7 d。标本经梯度乙醇脱水、二甲苯透明、常规石蜡包埋。蜡块沿着蜗轴正中行5 μm连续切片。切片常规脱蜡至水;PBS中浸泡5 min,于枸橼酸盐缓冲液(pH 6.0)中微波修复8 min;3%H2O2浸泡15 min;室温下山羊血清封闭20 min,滴加抗PNUTS抗体(1∶100稀释),4℃过夜。切片甩干,生物素标记IgG 37℃孵育30 min;37℃下SABC复合物孵育30 min;DAB显色,流水终止反应。以上每一步都需用PBS冲洗3次,每次5 min。苏木素复染,脱水、透明、封片,显微镜下观察结果、照相。阴性对照染色切片用PBS代替一抗,其余步骤不变。利用Image J 1.48软件进行分析。每组随机抽取10张切片,同等条件下测量各组耳蜗毛细胞、螺旋神经节及血管纹3个部位PNUTS阳性反应产物的光密度值。其数值越大,代表阳性反应越强烈。
1.3统计学方法采用SPSS 16.0软件进行统计学分析,计量资料以均数±标准差(x ±s)表示。2组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1D-半乳糖对小鼠ABR阈值的影响应用D-半乳糖后,在8、12和24 kHz这3个刺激频率下,D-半乳糖组小鼠的ABR阈值与对照组比较差异无统计学意义(均P>0.05),见表1。
Tab.1The ABR threshold in two groups表1 小鼠ABR阈值(dB SPL,)
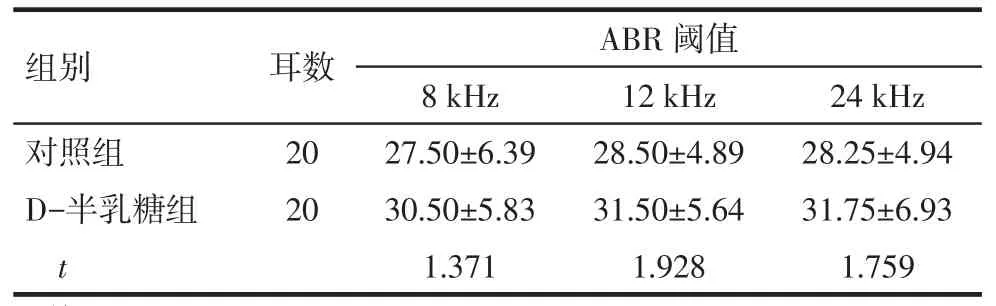
Tab.1The ABR threshold in two groups表1 小鼠ABR阈值(dB SPL,)
均P>0.05
组别对照组D-半乳糖组t耳数20 20 ABR阈值8 kHz 27.50±6.39 30.50±5.83 1.371 12 kHz 28.50±4.89 31.50±5.64 1.928 24 kHz 28.25±4.94 31.75±6.93 1.759
2.2PNUTS及p53蛋白在小鼠耳蜗的表达情况Western blot结果显示,对照组小鼠耳蜗中有PNUTS蛋白的表达,与对照组相比,D-半乳糖组小鼠耳蜗中PNUTS蛋白的表达水平显著降低(P<0.05),p53蛋白表达水平显著升高(P<0.01),见图1、表2。免疫组织化学结果显示,PNUTS在对照组小鼠耳蜗毛细胞、螺旋神经节及血管纹3个部位均有表达,给予D-半乳糖诱导老化后,PNUTS在上述3个部位的表达均显著减少(P<0.01),阴性对照未见阳性表达(P<0.01),见图2、表3。
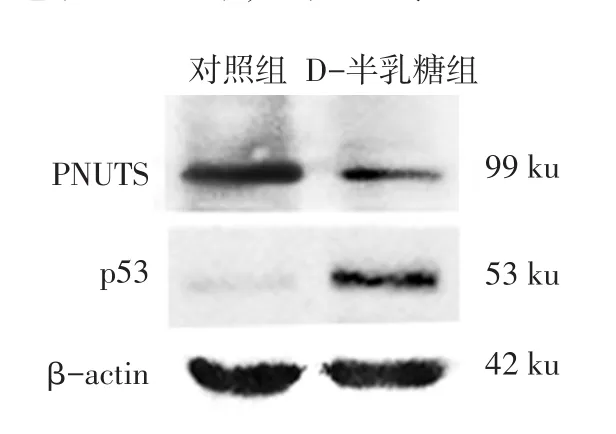
Fig.1Expressions of PNUTS and p53 protein in cochlear of mice图1 PNUTS和p53蛋白在小鼠耳蜗中的表达
Tab.2Comparison of expression levels of PNUTS and p53 protein in cochlear between two groups表2 PNUTS和p53蛋白在小鼠耳蜗中表达水平比较(%,)
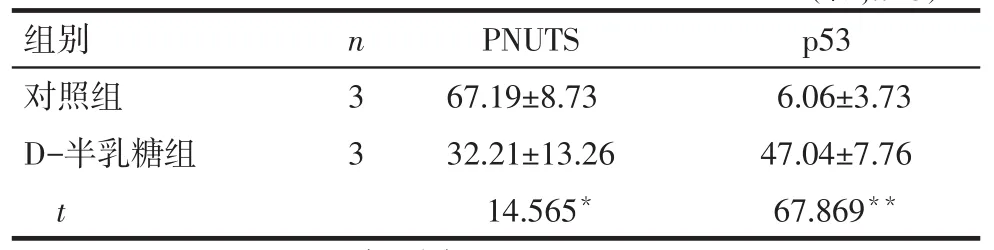
Tab.2Comparison of expression levels of PNUTS and p53 protein in cochlear between two groups表2 PNUTS和p53蛋白在小鼠耳蜗中表达水平比较(%,)
*P<0.05,**P<0.01,表3同
组别对照组D-半乳糖组t p53 6.06±3.73 47.04±7.76 67.869**n33 PNUTS 67.19±8.73 32.21±13.26 14.565*
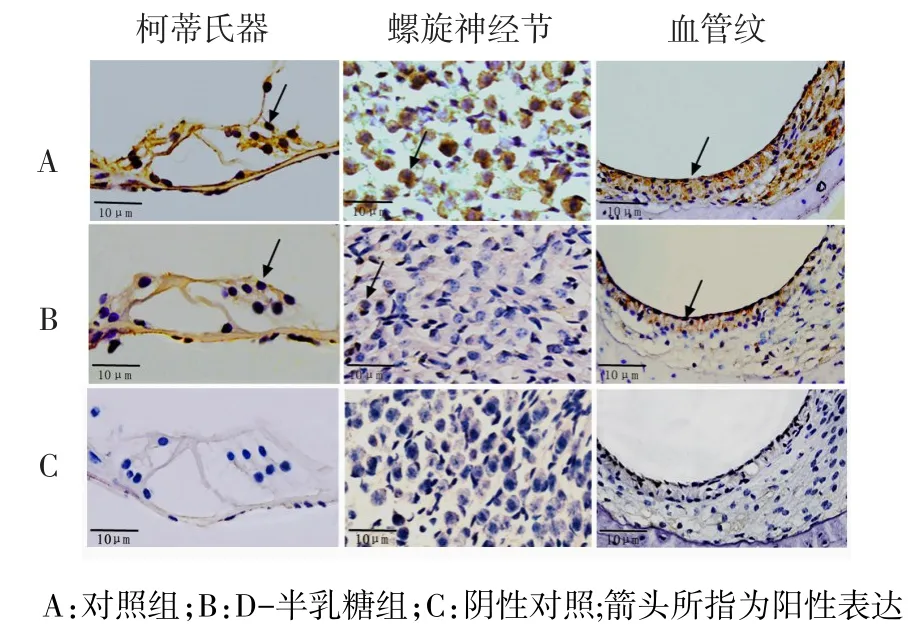
Fig.2Expressions of PNUTS in the cochlear Corti,spiral ganglion and striavascularis(DAB staining,×400)图2 PNUTS蛋白在柯蒂氏器、螺旋神经节及血管纹的表达(DAB染色,×400)
Tab.3Expressions of PNUTS in cochlear hair cells,spiral ganglion cells and striavascularis in two groups表3 PNUTS蛋白在耳蜗毛细胞、螺旋神经节及血管纹的表达情况
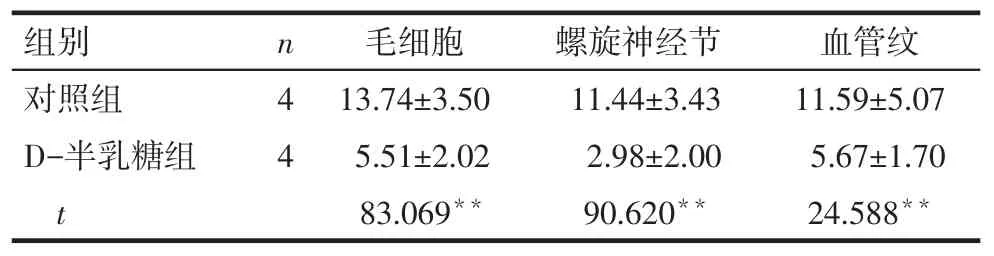
Tab.3Expressions of PNUTS in cochlear hair cells,spiral ganglion cells and striavascularis in two groups表3 PNUTS蛋白在耳蜗毛细胞、螺旋神经节及血管纹的表达情况
组别对照组D-半乳糖组t n44毛细胞13.74±3.50 5.51±2.02 83.069**螺旋神经节11.44±3.43 2.98±2.00 90.620**血管纹11.59±5.07 5.67±1.70 24.588**
3 讨论
随着世界人口老龄化的加剧,老年性耳聋现已引起医学界越来越多的关注。D-半乳糖可被半乳糖氧化酶转化成醛糖及氢过氧化物,产生过多的活性氧(ROS),导致细胞和机体的老化[6]。而高浓度的ROS可破坏DNA的结构,进而引发DNA损伤应答,或可通过直接调控衰老相关的信号通路,促进细胞衰老[7]。故国内学者常用D-半乳糖来构建老年性聋动物模型[8-9]。本研究参考Wu等[1]的研究剂量,给予小鼠高剂量D-半乳糖来建立小鼠老化模型。ABR结果显示D-半乳糖组小鼠在各频率下的ABR阈值与对照组比较差异均无统计学意义,听力改变与以往的报道一致,老年性耳聋小鼠模型建模成功。
Boon等[5]发现在老年化心脏中,PNUTS的表达相较于未老化的心肌细胞显著下调;而PNUTS的下调可以诱导心肌细胞DNA的损伤反应和端粒的磨损,继而引起心肌细胞的凋亡。本研究发现PNUTS蛋白在小鼠耳蜗中的毛细胞、血管纹和螺旋神经节细胞处均有表达,且在老年性耳聋模型小鼠耳蜗的上述3个部位中PNUTS的表达均较对照组显著下调。以上结果表明D-半乳糖诱导了小鼠耳蜗细胞中PNUTS的下调表达,进而导致内耳细胞老化。这与Boon等[5]在衰老心肌细胞中的发现基本一致,提示PNUTS与耳蜗细胞尤其是毛细胞、血管纹和螺旋神经节细胞的衰老关系密切。
最新研究表明,p53在细胞衰老的启动和维持中起着重要作用。生理状态下,p53具有抗癌和抗衰老的作用;而p53的过度激活则具有抗癌的作用,但同时也会促进衰老[7]。众多研究也证实了这一观点,在顺铂诱导的细胞衰老过程中,p53的表达水平持续升高[10]。研究人员发现,在D-半乳糖诱导的大鼠衰老模型的骨髓间充质干细胞中,p53蛋白表达同样显著增加[11]。而在衰老的C57BL/6小鼠耳蜗中,大量乙酰化的p53诱发了耳蜗毛细胞的凋亡增多,最终导致了小鼠老年性耳聋的发生[12]。本研究结果显示,D-半乳糖可以诱导小鼠耳蜗中PNUTS蛋白表达下调和p53蛋白表达上调。由此笔者推测,在老年性耳聋模型小鼠中,下调的衰老相关蛋白PNUTS可能通过上调凋亡相关因子p53,引起耳蜗毛细胞、螺旋神经节细胞及血管纹细胞发生凋亡,继而诱发听觉损伤,最终导致老年性耳聋的发生发展,提示PNUTS是D-半乳糖诱导的老年性耳聋的重要作用靶点。因此,PNUTS是小鼠耳蜗细胞老化中的重要因子,PNUTS可能通过上调p53导致小鼠耳蜗细胞老化从而引起老年性耳聋。这为临床防治老年性耳聋提供了理论依据和可能的治疗靶点。当然,由于本实验应用的是D-半乳糖诱导老化模型小鼠,与自然衰老动物还有一定的差异。本课题组将在自然衰老动物中近一步证实耳蜗中PNUTS的表达与老年性耳聋的关系及其致老年性耳聋的相关机制。
[1]Wu L,Sun Y,Hu YJ,et al.Increased p66Shc in the inner ear of D-galactose-induced aging mice with accumulation of mitochondrial DNA 3873-bp deletion:p66Shc and mtDNA damage in the inner ear during aging[J].PLoS One,2012,7(11):e50483.doi:10.1371/journal.pone. 0050483.
[2]Choy MS,Hieke M,Kumar GS,et al.Understanding the antagonism of retinoblastoma protein dephosphorylation by PNUTS provides insights into the PP1 regulatory code[J].Proc Natl Acad Sci U S A,2014,111(11):4097-4102.doi:10.1073/pnas.1317395111.
[3]Li DW,Liu JP,Schmid PC,et al.Protein serine/threoninephosphatase-1 dephosphorylates p53 at Ser-15 and Ser-37 to modulate its transcriptional and apoptotic activities[J].Oncogene,2006,25(21):3006-3022.doi:10.1038/sj.onc.1209334.
[4]Lee SJ,Lim CJ,Min JK,et al.Protein phosphatase 1 nuclear targeting subunit is a hypoxia inducible gene:its role in posttranslational modification of p53 and MDM2[J].Cell Death Differ,2007,14(6):1106-1116.doi:10.1038/sj.cdd.4402111.
[5]Boon RA,Iekushi K,Lechner S,et al.MicroRNA-34a regulates cardiac ageing and function[J].Nature,2013,495(7439):107-110.doi:10.1038/nature11919.
[6]Giorgio M,Migliaccio E,Orsini F,et al.Electron transfer between cytochrome and p66Shc generates reactive oxygen species that trigger mitochondria apoptosis[J].Cell,2005,122(2):221-233. doi:10.1016/j.cell.2005.05.011.
[7]Rufini A,Tucci P,Celardo I,et al.Senescence and aging:the critical roles of p53[J].Oncogene,2013,32(43):5129-5143.doi:10.1038/onc.2012.640.
[8]Du Z,Yang Q,Liu L,et al.NADPH oxidase 2-dependent oxidative stress,mitochondrial damage and apoptosis in the ventral cochlear nucleus of D-galactose-induced aging rats[J].Neuroscience,2015, 286:281-292.doi:10.1016/j.neuroscience.2014.11.061.
[9]Zeng L,Yang Y,Hu Y,et al.Age-related decrease in the mitochondrial sirtuindeacetylase Sirt3 expression associated with ROS accumulation in the auditory cortex of the mimetic aging rat model[J].PLoS One,2014,9(2):e88019.doi:10.1371/journal. pone.0088019.
[10]Qu K,Lin T,Wei J,et al.Cisplatin induces cell cycle arrest and senescence via upregulating p53 and p21 expression in HepG2 cells[J].Nan Fang Yi Ke Da Xue Xue Bao,2013,33(9):1253-1259.doi:10.3969/j.issn.1673-4254.2013.09.01.
[11]Yan BX,Yu SS,Feng X,et al.Effects of D-galactose on ageing of rat mesenchymal stem cells[J].J Zhejiang Univ(Medical Sci),2013,42(6):625-631.[颜冰希,余姗姗,冯晓,等.D-半乳糖对大鼠骨髓间充质干细胞衰老的影响[J].浙江大学学报(医学版),2013,42(6):625-631.doi:10.3785/j.issn.1008-9292.2013.06.006.
[12]Xiong H,Pang J,Yang H,et al.Activation of miR-34a/SIRT1/p53 signaling contributes to cochlear hair cell apoptosis:implications for age-related hearing loss[J].Neurobiol Aging,2015,36(4):1692-1701.doi:10.1016/j.neurobiolaging.2014.12.034.
(2015-12-30收稿2016-04-04修回)
(本文编辑魏杰)
The expression of PNUTS in the cochlea of D-galactose induced ageing mice
WU Xidi,ZHANG Qiao,LI Wenjing,LIU Shuangyue△
Department of Physiology,Jinzhou Medical University,Jinzhou 121000,China△
E-mail:dongfangyue5@sina.com
ObjectiveTo observe the expression of protein phosphates 1 nuclear targeting subunit(PNUTS)in the cochlea of D-galactose induced ageing mice.MethodsTwenty Kunming mice,six weeks old,cleaning degree,were randomly divided into two groups,control group and D-galactose group,ten mice for each group.Mice in D-galactose group were administrated with D-galactose at a dose of 800 mg/(kg·d)by subcutaneous injection for eight weeks.Mice in control group were injected with the same volume of saline.After eight weeks,auditory brainstem responses(ABR)were collected to test the hearing thresholds of mice.Western blot assay was used to detect expressions of PNUTS and p53 protein.The expression and distribution of PNUTS in the cochlear Corti,spiral ganglion and striavascularis cells were observed by immunohistochemical(IHC)staining.ResultsThere were no significant differences in ABRs at 8,12 and 24 kHz between two groups.Protein expressions of PNUTS were located in the cochlear hair cells,spiral ganglion cells and striavascularis cells,and the expression level of cochlea was significantly decreased in D-galactose group than that in control group(P<0.05).The expression level of p53 protein was significantly increased in D-galactose group than that in control group(P<0.01).ConclusionPNUTS is expressed in the normal mouse cochlea,and which is down-regulated in the cochlea of ageing mice induced by D-galactose.
protein phosphatase 1;galactose;presbycusis;cochlea;protein phosphates 1 nuclear targeting subunit
R764.43
A
10.11958/20150438
辽宁省教育厅基金资助项目(201410160023,L2015316)
锦州医科大学生理学教研室(邮编121000)
吴喜迪(1992),男,本科在读,主要从事老年性耳聋发病机制的研究
E-mail:dongfangyue5@sina.com

