龙井43号多酚氧化酶同工酶酶学性质研究
张书芹 许雷 陈盛虎 徐小云 黄莹婕 姚燕妮 黄友谊
摘要:以龙井43号[Camellia sinensis (L.) O. Ktze. cv. Longjing 43]鲜叶为材料,经分离纯化获得多酚氧化酶-同工酶(PPO II),对其部分酶学性质进行了研究。结果表明,PPO II最适反应pH为6.0;抑制剂抗坏血酸、亚硫酸钠和L-半胱氨酸对PPO II的抑制作用随抑制剂浓度的增加而增强;Cu2+浓度在0.25×10-7 mol/L时,PPO II活性最高;PPO II的Km为13.05 mmol/L,vmax为0.019 OD460/min。
关键词:龙井43号[Camellia sinensis (L.) O. Ktze. cv. Longjing 43];多酚氧化酶;同工酶;酶学性质
中图分类号:S571.1 文献标识码:A 文章编号:0439-8114(2016)06-1487-04
DOI:10.14088/j.cnki.issn0439-8114.2016.06.031
多酚氧化酶(Polyphenol oxidase,PPO,EC 1.10.3.1)是茶树生理学与茶叶产品加工工艺学中极为重要的生物酶之一,因此一直是人们的研究热点[1-3]。当前对茶树PPO的研究已进入分子水平[4-8],国外已有对茶树PPO同工酶进行分离纯化和酶学性质研究的报道[9-14]。然而,国内对茶树PPO性质的研究一直停留在粗酶的水平[15,16],除对同工酶谱变化有研究外[17-19],还未见任何分离纯化出同工酶及对同工酶性质进行研究的报道[20]。为此试验以适制绿茶的龙井43号茶树[Camellia sinensis(L.) O. Ktze. cv. Longjing 43]为材料,分离纯化出一个PPO同工酶,并对其部分酶性质进行了探讨,以期推动对茶树PPO的研究与利用[1,21]。
1 材料与方法
1.1 材料
茶树鲜叶采摘于华中农业大学茶学专业教学基地中龙井43号茶树,鲜叶规格为1芽2叶,采摘时间为春季,采下后迅速于-80 ℃超低温冰箱内保存,备用。试验所用试剂均为分析纯。
1.2 方法
1.2.1 PPO同工酶分离 取龙井43号1芽2叶20 g,用0.05 mol/L、pH 7.2的磷酸盐缓冲液4 ℃浸提12 h,然后4 ℃、9 000 r/min离心30 min,取上清液,滤纸过滤后即为粗酶液。将粗酶液用30 %~80 %硫酸铵沉淀,9 000 r/min离心30 min,弃上清液;用pH 7.2的磷酸盐缓冲液溶解沉淀,3 500 r/min离心30 min,脱盐3~4次;以上操作均在4 ℃条件下完成。将离子交换剂材料DEAE-Sepharose CL-6B用0.02 mol/L、pH 7.2磷酸盐缓冲液(4倍体积)进行预平衡,将样品加入预平衡柱。加样完成后,使之与柱材料结合20 min,然后分别用含0、0.05、0.10、0.20、0.30、0.40、0.50、0.60 mol/L 的NaCl 0.02 mol/L、pH 7.2的磷酸盐缓冲溶液作为洗脱液,每个浓度梯度洗脱液为3~4倍柱体积,流速60 mL/h。收集峰值洗脱液于超滤离心管中,4 ℃、3 500 r/min离心,脱盐,浓缩至500 μL左右。各峰值洗脱液分别加入预平衡(用含有0.1 mol/L NaCl的0.02 mol/L、pH 7.2的磷酸盐缓冲溶液进行预平衡)Sephadex G-150凝胶柱中,用相同的磷酸盐缓冲液洗脱,收集各峰值处洗脱液于超滤离心管中,4 ℃、3 500 r/min离心,脱盐、浓缩至约250 μL左右,4 ℃保存,备用。
1.2.2 抑制剂对PPO同工酶活性的影响 取10 μL酶液,以邻苯二酚为底物,分别加入终浓度为0、0.025、0.050、0.100、0.200、0.300 mmol/L的抑制剂反应混合液75 μL,按文献[22]、[7]的酶活性测定方法,在37 ℃条件下反应30 min,加入50 μL 6 mol/L的尿素終止反应,于酶标仪460 nm处测其残留酶活性,结果以残留酶活性与未加抑制剂的酶活性相比的百分数表示。抑制剂分别为亚硫酸钠、L-半胱氨酸、抗坏血酸。
1.2.3 pH对PPO同工酶活性的影响 配制pH分别为5.6、6.0、6.4、6.8、7.2、7.6、8.0的磷酸盐-柠檬酸盐缓冲液,分别取上述缓冲液4 mL和邻苯二酚1 mL配制反应混合液,在10 μL酶液中加入75 μL的反应混合液,于37 ℃条件下反应30 min,然后加入50 μL 6 mol/L的尿素终止反应,在酶标仪460 nm处测其活性。
1.2.4 底物浓度对PPO同工酶活性的影响 以不同浓度的邻苯二酚为底物,在10 μL酶液中加入75 μL终浓度分别为5、10、15、20、25、30 mmol/L的邻苯二酚反应混合液,按文献[22]、[7]的酶活性测定方法,在其最适pH的缓冲液中,于37 ℃条件下反应30 min,加入50 μL 6 mol/L的尿素终止反应,在酶标仪460 nm处测定PPO的活性。用双倒数曲线来求取Km值和最大反应速率vmax。
1.2.5 铜离子对PPO同工酶活性的影响 取10 μL酶液,加75 μL终浓度分别为 0、0.25×10-7、0.50×10-7、1.00×10-7、2.00×10-7、3.00×10-7 mol/L的Cu2+反应混合液,按文献[22]、[7]的酶活性测定方法,在37 ℃条件下反应30 min,加入50 μL 6 mol/L的尿素终止反应,在酶标仪460 nm处测其活性。
1.3 蛋白电泳方法
1.3.1 非变性蛋白电泳方法 PPO同工酶采用非变性凝胶不连续垂直板电泳(Native-PAGE)法,浓缩胶浓度为4%,分离胶浓度为7.5%,每孔上样量为20 μL。预电压为稳压50 V,当溴酚蓝指示剂进入分离胶后将电压调至稳压110 V,冰浴条件下进行电泳。结束电泳后,将凝胶置于染液(60 mL 1%邻苯二酚,20 mL 0.6 g/L对苯二胺,20 mL pH 7.2的 0.05 mol/L磷酸缓冲液)中 ,室温染色30 min后,蛋白胶用去离子水冲洗、浸泡至PPO同工酶带清晰为止。
1.3.2 变性蛋白电泳方法 PPO蛋白纯度采用变性凝胶不连续垂直板电泳((SDS-PAGE)法,浓缩胶浓度为4%,分离胶浓度为12%,每孔上样量为20 μL。开始电压为60 V,在溴酚蓝指示剂进入分离胶后将电压调到120 V。当溴酚蓝指示剂距分离胶底面1 cm左右时结束电泳,然后进行考马斯亮蓝染色处理。
1.4 PPO同工酶活性测定方法
根据文献[22]、[7]的酶活性测定方法,经过改进进行PPO活性测定。具体步骤如下:用移液枪取10 μL PPO酶液加入酶标板,再加入0.1 mol/L柠檬酸盐缓冲液50 μL和75 μL反应混合液,在37 ℃条件下反应30 min,即刻加入50 μL的6 mol/L尿素溶液终止反应,然后利用酶标仪在460 nm波长处测其吸光值,对照组选用煮沸5~10 min的PPO酶液来代替待测的样品。反应混合液配制方法按0.1 mol/L柠檬酸盐缓冲液∶0.1%脯氨酸∶1%邻苯二酚=10∶2∶3的比例配制,现配现用。在试验测定条件下,将以邻苯二酚为底物的反应液吸光值每分钟增加0.001定义为1个酶活力单位(U)。
1.5 蛋白浓度测定
用考马斯亮蓝法测定PPO蛋白浓度,采用蛋白定量试剂盒测定。
1.6 数据处理
所有试验均重复3次,试验所得数据采用Microsoft Office Excel 2003软件处理并作图。
2 结果与分析
2.1 茶树PPO同工酶纯化
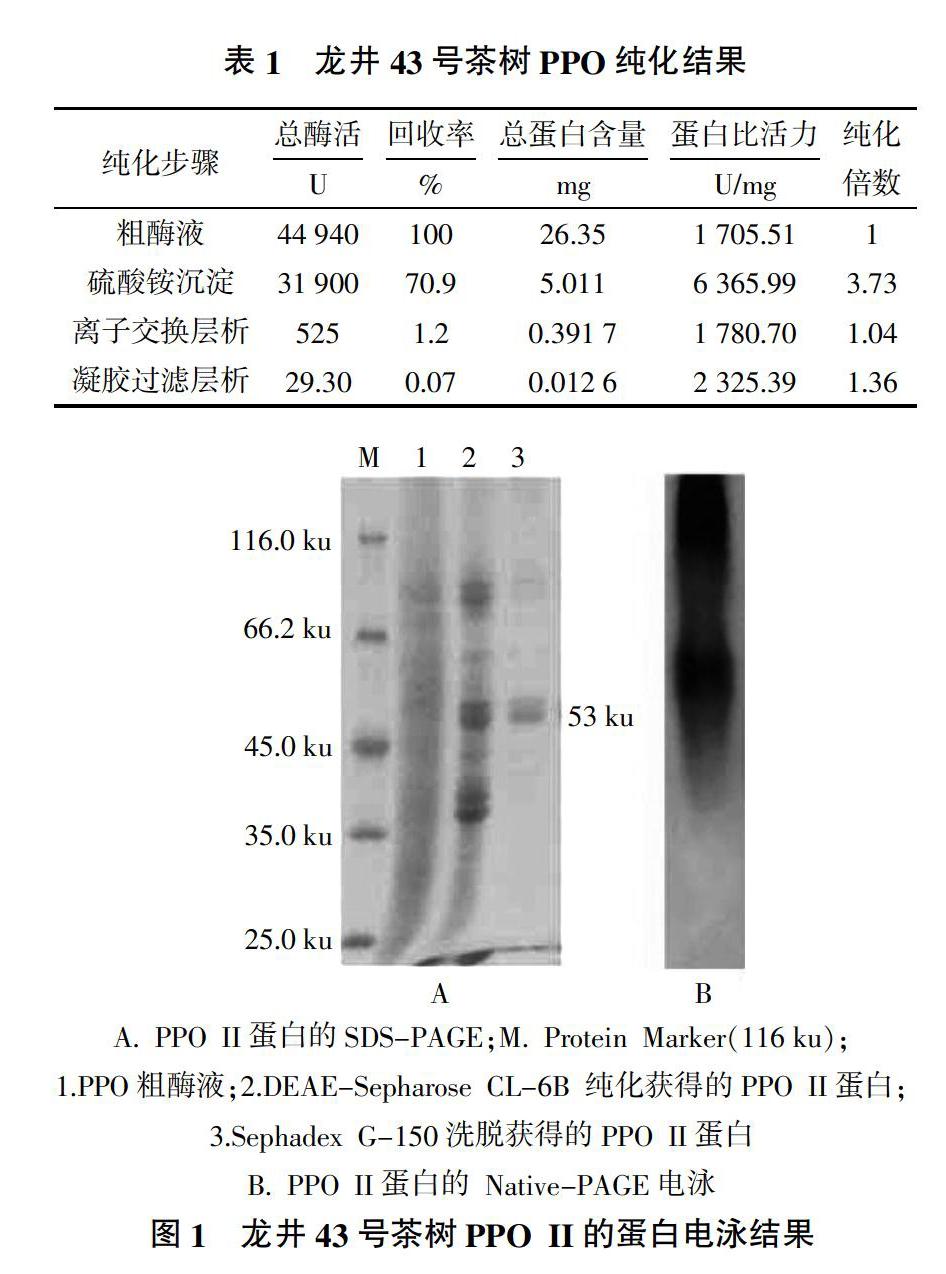
茶树PPO经过硫酸铵沉淀、离子交换层析和凝胶层析进行纯化后,得到一个单一的同工酶,具体见表1。经SDS-PAGE电泳后,结果见图1。从图1-A可见,该同工酶为单一谱帶,可达到电泳的纯度,PPO单链的分子量大小约为53 ku。经Native-PAGE电泳,结果见图1-B,图1-B显示有2条同工酶谱带。依据该同工酶在离子交换柱层析中洗脱的顺序,将其命名为PPO II。经检测,PPO II的比活力为2 325.39 U/mg,纯化倍数约为1.36倍,活性得率为0.07%。
2.2 抑制剂对PPO II活性的影响
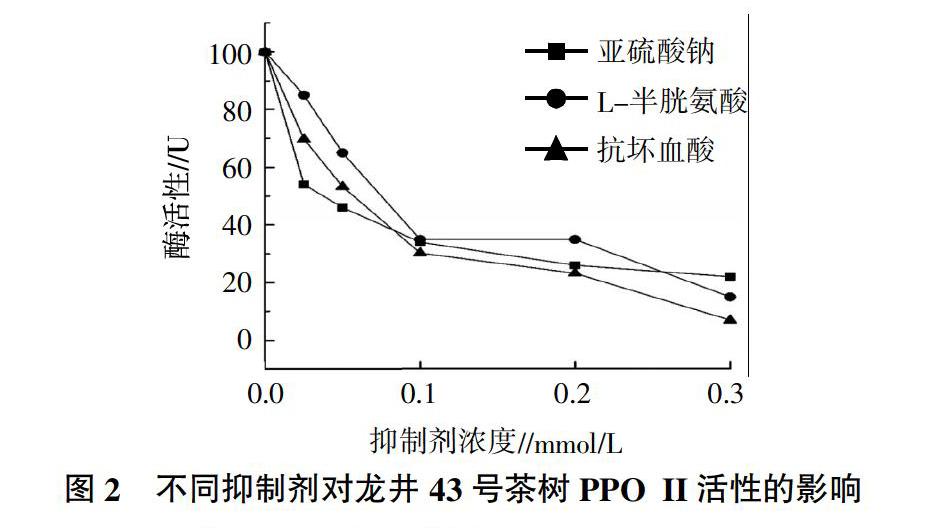
试验分析了亚硫酸钠、L-半胱氨酸、抗坏血酸 3种抑制剂对龙井43号茶树PPO II活性的影响,结果见图2。从图2可见,抗坏血酸、亚硫酸钠和L-半胱氨酸均对PPO II活性有抑制作用,并且随着抑制剂浓度的增加而增强。3种抑制剂对PPO II抑制效果的变化类似;在终浓度0.1 mmol/L之前,3种抑制剂随浓度的增加,对PPO II活性的抑制效果呈线性增强;至0.1 mmol/L浓度时,3种抑制剂抑制了PPO II 65%以上的酶活性;超过0.1 mmol/L浓度后,3种抑制剂抑制PPO II活性的降低程度趋于平缓。在3种抑制剂中,以抗坏血酸的抑制作用略强,其次为L-半胱氨酸,亚硫酸钠最弱;当抗坏血酸浓度为0.3 mmol/L时,PPOII残留的酶活性仅为6.98%。
2.3 pH对PPO II活性的影响
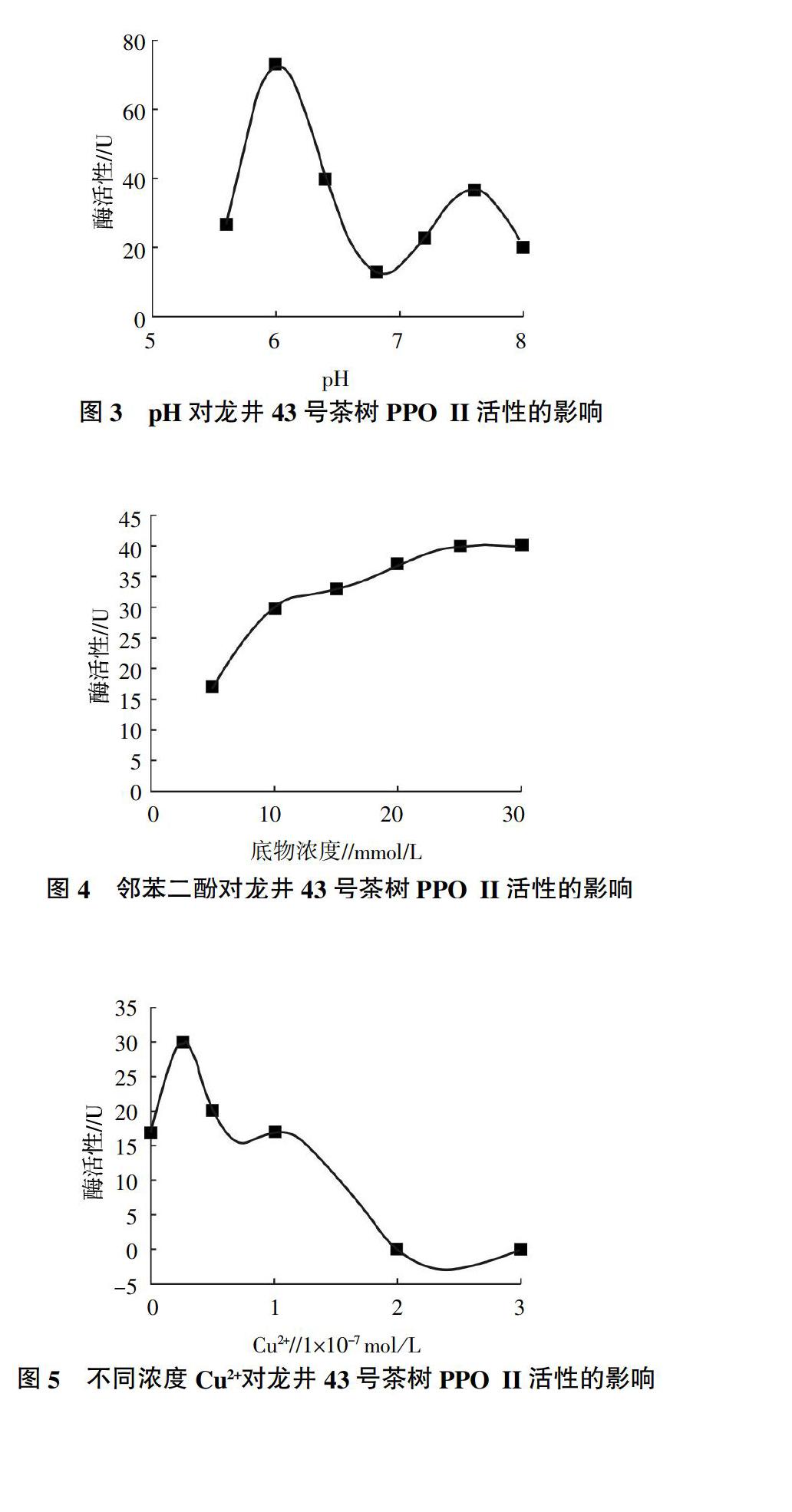
试验分析了不同pH对龙井43号茶树PPO II活性的影响,结果见图3。从图3可知,PPO II呈现两个活性峰,一个是在pH 6.0,一个是pH 7.6。但以pH 6.0的PPO II活性更高,约为pH 7.6处的2倍,由此可见PPO II的最适反应pH为6.0。
2.4 底物浓度对PPO II活性的影响
试验还分析了不同邻苯二酚浓度对PPO II活性的影响,结果见图4。从图4可以看出,随着底物浓度的增加,在5~25 mmol/L范围内PPO II活性呈上升趋势。但随着底物浓度的进一步增加,PPO II活性增加幅度逐渐趋于平缓,且在底物浓度为25 mmol/L时酶活性达到最大。根据Lineweaver-Burk方程,得出PPO II的Km为13.05 mmol/L,最大反应速率vmax为0.019 OD460/min。
2.5 铜离子对PPO II活性的影响
试验分析了添加不同浓度的Cu2+对龙井43号茶树PPO II活性的影响,结果见图5。从图5可知,Cu2+浓度对PPO II活性呈先促进后抑制的作用。随着Cu2+浓度的增加,PPO II活性升高;当Cu2+浓度为0.25×10-7 mol/L时出现一个活性峰,随后活性随Cu2+浓度的增加而降低。当Cu2+浓度达到2×10-7 mol/L时,PPO II活性消失,说明同工酶在此Cu2+浓度时完全受到了抑制。
3 讨论
3.1 PPO II的肽链组成形式
已经发现的植物和微生物中的PPO同工酶绝大多数是同源二聚体,仅少数是单体或其他组成形式[22]。现在一般也认为茶树PPO同工酶也是同源二聚体,但也有报道在同一茶树中的PPO同工酶存在单体、二聚体、三聚体等多种形式[10,11];本试验中暂未对PPO II的肽链构成进行分析。然而在对经过分子筛后的PPO II进行Native-PAGE电泳染色时,显示出有2条活性带,似表明有2个同工酶。但是试验在离子交换后的PPO II分离液进行非变性胶显色时,仅有一条活性带,变性胶显示也仅一条带。这表明茶树PPO II在分离纯化后的保存过程中,酶蛋白相互之间可能会产生一种聚合,但酶活性依然可以保留,这还有待于后续进行PPO II全酶分子量的测定以及分子组成形式分析来验证。
3.2 PPO II的最适反应pH
已有报道证明茶树PPO混合酶的最适反应pH为5.6[15,20],但茶树体内也有单一PPO同工酶的最适反应pH为5.6左右的报道[10],更有人发现茶树PPO混合酶的最适反应pH不在5.6,而是在8.6左右[16,23]。本试验中龙井43号茶树PPO II的最适反应pH为6.0,除此之外在pH 7.6时会产生另一个活性峰值。而试验在以不同pH的缓冲液进行龙井43茶树PPO蛋白粗提过程中,发现在酸性和碱性条件下均会产生一个酶活性峰值,但以酸性条件下的峰值更高。令人感兴趣的是在酸、碱两种完全不同的条件下,茶树PPO催化的机理是否完全一致、催化产物方面是否会有所不同还有待于后续试验来比较。
3.3 铜离子对PPO II的作用
铜离子是植物PPO催化活性中心的必需因子,已有研究证实铜离子是茶树PPO的重要组成部分[11,22]。试验中发现,Cu2+浓度在0.25×10-7 mol/L时酶活性最高,证实Cu2+可以提高PPO II的活性。而在基因表达的茶树PPO蛋白试验中,发现Cu2+浓度在1.0×10-7 mol/L时PPO活性最高[5]。这表明Cu2+应该是茶树PPO催化所需的因子。
由于试验仅对分离纯化获得的一个龙井43号茶树PPO同工酶进行了部分酶学性质研究,局限性不言而喻,还有很多酶学性质方面的问题有待于后续深入进行研究来解决。
参考文献:
[1] 叶 飞,高士伟,龚自明.砂梨多酚氧化酶处理对夏秋红茶品质的影响[J].食品科学,2013,34(23):92-95.
[2] ALTUNKAYA A. Partial purification and characterization of polyphenoloxidase from turkish tea leaf (Camellia sinensis L)[J].International Journal of Food Properties,2014,17(7): 1490-1497.
[3] 赵振军,郭胡津,黎星辉.鲜茶汁贮藏过程中多酚氧化酶活性分析[J].广东农业科学,2014,41(1):90-92,95.
[4] 黄建安,黄意欢,李家贤,等.茶树多酚氧化酶基因的PCR-RFLP多态性分析[J].茶叶科学,2008,28(5):370-378.
[5] LIU J W,HUANG Y Y,DING J,et al. Prokaryotic expression and purification of Camellia sinensis polyphenol oxidase[J]. Journal of the Science of Food and Agriculture,2010,90(14): 2490-2494.
[6] WU Y L,PAN L P,YU S L, et al. Cloning, microbial expression and structure-activity relationship of polyphenol oxidases from Camellia sinensis[J]. Journal of Biotechnology,2010,145(1): 66-72.
[7] 劉敬卫,黄友谊,丁 建,等.茶树多酚氧化酶成熟蛋白的原核表达[J].茶叶科学,2010,30(2):136-140.
[8] 王乃栋,张丽霞,向勤锃,等.茶树多酚氧化酶基因的生物信息学分析及原核表达[J].茶叶科学,2011,31(1):33-39.
[9] TAKEO T,BAKER J E. Changes in mulitiple forms of polyphenol oxidase during maturation of tea leaves[J]. Phytochemistry, 1973,12(1):21-24.
[10] BUZUN G A,DZHEMUKHADZE K M,MILESHKO L F. Some properties of tea polyphenol oxidase[J]. Biokhimiia (Moscow Russia),1970,35(5):1002-1006.
[11] TAKEO T,URITANI I. Tea leaf polyphenol oxidase Part II. purification and properties of the solubilized polyphenol oxidase in tea leaves[J]. Agricultural and Biological Chemistry, 1966,30(2):155-163.
[12] PRUIDZE G N,MCHEDLISHVILI N I,OMIADZE N T,et al. Multiple forms of phenol oxidase from Kolkhida tea leaves (Camelia sinensis L.) and Mycelia sterilia IBR 35219/2 and their role in tea production[J]. Food Research International, 2003,36(6):587-595.
[13] RAJANNA L, RAMAKRISHNAN M. Isozyme studies on some selected Camellia clones[J].International Journal of Engineering Science and Technology,2010,2(12):6918-6921.
[14] ?譈MIT ?譈 M,SELIN N,YABACI M,et al. Exraction,partial purification and characterisation of polyphenol oxidase from tea leaf (Camellia sinensis)[J].GIDA,2011,36(3):137-144.
[15] 赵淑娟,王坤波,傅冬和,等.茶多酚氧化酶酶学性质研究[J].湖南农业大学学报(自然科学版),2008,34(1):84-86.
[16] 孙慕芳,张 洁,郭桂义.白毫早鲜叶茶多酚氧化酶酶学特性[J].贵州农业科学,2014,42(6):140-143.
[17] 刘仲华,施兆鹏.红茶制造中多酚氧化酶同工酶谱与活性的变化[J].茶叶科学,1989(2):141-150.
[18] 唐 茜.蜀永系列茶树品种多酚氧化酶的等电聚焦研究[J].四川农业大学学报,1997(2):14-17.
[19] 黄福平,梁月荣,陈荣冰,等.做青强度对做青叶蛋白质组成、多酚氧化酶和酯酶同工酶谱的影响[J].茶叶科学,2004,24(1):70-74.
[20] 滕 杰,丰金玉,熊 硕,等.茶叶多酚氧化酶及其同工酶的研究进展[J].茶叶通讯,2014,41(2):10-13.
[21] 王坤波,刘仲华,赵淑娟,等.梨多酚氧化酶同工酶组成及其对茶黄素合成的影响[J].湖南农业大学学报(自然科学版),2007,33(4):459-462.
[22] 黄意欢.茶学实验技术[M].北京:中国农业出版社,1997.
[22] 雷东锋,冯 怡,蒋大宗.植物中多酚氧化酶的特征[J].自然科学进展,2004,14(6):606-613.
[23] 王丽霞,陆 蒸,林启训,等.福云6号茶叶茶多酚氧化酶特性的研究[J].江苏农业科学,2008(1):213-215.

