甘蓝型油菜BnFAD2-C5基因启动子及内含子在表达水平的功能分析
刘睿洋刘 芳张振乾 官春云
湖南农业大学农学院 / 国家油料改良中心湖南分中心, 湖南长沙 410128
甘蓝型油菜BnFAD2-C5基因启动子及内含子在表达水平的功能分析
刘睿洋**刘 芳**张振乾 官春云*
湖南农业大学农学院 / 国家油料改良中心湖南分中心, 湖南长沙 410128
富含油酸的菜籽油具有重要的经济价值, 使得高油酸育种及油酸形成机制成为热点。油酸脱氢酶基因(FAD2基因)是控制油酸含量的关键酶基因。本文针对BnFAD2-C5基因展开研究, 根据油菜和甘蓝的同源性, 克隆了1257 bp启动子序列, 利用 GUS和 GFP作为报告基因分别构建含有不同片段长度的启动子和内含子的缺失载体并转化拟南芥, 经GUS染色检测发现-319 ~-1 bp为该研究中最小启动子; 采用Western blot技术分析启动子和内含子不同区域的功能, 发现BnFAD2-C5启动子区域-1257 ~-1020 bp和-319 ~-1 bp能够诱导报告基因在转基因拟南芥种子发育中期高效表达, BnFAD2-C5内含子具有增强启动子转录水平的功能, 该功能主要由+631~ +1033 bp区域调控。
甘蓝型油菜; BnFAD2-C5基因; 内含子增强效应; 拟南芥
菜籽油在我国食用成品油市场占有重要地位,高油酸菜籽油不容易被氧化, 保鲜更持久[1-3], 具有重要的商业价值[4]。因此, 油酸含量的高低也成为评判油菜品质的重要指标, 同时, 高油酸育种及形成相关机理也成为目前各油料作物研究的热点[5-6]。
目前在高油酸育种方面, 通过传统育种的手段,官春云等[7]用60Co辐射诱变获得油酸含量高达93.5%的材料, 和江明等[8]利用 EMS诱变油菜小孢子获得油酸含量为80.34%的材料。油酸脱氢酶基因(fatty acid desaturase, FAD2)作为控制油酸、亚油酸和亚麻酸含量的主要基因[9-10], 其功能主要是将油酸磷脂胆碱去饱和成亚油酸磷脂胆碱。Stoutjesdijk等[10]通过共抑制法沉默甘蓝型油菜 FAD2基因, 将油酸含量提高至89%; Peng等[11]通过RNAi技术将甘蓝型油菜FAD2基因和FAE1基因共同沉默, 使油酸含量提高至85.34%。然而, 与高油酸油菜育种相比, 油酸形成机制的研究则比较落后。详细探究脂肪酸代谢路径中的关键酶基因(FAD2基因)的调控机制, 将有助于充分利用 FAD2基因为高油酸育种提供参考。2006年, Kim等[12]通过缺失分析的手段,对芝麻FAD2基因(SeFAD2)上游调控序列分析研究,发现在上游5′端非翻译区(untranslated region, UTR)内部存在一个1131 bp长度的内含子, 并且具有增强启动子功能的效应, 而启动子区域则主要含有一些起到负调控作用的顺式作用元件。同时证实脱落酸(abscisic acid, ABA)可以促进芝麻FAD2启动子的启动转录功能, 增强SeFAD2基因的表达, 并确定了ABA应答元件在启动子上的大致区域。Xiao等[13]通过对甘蓝型油菜 BnFAD2-A5基因研究, 预测并分析了该启动子及内含子上的顺式作用元件,通过检测转基因拟南芥中 GUS活力, 证明BnFAD2-A5启动子属于组成型启动子, 其内含子同样具有增强基因表达的功能。BnFAD2-A5启动子的活性受 ABA的诱导出现高表达现象, 并且定位到ABA在启动子上的顺式作用结合位点 ABRE所处的位置。
本实验室前期已克隆到甘蓝型油菜 BnFAD2基因的4个拷贝(BnFAD2-A5、BnFAD2-C5、BnFAD2-A1 和BnFAD2-C1), 初步分析了BnFAD2-A5[13]和BnFAD2-C1[14]在转录水平的功能, 而BnFAD2-A1则是假基因(待发表), 因此本研究针对 BnFAD2-C5基因展开研究, 克隆 BnFAD2-C5启动子, 采用生物信息学分析启动子及内含子的顺式作用元件, 通过PCR技术构建启动子及内含子的缺失载体并转化拟南芥, 分析BnFAD2-C5启动子和内含子的功能, 旨在为高油酸油菜分子育种在表达水平提供理论基础。
1 材料与方法
1.1 试验材料
甘蓝型油菜湘油15和拟南芥(Arabidopsis thaliana Col)由国家油料改良中心湖南分中心提供。大肠杆菌 trans-T1购自北京全式金公司, pCAMBIA1303载体和农杆菌 GV3101均由湖南省作物基因工程重点实验室陈信波教授赠予。
1.2 克隆BnFAD2-C5启动子区域
本实验室已通过RACE技术克隆了BnFAD2-C5基因的全长序列, 确定转录起始位点及转录终止位点, 且发现在5′UTR内部含有一个内含子序列(图1)。在此基础上, 本研究根据油菜与甘蓝的同源性, 依据甘蓝数据库信息(http://ocri-genomics.org/bolbase),在转录起始位点上游约 1700 bp处设计正向引物PBn-F1 (5′-AAATGAAATGAAAATCATGGTAGGTG-3′), 在该基因编码区内部设计反向引物CDS-R (5′-GCTTGATGTTGTGTCGGTTTCAGACTT-3′), 通过PCR技术从甘蓝型油菜基因组DNA中扩增BnFAD2-C5启动子区域, 然后转化到大肠杆菌并测序。

图1 BnFAD2-C5序列结构示意图Fig.1 Model of BnFAD2-C5 gene structure
1.3 生物信息学分析
利用 PLACE (http://www.dna.affrc.go.jp/htdocs/ PLACE)和PlantCARE (http://www.intra.psb.ugent.be:8080/PlantCARE)网站对 BnFAD2-C5启动子及内含子序列预测分析。
1.4 启动子及内含子缺失表达载体构建及拟南芥的转化
缺失载体构建过程中所用引物见表1。采用PBn-F1和IBn-r引物从基因组中克隆启动子+内含子片段, 经 Hind III/Nco I双酶切处理, 连接到pCAMBIA1303载体, 构建表达载体 Bn-1, 导入大肠杆菌保存。以含有Bn-1载体的大肠杆菌菌液为模板, 分别以引物 PBn-F1/PBn-R、PBn-F2/PBn-R、 PBn-F3/PBn-R、PBn-F4/PBn-R、PBn-F5/PBn-R克隆启动子缺失片段, 经 Hind III/Nco I双酶切处理后,按照上述方法, 将其连接到 pCAMBIA1303载体,构建启动子缺失表达载体 BnP-1、BnP-2、BnP-3、BnP-4和BnP-5 (图2)。
同样以含有 Bn-1载体的大肠杆菌菌液为模板,以IBn-F/IBn-r引物进行扩增; 以IBn-R1、IBn-R2、IBn-R3和IBn-R4为反向引物, IBn-F1为正向引物,进行 PCR扩增, 各取 3 μL PCR产物与 3 μL IBn-F/IBn-r产物进行融合 PCR, 反应体系含缓冲液4 μL、dNTPs 2 μL、HS Taq聚合酶0.5 μL、ddH2O 7.5 μL; 反应条件为95 ℃ 5 min ; 95 ℃ 50 s, 58℃ 50 s,72 ℃ 4 min, 15个循环。取2 μL融合产物作为模板,以IBn-F1/IBn-r为引物进行PCR扩增, 扩增程序为95℃ 5 min; 95 ℃ 50 s, 58℃ 50 s, 72 ℃ 4 min, 25个循环; 72 ℃ 10 min。将融合产物克隆到大肠杆菌并测序。选择测序正确的菌株摇菌, 提取质粒并进行Hind III/Nco I双酶切, 然后将酶切后的产物纯化并连 接 到经 Hind III/Nco I 双酶 切 处理 的pCAMBIA1303载体, 构建内含子缺失载体BnI-1、BnI-2、BnI-3和BnI-4 (图2)。以含有CaMV35S启动子的 pCAMBIA1303载体为阳性对照, 去除CaMV35S启动子的作为阴性对照。

表1 不同长度BnFAD2-C5启动子片段和引物序列Table1 Different fragments of the BnFAD2-C5 promoter and the primer sequences
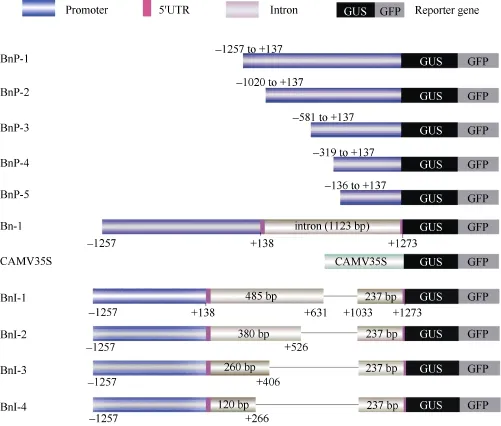
图2 缺失载体构建模式图Fig.2 Construction pattern diagram of deleted vector
将构建好的表达载体通过冻融法导入农杆菌GV3101, 将转化后的农杆菌菌液涂到含有庆大霉素(GM)和卡那霉素(Kan)的YEB固体平板筛选, 挑选单菌落进行PCR检测, 并将阳性菌液保存于-80℃。在转化拟南芥前, 将含有目的表达载体的农杆菌画线接种于含有50 mg L-1GM+50 mg L-1Kan的YEB固体平板, 28℃倒置培养2 d, 挑取单菌落于10 mL含有50 mg L-1GM+50 mg L-1Kan的YEB液体培养基摇过夜, 取2 mL接种于50 mL含有50 mg L-1GM+50 mg L-1Kan的YEB液体培养基, 待其OD600为0.4~0.6时, 收集菌体(5000转 min-1, 5 min), 用5 mL 10 mmol L-1MgSO4溶液重悬, 加入5 μL乙酰丁香酮(200 μmol L-1)于暗光下静置 1.5 h。随后加入100 mL渗透培养基, 通过花序浸染法转化拟南芥。
1.5 GUS染色及GFP蛋白相对表达量分析
参照 Jefferson等[15]GUS组织化学检测的方法检测转基因拟南芥种子不同发育时期(4、7、10和13 d) GUS表达情况。以GFP为报告基因, 以Actin为内参, 通过Western blot技术对GFP和Actin显影,利用 Quality One软件将 Western杂交斑点数字化,以GFP含量比Actin含量所得的数值表示GFP蛋白的相对含量, 以此确定不同缺失载体启动报告基因GFP的功能大小。
2 结果与分析
2.1 启动子区域的克隆及 BnFAD2-C5基因上游序列的生物信息学分析
根据油菜和甘蓝的同源性, 同源克隆了1257 bp启动子序列, 与甘蓝基因组序列仅有 2个碱基的差异。利用PLACE和PlantCARE网站对BnFAD2-C5基因启动子和内含子区域预测分析(图3), 发现在启动子区域存在核心启动子必备的元件 TATA box (-139 bp)和CAAT box (-61 bp), 同时还存在一些控制基因高效转录的元件(CCAATT box, GATA, 5′UTR Py-rich), 激素应答元件(TCA motif、CGTCA motif、ABRE、MYB、MYC和GARE), 根毛特异性元件(root hair specific element, RHE), 光调控元件(GAG,G-boxGT-1 consensus合Dof), 花粉特异性表达元件(GTGA), 胚乳特异性表达元件(ACGT), 以及具有正、负调控功能的元件CACA。
在内含子区域, 同样存在 TATA box和 CAAT box, 分别位于+1241 bp和+1040 bp处。另外, 内含子区域也包含一些顺式作用元件, 如胚乳特异性表达原件(ACGT, Skn-1motif), 激素应答原件(MYB、MYC、GARE), 分生组织特异性原件(CAT box), 抗性原件(W-box), 光控原件(G-box、GT-1consensus),热激蛋白原件(heatshockprotein element, HSE)以及Dof和E-box。
2.2 BnFAD2-C5启动子功能分析
由GUS染色结果(图4)可知, 当BnFAD2-C5启动子缺失掉大部分区域, 仅保留-136 ~ +137 bp区域时(BnP-5), GUS染色结果与阴性对照相同, 该部分序列不能发挥启动子功能, 而 BnP-1、BnP-2、BnP-3和BnP-4均有不同程度的着色。将含有BnP-1、BnP-2、BnP-3和BnP-4的转基因拟南芥发育中的种子进行蛋白相对定量检测, 将 Western blot结果经Quality软件数字化后, 以GFP含量比Actin含量所得的数值表示 GFP蛋白的相对含量, 结果如图5。BnP-1和BnP-4的GFP蛋白相对含量高于BnP-2和BnP-3, 而BnP-2和BnP-3的相对蛋白含量较为接近,说明在缺失的-1257 ~-1020 bp区间存在调控基因高表达的正调控元件, 在-581 ~-319 bp区间存在抑制基因表达的负调控元件, 且主要是抑制-319 ~-1 bp区间的顺式作用元件的功能发挥。BnP-1和BnP-4在种子发育中期出现表达高峰, 而 BnP-2和 BnP-3在整个种子发育过程中表达量变化较为平缓, 说明在-1257~-1020 bp和-319~-1 bp区间存在某些调控元件诱导报告基因GFP在种子发育中期高效表达。
2.3 BnFAD2-C5内含子功能分析
由图5-A中BnP-1转基因拟南芥种子GFP蛋白相对含量与图6-A中Bn-1比较可知, BnFAD2-C5内含子具有增强启动子功能的效应, 为了研究发挥这一增强效应的内含子区域, 本研究将内含子区间缺失并转化拟南芥验证。分别采用GUS染色和Western blot方法检测转基因拟南芥不同发育时期(4、7、10 和13 d)种子中报告基因GUS/GFP的含量。GUS染色结果显示, 随着内含子片段的逐步缺失, 染色有不同程度的变化(图7), 说明内含子不同区域发挥着一定的功能。利用Quality One软件将Western杂交斑点数字化后绘制曲线(图6), 发现当缺失+631~+1033 bp区域后, GFP蛋白相对含量大幅下降, 当继续缺失+526 ~ +631 bp时, GFP相对蛋白含量几乎降至零, 但下降幅度减小, 说明在+631 ~ +1033 bp区域存在正调控元件促进基因的高效表达, 在+526 ~+631 bp区域也存在正调控元件, 但功能较弱。随着进一步的缺失, BnI-3和BnI-4 GFP蛋白相对含量逐渐上升, 说明在缺失掉的+266 ~ +526 bp区间, 含有负调控元件抑制启动子的功能。因此, 推测内含子的增强效应主要取决于+631 ~ +1033 bp区域顺式作用元件的功能发挥。

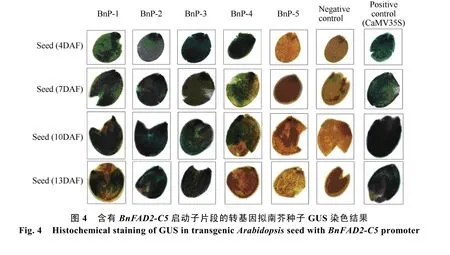
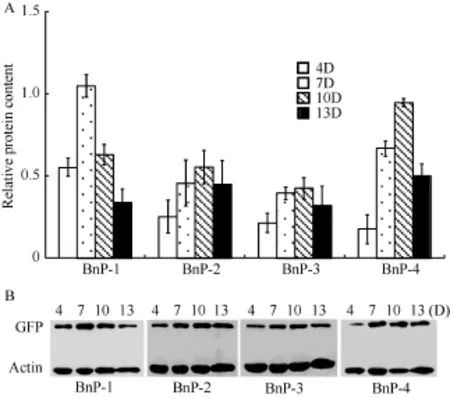
图5 转基因拟南芥种子中BnFAD2-C5启动子的功能分析Fig.5 Functional analysis of BnFAD2-C5 promoter in transgenic Arabidopsis seed
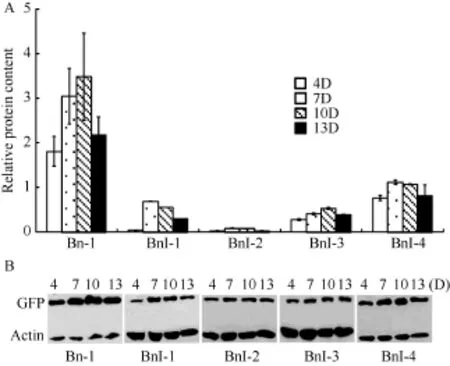
图6 转基因拟南芥种子中BnFAD2-C5内含子功能分析Fig.6 Functional analysis of BnFAD2-C5 intron in transgenic Arabidopsis seed
3 讨论

图7 含有BnFAD2-C5内含子片段的转基因拟南芥种子GUS染色结果Fig.7 Histochemical staining of GUS in transgenic Arabidopsis seed with BnFAD2-C5 intron
3.1 内含子具有增强BnFAD2-C5表达水平的功能
BnFAD2-C5基因的全长序列已克隆, 发现长度为1123 bp的内含子位于5′UTR内部。类似的序列特征在玉米[16]、大豆[17]、拟南芥[12]、芝麻[12]和油菜[13]中均有报道, 且发现这些内含子通常具有增强效应。本文也证实该内含子具有增强BnFAD2-C5基因表达水平的功能。一般而言, 内含子增强效应由内含子剪切模式[18]、内含子的长度[19]以及内含子的特殊元件决定, 但是Parra等[20]认为内含子剪切模式不足以对启动子功能产生增强效应, Carola等[21]证实内含子的长度越长其增强效应越强。在本研究中, 缺失掉大部分内含子序列的BnI-4其GFP蛋白相对含量却比BnI-3和BnI-4有所增加, 那么, 认为内含子的长度并不是导致该内含子发挥增强效应的原因,该内含子的增强效应极有可能是特殊的调控元件与启动子区域互作引起的。当内含子+631~ +1033 bp区域缺失后, GFP蛋白相对含量明显下降, 而随着进一步缺失并没有再次引起GFP蛋白相对含量的大幅下降(图5-A), 说明内含子增强效应区域主要存在于+631 ~ +1033 bp区域, 而不是整个内含子区间。Parra等[20]认为, 内含子的增强效应元件主要存在于内含子的5′端, 而不是内含子的3′端, 在5′UTR和编码区也会大量出现。如果内含子含有大量 CGATT拷贝, 则会大幅增加基因的表达量。在油菜BnFAD2-C5内含子的5′端+262 ~ +266 bp处存在一个CGATT,并且BnI-4 GFP蛋白相对含量高于BnI-1、BnI-2和BnI-3, 所以当+266 ~ +631 bp区间的负调控元件被解除后, CGATT元件极有可能增强了基因的表达水平, 导致BnI-4中GFP蛋白相对含量增加。Kim等[12]发现芝麻 FAD2基因的内含子增强效应区域为+791 ~+1517 bp, 处于远离内含子5′端的位置, 并推测内含子中具有增强功能的元件与增强子的作用方式相近,并不受距离的影响, 可以在远距离发挥增强作用。本研究中BnFAD2-C5内含子增强效应的主效元件位于+631 ~ +1033 bp区域, 也远离内含子 5′端, 推测该内含子功能的发挥不受距离的影响, 发挥功能的元件可以远距离增强启动子的转录水平。
Rose[22]研究发现, 内含子增强效应主要是富含U的序列导致, 内含子的 5′和 3′剪切位点和分支点突变时, 会影响内含子的剪切, 但不一定会引起内含子增强效应的减弱。我们分析了+631 ~ +1033 bp区域, 其中存在 38.7%的 U序列, 同时还存在ABRE/MYB/MYC、E-box、GARE元件, 研究发现这些元件在油菜种子napA启动子和拟南芥中, 当植物受到干旱刺激和病原菌危害时能够增强相应启动子的功能, 诱导基因的高表达[23-24]。
3.2 BnFAD2-C5启动子具有诱导基因表达的功能
从图4-C可知, 含有BnP-1和BnP-4的转基因拟南芥种子发育至7 d时, 出现高表达现象, 具有典型诱导表达的特点, BnP-2和BnP-3则呈现组成型表达的特点, 在种子发育的各个时期蛋白含量变化微弱。因此我们认为-1020 ~-319区域存在控制基因组成型表达的相关元件。在BnP-1的-1257 ~-1020 bp和BnP-4的-319 ~-1 bp中存在某些元件在种子发育至7 d时可以被激活, 诱导该基因的表达, 通过PLACE和 PlantCARE网站预测可知, 在-1257~-1020 bp和-319~-1 bp分别含有 2 Dof, 3 GT-1consensus、BoxII、TCA motif、GAG和GATA、G-box、3GT-1consensus、4 Dof、GAG、GC-motif、CGTCA motif、TATA-box和CAAT-box。GT-1consensus在病原菌和NaCl的诱导下会促进SCaM-4基因启动子转录[25], TCA motif是水杨酸应答元件, 抑制iMyAP基因启动子的转录[26]。Dof、BoxII、GAG是光诱导调控元件, 感受光刺激诱导基因的表达, Dof蛋白结合Dof调控位点增强cyPPDK基因和PEPC基因的转录[27]。CGTCA motif是茉莉酸应答元件,当植物体内茉莉酸含量上升时, 诱导相关基因的表达[26,28]。GATA元件, 具有增强cab基因启动子转录水平的功能[29]。CAAT-box能提高转录起始频率, 并且参与基因表达量的调控[30]。因此, 下一步工作可以针对-1257 ~-1020 bp和-319 ~-1 bp区域展开研究, 探索对BnFAD2-C5基因发挥诱导功能的主效区域及主效元件。
4 结论
克隆了 BnFAD2-C5启动子序列, 其-1257~-1020 bp和-319~-1 bp区域具有诱导基因表达的功能; BnFAD2-C5内含子具有增强转录水平的效应,这一功能主要由+631~ +1033 bp区域调控。
References
[1] Jung S, Swift D, Sengoku E, Patel M, Teule F, Powell G, Abbott A.The high oleate trait in the cultivated peanut (Arachis hypogaea L.).Isolation and characterization of two genes encoding microsomal oleoyl-PC desaturases.Mol Gen Genet,2000, 263: 796-805
[2] Terés S, Barceló-Coblijn G, Benet M, Alvarez R, Bressani R,Halver J E, EscribáP V.Oleic acid content is responsible for the reduction in blood pressure induced by olive oil.Proc Natl Acad Sci USA, 2008, 105: 13811-13816
[3] Wijesundera C, Ceccato C, Fagan P, Shen Z, Burton W, Salisbury P.Canola quality Indian mustard oil (Brassica juncea) is more stable to oxidation than conventional Canola oil (Brassica napus).Am J Clin Nutr, 2008, 85:693-699
[4] Tang G Q, Novitzky W P, Carol Griffin H.Oleate desaturase enzymes of soybean: evidence of regulation through differential stability and phosphorylation.Plant J, 2005, 44: 433-446
[5] Rojas-Barros P, de Haro A, Fernandez-Martinez J M.Inheritance of high oleic/low ricinoleic acid content in the seed oil of castor mutant OLE-1.Cropence, 2005, 45: 157-162
[6] Nabloussi A, Fernandez-Martinez J M, Velasco L.Inheritance of mid and high oleic acid content in Ethiopian mustard.Cropence,2006, 46: 2361-2367
[7] 官春云, 刘春林, 陈社员, 彭琦, 李栒, 官梅.辐射育种获得油菜(Brassica napus)高油酸材料.作物学报, 2006, 32:1625-1629 (in Chinese with English abstract)Guan C Y, Liu C L, Chen S Y, Peng Q, Li X, Guan M.High oleic acid content materials of rapeseed (Brassica napus) produced by radiation breeding.Acta Agron Sin, 2006, 32: 1625-1629
[8] 和江明, 王敬乔, 陈薇, 李根泽, 董云松, 寸守铣.用 EMS诱变和小孢子培养快速获得甘蓝型油菜高油酸种质材料的研究.西南农业学报, 2003, 16(2): 34-36 He J M, Wang J Q, Chen W, Li G Z, Dong Y S, Cun S X.Studies on rapidly obtaining high oleic acid germplasm of Brassica napus by mutagen EMS and microspore culture.Southwest China J Agric Sci, 2003, 16(2): 34-36 (in Chinese with English abstract)
[9] Hu X, Sullivan-Gilbert M, Gupta M, Thompson S A.Mapping of the loci controlling oleic and linolenic acid contents and development of fad 2 and fad 3 allele-specific markers in canola (Brassica napus L.).Theor Appl Genet, 2006, 113: 497-507
[10] Stoutjesdijk P A, Hurlestone C, Singh S P, Green A G.High-oleic acid Australian Brassica napus and B.juncea varieties produced by co-suppression of endogenous D12-desaturases.Biochem SocT, 2000, 28: 938-940
[11] Peng Q, Hu Y, Wei R, Zhang Y, Guan C, Ruan Y, Liu C.Simultaneous silencing of FAD2 and FAE1 genes affects both oleic acid and erucic acid contents in Brassica napus seeds.Plant Cell Rep, 2010, 29: 317-325
[12] Kim M J, Kim H, Shin J S, Chung C H, Ohlrogge J B, Suh M C.Seed-specific expression of sesame microsomal oleic acid desaturase is controlled by combinatorial properties between negative cis-regulatory elements in the SeFAD2 promoter and enhancers in the 5′-UTR intron.Mol Genet Genom, 2006, 276:351-368
[13] Xiao G, Zhang Z Q, Yin C F, Liu R Y, Wu X M, Tan T L, Chen S Y, Lu C M, Guan C Y.Characterization of the promoter and 5′-UTR intron of oleic acid desaturase (FAD2) gene in Brassica napus.Gene, 2014, 545: 45-55
[14] 刘芳, 刘睿洋, 彭烨, 官春云.甘蓝型油菜 BnFAD2-C1 基因全长序列的克隆, 表达及转录调控元件分析.作物学报, 2015,41: 1663-1670 Liu F, Liu R Y, Peng Y, Guan C Y.Cloning and expression of BnFAD2-C1 gene involved in Brassica napus and analysis of transcription regulation elements.Acta Agron Sin, 2015, 41:1663-1670 (in Chinese with English abstract)
[15] Jefferson R A, Kavanagh T A, Bevan M W.GUS fusion:β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants.EMBO J, 1987, 6: 3901-3907
[16] Heppard E P, Kinney A J, Stecca K L, Miao G H.Developmental and growth temperature regulation of two different microsomal [omega]-6 desaturase genes in soybeans.Plant Physiol, 1996, 110:311-319
[17] Pirtle I L, Kongcharoensuntorn W, Nampaisansuk M, Knesek J E,Chapman K D, Pirtle R M.Molecular cloning and functional expression of the gene for a cotton Δ-12 fatty acid desaturase (FAD2).BBA-Gene Struc Exp, 2001, 1522: 122-129
[18] Mascarenhas D, Mettler I J, Pierce D A, Lowe H W.Intron-mediated enhancement of heterologous gene expression in maize.Plant Mol Biol, 1990, 15: 913-920
[19] Chung B Y, Simons C, Firth A E, Brown C M, Hellens R P.Effect of 5'UTR introns on gene expression in Arabidopsis thaliana.BMC Genom, 2006, 7: 120
[20] Parra G, Bradnam K, Rose A B, Korf I.Comparative and functional analysis of intron-mediated enhancement signals reveals conserved features among plants.Nucl Acids Res, 2011,39: 5328-5337
[21] Carola M, Finer J J.The intron and 5′ distal region of the soybean Gmubi promoter contribute to very high levels of gene expression in transiently and stably transformed tissues.Plant Cell Rep,2015, 34: 111-120
[22] Rose A B.Requirements for intron-mediated enhancement of gene expression in Arabidopsis.RNA, 2002, 8: 1444-1453
[23] Stålberg K, Ellerstöm M, Ezcurra I, Ablov S, Rask L.Disruption of an overlapping E-box/ABRE motif abolished high transcription of the napA storage-protein promoter in transgenic Brassica napus seeds.Planta, 1996, 199: 515-519
[24] Eulgem T, Rushton P J, Robatzek S, Somssich I E.The WRKY superfamily of plant transcription factors.Trends Plant Sci, 2000,5: 199-206
[25] Park H C, Kim M L, Kang Y H, Jeon J M, Yoo J H, Kim M C,Yoon H W.Pathogen-and NaCl-induced expression of the SCaM-4 promoter is mediated in part by a GT-1 box that interacts with a GT-1-like transcription factor.Plant Physiol, 2004, 135:2150-2161
[26] Andreasson E, Taipalensuu J, Rask L, Meijer J.Age-dependent wound induction of a myrosinase-associated protein from oilseed rape (Brassica napus).Plant Mol Biol, 1999, 41: 171-180
[27] Yanagisawa S.Dof1 and Dof2 transcription factors are associated with expression of multiple genes involved in carbon metabolism in maize.Plant J, 2000, 21: 281-288
[28] Rouster J, Leah R, Mundy J, Cameron-Mills V.Identification of a methyl jasmonate-responsive region in the promoter of a lipoxygenase 1 gene expressed in barley grain.Plant J, 1997, 11:513-523
[29] Lam E, Chua N H.ASF-2: a factor that binds to the cauliflower mosaic virus 35S promoter and a conserved GATA motif in Cab promoters.Plant Cell, 1989, 1: 1147-1156
[30] Kusnetsov V, Landsberger M, Meurer J.The assembly of the CAAT-box binding complex at a photosynthesis gene promoter is regulated by light, cytokinin, and the stage of the plastids.J Biol Chem, 1999, 274: 36009-36011
Functional Analysis of BnFAD2-C5 Promoter and Intron at Expression Level in Brassica napus
LIU Rui-Yang**, LIU Fang**, ZHANG Zhen-Qian, and GUAN Chun-Yun*
College of Agriculture, Hunan Agricultural University / National Oilseed Crops Improvement Center in Hunan, Changsha 410128, China
High oleic rapeseed breeding and the formation mechanism of oleic acid have become a central issue after finding the important economic value of rapeseed oil with high oleic acid.The fatty acid dehydrogenase gene (FAD2) is a key enzyme gene to control oleic acid content, but the regulation of FAD2 gene is not well understood.According to the homology between rapeseed and oleracea, the BnFAD2-C5 promoter sequence of 1257 bp was cloned.Promoter and intron of BnFAD2-C5 gene were analyzed using β-glucuronidase (GUS) reporter and green fluorescent protein (GFP) reporter system to construct deleted vectors and transform Arabidopsis thaliana.Deletion analysis of BnFAD2-C5 promoter through GUS stainning revealed that-319 to-1 bp was the minimum promoter region.And deletion analysis of BnFAD2-C5 promoter and intron through GFP reporter system using western technique showed that-1257 to-1020 bp and-319 to-1 bp regions of BnFAD2-C5 promoter could induce expression of reporter genes effectively in transgenic Arabidopsis seed in the mid stage of seed development, while BnFAD2-C5 intron could confer the enhancement of promoter’s function and the intron-mediated enhancement region was mainly located in +631 to +1033 bp.
Brassica napus; BnFAD2-C5 gene; Intron-mediated enhancement; Arabidopsis thalina
10.3724/SP.J.1006.2016.01471
本研究由湖南省科技创新项目(CX2013A012)和国家重点基础研究发展规划项目(2015CB150200)资助。
This study was supported by the Science and Technology Innovation Project of Hunan Province (CX2013A012) and the National Basic Research Program of China (2015CB150200).
(Corresponding author): 官春云, E-mail: guancy2011@aliyun.com
联系方式: E-mail: ruiyang_liu2007@126.com**同等贡献(Contributed equally to this work)
Received(): 2016-02-16; Accepted(接受日期): 2016-05-09; Published online(网络出版日期): 2016-06-06.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160606.0855.002.html

