Hsa-miR-498对肾上腺皮质癌细胞SW-13增殖及凋亡的影响△
赵欣 张学斌 李汉忠
中国医学科学院北京协和医学院北京协和医院泌尿外科/北京协和转化医学中心,北京100730
Hsa-miR-498对肾上腺皮质癌细胞SW-13增殖及凋亡的影响△
赵欣张学斌#李汉忠
中国医学科学院北京协和医学院北京协和医院泌尿外科/北京协和转化医学中心,北京100730
目的探索微小核糖核酸(micro RNA)Hsa-miR-498对肾上腺皮质癌细胞(SW-13)增殖及凋亡的影响,并初步预测其靶基因。方法将SW-13细胞分为3组,空白对照组(A组)为未接受转染细胞,阴性对照组(B组)为无意义寡聚核苷酸和LipofectamineTM2000转染试剂按1∶1混合转染,敲低组(C组)为转染Has-miR-498 inhibitor组。使用RT-PCR检测各组中Has-miR-498的表达情况;应用MTT法测定各组细胞的生长曲线;采用Annexin V-FITC/PI双染法检测各组细胞的凋亡率;并用miRDB初步预测与Hsa-miR-498相关的靶基因。结果经RT-PCR检测发现C组细胞中Hsa-miR-498表达下降;MTT结果显示,与A、B组相比,C组细胞增殖能力下降(P<0.05);Annexin V-FITC/PI双染法结果显示,A、B组相比,C组细胞凋亡率增加,但差异无统计意义(P>0.05)。经miRDB初步预测Has-miR-498与细胞增殖及凋亡最相关的靶基因为CD93和JHDM1D。结论降低Hsa-miR-498在SW-13中的表达可抑制SW-13的增殖并促进其凋亡。表明Hsa-miR-498可能与SW-13的增殖及凋亡相关。
肾上腺皮质癌细胞;细胞增殖;细胞凋亡;微小核糖核酸-498
Oncol Prog,2016,14(6)
肾上腺皮质肿瘤(adrenalcortical tumor,ACT)是内分泌系统常见的肿瘤,尸检中发现率为7.3%。在引起肾上腺皮质醇症的肾上腺皮质肿瘤中,肾上腺皮质腺瘤占10%,肾上腺皮质癌(adrenalcortical carcinomas,ACC)占6%[1]。
微小RNA(micro RNA)是一种短链非编码RNA,它的主要作用为调控靶mRNA的表达,与多种疾病的发生发展密切相关。Hsa-miR-498位于19q13.41,研究表明,Hsa-miR-498在卵巢癌、乳腺癌、结直肠癌等疾病起病中起重要作用[2-4],尚无研究探索Hsa-miR-498在肾上腺皮质癌中的作用。本研究旨在初步探索Hsa-miR-498对肾上腺皮质癌细胞增殖及凋亡的影响。
1 材料与方法
1.1实验材料
肾上腺皮质癌细胞系SW-13(中国医学科学院细胞中心)。
主要试剂包括:L15培养基(中国医学科学院细胞中心);胎牛血清(美国Gibco公司);miR引物、U6引物(上海英俊生物技术有限公司);miRNA Inhibitor套装(苏州吉玛生物技术公司);LipofectamineTM2000转染试剂(美国Invitrogen公司);MTT四甲基偶氮唑盐(美国Sigma公司);Annexin V-FITC(美国Invitrogen公司)。经苏州吉玛生物技术公司设计合成相应的Has-miR-498 inhibitor。阴性对照无意义寡聚核苷酸序列为:5'-CAGUACUUUUGUGUAGUACAA-3'。
主要仪器包括:细胞培养箱(美国Thermo Scientific Forma公司);Eppendorf 5417c离心机(德国Eppendorf公司);SMA4000分光光度计(北京Meriton公司);流式细胞仪(美国Beckman Courlter公司)。
1.2实验方法
1.2.1细胞培养及实验分组SW-13细胞培养于L15培养基中(含10%胎牛血清),置于37℃、无CO2环境的细胞培养箱中传代。取对数生长期细胞进行实验。分为3个实验组,每组细胞3个复孔,每孔3000~10000个细胞。其中A组为空白对照组,为未接受转染细胞。B组为阴性对照组,无意义寡聚核苷酸和LipofectamineTM2000转染试剂按1∶1混合。C组为转染Has-miR-498 inhibitor组,即敲低组。
1.2.2体外转染转染前24 h取对数生长期长势良好的SW-13细胞,以每孔3×103个细胞置于24孔培养板中,37℃,无CO2细胞培养箱中培养24 h。细胞融合达50%~60%时,将LipofectamineTM2000转染试剂盒Hsa-miR-498 inhibitor按1∶1混合,孵育15 min,加入24孔板中,6 h后更换培养液,培养24 h后重复转染一次,然后继续培养24 h。
1.2.3RT-PCR检测各组Has-miR-498的表达情况使用Trizol法提取各组细胞样本总RNA,以U6作为内参照进行校正和标准化。RT反应程序为16℃,30 min;42℃,42 min;85℃,5 min。RTPCR反应程序为95℃,5 min;95℃,10 s;60℃,20 s;72℃,20 s;反应40个循环。通过各组产物的标准曲线及熔解曲线,得到各反应管循环阈值Ct,应用GenePix ProV6.0进行数据分析。实验重复3次。定制的引物序列为:
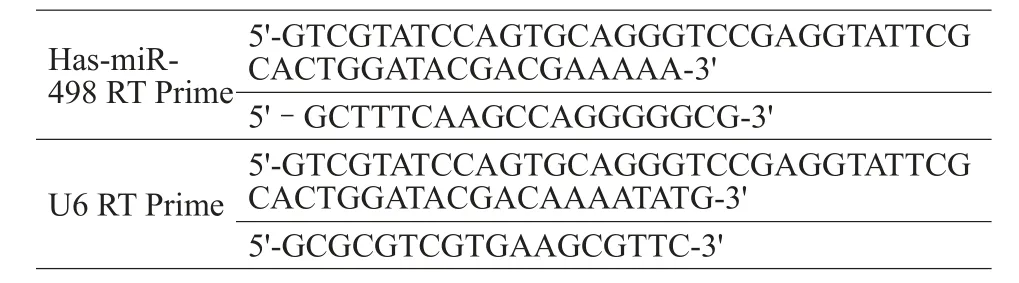
Has-miR-498 RT Prime 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCG CACTGGATACGACGAAAAA-3' 5'-GCTTTCAAGCCAGGGGGCG-3' 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCG CACTGGATACGACAAAATATG-3' 5'-GCGCGTCGTGAAGCGTTC-3' U6 RT Prime
1.2.4MTT法检测3组细胞的生长曲线①接种细胞:用L15培养液配成单个细胞悬液,以每孔1000~ 10000个细胞接种到96孔板,每孔体积200 μl。②培养细胞:培养0 h、24 h、48 h、72 h、96 h。③显色:在0 h、24 h、48 h、72 h、96 h的相应时间点,每孔加MTT溶液(5 mg/ml用PBS配)20 μl继续孵育4 h,终止培养。每孔加150 μl DMSO,振荡10 min,使结晶物充分融解。④读取OD值:选择570 nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以0 h、24 h、48 h、72 h、96 h时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.5Annexin V-FITC/PI双染法检测3组细胞凋亡率①离心收集悬浮细胞,微量离心机转速2000 rpm,离心时间5 min,弃培养基。②用冷PBS洗涤细胞两次(2000 rpm,5 min,收集细胞)。③用400 μl 1×Binding Buffer悬浮细胞,浓度约为1×106/ml。④在细胞悬浮液中加入5 μl Annexin V-FITC,轻轻混匀后于2~8℃避光条件下孵育15 min。加入10 μl PI后轻轻混匀于2~8℃避光条件下孵育5 min。⑤在1 h内用流式细胞仪检测。
1.2.6Hsa-miR-498靶基因的初步预测经miRDB靶点预测工具(http://mirdb.org/miRDB/),对Hsa-miR-498靶基因进行初步预测。
1.3统计学方法
使用SPSS17.0软件处理数据。各组实验-均独立重复3次,实验数据采用均数±标准差(±s)表示。多组间数据比较采用单因素方差分析,组间两两比较采用t检验。当P<0.05时差异有统计学意义。
2 结果
2.1RT-PCR检测结果
A、B、C组2-ΔΔCt值分别为(1.00±0.00)、(1.12± 0.15)和(0.46±0.11)。C组细胞中Has-miR-498表达明显低于A组和B组,差异有统计学意义(P<0.05)。
2.2MTT法测定3组细胞的生长曲线
C组细胞在48 h、72 h和96 h增殖率(29.80%± 1.45%,37.67%±0.59%和45.1%±1.10%)低于A组(34.60%±3.47%,41.20%±0.78%,54.00%±1.59%)和B组(36.37%±1.15%,47.17%±2.55%,53.35%± 0.28%),差异均有统计学意义(P<0.05)。(图1)

图1 3组细胞的生长曲线
2.3Annexin V-FITC/PI双染法检测细胞凋亡率
Hsa-miR-498在SW-13细胞中敲低后,A、B、C组细胞凋亡率分别为1.92%±0.82%,2.11%±0.76%和4.95%±0.81%,C组细胞凋亡率高于A、B组,但差异无统计学意义(P>0.05)。
2.4Hsa-miR-498靶点预测
经miRDB预测Hsa-miR-498有多个靶基因,包括PDK3、JHDM1D、CD93、NAP1L3、DCTN4、KCNK10、CCPG1等。发现其中与细胞增殖、凋亡、血管形成最相关的靶基因为JHDM1D和CD93。
3 讨论
Micro RNA具有复杂功能和调控途径。有研究提示Hsa-miR-498与散发三阴性乳腺癌的发病有关,在三阴性乳腺癌组织中表达明显上调,BRCA1为其靶基因,可能是一种癌基因[2]。Gopalan[4]的研究显示,Hsa-miR-498在结直肠癌组织中表达下调,能促进结直肠癌细胞增殖,与结直肠癌的发生有密切关系,可能是一种抑癌基因。有研究提示卵巢癌组织中Hsa-miR-498下调提示预后欠佳,其主要的靶基因为FOXO3[3,5],可能是一种肿瘤抑制因子。Wang等[6]研究指出Hsa-miR-498在非小细胞肺癌中明显下调,并与疾病的进展有关。本研究中实验结果显示,Hsa-miR-498可促进肾上腺皮质癌细胞的增殖,具有部分癌基因特征,HsamiR-498表达敲低后,肾上腺皮质细胞增殖明显下降,因此可作为治疗肾上腺皮质肿瘤靶向药物的潜在靶点。但同时也应该关注将其用作靶向药物时带来的不良反应,尤其是导致其他组织肿瘤的发生,比如结直肠癌、卵巢癌等。
Hsa-miR-498有多个的靶点,经miRDB靶点预测工具发现其与肿瘤发生最相关的靶基因为JHDM1D和CD93[7-8]。这些靶基因有独特的细胞功能,比如细胞增殖、血管形成和凋亡等,为进一步探索Hsa-miR-498作用途径提供了线索。
本研究发现敲低肾上腺皮质癌细胞中的HsamiR-498后,肾上腺皮质癌细胞的增殖能力降低,提示Hsa-miR-498可促进肾上腺皮质癌细胞的增殖。但查阅文献目前尚无Hsa-miR-498在肾上腺皮质癌组织中表达上调的报道,因此Hsa-miR-498可能仅有促进肾上腺皮质癌细胞增殖的作用,有部分癌基因特征,这对理解肾上腺皮质肿瘤的发病提供了新的线索,但目前资料无法评价其促使肾上腺皮质细胞恶变的作用。进一步研究应检测其在肾上腺良性肿瘤及肾上腺皮质癌中的表达,以评价其与肾上腺皮质细胞增殖的关系,以及主要的靶基因和信号传导途径。
[1]Alan J,Wein LRAW.Campbell-Walsh Urology[M].10th ed.Elsevier,2012:1693.
[2]Matamala N,Vargas MT,Gonzalez-Campora R,et al.MicroRNA deregulation in triple negative breast cancer reveals a role of miR-498 in regulating BRCA1 expression[J].Oncotarget,2016,7(15):20068-20079..
[3]Cong J,Liu R,Wang X,et al.Low miR-498 expression levels are associated with poor prognosis in ovarian cancer[J]. Eur Rev Med Pharmacol Sci,2015,19(24):4762-4765.
[4]Gopalan V,Smith RA,Lam AK.Downregulation of microRNA-498 in colorectal cancers and its cellular effects[J].Exp Cell Res,2015,330(2):423-428.
[5]Liu R,Liu F,Li L,et al.MiR-498 regulated FOXO3 expression and inhibited the proliferation of human ovarian cancer cells[J].Biomed Pharmacother,2015,72:52-57.
[6]Wang M,Zhang Q,Wang J,et al.MicroRNA-498 is downregulated in non-small cell lung cancer and correlates with tumor progression[J].J Cancer Res Ther,2015,11(Suppl): C107-C111.
[7]Nawrocki MJ,Strugala AJ,Piotrowski P,et al.JHDM1D and HDAC1-3 mRNA expression levels in peripheral blood mononuclear cells of patients with systemic lupus erythematosus[J].Z Rheumatol,2015,74(10):902-910.
[8]Galvagni F,Nardi F,Maida M,et al.CD93 and dystroglycan cooperation in human endothelial cell adhesion and migration adhesion and migration[J].Oncotarget,2016,7(9): 10090-10103.
The effect of Hsa-miR-498 on proliferation and apoptosis of human adrenal cortical carcinoma cell line SW-13△
ZHAO Xin ZHANG Xue-bin#LI Han-zhong
Department of Urology/Translational Medicine Center,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100730,China
ObjectiveTo investigate the effect of Hsa-miR-498 on proliferation and apoptosis of human adrenal cortical carcinoma cell line SW-13,and try to determine the target genes.MethodThe cell line was divided into three groups,including blank group(group A),negative control(NC)group(group B),and inhibitor group(group C),with no transfection,transfection of oligonucleotide and LipofectamineTM2000 transfection reagent(1∶1),and transfection of Has-miR-498 inhibitors,respectively.RT-PCR was applied to determine the expression of the Has-miR-498 in each group;then the proliferation was tested by MTT and the apoptosis by Annexin V-FITC/PI.The target genes of Hsa-miR-498 were predicted using miRDB.ResultRT-PCR showed that Has-miR-498 was knocked down in group C;MTT showed that,compared with group A and group B,proliferation slowed in group C;And in Annexin V-FITC/PI,it was found that knocking down Hsa-miR-498 could mildly promote apoptosis of SW-13 cells,though no statistically significant difference was observed(P>0.05).By miRDB analysis,CD93 and JHDM1D were most probably related to the proliferation and apoptosis of SW-13 cell line.ConclusionKnocking down Hsa-miR-498 could reduce proliferation and mildly promote apoptosis of SW-13 cells,suggesting a correlation between them.
adrenocortical carcinoma cell;cell proliferation;cell apoptosis;Has-miR-498
R736.6
A
10.11877/j.issn.1672-1535.2016.14.06.11
2016-04-19)
国家自然科学基金(81070628)
(corresponding author),邮箱:xuebinzh@126.com

