肝硬化门静脉高压食管胃静脉曲张出血的防治指南
中华医学会肝病学分会 中华医学会消化病学分会 中华医学会内镜学分会
肝硬化门静脉高压食管胃静脉曲张出血的防治指南
中华医学会肝病学分会中华医学会消化病学分会中华医学会内镜学分会
目录
一、概述
二、基本概念
三、GOV的发病机制、自然史和风险评估
四、食管胃静脉曲张出血的一级预防
五、急性食管胃底静脉曲张出血的治疗
六、食管静脉曲张出血的二级预防
七、特殊类型静脉曲张的处理
八、原发疾病的治疗
九、待解决的问题
十、中英文缩略词表
一、概述
门静脉高压症是指由各种原因导致的门静脉系统压力升高所引起的一组临床综合征,其最常见病因为各种原因所致的肝硬化。门静脉高压症基本病理生理特征是门静脉系统血流受阻和(或)血流量增加,门静脉及其属支血管内静力压升高并伴侧支循环形成,临床主要表现为腹水、食管胃静脉曲张(gastroesophageal varices,GOV)、食管胃静脉曲张破裂出血(esophagogastric variceal bleeding,EVB)和肝性脑病等,其中EVB病死率高,是最常见的消化系统急症之一。为规范肝硬化门静脉高压EVB的预防、诊断和治疗,中华医学会肝病学分会、消化病学分会和内镜学分会于2008年组织国内有关专家制订了《肝硬化门静脉高压食管胃静脉曲张出血的防治共识》[1]。近7年来,国内外有关肝硬化门静脉高压EVB的临床研究取得一定进展。许多随机对照研究更新了EVB的处理方法,发表了2008年的苏格兰校际指南网(SIGN)、2012年英国国家卫生与临床研究所(NICE)指南和2015年英国指南及Baveno VI[2]等。此外,有关患者教育、基础治疗、如何降低内镜治疗后再出血率,术前术后包括肝功能、门脉高压及侧枝循环的评估等对治疗方案选择的影响,也是临床存在的突出问题。
本指南旨在帮助医生在肝硬化门静脉高压EVB的诊疗和预防工作中做出合理决策,但不是强制性标准,也不可能包括或解决肝硬化门静脉高压EVB诊治中的所有临床问题。因此,临床医生在面对某一患者时,应在充分了解有关本病的最佳临床证据、认真考虑患者具体病情及其意愿的基础上,根据自己的专业知识、临床经验和可利用的医疗资源,制定全面合理的诊疗方案。
本文中的证据等级分为A、B、C,3个级别,推荐等级分为1.2级别(表1)。

表1 推荐意见的证据等级和推荐等级
二、基本概念
(一)EVB的治疗目的
EVB的防治目的包括:1.预防首次EVB(一级预防);2.控制急性EVB;3.预防再次EVB(二级预防);4.改善肝脏功能储备。
(二)EVB和再出血
1.EVB的诊断:出血12-24小时内进行食管胃十二指肠镜(Esophagogastroduodeno-scopy,EGD,简称胃镜)检查是诊断EVB的可靠方法。内镜下可见曲张静脉活动性出血(渗血、喷血)、在未发现其他部位有出血病灶但有明显静脉曲张的基础上,发现有血栓头[2]。
胃镜作为一种侵入性的检查措施,目前仍是对静脉曲张进行筛查的主要方法。推荐采用胃镜检查确定患者是否存在GOV并评估曲张静脉破裂出血的危险性[3]。一项包含了9项研究、631例患者的Meta分析显示,胶囊内镜检查用于诊断食管胃静脉曲张的敏感度和特异度分别为83%和85%[4],另一项包含了16项研究的Meta分析显示,胶囊内镜诊断的敏感度和特异度分别为84.8%和84.3%[5],其中仅1项研究出现了严重不良事件,为食管狭窄嵌顿。相比于胃镜,胶囊内镜检查耐受性良好,但其在评估静脉曲张的存在、大小和红色征等方面仍不理想,预测精度目前尚不满意。超声内镜(Endoscopic Ultrasound,EUS)可在内镜检查的基础上,提供更多细节信息,如内部解剖结构变化和粘膜血流的改变,可提高病程早期的诊断率[6]。
腹部超声检查可反映肝硬化和门静脉高压的严重程度,辅助GOV的诊断。多排螺旋CT(Multidetector computed tomography,MDCT)可作为筛查门静脉高压症食管胃静脉曲张的无创性检查方法[7],尤其对较大GOV的诊断敏感度和特异度均较高[8]。CT门静脉血管成像(CT portography,CTP)可清晰显示门静脉主干及其分支与侧支循环,与胃镜检查在GOV诊断方面具有一致性[9],对孤立胃静脉曲张,也是一种有效的筛查和治疗效果评估的工具[10]。在GOV分级方面,CT检查与内镜检查之间尚不具有很好的相关性[11]。磁共振血管成像(magnetic resonance angiopraphy,MRA)能较好地显示门静脉系统解剖图像[12],磁共振弹性成像(magnetic resonance elastography,MRE)和动态增强磁共振成像(dynamic contrast material-enhanced MR,DCE MR)等技术均可用于预测食管胃静脉曲张[13]。肝弹性检测与肝静脉压力梯度(hepatic venou s pressure gradient,HVPG)具有一定相关性,也可用于肝硬化门静脉高压的辅助诊断[14,15],但均不足以代替胃镜检查。一些研究选取了部分非侵入性的指标来进行评价,如血小板计数、纤维蛋白原等,其GOV风险评估程度还需进一步确认。
2.提示EVB未控制的征象:具有以下表现之一:(1)在药物治疗或内镜治疗后≥2小时,出现呕吐新鲜血液或鼻胃管吸出超过100 ml新鲜血液;(2)发生失血性休克;(3)未输血情况下,在任意24小时期间,血红蛋白下降30 g/L(红细胞压积降低≈9%)。
3.提示EVB再出血的征象:出血控制后再次有临床意义的活动性出血事件(呕血、黑便或便血;收缩压降低20 mmHg以上或心率增加>20次/min;在没有输血的情况下血红蛋白下降30 g/L以上)。早期再出血:出血控制后72小时~6周内出现活动性出血。迟发性再出血:出血控制6周后出现活动性出血。
(三)GOV的分型与分级:
我国、日本及欧美有关食管胃静脉曲张的分型分级标准不同,本指南推荐我国的分型方法—LDRf分型[16],LDRf是具体描述静脉曲张在消化管道内所在位置(Location,L)、直径(Diameter,D)与危险因素(Risk Factor,Rf)的分型记录方法,统一表示方法为:LXx D0.3-5 Rf0,1,2。
LXx:第一个X为脏器英文名称的首字母,即食管e(esophageal),胃g(gastric),十二指肠d(duodenum),空肠j(jejunum),回肠i(ileum),直肠r(rectum)等,第二个x是曲张静脉位于该器官的哪一段,以食管为例,上段s(superior),中段(mmiddle),下段i(inferior),分别记做Les,Lem,Lei。孤立胃静脉曲张记做Lg,Lgf表示曲张静脉位于胃底;Lgb表示曲张静脉位于胃体;Lga表示曲张静脉位于胃窦;若食管静脉曲张延伸至胃底则记做Le,g;若曲张静脉为多段,使用相应部位代号联合表示,如为食管下段与胃底均存在静脉曲张,但未相同,记录为Lei,Lgf。
D0.3-5:表示所观察到曲张静脉最大直径,按D+直径数字方法表示,数字节点以内镜下治疗方式选择为依据:D0.3,D1,D1.5,D2.0,D3.0等。
Rf0,1,2:危险因素表示观察到的曲张静脉出血的风险指数,静脉曲张破裂出血的相关危险因素有:(1)红色征(red color RC),RC+(包括鞭痕征、血疱征等)提示曲张静脉易于出血的征象;(2)肝静脉压力梯度(HVPG),用于判断食管胃静脉曲张的发生及其预后;(3)糜烂,提示曲张静脉表层黏膜受损,是近期出血的征象,需要及时内镜下治疗;(4)血栓,无论是红色血栓或是白色血栓都是即将出血的征象,需要及时内镜下治疗;(5)活动性出血,内镜下可以看到曲张静脉正在喷血或是渗血;(6)以上因素均无,但是镜下可见到新鲜血液并能够排除非静脉曲张出血因素。依照是否有近期出血征象以及是否有急诊内镜下治疗的指征分为3个梯度:Rf0:无以上5个危险因素,无近期出血指征;Rf1:RC+或HVPG>12 mmHg,有近期出血的征象,需要择期进行内镜下治疗;Rf2:可见糜烂、血栓、活动性出血,需要及时进行内镜下治疗。
具体可参照中华医学会消化内镜学分会食管胃静脉曲张学组《消化道静脉曲张及出血的内镜诊断和治疗规范试行方案(2009年)》,见表2[17]。

表2 食管胃静脉曲张记录方法
食管静脉曲张也可按静脉曲张形态、是否有红色征及出血危险程度简分为轻、中、重3度[1]。轻度(G1):食管静脉曲张呈直线形或略有迂曲,无红色征。中度(G2):食管静脉曲张呈直线形或略有迂曲,有红色征或食管静脉曲张呈蛇形迂曲隆起但无红色征。重度(G3):食管静脉曲张呈蛇形迂曲隆起且有红色征或食管静脉曲张呈串珠状、结节状或瘤状(不论是否有红色征)。

三、GOV的发病机制、自然史和危险因素评估
任何原因引起的肝硬化均有可能引起门静脉高压,GOV及EVB的主要原因是门静脉高压。门静脉压力升高缘于肝组织纤维化及结节再生所致的小血管扭曲变形,阻碍血液流动。此外,体循环大血管收缩占肝内血流阻力增高原因的20%~30%。门静脉高压导致门-体侧枝循环形成,但由于以下两个原因,门静脉高压仍持续存在:(1)门-体侧枝循环形成后,内脏小血管舒张,门静脉血流阻力增高;(2)门体分流并不能有效减压,门静脉血流阻力仍高于正常肝脏。因而,门静脉压力的增加,一方面是因为门静脉阻力(肝内及侧支循环)增加,另一方面为血容量增加所致[18]。
代偿期肝硬化患者首先应确定是否存在GOV,GOV患者发生肝功能失代偿的风险和病死率均显著高于无GOV者[19]。GOV可见于约50%的肝硬化患者,与肝病严重程度密切相关,约40%的Child-Pugh A级和85%的C级患者发生静脉曲张。孤立胃静脉曲张发生率为33.0%~72.4%,2年的出血发生率约25%。原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)可在病程早期、没有明显肝硬化形成前即发生静脉曲张及出血。较小直径的曲张静脉以每年8%的速度发展为较大直径的曲张静脉。EVB的年发生率为5%~15%,6周的病死率可达20%。
食管胃静脉曲张的出血危险因素包括:食管胃静脉曲张程度、红色征及Child-Pugh分级。食管胃静脉曲张程度与曲张静脉直径呈线性正相关。肝脏疾病病程是静脉曲张进展的主要决定因素,一项前瞻性队列研究纳入了494例肝硬化患者,随访145±109个月,应用竞争风险模型进行分析,发现在病程10年、20年时,出现静脉曲张的概率分别为44%和53%[20]。轻度静脉曲张即曲张静脉直径<5 mm,暂不需要行预防性治疗,但必须行胃镜随访[2]。肝硬化的诊断一旦成立,即应定期进行胃镜检查,复查的频度取决于患者的肝硬化程度和静脉曲张程度。HVPG是进行风险评估的有效方法。HVPG>5 mmHg(正常3~5 mmHg)认为存在门脉高压,HVPG>10 mmHg是发生静脉曲张、肝硬化失代偿的预测因子,对于EVB的患者HVPG>20 mmHg是预后不良的有效预测因子[2]。一般认为,HVPG低于12 mmHg者不会发生静脉曲张出血。HVPG较基线值下降超过10%,认为治疗有效,再出血风险亦会显著下降。HVPG≤12 mmHg以下或较基线值下降≥10%者(定义为“HVPG应答者”)不仅静脉曲张出血复发的机会减少,发生腹水、肝性脑病和死亡的风险均会降低。但HVPG的检测是通过经皮穿刺插管,置入带有球囊导管的方式进行,该方法为侵入性操作,在国内尚未广泛应用。
其他较重要的预测因素为曲张静脉的直径和肝脏储备功能。曲张静脉壁张力亦是决定其是否破裂的主要因素。血管直径与血管壁张力、HVPG密切相关。相同血管内压力下,直径越大,管壁张力越大,越容易破裂。HVPG下降会使曲张静脉壁张力降低,减少破裂出血的风险。EVB未预防治疗的患者后期再出血率约为60%,大部分发生在首次出血后1~2年。Child-Pugh分级、白蛋白的水平以及国际标准化比值(INR)与临床显著门静脉高压症大致相关,可用于代偿期及失代偿期肝硬化患者的风险评估[21]。Child-Pugh C级;INR>1.5;门静脉直径>13 mm和血小板明显减少;3项条件可预测肝硬化患者发生静脉曲张的可能性,分别满足0、1、2项或3项者,估计出现食管静脉曲张的比率为<10%,20-50%,40-60%和>90%。肝硬化患者符合3项条件中的1项及1项以上可作为内镜筛查静脉曲张和进行EVB一级预防的指征。MELD积分可用于预测无静脉曲张患者肝脏失代偿的发展,亦可用于预测静脉曲张出血的6周病死率[22]。

四、食管胃静脉曲张出血的一级预防
EVB一级预防的目的是防止曲张静脉形成和进展、预防中-重度曲张静脉破裂出血,防止并发症的发生,提高生存率。
不同程度静脉曲张的预防措施
(一)无食管静脉曲张一项多中心、随机、安慰剂对照试验纳入了213例无食管静脉曲张的门脉高压患者[23,24],随机给予噻吗洛尔(108例)或安慰剂治疗(105例),平均随访时间54.9个月,随访结束时终点事件率(静脉曲张的出现或出血)两组间差异无统计学意义,同时两组在发生腹水、肝性脑病、需要肝移植、病死率的差异亦无统计学意义,治疗组不良事件发生率高于安慰剂组,显示非选择性β受体阻滞剂用于无食管静脉曲张者并无益处。
(二)轻度食管静脉曲张非选择性β受体阻滞剂是否应用于较小食管静脉曲张者具有争议。一项包含6项随机对照临床试验、916例患者的Meta分析研究了非选择性β受体阻滞剂在无或轻度静脉曲张患者中的预防效果,结果显示非选择性β受体阻滞剂组和安慰剂组在进展至较大静脉曲张率、首次出血率、病死率方面差异无统计学意义,而非选择性β受体阻滞剂组的不良事件发生率高于安慰剂组[25]。因此,仅在出血风险较大的轻度食管静脉曲张患者中推荐使用非选择性β受体阻滞剂。
(三)中、重度食管静脉曲张
1、药物预防一项包括9项临床试验、966例患者的Meta分析评估了非选择性β受体阻滞剂和非活性药物预防首次出血的效果,结果显示非选择性β受体阻滞剂组首次出血风险明显降低,尤其是在较大食管静脉曲张、HVPG>12 mmHg的患者中[26]。另一项包括11项临床试验、1189例患者的Meta分析也得到了类似结果,非选择性β受体阻滞剂应用于中、重度食管静脉曲张时,治疗组首次出血风险明显低于对照组[27],同时病死率也显著降低。非选择性β受体阻滞剂与内镜下曲张静脉套扎术(endoscopic variceal ligation,EVL)相比,预防效果相当[28]。非选择性β受体阻滞剂通过降低心输出量、收缩内脏血管发挥降低门静脉压力的作用,同时,减少细菌易位,减少腹水[29],自发性细菌性腹膜炎[30]的发生。
卡维地洛为同时具有阻断α1受体作用的非选择性β受体阻滞剂,可降低肝血管张力和阻力[31]。一些研究证实,卡维地洛降低HVPG的幅度可达20%,甚至显著高于普萘洛尔[32-34]。一项随机、双盲、对照临床试验比较了卡维地洛和普萘洛尔降低HVPG的效果[34],试验选取了38例HVPG≥12 mmHg的肝硬化患者,随机给予卡维地洛(21例)或普萘洛尔(17例)治疗,90天后再次测量HVPG,结果显示两组患者HVPG均显著下降,两组间下降幅度差异无统计学意义。另一项多中心、随机、对照试验将卡维地洛和EVL的预防效果进行了对比[32],其中纳入了152例中、重度食管静脉曲张患者,77例给予卡维地洛12.5 mg、每日1次,75例每2周行EVL术直至静脉曲张消失,结果显示服用卡维地洛组的首次出血率低于EVL组,两组病死率、出血相关病死率均无统计学意义,EVL组有6例发生套扎后溃疡出血。卡维地洛有望成为新的预防药物,但其有效性和长期应用安全性尚有待进一步研究证实。
辛伐他汀可增加肝脏中一氧化氮的含量,从而降低肝硬化患者HVPG且不影响全身血流动力学稳定[35]。一项随机、安慰剂对照试验对59例肝硬化门静脉高压患者进行了研究[35],治疗组给予辛伐他汀20 mg/d(15天后加至40 mg/d),对照组给予安慰剂,1个月后显示治疗组HVPG平均下降8%,对照组HVPG较治疗前无变化。辛伐他汀降低HVPG的效果可与非选择性β受体阻滞剂叠加,但其长期应用的有效性和安全性尚需更大样本的研究。
一项包含了10个随机、对照临床试验的Meta分析显示,单用硝酸酯与单用非选择性β受体阻滞剂、硝酸酯联合非选择性β受体阻滞剂、安慰剂相比,生存率之间的差异无统计学意义,在某些临床试验中,单用硝酸酯的出血风险甚至高于安慰剂[36],且其不良反应较多,因此不推荐单独使用硝酸酯或联合使用非选择性β受体阻滞剂。
肝硬化患者血管紧张素II水平增加,可引起门静脉压力升高[37],但将血管紧张素II受体拮抗剂(Angiotensin Receptor Blocker,ARB)应用于门静脉高压患者未能取得较好疗效[38],一项随机、安慰剂对照、双盲临床试验纳入了32例患者[38],17例给予氯沙坦+普萘洛尔,15例给予安慰剂+普萘洛尔,两组HVPG均较前下降(由19.6±1.5 mmHg下降至16.6±1. 2 mmHg、17.8±1.1 mmHg下降至15.1±1.2 mmHg),但在普萘洛尔基础上加用氯沙坦未能增加HVPG下降幅度。血管紧张素转换酶抑制剂(angiotension converting enzyme inhibitors,ACEI)和ARB类药物作用相似,但ACEI/ARB类药物的主要副作用为低血压和肾功能衰竭,因而目前不推荐ACEI/ARB类药物用于门静脉高压治疗[39]。
螺内酯通过减少血容量和内脏血流也可降低门静脉压力,一项多中心、双盲、安慰剂对照试验观察了非选择性β受体阻滞剂联合螺内酯的干预效果[40],试验选取了100例无腹水、中、重度食管静脉曲张的肝硬化患者,51例给予纳多洛尔+安慰剂治疗,49例给予纳多洛尔+螺内酯治疗,平均随访22±16个月,结果显示两组的出血率、腹水发生率差异无统计学意义,纳多洛尔联合螺内酯的不良事件发生率却明显升高,因此不推荐在非选择性β受体基础上加用螺内酯。
2、内镜预防EVL用于预防食管静脉曲张首次出血具有较好的疗效,一项近期的Meta分析纳入了19项随机临床试验、1504例患者,对比了EVL和非选择性β受体阻滞剂的一级预防效果,结果显示两者在消化道出血率、病死率、出血相关病死率等方面无统计学差异[28]。
一些早期的研究显示,内镜下注射硬化剂治疗用于食管静脉曲张一级预防有效[41],但随后的一些更大的临床研究得到了相反结果[42],另一项预防性硬化治疗的前瞻性、随机临床试验则因硬化治疗组的病死率显著高于“假治疗组”而被提前终止[43]。
3、内镜联合药物预防药物联合EVL治疗疗效不优于单用药物或EVL,且增加不良事件发生率。一项近期的Meta分析纳入了12项随机临床试验、1571例患者[44],结果显示联合治疗组在降低首次食管静脉曲张出血率上并无优势,同时不良事件发生率显著增加。
4、门体分、断流术预防门体分、断流手术均通过降低门脉压力,减少首次出血风险,但其肝性脑病发生率明显升高,病死率反而增加[42],经颈静脉肝内门体分流术(Transjugu lar intrahepatic potorsystemic shunt,TIPS)和分流手术原理相似,因此均不适用于作为预防首次出血的措施。
(四)胃静脉曲张的预防关于胃静脉曲张出血的一级预防研究相对较少,GOV1Le,g型为食管静脉曲张的延伸,目前一级预防措施同食管静脉曲张。一项随机、对照临床试验纳入了89例食管静脉曲张已消失的GOV2或IGV1患者[45],随机应用组织粘合剂注射(30例)、非选择性β受体阻滞剂(29例)治疗或不采取治疗(30例),平均随访26个月,结果显示组织粘合剂组的胃静脉曲张出血率显著低于非选择性β受体阻滞剂组和无治疗组,与无治疗组相比,组织粘合剂组的生存率也更高。组织粘合剂注射的主要不良事件为血栓、感染等,其应用于胃静脉曲张患者的安全性和有效性尚需进一步研究,对这部分患者目前仍主张应用非选择性β受体阻滞剂。

五、急性食管胃静脉曲张出血的治疗[2,24,46]
(一)、药物治疗
1、一般处理
肝硬化急性食管胃静脉曲张大量出血者,早期治疗主要针对纠正低血容量休克、防止胃肠道出血相关并发症(感染、电解质酸碱平衡紊乱、肝性脑病等)、有效控制出血、监护生命体征和尿量,有条件者入住ICU。少量出血、生命体征稳定的患者可在普通病房密切观察。内科处理流程见图1。
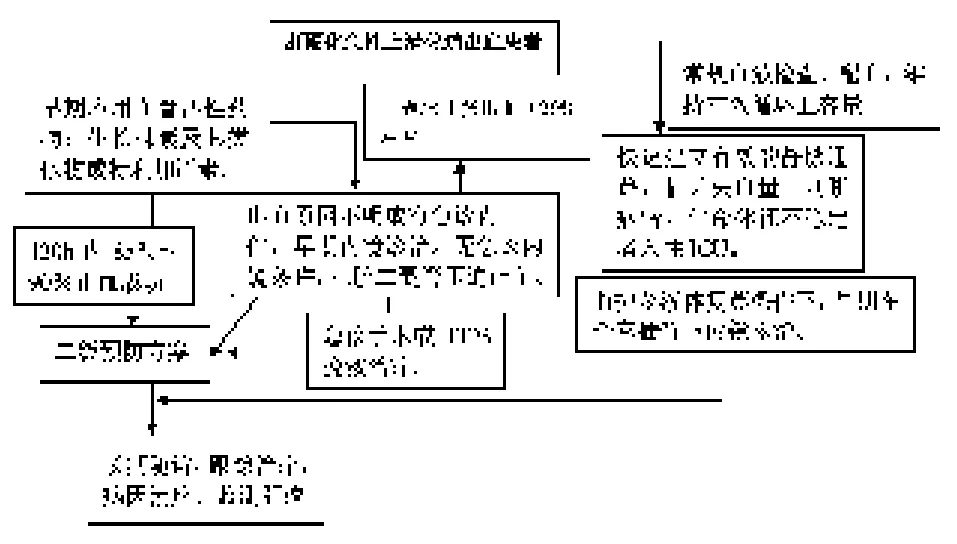
图1 肝硬化急性上消化道出血临床处理推荐流程
2、血容量的恢复保持有效(至少两条)的静脉通路,以便快速补液输血,根据出血程度确定扩血容量和液体性质,输血以维持血液动力学稳定并使血红蛋白维持在6g/dl以上,同时应该遵守输血管理规范,推广互助输血,以缓解血源紧缺的问题。需要强调的是,对肝硬化患者恢复血容量要适当,过度输血或输液可能导致继续或重新出血,避免仅用盐溶液补足液体,从而加重或加速腹水或其他血管外部位液体的蓄积。必要时应及时补充血浆和血小板等。有效血容量恢复的指征:(1)收缩压90 mmHg~120 mmHg;(2)脉搏<100次/min;(3)尿量>17 ml/h;(4)临床表现为神志清楚/好转,无明显的脱水貌。
3、早期降低门静脉压药物的应用目前临床急诊常用降门脉压药物包括血管加压素及其类似物(特利加压素)、十四肽生长抑素及其类似物(奥曲肽)。D'Amico G等一项包括15个临床实验的荟萃分析,比较急诊内镜治疗和药物治疗(血管加压素±硝酸甘油、特利加压素、十四肽生长抑素及奥曲肽)的效果及安全性,结果发现药物治疗具有更少的副作用,而与内镜治疗相似的效果。药物治疗是各级医院、各级临床医师均容易获得的可快速掌握的技能。因此,在疑食管静脉曲张破裂出血时,药物治疗应作为首选的一线方案。尽管部分患者应用β受体阻滞剂也可有效降低门静脉压力,但它可以降低血压和增加心率,因此在急性出血期不建议使用β受体阻滞剂[47]。
(1)血管加压素及其类似物血管加压素是治疗急性静脉曲张出血最常用的内脏血管收缩剂。人工合成的血管加压素为9肽,半衰期为10~20分钟;其活性形式有精氨酸血管加压素及赖氨酸血管加压素两种。血管加压素通过激活血管平滑肌V1受体,增加肠系膜血管及周围血管的阻力,平均动脉压增加,心输出量减少,从而导致门静脉血流减少,门脉压力下降;对窦性及窦后血管阻力无影响。血管加压素的多种副作用与它的强有力的收缩血管作用有关,包括心脏和外周血管缺血表现,如心律失常,心绞痛、心肌梗死,高血压,肠缺血。也可能因为血管加压素激活肾小管V2受体,出现水钠潴留或低钠血症。联合硝酸甘油(硝酸甘油40 μg/分,可增加到400 μg/分钟,调整以维持收缩压>90 mmHg)可以减少血管加压素的不良反应[48]。
血管加压素一次注射剂量为10-20 U,10分钟后持续静脉滴注0.4 U/min,最大速度为0.9 U/min,随剂量的增加全身不良反应增加;如果出血停止,剂量逐渐减少应每6~12小时减0.1 U/min,疗程一般为3-5天。但近来发现,血管加压素突然中断,门脉压并不增加。因此,在停药前逐渐减量似乎不必要。多数学者报道其首次控制出血率为50%~60%,停药24~48小时再出血率高达45%,约1/3患者出现明显的不良反应。
目前国内一些基层医院仍没有特利加压素、十四肽生长抑素及奥曲肽等药物,临床仍在应用垂体后叶素,其用法、疗效与血管加压素相似,价格低廉。但是,垂体后叶素的疗效有限,副作用多,近年来临床应用有减少的趋势[49,50]。
三甘氨酰赖氨酸血管加压素(glypressin,特利加压素)是一种人工合成的血管加压素缓释剂,其原形对平滑肌无影响,进入人体后其末端甘氨酰基脱落后才转化为具有活性的9肽血管加压素,其半衰期长,由于其缓慢释放机制,故不需要持续静脉给药。该药不引起血液系统改变,因直接作用肠系膜血管V1受体,具有活性的血管加压素浓度低,故其不良反应少而轻。近年来还发现,特利加压素降低奇静脉及侧枝循环的血流量,有效控制急性静脉曲张出血,并可降低出血相关的病死率[27]。
用法:特利加压素1mg每4小时1次,静脉注射或持续点滴,首剂可加倍。维持治疗特利加压素1mg每12小时1次。疗程3-5天,多数报道80%-85%患者出血可成功控制。临床经验发现,对于特利加压素控制出血失败者,可联合应用生长抑素及其类似物。
(2)生长抑素及其类似物十四肽生长抑素半衰期3~5 min,人工合成八肽生长抑素-奥曲肽及伐普肽,其半衰期为70~90 min。生长抑素及其类似物影响门脉高压症血液动力学机制尚不完全清楚,有学者认为是由于选择性作用于内脏血管平滑肌,导致腹腔局部动脉收缩,门脉血流量减少从而降低门脉压力。有的研究发现,生长抑素及其类似物能降低肝静脉压力梯度(HVPG)及肝脏血流量,随着剂量的增加,其降压作用并不增加,全身动脉压及血管阻力无变化;有些学者发现该药对侧支循环的影响比降低门脉压力作用更大,表明生长抑素治疗食管静脉曲张出血可能是由于减少了侧支循环血流量,而不是降低门脉压力。近年来认为,生长抑素及其类似物抑制了胃肠道血管扩张因子的作用,如胰高血糖素、血管活性肠肽、降钙素基因相关肽(CGRP)、P物质等,从而出现局部缩血管效应,导致门脉血流量减少从而降低门脉压力。
用法:十四肽生长抑素250-500μg/小时,奥曲肽25-50μg/小时,持续静脉点滴,一般使用3-5天。伐普肽最初50μg静脉推注,然后50μg每小时输注,国内尚无伐普肽的应用经验。其控制首次出血率为80%~90%,副作用少。国内多中心研究发现,比较奥曲肽25μg/小时、50μg/小时,72小时内控制静脉曲张出血率分别为71.8%、91.7%[51]。
国产十四肽生长抑素及奥曲肽与进口药物具有相似的临床效果,但缺乏多中心随机对照临床研究。韩国Seo YS等报告了一项前瞻性、多中心、随机对照的非劣效性试验,比较特利加压素,生长抑素,奥曲肽早期治疗急性食管静脉曲张破裂出血患者的疗效和安全性。肝硬化上消化道大出血的患者早期被随机分配接受特利加压素,生长抑素或奥曲肽,24小时内进行内镜检查,5天内未接受挽救治疗作为出血控制成功的评价指标。特利加压素组261例,生长抑素组259例;奥曲肽组260例。在早期内镜检查时,3组患者活动性出血率分别为43.7%,44.4%,和43.5%,出血控制成功率分别为86.2%,83.4%,83.8%,没有挽救治疗率分别为89.7%,87.6%,88.1%,再出血率分别为3.4%,4.8%,4.4%,三组间没有统计学差异。因此认为,生长抑素及其类似物、特利加压素在控制其急性静脉曲张出血的疗效相似[52,53]。
最近国内Wang C等进行了一项包括5个临床研究的荟萃分析,比较血管加压素、特利加压素和生长抑素奥曲肽初始控制食管静脉曲张出血成功率、5天后再出血发生率,结果表明血管加压素、特利加压素或生长抑素/奥曲肽治疗患者,不论是控制出血成功率,还是5天以后再出血率各组间均无明显差异[54]。
对于生长抑素及其类似物控制出血失败者,可换用或联合应用特利加压素。
4、抗生素的应用活动性出血时常存在胃粘膜和食管粘膜炎症水肿,因此20%左右肝硬化急性静脉曲张出血患者48小时内发生细菌感染。Child-Pugh C级合并糖尿病及肝癌患者特别容易受到感染。早期再出血及病死率与未能控制的细菌感染有关。尽管静脉曲张破裂出血死亡与感染的关系值得商榷,但研究表明,内镜检查前8小时,预防性应用抗生素可减少菌血症和自发性细菌性腹膜炎的发生。肠来源的需氧革兰阴性杆菌是最常见的病原菌,但最近革兰阳性和喹诺酮耐药微生物越来越多,其临床意义尚不清楚。国外多个指南中建议,短期(7天)应用氟喹诺酮类(环丙沙星或诺氟沙星)。由于医院内喹诺酮耐药菌的增加,短期静脉应用头孢三代类抗生素已被证明是有益的,特别是在高感染风险晚期肝硬化、糖尿病及肝癌患者。因此,对肝硬化急性静脉曲张破裂出血的患者应短期使用抗生素,首选头孢三代类抗生素,若过敏,则选择喹诺酮类抗生素,如左旋氧氟沙星、莫西沙星等,一般疗程5-7天[55]。
5.质子泵抑制剂(PPI)的应用当胃液PH>5,可以提高止血成功率。PPI临床应用种类较多,包括奥美拉唑、埃索美拉唑、潘托拉唑等。一般情况下,PPI 40~80 mg/d,静脉滴注,对于难控制的静脉曲张出血患者,PPI 8mg/小时持续静脉点滴。Sreedharan A等系统评价了6个来自随机对照试验2223例静脉曲张出血患者,在内镜治疗前应用PPI与不使用的患者,其病死率差异无统计学意义,但是早期应用PPI可以减少内镜治疗需求[56]。
一项随机对照临床试验证明,PPI可减少EVL术后食管溃疡的大小,减少再出血发生,但该研究病例数较少[57]。最近韩国学者也评价了PPI对内镜下组织黏合剂治疗的影响,结果发现,2/3(66.7%)接受PPI和3/4(75.0%)没有接受PPI的患者再出血,两组没有统计学差异,但没有接受PPI的患者有较长的出血时间[58]。有研究报告,PPI可增加肝硬化静脉曲张出血患者发生自发性腹膜炎和死亡的风险。最近Terg R的一项多中心大样本、前瞻性临床研究发现,肝硬化自发性腹膜炎与PPI治疗无关[59-61]。迄今,没有证据表明PPI治疗肝硬化静脉曲张出血可以影响患者的临床结局,即死亡或再出血。如果PPI不可及,临床上也可使用H2受体阻滞剂,如法莫替丁80 mg/d,静脉滴注,5-7天。
目前没有足够的临床证据表明,局部使用凝血酶、冰盐水(8 mg去甲肾上腺素/100 ml盐水)、云南白药及静脉应用血凝酶、凝血酶原复合物、维生素K1等在肝硬化EVB的治疗中有确切疗效,应该避免滥用这类止血药。
(二)、内镜治疗[3,17]
内镜治疗的目的是控制肝硬化急性食管静脉曲张出血及尽可能使静脉曲张消失或减轻,以防止其再出血。内镜治疗包括内镜下曲张静脉套扎术(EVL)、硬化剂注射治疗(EIS)及钳夹法或组织黏合剂注射治疗胃静脉曲张(见特殊静脉曲张部分)。
1、EVL治疗:(1)适应证:急性食管静脉曲张出血;外科手术等其他方法治疗后食管静脉曲张再发急性出血;既往有食管静脉曲张破裂出血史。LDRf分型D1.0—D2.0曲张静脉适用。当曲张静脉直径〉2.0 cm,内镜套扎治疗后近期再发大出血风险增加。(2)常用六环或七环套扎器,首次套扎间隔2-4周可行第2次套扎或硬化剂注射治疗,直至静脉曲张消失或基本消失。并发症:食管狭窄、大出血、发热等。
2、EIS治疗:(1)适应证同EVL治疗。对于不适合EVL治疗的食管静脉曲张者,可考虑应用EIS。(2)疗程:第1次EIS后,间隔1-2周行第2、3次EIS,直至静脉曲张消失或基本消失。硬化剂:常用聚桂醇、5%鱼肝油酸钠。注射方法:曲张静脉内注射为主;每次注射1-4点;初次注射每条血管(点)以10 ml左右为宜,一次总量一般不超过40 ml,依照静脉曲张的程度减少或增加剂量。并发症:食管狭窄、穿孔、出血、纵隔炎、溶血反应(5%鱼肝油酸钠)、异位栓塞等。
3、药物辅助内镜治疗:可以显著提高内镜治疗安全性和疗效,减少近期再出血。韩国学者Cho SB随机双盲比较了特利加压素(n=43,开始2 mg静脉注射,然后1 mg静脉滴注,每4小时一次,连续3天)和奥曲肽(n=45,25 ug/小时,静脉点滴,连续5天)联合内镜下食管静脉曲张套扎(EVL)早期再出血疗效。最初止血率分别为98%(42/43)、96%(43/45)。5天和42天再出血率分别为12%(5/43)、28%(12/43),9%(4/45)和24%(11/45)。特利加压素和奥曲肽组之间没有差异。在42天两组病死率相似,病死率高(48%)与42天再出血有关。42天再出血的相关危险因素包括Child-Pugh C级(AOR=30.2,95%CI=7.7-117.9),2级以上腹水(AOR=6. 6,95%CI=2.2-19.2)和晚期肝细胞癌(AOR=4.6,95%CI =1.1-18.9)。认为比较特利加压素和奥曲肽联合EVL显示同样安全性和有效性。与国内多数学者的研究一致[62]。
Abid S等头对头比较了特利加压素和奥曲肽辅助内镜治疗静脉曲张出血的效果。324例肝硬化食管静脉曲张破裂出血的患者随机分入接受特利加压素(A组,n=163)、奥曲肽(B组,n=161)和安慰剂队列。入组时急诊上消化道内镜检查仍有活动性出血A组16%、B组25.5%(P=0.034)。两组病死率(5.5%vs 4.3%)、控制食管静脉曲张破裂出血率(92.6%vs 95.6%)无显著性差异。两组患者平均输血量无差异,未见心脏系统不良反应。A组患者的平均住院时间短(108.40±34.81 vs 126.39±47.45小时)。因此认为,特利加压素的疗效不劣于奥曲肽辅助内镜治疗食管静脉曲张破裂出血[63]。国内临床医生也有较多经验[64,65]。
4、自膨式覆膜食管金属支架(SEMS):经过药物或常规内镜套扎或硬化剂治疗后,仍有15%-20%患者反复出血或活动性出血不能有效控制(称为难治性静脉曲张出血),而其他挽救治疗措施(如TIPS、外科手术)不可及或没有时机,严重威胁患者生命时,内镜下覆膜食管支架挽救治疗具有一定的效果。Holster IL等最早报告了5例采用自膨式覆膜食管金属支架(SEMS)治疗难控制食管静脉曲张破裂出血,作为患者能够获得其他治疗机会的桥梁。初步止血成功率100%,持续控制出血90%。2例患者14天取出支架,3例患者直到死亡(6-214天)[66]。Zakaria MS报道了16例采用SEMS治疗难治性静脉曲张大出血的经验,93.7%患者成功放置SEMS,初始控制出血成功率87.5%,但是住院病死率仍高达25%。SEMS可作为不适合急诊TIPS或手术患者,且威胁患者生命时有效的挽救治疗方法,但国内迄今尚无临床应用的经验[67]。
5、内镜治疗禁忌证:(1)有上消化道内镜检查禁忌;(2)未纠正的失血性休克;(3)未控制的肝性脑病,患者不配合;(4)患方未签署知情同意书;(5)伴有严重肝、肾功能障碍、大量腹水患者。
近年来,随着内镜治疗技术和危重症监护医学的进步,在ICU及麻醉科的支持下,对难控制的失血性休克或肝性脑病患者,在征得家属充分理解和知情的基础上,在全麻插管下,仍可采取内镜治疗。因此,肝硬化急性食管静脉曲张出血抢救时,应根据医师经验及医院的医疗技术条件确定内镜治疗的时机和方法。
6、跟踪治疗、长期随访:经首次治疗,1-2周进行内镜复查,静脉曲张尚未到达根除或溃疡完全愈合的患者,根据曲张静脉情况可行第2、3次内镜治疗,直至静脉曲张消失或基本消失。静脉曲张消失或基本消失后,一般每隔6~12个月复查一次。经过内镜治疗的患者,应终生内镜随访、跟踪治疗。
(三)三腔二囊管压迫止血
药物控制出血无效及无急诊内镜或无TIPS治疗条件的情况下,使用三腔二囊管压迫可使80%~90%出血的病例得到控制,但再出血率高达50%以上,并且患者痛苦大,并发症多,如吸入性肺炎、气管阻塞等。一般在药物或内镜治疗失败24小时内实施三腔二囊管压迫止血,作为挽救生命的措施,三腔二囊管压迫止血无绝对禁忌证。患者深度昏迷、不能配合操作或患方拒绝签署知情同意书者,不能进行三腔二囊管压迫止血。最近,国内Zhang D等回顾性评估了83例三腔二囊管联合强化内镜密集结扎治疗食管静脉曲张破裂大出血有效性与安全性。入院后,所有患者均接受12小时三腔二囊管压迫及常规药物治疗(血容量复苏、预防性应用抗生素、生长抑素)。24小时内,所有患者进一步接受内镜下食管静脉曲张尼龙圈密集结扎术,每例结扎10-15环。所有患者三腔二囊管持续压迫12小时均无严重并发症,98.8%有效止血,术后1周再出血1例,但再次套扎后出血控制。认为对于静脉曲张大出血患者,先实施三腔二囊管压迫止血,24小时内进行内镜下密集结扎治疗是安全有效的[68]。
(四)、经颈静脉肝内门-体静脉分流术(TIPS)
临床应用近30年历史。TIPS是经颈静脉穿刺,在肝静脉和肝内门静脉分支之间,创建一个减压通道降低门静脉高压的方法,达到与外科分流相同的效果。TIPS优点是微创手术,但也可发生分流道再狭窄或闭塞和肝功能受损及肝性脑病。近年来聚四氟乙烯(polytetrafluoroethylene,PTFE)内膜支架应用于临床,明显降低了TIPS术后再狭窄及血栓形成的严重并发症,临床应用有增加的趋势[69-71]。TIPS除了作为药物和/或内镜治疗失败患者的抢救治疗外,对于存在高风险治疗失败的患者,如Child-Pugh C(<14分)或B级合并活动性出血的患者,在药物和内镜治疗控制出血后即应尽早行TIPS治疗,提出了实施早期TIPS的概念(72小时内,最好24小时内)[2,72]。
一项包括4个随机对照临床试验的荟萃分析报道,TIPS后静脉曲张再出血率(OR=7.45,95%CI:3.93-14.15)、支架或吻合口狭窄(OR=20.01,95%CI:6.67-59.99)、肝性脑病(OR=2.50,95%CI:1.63-3.84)发生率均高于外科分流手术,而2年生存率、5年生存率显著低于外科分流手术,因此建议外科分流手术而不是TIPS[73]。Orloff MJ报告了包括2个随机临床试验的急诊外科分流手术治疗食管胃静脉曲张出血患者(Child-Pugh A/B级)53年的经验,发现分流术后持久控制出血,无吻合口狭窄,长期生存率及花费均较内镜治疗或TIPS好[74]。
TIPS微创手术,需有丰富经验的介入医师操作与设备、器材和外科等后备支持,在急诊或基层医院该治疗方法常常不可及。术前需完善各种实验室检查、肝脏增强CT/MRI、门静脉系统血管重建等,了解肝脏的大小、形态、肝静脉与门静脉的关系、门静脉分叉的位置、分叉是否在肝外、腹水情况、脾脏是否切除等。判断手术成功的可能性和存在的风险。一旦药物或内镜治疗失败,TIPS应在早期(72小时内)实施,做好术前讨论和手术操作方案[75]。
(1)适应证:存在高风险治疗失败的患者,如Child-Pugh C(<14分)或B级合并活动性出血的患者;食管静脉曲张大出血常规药物及内镜下治疗效果不佳;终末期肝病等待肝移植术期间静脉曲张出血等。
(2)禁忌证:救治急性食管胃静脉曲张破裂大出血时TIPS无绝对禁忌证。但在下列情况下应持谨慎态度,在征得患方充分理解和知情的基础上方可实施。①重要脏器(心、肺、肾等)功能严重障碍者;②难以纠正的凝血功能异常;③未能控制的全身炎症反应综合征,尤其存在胆系感染者;④肺动脉高压存在右心功能衰竭者;⑤反复发作的肝性脑病;⑥多囊肝或多发性肝囊肿(容易导致囊腔内出血);⑦肝癌合并重度静脉曲张;⑧门静脉海绵样变性。
由于内镜治疗技术的普及、TIPS的早期临床应用,其他放射介入治疗方法,如经皮经肝胃冠状静脉栓塞术,创伤大,临床已经很少开展。
(五)外科手术
药物或内镜治疗不能控制的出血或出血一度停止后5天内再次出血,Child-Pugh A-B级者行急诊手术有可能挽救患者生命;对Child-Pugh C级者肝移植是理想的选择[76]。因此,外科急诊手术仅作为药物和内镜治疗失败的挽救治疗措施之一,而没有证据支持外科手术作为TIPS治疗失败的挽救治疗。目前国内外尚无高质量临床试验评价内镜治疗、TIPS与外科手术的效果及安全性。因此,肝硬化急性食管静脉曲张出血抢救时,应根据医师经验及医院的综合医疗技术条件确定外科手术治疗的时机和方法。

六、食管静脉曲张出血的二级预防
急性食管静脉曲张出血停止后的患者再次出血和死亡的风险很大。对于未进行二级预防治疗的患者,1~2年内再出血率高达60%,病死率达33%。因此,二级预防非常重要。二级预防措施包括药物治疗、内镜治疗、外科或放射介入治疗[77-79]。
1、二级预防的目的:根除食管静脉曲张,减少再出血率及病死率。
2、二级预防的时机:既往有食管静脉曲张出血史或急性食管胃静脉曲张出血5天后开始二级预防治疗,更早开始二级预防患者是否获益尚不清楚。二级预防治疗前,应该常规行增强CT/MRI检查及门脉系统血管重建,了解肝动脉血供及门脉系统侧枝循环情况。常规B超检查明确门脉系统有无血栓。
3、食管静脉曲张再出血的危险因素:目前临床证据显示,肝硬化Child-PughC级、门静脉血栓或癌栓、重度静脉曲张(直径>20mm)或伴红色征、血疱征是食管胃静脉曲张再出血的高危因素。HVPG>18mmHg,可能是食管胃静脉曲张再出血最可靠的预测指标,需要临床进一步验证。
4、药物治疗:
(1)非选择性β受体阻滞剂常用药物为普萘洛尔,见一级预防。卡维地洛是一种新的β受体阻滞剂,可通过阻断α-受体而扩张血管。它可降低肝内血管阻力,较传统非选择性β受体阻滞剂更能降低HVPG[80]。Sinagra E等比较卡维地络与普萘洛尔血液动力学应答研究(HVPG较基线下降≥20%或≤12 mmHg定义为血液动力学应答)的荟萃分析(5个研究,175例患者)显示,从长期血液动力学应答看,卡维地络优于普萘洛尔,二者的不良反应无显著性差异[81]。Hobolth L研究发现卡维地络与普萘洛尔对心脏、内脏(包括HVPG)及全身血液动力学(包括氧饱和度)无显著性差异,因而从机制上没有证明二者临床效果的差异[82]。值得注意的是,近年来研究发现,非选择性β受体阻滞剂可增加Child-Pugh C级患者的病死率[83,84]。因此,该类药物适用于Child-Pugh A/B级肝硬化并发食管胃静脉曲张出血患者。卡维地络国内应用经验较少,长期效果及安全性仍需要进一步研究[33,85]。
(2)血管扩张剂血管扩张剂是一类通过抑制肝窦肌纤维母细胞主动收缩,从而降低肝内血管阻力或扩张门脉侧支循环,降低门脉压力的药物。这类药物有:硝酸盐、α2-受体阻滞剂、钙离子阻滞药、5-HT受体阻滞剂等。目前临床应用的证据和经验很少[37,38,86]。
近年来发现,肝硬化患者急性肾损伤与内脏血管扩张有关[87,88]。因此推测这些扩血管药物可能对肝硬化肾损伤有不利影响。国外学者系统评估了4个RCT比较β受体阻滞剂联合5-单硝酸异山梨酯(BB+ISMN)和EBL预防再出血效能的临床试验,结果发现两组再出血率相似。出血的相关病死率(RR 0.76;95%CI 0.31-1.42)、总体病死率(RR,0.81;95%CI,0.61-1.08)与其它并发症(RR 1.26;95%CI,0.93-1.70)无显著性差异。BB+ISMN与EBL均可预防食管静脉曲张破裂再出血[36,89]。
(3)药物的联合应用部分肝硬化门脉高压患者因各种原因对药物无反应或不宜使用,故需选择联合用药。①非选择性β受体阻滞剂(普萘洛尔)与硝酸酯类合用:研究发现静脉滴注普萘洛尔和硝酸甘油的门脉高压大鼠,其门静脉压力下降幅度较两药单用时明显。肝硬化患者合用普萘洛尔和硝酸异山梨酯(ISMN)4±13天后,降低门脉压力的作用比单用普萘洛尔时更显著。这两种药物能产生协同作用的机制可能有:a.硝酸酯类扩张静脉血管,降低门静脉及侧支循环的阻力,抵消了普萘洛尔使之增加的不利作用;b.硝酸酯降低动脉血压,通过压力受体介导的内脏血管收缩,进一步减少门脉血流量。②普萘洛尔与螺内酯合用:对普萘洛尔无反应的患者加用螺内酯(安体舒通)能降低食管曲张静脉压。近年来研究发现,螺内酯可降低门静脉压力,与减轻肝纤维化、肝内阻力和抑制HSC活化有关[40,90]。
值得注意的是,这些扩血管药物可能对肝硬化患者急性肾损伤存在不利影响[91]。总之,理想的降低门脉压药应具备选择性作用于内脏血管床,能维持肝脏有效血液灌注及改善肝功能三个条件,但目前所有药物均不具备这三个条件。因此,寻找新的降门脉压药物及评价药物的确切疗效有待于基础和临床进一步研究。
5、内镜治疗[92]二级预防采用内镜治疗的目的是根除或基本使静脉曲张消失,减少再出血率及相关病死率。内镜治疗方法主要包括EIS、EVL,详见急性静脉曲张出血部分。至于何时选择内镜下硬化剂或套扎或二者联合治疗,要根据医院的条件和医生的经验,更多的高质量循证医学证据仍需要研究。可参照中华消化内镜学会静脉曲张学组提出“消化道静脉曲张及出血的内镜诊断和治疗规范试行方案”[17]。
6、非选择性β受体阻滞剂联合内镜治疗近年来,多项高质量临床研究证明,非选择性β受体阻滞剂联合内镜治疗是二级预防食管静脉曲张出血首选的标准方案。Kumar A等研究EVL联合普萘洛尔/ISMN是否比单纯EVL二级预防更有效。静脉曲张破裂出血患者被随机分配到联合组(n=88)EVL联合普萘洛尔(剂量滴定,以减少心脏速率为每分钟55次),或ISMN(40mg/天)及单独EVL组(n=89)。结果发现:2年内联合治疗组再出血为27%,EVL单独组为31%。多变量分析,腹水存在、血清白蛋白<33g/l,HVPG>18 mmHg是静脉曲张再出血独立的危险因素。因此认为,EVL本身就足以防止肝硬化静脉曲张出血,联合普萘洛尔或ISMN后静脉曲张再出血发生率没有显著降低,相反会增加不良反应[93]。
但是,Funakoshi N等也随机比较了内镜下单独硬化剂治疗、硬化剂+普萘洛尔及内镜下套扎治疗+普萘洛尔预防肝硬化食管胃静脉曲张再出血的疗效,普萘洛尔联合内镜治疗可显著减少6月、12月及24月静脉曲张再出血率(OR 2. 20,95%CI:1.69-2.85),24月出血病死率显著低于单独内镜治疗(OR:1.83,95%CI:1.16-2.90).因此认为,普萘洛尔联合内镜可以作为肝硬化静脉曲张出血标准的二级预防方法[94]。
最近,Puente A等系统评估了5个RCT临床研究(共476例)比较EVL联合β受体阻滞剂或单硝酸异山梨酯(ISMN)与任何一个单独治疗预防食管静脉曲张破裂出血的效果,联合治疗可减少再出血的风险比(RR=0.44,95%CI 0.28-0.69),并呈现低病死率趋势(RR=0.58,95%CI=0.33-1.03),联合治疗没有增加并发症。β受体阻滞剂联合单硝酸异山梨酯与单独EVL比较,联合治疗食管静脉曲张再出血显著下降,单用EVL再出血与食管溃疡增加。因此,β受体阻滞剂+ISMN可能是一种有效的替代内镜治疗的措施[94,95]。
7、外科手术适应症:反复静脉曲张再出血、内镜或药物治疗无效;Child-Pugh A级或B级;特别是年龄小于60岁者。目前仍缺乏高质量临床研究比较外科手术、内镜下或药物治疗的成本效果。外科分流手术可以显著降低食管胃静脉曲张再出血风险,但术后发生肝性脑病的风险明显增加。以门静脉压力指导的外科断流手术也可显著减少术后曲张静脉再出血的风险,但术后门静脉血栓形成发生率高[96,97]。因此,要根据医院的条件和医生的经验,选择合适的外科手术方式作为二级预防的方案。肝脏移植是终末期肝病最有效的治疗方法,但是由于供体紧缺,肝脏移植技术的准入,限制了其临床应用。
8、TIPS作为药物、内镜治疗失败的选择方案。对于Child-Pugh A、B组的患者,在内镜、药物治疗失败后优先考虑TIPS,在没有进行TIPS治疗条件时再考虑外科分流术[24]。迄今,尚缺乏高质量临床研究比较TIPS、外科手术及内镜或药物治疗二级预防静脉曲张出血的效果及安全性。TIPS的注意事项如前叙述。

七、特殊类型静脉曲张的处理
(一)孤立胃静脉曲张(Lg型)
尽管胃静脉曲张破裂出血在肝硬化静脉曲张出血中的比例并不多,约占15%-30%,但具有较高的病死率,约占45-55%。针对胃静脉曲张出血的防治研究较少,如何选择适宜的治疗方法一直是临床面临的难题。
1、各种防治孤立胃静脉曲张出血的方法的询证医学证据
目前文献报道,预防与治疗肝硬化孤立胃静脉曲张出血的方法包括:内镜治疗、非选择性β受体阻滞剂、TIPS及外科手术。
Mishra SR等比较氰基丙烯酸酯注射液(cyanoacrylate)和非选择性β受体阻滞剂在胃静脉曲张破裂出血一级预防中的效果。肝硬化患者胃静脉曲张且根除食管静脉曲张(GOV1,Leg型)患者;或孤立胃静脉曲张的患者,均无胃静脉曲张出血史,被随机分配到氰基丙烯酸酯注射液(Ⅰ组,N= 30),β受体阻滞剂(II组,n=29)或不治疗(III组,N=30)。随访中位数时间为26个月,结果发现,I、II、III组胃静脉曲张出血发生率分别为13%、28%、45%,存活率I组显著高于未治疗组(90%vs72%)。I/III组患者HVPG的中位数分别增加14-15mmHg、14-16mmHg,而II组HVPG降低14-12 mmHg。胃静脉曲张直径大于20mm、MELD评分≥17、门脉高压性胃病是预测胃静脉曲张首次出血的高风险因素。结论认为:高风险胃静脉曲张患者需要一级预防,以减少首次出血及相关死亡的风险。内镜下氰基丙烯酸酯注射比β受体阻滞剂在预防胃静脉曲张破裂首次出血更有效[45]。
Mishra SR等比较消除了食管静脉曲张的胃食管静脉曲张患者或孤立性胃静脉曲张患者内镜治疗与β受体阻滞剂的效果及安全性,既往有胃静脉曲张出血史。随机入组氰基丙烯酸酯注射(n=33)或β受体阻滞剂治疗(n=34),随访中位数时间为26个月,结果发现,在氰基丙烯酸酯组胃静脉曲张再出血率明显低于β受体阻滞剂组(15%vs 55%),病死率低(3%vs 25%)。内镜治疗组基线和随访期间HVPG从中位数15(10-23)增加到17(11-24)mm Hg,而β受体阻滞剂组HVPG从中位数14(11-24)降低13(8-25)mm Hg。虽然内镜治疗组患者没有HVPG降低,而在β受体阻滞剂组42%患者HVPG显著下降,但是应答者中41%患者仍胃静脉曲张再出血。多因素分析发现,不同治疗方法、门脉高压性胃病和胃静脉曲张大小(>20mm)是胃静脉曲张出血的独立危险因素,胃静脉曲张破裂出血与病死率独立相关。因此认为,内镜氰基丙烯酸酯注射比β受体阻滞剂治疗预防胃静脉曲张出血和提高生存率更有效[98]。
Orloff MJ等进行的一项包括580例肝硬化胃静脉曲张患者的前瞻性随机对照试验,比较内镜治疗(ET)与择期门腔分流手术的效果,在另一项临床试验中比较70例胃静脉曲张出血患者紧急TIPS与外科门腔分流术的效果。内镜治疗与择期分流手术Child-Pugh C患者分别占28%、30%,紧急TIPS与外科门腔分流术组Child-Pugh C患者分别40%和41%。急诊或择期外科门腔分流术可持久控制胃静脉曲张出血者占97-100%,而内镜治疗者占27-29%,TIPS持久控制胃静脉曲张出血者仅占6%。外科分流手术患者生存率最高。TIPS术组、内镜治疗及外科分流手术后肝性脑病的发生率分别为50%、16-17%、8-11%。67%TIPS患者出现分流狭窄或闭塞,而外科分流手术患者0-2%。因此,这些证据支持外科手术治疗胃静脉曲张较内镜或TIPS更有效[99]。
Kochhar GS回顾性比较了2001年-2011年共169例肝硬化急性胃静脉曲张出血患者内镜氰基丙烯酸酯胶注射与TIPS效果,TIPS组140例,内镜治疗组29例。两组患者30天内再出血、住院时间及住院病死率没有显著性差异,白蛋白降低、高MELD和CTP评分、出血均与住院死亡显著相关。结论认为,内镜组织胶注射及TIPS治疗急性胃静脉曲张均有效,而内镜注射氰基丙烯酸酯是一种安全、快捷的治疗方法,可以作为替代TIPS治疗胃底静脉曲张出血。但是,临床医生在选择时要综合考虑患者的情况、医院的技术支撑及医生的技术水平[100]。韩国学者Joo HS观察了内镜下注射Histoacryl(N-丁基-2-氰基丙烯酸酯)治疗胃静脉曲张的长期疗效和安全性。10年共85例胃静脉曲张内镜接受注射Histoacryl。其中65例患者胃静脉曲张破裂出血后1周接受内镜治疗,其余13例患者为一级预防治疗。每次治疗注射Histoacryl的平均体积为1.43 ml,随访中位时间为24.5个月。结果发现:止血成功率为98.6%,再出血发生29.2%。76.2%为治疗后1年内发生再出血,合并肝癌或GOV2型胃静脉曲张再出血率较高。治疗失败相关病死率为1.4%,主要死亡原因是肝癌或肝衰竭。因此认为Histoacryl注射疗法是一种安全有效的治疗方法。进一步增加病例数,其研究结果相似[101-103]。
2、内镜下组织黏合剂治疗:一、二级预防均适合孤立胃静脉曲张出血。
(1)适应证:胃静脉曲张;急诊可用于所有消化道静脉曲张出血,在食管静脉曲张宜小剂量使用。(2)根据曲张静脉容积,选择注射剂量。组织粘合剂为α-氰基丙烯酸正丁酯或异丁酯。疗程:一般注射1次,最好一次将曲张静脉闭塞,在曲张静脉栓堵效果不满意时可重复治疗,1-3个月复查胃镜,可重复治疗直至胃静脉闭塞。注射方法:曲张静脉内注射,三明治夹心法,根据粘合剂性质,采用聚桂醇、碘化油或高渗葡萄糖。(3)术后处理:同EIS,给予抗菌药物治疗5~7天,应用抑酸药,疗程一般不超过2周。并发症:异位栓塞,偶有门静脉、肠系膜静脉、肺静脉栓塞、近期发生排胶出血、脓毒血症。
(二)Leg型胃静脉曲张
即食管曲张静脉与胃曲张静脉相通,认为是食管静脉的延伸,其内镜治疗方法同食管静脉曲张:1.EIS:从食管静脉曲张内注射的硬化剂可以对胃静脉曲张进行治疗;2.组织胶注射:从胃静脉曲张注射的组织胶可以对食管静脉曲张达到治疗作用;3.联合序贯治疗:首先对胃静脉曲张进行组织治疗,择期或同时再对食管静脉曲张进行套扎或硬化治疗。
(三)少见部位静脉曲张
如十二指肠静脉曲张、大肠静脉曲张也可选择内镜下硬化剂治疗,仅个案报道也具有较好的疗效和安全性。


八、原发疾病的治疗:
引起肝硬化的病因包括病毒性、酒精性、胆汁淤积性、自身免疫性、遗传代谢、药物性肝病及寄生虫病等,应重视对原发疾病的治疗。乙型肝炎和丙型肝炎是我国肝硬化的主要病因,抗病毒治疗可减轻肝纤维化,降低门静脉压力,从而起到预防静脉曲张发生或出血的作用,具体抗病毒方案参考相关指南[104-106]。其他原因所致肝病也应积极针对原发疾病进行治疗,以阻止肝硬化的进展,从而延缓门静脉高压等并发症的出现。
扶正化瘀胶囊通过抑制肝星状细胞活性[107],发挥其降低门静脉压力、抗肝纤维化的作用,一项多中心、双盲、随机对照研究将181例食管静脉曲张者分为食管静脉曲张轻度组、食管静脉曲张中/重度组、预防再出血组[108],食管静脉曲张轻度组患者随机分配接受扶正化瘀胶囊和安慰剂治疗;食管静脉曲张中/重度组患者随机分配接受扶正化瘀胶囊、普萘洛尔联用安慰剂、扶正化瘀胶囊联用普萘洛尔治疗;预防再出血组患者随机分配接受普萘洛尔联用安慰剂、扶正化瘀胶囊联用普萘洛尔治疗,随访时间为2年,结果显示,扶正化瘀胶囊能降低肝硬化食管静脉轻度曲张患者累积出血概率,不论是否有食管静脉曲张破裂出血史,扶正化瘀胶囊联用普萘洛尔可降低食管静脉中/重度曲张患者累积出血概率。此外,安络化纤丸[109]、复方鳖甲软肝片[110]等中药均有辅助治疗肝纤维化、肝硬化的作用。

九、待解决的问题[111]
理论上讲,持续降低门静脉压力,可有效地预防、治疗肝硬化门脉高压相关并发症,药物是防治肝硬化门脉高压症并发食管胃静脉曲张出血最重要的措施,迄今仍无理想的降门脉压药物。因此,在未来寻找新的降门脉压药物、药物优化组合或联合治疗的评价等仍需进一步研究。
(一)、HVPG测定是进一步深入临床研究的基础
理想的药物至少应具备:选择性作用内脏血管床,降低门静脉压;能维持肝脏有效血液灌注及改善肝功能;长期用药方便,依从性好。HVPG测定是评价降门脉压力药物疗效的金标准,是诊断门脉高压症最可靠的方法。因此,未来理想的降门脉压药物具备有效降低HVPG,对肝脏血流无影响或增加肝脏血流,同时逆转肝脏纤维化。但是,HVPG测定需要经颈静脉穿刺,检查方法为有创,因此临床未推广应用。近年来,一些无创门静脉压力评估的方法,如增强CT扫描肝脾体积测定与HVPG具有较高的相关性[112],肝脏瞬时弹性测定与食管静脉曲张程度及HVPG相关[14,15]。因此,无创HVPG的评估方法或模型来评价药物、内镜及外科手术治疗肝硬化门脉高压症,是未来重点研究的方向之一。
(二)、目前药物的优化与联合
近年来,国外较多高质量临床研究证明,非选择性β受体阻滞剂联合内镜治疗可以作为食管静脉曲张出血首选的二级预防方案。但是,一方面普萘洛尔由于价格便宜,临床面临药物短缺,另一方面,我国肝硬化患者普萘洛尔的应答率及最大耐受剂量仍不清楚。新的非选择性β受体阻滞剂——卡维地络的疗效及安全性,特别是联合内镜应用,适宜的“窗口期”及可耐受剂量值得深入研究。肝硬化胃静脉曲张出血的预防、治疗方法仍需要更多的临床研究证据。纠正肝硬化患者异常凝血功能及血小板后,是否影响二级预防治疗的效果及临床结局尚不清楚。
(三)、重视肝硬化进展为肝癌的筛查:肝硬化是发生肝癌的极高危人群,其肝癌年发生率2%-5%,无论是否进行病因治疗或病因清除,都需要进行肝癌的筛查[113,114]。
(四)、新的研究动向
1、微生态制剂(probiotics):一项随机双盲安慰剂对照试验将94例食管静脉曲张无出血史的肝硬化患者随机分为三组:普萘洛尔加安慰剂、普萘洛尔加用抗生素(诺氟沙星400 mg/天)或普萘洛尔加益生菌。与单独应用普萘洛尔比较,益生菌提高了应答率(58%vs31%,P=0.046),其效果与抗生素相似(54%)。因此认为,辅助应用益生菌提高了普萘洛尔的治疗效果[115]。
2.新的治疗靶点:尽管很难建立肝硬化食管胃静脉曲张的动物模型,但是针对肝硬化门脉高压症主要发生机制——肝内阻力增加及门静脉及其侧枝循环血流量显著增加的基础研究取得了较好的结果。应用肝脏特异的NO供体(NCX1000)可显著降低肝硬化大鼠对缩血管活性物质的作用,并降低肝内阻力。门静脉高压与显著的血管生长及新生血管有关。特别是内镜治疗食管新生血管、脾脏血管增生与过表达血管生长因子(VEGF)、血小板衍生生长因子(PDGF)及胎盘生长因子(Placental growth factor)有密切关系。因此,近年来,有关血管生成抑制剂(Antiangiogenics)、抗氧化剂(Antioxidants)、环氧化酶抑制剂(COX-1 inhibitors)、他汀类药物(Statins)等的基础研究取得了令人兴奋的结果[111]。因此,肝硬化门脉高压症转化医学研究的这些结果可能是未来新治疗靶点的重要依据。
十、中英文缩略词表

ACEI(angiotension converting enzyme inhibitors)血管紧张素转换酶抑制剂ARB(Angiotensin Receptor Blocker)血管紧张素受体拮抗剂BORTO(balloon-occluded retrograde transvenous obliteration)经皮经肝胃静脉球囊栓塞术CGRP(Calcitonin Gene-Related Peptide)降钙素基因相关肽CTP(CT portography)CT门静脉血管成像DCE MR(dynamic contrast material-enhanced MR)动态增强核磁共振成像EGD(Esophagogastroduodenoscopy)食管胃十二指肠镜EIS(Endoscopic injection sclerotherapy)内镜下硬化剂治疗

EUS(endoscopicultrasound)超声内镜检查EVB(esophagogastric variceal bleeding)食管胃静脉曲张破裂出血EVL(endoscopic variceal ligation)内镜下静脉曲张套扎术Glypressin三甘氨酰赖氨酸血管加压素GOV(gastroesophageal varices)食管胃静脉曲张HistoacrylN-丁基-2-氰基丙烯酸酯HVPG(Hepatic venous pressure gradient)肝静脉压力梯度IGV(isolated gastric varices)孤立的胃静脉曲张INR(International Normalized Ratio)国际标准化比值ISMN(Isosorbidemononitrate)单硝酸异山梨酯MDCT(multidetector computed tomography)多排螺旋CT MELD(model for end stage liver disease)终末期肝病模型MRA(magnetic resonance angiopraphy)磁共振血管成像MRE(magnetic resonance elastography)磁共振弹性成像NICE(National Institute for Health and Clinical Excellence)英国国家卫生与临床优化研究所PBC(primary biliary cirrhosis)原发性胆汁性肝硬化PPI(proton pump inhibitor)质子泵抑制剂PSE(port-systemicencephabpathy)门体性脑病PT(pharmaceutical therapy)药物治疗PTFE(Polytetrafluoroethylene)聚四氟乙烯RCT(Randomized controlled trial)随机对照试验SEMS(self-expandable esophageal metallic stent)自膨式食管金属支架SIGN(Scottish Intercollegiate Guidelines Network)苏格兰校际指南网TIPS(Transjugular intrahepatic potorsystemic shunt)经颈静脉肝内门体分流术WHVP(Wedgedhepatic venous pressure)肝静脉楔入压
[1]中华医学会消化病学分会,中华医学会肝病学分会,中华医学会内镜学分会.肝硬化门脉高压食管胃静脉曲张出血的防治共识(2008,杭州).中华肝脏病杂志,2008,16:564-570.
[2]de Franchis R;Baveno VI Faculty.Expanding consensus in portal hypertension:report of the Baveno VI Consensus Workshop:Stratifying risk and individualizing care for portal hypertension.J Hepatol.2015;63(3):745-752.
[3]Hwang JH,Shergill AK,Acosta RD,et,al.The role of endoscopy in the management of variceal hemorrhage.Gastrointest Endosc. 2014;80(2):221-227.
[4]Guturu P,Sagi SV,Ahn D,et al.Capsule endoscopy with PILLCAMESOfordetectingesophagealvarices:ameta-analysis. Minerva GastroenterolDietol,2011,57:1-11.
[5]Colli A,Gana JC,Turner D,et al.Capsule endoscopy for the diagnosis of oesophageal varices in people with chronic liver disease or portal vein thrombosis,Cochrane Database Syst Rev,2014 Oct 1;10:CD008760.
[6]Ghassan M Hammoud,Jamal A Ibdah.Utility of endoscopic ultrasound in patients with portal hypertension.World J Gastroenterol.2014 Oct 21;20(39):14230-14236.
[7]Chen TW,Yang ZG,Li X,et al.Evaluation of entire gastric fundic and esophageal varices secondary to posthepatitic cirrhosis:portalvenographyusing64-rowMDCT.AbdomImaging,2010.35:1-7.
[8]沈敏,朱康顺,孟晓春,等.门静脉高压症食管静脉曲张的CT诊断及出血风险预测.中华医学杂志.2010(41):2911-2915.
[9]刘桂勤,华静,沈加林.CT门静脉血管成像预测肝硬化门静脉高压食管胃底静脉曲张破裂出血价值.中华实用诊断与治疗杂志.2015.29(4):396-398.
[10]琲史,朱晖,郑嘉岗,等.门静脉CTA对孤立性胃静脉曲张内镜下治疗前后的评估.肝脏.2013(10):659-663.
[11]吴明蓬,谢艳,宋彬,等.门静脉高压症患者食管静脉曲张多层螺旋CT与内镜分级的相关性.中华消化病与影像杂志(电子版).2014,3:108-111.
[12]李楠,敖国昆,王欣,等.磁共振血管成像在食管胃底静脉曲张形态学评估中的临床应用.中国全科医学,2009(12):681-683.
[13]Shin SU,Lee JM,Yu MH,et al.Prediction of esophageal varices in patients with cirrhosis:usefulness of three-dimensional MR elastographywithecho-planarimagingtechnique.Radiology. 2014 Jul;272(1):143-153.
[14]Hu Z,Li Y,Li C,et al.Using Ultrasonic Transient Elastometry(FibroScan)to Predict Esophageal Varices in Patients with Viral Liver Cirrhosis.Ultrasound Med Biol.2015;41(6):1530-1537.
[15]Abd E,Rihim AY,Omar RF,et al.FathalahW,Role of fibroscan and APRI in detection of liver fibrosis:a systematic review and meta-analysis.Arab J Gastroenterol.2013;14(2):44-50.
[16]令狐恩强,冯佳.位置直径、出血风险在食管胃底静脉曲张破裂出血患者分型中应用初探.中华消化内镜杂志.2008.10(25):507-511.
[17]中华医学会消化内镜学分会食管胃静脉曲张学组.消化道静脉曲张及出血的内镜诊断和治疗规范试行方案(2009年).中华消化内镜杂志.2010;27(1);1-7.
[18]李敏然,徐小元.肝硬化门静脉高压食管胃静脉曲张出血的防治研究.中华肝脏病杂志.2015,23(04):247-249.
[19]Cremers I,Ribeiro S.Management of variceal and nonvariceal upper gastrointestinal bleeding in patients with cirrhosis.Therap Adv Gastroenterol.2014 Sep;7(5):206-216.
[20]D'Amico G,Pasta L,Morabito A,et al.Competing risks and prognostic stages of cirrhosis:a 25-year inception cohort study of 494 patients.Aliment PharmacolTher.2014;39(10):1180-1193.
[21]Qi X,Dai J,Yang M,et al.Association between Portal Vein Thrombosis and Survival in Non-Liver-Transplant Patients with Liver Cirrhosis:A Systematic Review of the Literature.Gastroenterol Res Pract.2015;2015:480842.
[22]AsraniSK,KamathPS.Predictionofearlymortalityafter variceal bleeding:score one more for MELD.Gastroenterology. 2014;146(2):337-339.
[23]Groszmann RJ,Garcia-Tsao G,Bosch J,et al.Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis.N Engl J Med.2005;353(21):2254-2261.
[24]Tripathi D,Stanley AJ,Hayes PC,et al.UK guidelines on the management of variceal haemorrhage in cirrhotic patients.Gut. 2015.pii:gutjnl-2015-309262.
[25]Qi XS,Bao YX,Bai M,et al.Nonselective beta-blockers in cirrhotic patients with no or small varices:A meta-analysis.World J Gastroenterol.2015 Mar 14;21(10):3100-3108.
[26]Pagliaro L,D'Amico G,Sorensen TI,et al.Prevention of first bleeding in cirrhosis.A meta-analysis of randomized trials of nonsurgical treatment.Ann Intern Med 1992;117:59-70.
[27]D'Amico G,Pagliaro L,Bosch J.Pharmacological treatment of portal hypertension:an evidence-based approach.Semin Liver Dis 1999;19:475-505.
[28]Gluud LL,Krag A.Banding ligation versus beta-blockers for primary prevention in oesophageal varices in adults.Cochrane Database Syst Rev.2012 15;8:CD004544.
[29]Hernández-Gea V,Aracil C,Colomo A,et al.Development of ascites in compensated cirrhosis with severe portal hypertension treatedwithβ-blockers.AmJGastroenterol2012;107(3):418-427.
[30]Senzolo M,Cholongitas E,Burra P,et al.Beta-Blockers protect against spontaneous bacterial peritonitis in cirrhotic patients:a meta-analysis.Liver Int2009;29:1189-1193.
[31]Bosch J.Carvedilol for portal hypertension in patients with cirrhosis.Hepatology2010;51:2214-2218.
[32]Tripathi D,Ferguson JW,Kochar N,et al.Randomized controlled trial of carvedilol versus variceal band ligation for the prevention of the first variceal bleed.Hepatology2009;50:825-833.
[33]Reiberger T,Ulbrich G,Ferlitsch A,et al.Carvedilol for primary prophylaxis of variceal bleeding in cirrhotic patients dynamic non-response to propranolol.Gut 2013;62:1634-1641.
[34]Hobolth L,Moller S,Gronbak H,et al.Carvedilol or propranolol in portal hypertension A randomized comparison.Scand J Gastroenterol.2012;47(4):467-474.
[35]Abraldes JG,Albillos A,Banares R,et al.Simvastatin lowers portal pressure in patients with cirrhosis and portal hypertension:a randomized controlled trial.Gastroenterology 2009;136:1651-1658.
[36]Gluud LL,Langholz E,Krag A.Meta-analysis:isosorbide-mononitrate alone or with either beta-blockers or endoscopic therapy for the management of oesophageal varices.Aliment PharmacolTher.2010;32(7):859-871.
[37]Herath CB,Grace JA,Angus PW.Therapeutic potential of targetingthereninangiotensinsysteminportalhypertension. World J Gastrointest Pathophysiol.2013;4(1):1-11.
[38]Schepke M,Wiest R,Flacke S,et al.Irbesartan plus low-dose propranololversuslow-dosepropranololaloneincirrhosis:a placebo-controlled,double-blindstudy.AmJGastroenterol. 2008;103(5):1152-1158.
[39]Kim DH,ParkJY.PreventionandManagementof Variceal Hemorrhage.Int J Hepatol.2013:434609.
[40]Abecasis R,Kravetz D,Fassio E,et al.Nadolol plus spironolactone in the prophylaxis of first variceal bleed in nonascitic cirrhotic patients:A preliminary study.Hepatology.2003;37(2):359-365.
[41]Piai G,Cipolletta L,Claar M,et al.Prophylactic sclerotherapy of high-risk esophageal varices:results of a multicentric prospectivecontrolled trial.Hepatology.1988;8(6):1495-1500.
[42]D'Amico G,Pagliaro L,Bosch J.The treatment of portal hypertension:a meta-analytic review,Hepatology.1995;22(1):332-354.
[43]Prophylactic sclerotherapy for esophageal varices in men with alcoholicliverdisease:arandomized,single-blind,multicenter clinical trial.The Veterans Affairs Cooperative Variceal Sclerotherapy Group,N Engl J Med.1991;324(25):1779-1784.
[44]Bai M,Qi X,Yang M,et al.Combined therapies versus monotherapies for the first variceal bleeding in patients with high-risk varices:a meta-analysis of randomized controlled trials.J GastroenterolHepatol.2014;29(3):442-452.
[45]Mishra SR,Sharma BC,Kumar A,et al.Primary prophylaxis of gastric variceal bleeding comparing cyanoacrylate injection and beta-blockers:a randomized controlled trial.J Hepatol 2011;54:1161-1167.
[46]Garcia-Tsao G,Bosch J.Management of varices and variceal hemorrhage in cirrhosis.N Engl J Med.2010;362(9):823-832.
[47]D'Amico G,Pietrosi G,Tarantino I,et al.Emergency sclerotherapy versus vasoactive drugs for variceal bleeding in cirrhosis:a Cochrane meta-analysis.Gastroenterology 2003;124:1277-1291.
[48]Groszmann RJ,Kravetz D,Bosch J,et al.Nitroglycerin improves the hemodynamic response to vasopressin in portal hypertension. Hepatology 1982;2:757-762.
[49]刘菲,陆玮,袁耀宗,等.血管加压素治疗肝硬化食管静脉曲张出血.上海医学,1997;10:599-600.
[50]金瑞,陆英,于中麟,等.生长抑素与血管加压素治疗食管静脉曲张出血多中心对照研究.临床肝胆病杂志,1999,15(3):163-168.
[51]奥曲肽全国协作组,李兆申.两种剂量奥曲肽治疗食管、胃静脉曲张大出血多中心随机对照临床疗效观察中华消化杂志,2005,25(01):37-40.
[52]Seo YS,Park SY,Kim MY,et al.Lack of difference among terlipressin,somatostatin,andoctreotideinthecontrolofacute gastroesophageal variceal hemorrhage.Hepatology.2014;60(3):954-963.
[53]Wells M,Chande N,Adams P,et al.Meta-analysis:vasoactive medications for the management of acute variceal bleeds.Aliment Pharmacol Ther.2012;35(11):1267-1278.
[54]Wang C,Han J,Xiao L,et al.Efficacy of vasopressin/terlipressin and somatostatin/octreotide for the prevention of early variceal rebleeding after the initial control of bleeding:a systematic review and meta-analysis.Hepatol Int.2015;9(1):120-129.
[55]Lee YY,Tee HP,Mahadeva S.Role of prophylactic antibiotics in cirrhotic patients with variceal bleeding.World J Gastroenterol.2014;20(7):1790-1796.
[56]Sreedharan A,Martin J,Leontiadis GI,et al.Proton pump inhibitor treatment initiated prior to endoscopic diagnosis in uppergastrointestinalbleeding.CochraneDatabaseSystRev. 2010;(7):CD005415.
[57]Shaheen NJ,Stuart E,Schmitz SM,et al.Pantoprazole reduces the size of post banding ulcers after variceal band ligation:a randomized,controlled trial.Hepatology 2005;41:588-594.
[58]Jang WS,Shin HP,Lee JI,et al.Proton pump inhibitor administration delays rebleeding after endoscopic gastric variceal obturation.World J Gastroenterol.2014;20(45):17127-17131.
[59]Min YW,Lim KS,Min BH,et al.Proton pump inhibitor use significantly increasesthe risk of spontaneous bacterial peritonitis in 1965 patients with cirrhosis andascites:a propensity score matched cohort study.Aliment Pharmacol Ther.2014;40:695-704.
[60]Dultz G,Piiper A,Zeuzem S,et al.Proton pump inhibitor treatment is associatedwith the severity of liver disease and increased mortality in patients with cirrhosis.Aliment Pharmacol Ther 2015;41:459-466.
[61]T erg R,Casciato P,Garbe C,et al.Study Group of Cirrhosis Complications of the Argentine Association for the Study of Liver Disease.Proton pump inhibitor therapy does not increase the incidence of spontaneous bacterial peritonitis in cirrhosis:a multicenter prospective study.J Hepatol.2015;62(5):1056-1060.
[62]Cho SB,Park KJ,Lee JS,et al.Comparison of terlipressin and octreotide with variceal ligation for controlling acute esophageal varicealbleeding-arandomizedprospectivestudy.KoreanJ Hepatol.2006;12(3):385-393.
[63]Abid S,Jafri W,Hamid S,et al.Terlipressin vs octreotide in bleeding esophageal varices as an adjuvant therapy with endoscopic band ligation:a randomized double-blind placebo-controlled trial.Am J Gastroenterol.2009;104(3):617-623.
[64]晋琼玉,吴攀,徐泽燕,等.内镜下套扎术联合药物治疗食管静脉曲张出血的疗效观察.华西医学,2012,27(8):1129-1132.
[65]何晓玲.单用奥曲肽与联用硬化剂治疗食管静脉曲张破裂出血的疗效对比.中华消化内镜杂志.2002,19(03):171-172.
[66]Holster IL,Kuipers EJ,van Buuren HR,et al.Self-expandable metalstentsasdefinitivetreatmentforesophagealvariceal bleeding.Endoscopy.2013;45(6):485-488.
[67]Zakaria MS,Hamza IM,Mohey MA,et al.The first Egyptian experience using new self-expandable metal stents inacute esophageal variceal bleeding:pilot study.Saudi J Gastroenterol. 2013;19(4):177-181.
[68]Zhang D,Shi R,Yao J,Zhang R,et al.Treatment of massive esophageal variceal bleeding by sengstaken-blackmore tube compression and intensive endoscopic detachable mini-loop ligation:a retrospective study in 83 patients.Hepatogastroenterology.2015;62(137):77-81.
[69]RossleM.TIPS:25yearslater.JHepatol.2013;59(5):1081-1093.
[70]Suhocki PV,Lungren MP,Kapoor B,et al.Transjugular intrahepatic portosystemic shunt complications:prevention and management.Semin Intervent Radiol.2015;32(2):123-132.
[71]Siramolpiwat S.Transjugular intrahepatic portosystemic shunts and portal hypertension-related complications.World J Gastroenterol.2014;20(45):16996-17010.
[72]García-Pagán JC1,Caca K,Bureau C,Laleman W,Appenrodt B,Luca A,Abraldes JG,Nevens F,Vinel JP,Mossner J,Bosch J. EarlyuseofTIPSinpatientswithcirrhosisandvariceal bleeding.N Engl J Med.2010 Jun 24;362(25):2370-9.
[73]Huang L,Yu QS,Zhang Q,et al.Transjugular intrahepatic portosystemic shunt versus surgical shunting in the management ofportal hypertension.Chin Med J(Engl).2015.20;128(6):826-834.
[74]Orloff MJ.Fifty-three years'experience with randomized clinical trials of emergency portacaval shunt for bleeding esophageal varicesinCirrhosis:1958-2011.JAMASurg.2014;149(2):155-169.
[75]Satapathy SK,Sanyal AJ.Nonendoscopic management strategies for acute esophagogastric variceal bleeding.Gastroenterol Clin North Am.2014;43(4):819-833.
[76]吴志勇.肝硬化门静脉高压症外科治疗的合理选择.外科理论与实践,2009;1:1-3.
[77]ShiKQ,LiuWY,PanZZ,etal.Secondaryprophylaxisof varicealbleedingforcirrhoticpatients:amultiple-treatments meta-analysis.Eur J Clin Invest.2013.doi:10.1111/eci.12115.
[78]Garbuzenko DV.Contemporary concepts of the medical therapy of portal hypertension under liver cirrhosis.World J Gastroenterol 2015;21(20):6117-6126.
[79]Albillos A,Tejedor M.Secondary Prophylaxis for Esophageal Variceal Bleeding.Clin Liver Dis.2014;18(2):359-370.
[80]李波,黄志刚,沈健伟,宋毓飞.卡维地洛与普萘洛尔降低肝硬化门静脉高压效果的对照研究.浙江医学,2012;24:1973-1975.
[81]Sinagra E,Perricone G,D'Amico M,et al.Systematic review with meta-analysis:the haemodynamic effects of carvedilol compared with propranolol for portal hypertension in cirrhosis.Aliment Pharmacol Ther.2014;39(6):557-568.
[82]Hobolth L,Bendtsen F,Hansen EF,et al.Effects of carvedilol and propranolol on circulatory regulation and oxygenation in cirrhosis:a randomised study.Dig Liver Dis.2014;46(3):251-256.
[83]Sersté T,Melot C,Francoz C,et al.Deleterious effects of beta-blockers on survival in patients with cirrhosis and refractory ascites.Hepatology.2010;52(3):1017-1022.
[84]范春蕾,丁惠国.非选择性β受体阻滞剂预防肝硬化食管胃静脉曲张出血研究进展.中华医学杂志.2013,93(6):474-476.
[85]Giannelli V,Lattanzi B,Thalheimer U,et al.Beta-blockers and cirrhosis.Annl Gastroentol,2014;27:20-26.
[86]González-Abraldes J,Albillos A,Banares R,et al.Randomized comparison of long-term losartan versus propranolol in lowering portal pressure in cirrhosis.Gastroenterology 2001;121:382.
[87]Wong F,Nadim MK,Kellum JA,et al.Working Party proposal for a revised classification system of renal dysfunction in patients with cirrhosis.Gut,2011,60:702-709.
[88]Angeli P,et al.Diagnosis and management of acute kidney injury in patients with cirrhosis:revised consensus recommendations of the International Club of Ascites.Gut;2015 Vol 64 No 4.
[89]Ding SH,Liu J,Wang JP.Efficacy of β-adrenergic blocker plus 5-isosorbide mononitrate and endoscopic band ligation for prophylaxis of esophageal variceal rebleeding:A meta-analysis World J Gastroenterol.2009;15(17):2151-2155.
[90]Wei Luo,Ying Meng,Hong-Li Ji,et al.Spironolactone Lowers Portal Hypertension by Inhibiting Liver Fibrosis,ROCK-2 Activity and Activating NO/PKG Pathway in the Bile-Duct-Ligated Rat.PLoS One.2012;7(3):e34230.
[91]Florence Wong,et al.Acute kidney injury in decompensated cirrhosis.Gut 2013;62:131-137.
[92]Lo GH.The optimal interval of endoscopic variceal ligation:an issue of controversy.Gastrointest Endosc.2015;81(3):774.
[93]Kumar A,Jha SK,Sharma P,et al.Addition of propranolol and isosorbide mononitrate to endoscopic variceal ligation does not reduce variceal rebleeding incidence.Gastroenterology.2009;137(3):892-901.
[94]FunakoshiN,Ségalas-LargeyF,DunyY,etal.Benefitof combination β-blocker and endoscopic treatment to prevent varicealrebleeding:ameta-analysis.WorldJGastroenterol. 2010;16(47):5982-5992.
[95]Puente A,Hernández-Gea V,Graupera I,et al.Drugs plus ligation to prevent rebleeding in cirrhosis:an updated systematic review.Liver Int.2014;34(6):823-833.
[96]陈炜,罗蒙,孙勇伟,等.术中门静脉压力动态测定在门静脉高压症术式选择中的作用.中华外科杂志,2008,46(22):1703-1706.
[97]Zeng DB,Dai CZ,Lu SC,et al.Abnormal splenic artery diameter/hepatic artery diameter ratio in cirrhosis-induced?portal hypertension.World J Gastroenterol.2013;19(8):1292-1298.
[98]MishraSR,ChanderSharmaB,KumarA,etal.Endoscopic cyanoacrylateinjectionversusbeta-blockerforsecondary prophylaxisofgastricvaricealbleed:arandomisedcontrolled trial.Gut.2010;59(6):729-735.
[99]Orloff MJ,Hye RJ,Wheeler HO,et al.Randomized trials of endoscopic therapy and transjugular intrahepatic portosystemic shuntversusportacavalshuntforemergencyandelective treatmentofbleedinggastricvaricesincirrhosis.Surgery. 2015;157(6):1028-1045.
[100]Kochhar GS,Navaneethan U,Hartman J,et al.Comparative study of endoscopy vs transjugular intrahepatic portosystemic shunt in the management of gastricvariceal bleeding.Gastroenterol Rep(Oxf).2015;3(1):75-82.
[101]JooHS,JangJY,EunSH,etal.Long-termresultsof endoscopichistoacryl(N-butyl-2-cyanoacrylate)injectionfor treatment of gastric varices-a10-yearexperience.KoreanJ Gastroenterol.2007;49(5):320-326.
[102]KangEJ,JeongSW,JangJY,etal.Long-termresultof endoscopic Histoacryl(N-butyl-2-cyanoacrylate)injectionfor treatment of gastric varices.World J Gastroenterol.2011;17(11):1494-1500.
[103]Sarin SK,Kumar A2.Endoscopic treatment of gastric varices. Clin Liver Dis.2014;18(4):809-827.
[104]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015年版).实用肝脏病杂志,2016,19(3):Ⅴ-ⅩⅩⅢ.
[105]中华医学会肝病学分会,中华医学会感染病学分会.慢性丙型肝炎防治指南(2015年版).实用肝脏病杂志,2016,19(4):Ⅸ-ⅩⅩⅥ.
[106]AASLD/IDSAHCVGuidancePanel.HepatitisCguidance:AASLD-IDSA recommendations for testing,managing,and treating adults infected with hepatitis C virus.Hepatology.2015;62(3):932-954.
[107]LiuC,JiangCM,LiuCH,etal.EffectofFuzhenghuayudecoctiononvascularendothelialgrowthfactorsecretionin hepatic stellate cells.Hepatobiliary Pancreat Dis Int.2002;1(2):207-210.
[108]Jie Gu,Qin Zhang,Dongying Xue,et al.A randomized controlled study of fuzheng huayu capsule for prevention of esophageal variceal bleeding in patients with liver cirrhosis.Evidence-based complementary and alternative medicine.2013:534960.
[109]蒋永芳,马静,贺波,等.阿德福韦酯联合安络化纤丸治疗慢性乙型肝炎的疗效.中华肝脏病杂志,2012;20(5):344-347.
[110]吴刚,何鸿雁,李烨,等.复方鳖甲软肝片联合恩替卡韦对HBV相关肝硬化患者的临床疗效观察.中华肝脏病杂志,2014;22(08):604-608.
[111]Vorobioff JD,Groszmann RJ.Prevention of portal hypertension:fromvaricealdevelopmenttoclinicaldecompensation. Hepatology.2015;61(1):375-381.
[112]Iranmanesh P,Vazquez O,Terraz S,et al.Accurate computed tomography-based portal pressure assessment in patients with hepatocellular carcinoma.Journal of Hepatology 2014;60(5):969-974.
[113]Li L,Liu W,Chen YH,et al.Antiviral drug resistance increases hepatocellular carcinoma:a prospective decompensated cirrhosis cohort study.World J Gastroenterol.2013;19(45):8373-8381.
[114]Guo LH,Xu HX.Contrast-enhanced ultrasound in the diagnosis of hepatocellular carcinoma and intrahepatic cholangiocarcinoma:controversy over the ASSLD guideline.Biomed Res Int.2015. doi:10.1155/2015/349172.
[115]Gupta N,Kumar A,Sharma P,et al.Effects of the adjunctive probioticVSL#3onportalhaemodynamicsinpatientswith cirrhosis and large varices:a randomized trial.Liver Int.2013;33(8):1148-1157.
执笔:徐小元(北京大学第一医院感染科)、丁惠国(首都医科大学附属北京佑安医院肝病消化中心)、贾继东(首都医科大学附属北京友谊医院肝病中心)、魏来(北京大学人民医院肝病科)、段钟平(首都医科大学附属北京佑安医院人工肝中心)、令狐恩强(解放军301医院消化科)、刘玉兰(北京大学人民医院消化科)、庄辉(北京大学医学部病原生物学系)
专家组成:(以姓氏汉语拼音为序)
安纪红(内蒙古自治区医院感染科)、陈红松(北京大学人民医院肝病研究所)、陈新月(首都医科大学附属北京佑安医院肝病综合科)、陈智(浙江大学医学院)、窦晓光(中国医科大学附属盛京医院感染科)、范建高(上海交通大学医学院附属新华医院消化科)、傅青春(解放军85医院肝病中心)、甘建和(苏州大学附属第一医院感染科)、高人焘(安徽省立医院感染科)、郭武华(南昌大学第二附属医院消化科)、韩涛(天津市第三中心医院肝内科)、韩英(第四军医大学西京医院消化科)、侯金林(南方医科大学南方医院感染科)、黄燕(中南大学湘雅医院感染科)、江家骥(福建医科大学附属第一医院肝病中心)、江建宁(广西医科大学第一附属医院感染科)、江应安(湖北省人民医院感染科)、姜慧卿(河北医科大学第二医院消化科)、李杰(北京大学医学部病原生物学系)、李军(江苏省人民医院感染科)、李树臣(哈尔滨医科大学附属第二医院感染科)、李武(昆明医科大学第一附属医院感染科)、李玉芳(宁夏医科大学总医院感染科)、林锋(海南省人民医院感染科)、蔺淑梅(西安交通大学医学院第一附属医院感染科)、刘成海(上海中医药大学附属曙光医院肝硬化科)、刘景丰(福建医科大学孟超肝胆医院肝胆外科)、刘晓清(北京协和医院感染科)、陆伦根(上海交通大学附属第一人民医院消化科)、路青华(青海省第四人民医院肝病科)、罗新华(贵州省人民医院感染科)、马雄(上海交通大学医学院附属仁济医院消化科)、毛青(第三军医大学西南医院感染科)、茅益民(上海交通大学医学院附属仁济医院消化科)、梅浙川(重庆医科大学附属第二医院消化科)、南月敏(河北医科大学第三医院中西医结合肝病科)、聂玉强(广州市第一人民医院消化科)、牛俊奇(吉林大学第一医院感染科)、任红(重庆医科大学附属第二医院感染科)、尚佳(河南省人民医院感染科)、施瑞华(江苏省人民医院消化科)、石荔(西藏自治区人民医院感染科)、孙刚(解放军301医院消化科)、王邦茂(天津医科大学总医院消化科)、王磊(山东大学第二医院感染/肝病科)、吴浩(四川大学华西医院消化科)、谢雯(首都医科大学附属北京地坛医院肝病中心)、谢尧(首都医科大学附属北京地坛医院肝病中心)、辛绍杰(解放军302医院肝衰竭诊疗与研究中心)、邢卉春(首都医科大学附属北京地坛医院肝病中心)、徐红(吉林大学第一医院消化科)、徐列明(上海中医药大学附属曙光医院肝硬化科)、宣世英(青岛市市立医院消化科)、闫杰(首都医科大学附属北京地坛医院肝病中心)、阎明(山东大学齐鲁医院消化科)、杨长青(同济大学附属同济医院消化科)、杨东亮(华中科技大学同济医学院附属协和医院感染科)、杨积明(天津市传染病医院感染科)、杨力(宁夏医科大学总医院消化科)、杨玉秀(河南省人民医院消化科)、尤红(首都医科大学附属北京友谊医院肝病中心)、张春清(山东省立医院消化科)、张岭漪(兰州大学第二医院肝病科)、张欣欣(上海交通大学附属瑞金医院感染科)、张跃新(新疆医科大学第一附属医院感染科)、张专才(解放军253医院感染科)、赵景民(解放军302医院病理科)、赵龙凤(山西医科大学第一医院感染科)、赵守松(蚌埠医学院附属医院感染科)、诸葛宇征(南京市鼓楼医院消化科)、左维泽(石河子大学医学院第一附属医院感染科)
秘书:曹颖(北京大学第一医院感染科)、古川(北京大学第一医院感染科)、张妍(首都医科大学附属北京佑安医院肝病消化中心)、张霞霞(北京大学第一医院感染科)
(收稿:2016-06-14)
(本文编辑:陈从新)
10.3969/j.issn.1672-5069.2016.05.036

