开腹与内镜下胆道支架置入治疗晚期恶性梗阻性黄疸的对比分析
蒋 翔
(淮安市第一人民医院 肝胆外科,淮安 223000)
开腹与内镜下胆道支架置入治疗晚期恶性梗阻性黄疸的对比分析
蒋 翔
(淮安市第一人民医院 肝胆外科,淮安 223000)
目的:探讨开腹手术放置胆道支架与内镜下支架置入在恶性梗阻性黄疸患者临床治疗中的应用价值及适应症选择。方法:回顾分析35例不能根治切除的恶性梗阻性黄疸患者采用金属记忆合金胆道内撑支架经开腹手术置入(n=23)、经ERCP置入(n=12)完成胆汁内引流,比较手术前后肝功能变化情况。结果:所有患者均完成胆管末端支架置入达到内引流的目的。支架置入术后胆红素均在术后第1周下降约100 μmol/L;术后第2周胆红素仍有继续下降;谷草转氨酶、谷丙转氨酶、碱性磷酸酶及谷氨酰转肽酶在术后第1周开始较术前明显下降。主要并发症有胆管炎2例,胰腺炎2例,胆道出血3例。结论:胆道支架经开腹手术置入与经ERCP置入均可有效解除恶性梗阻性黄疸患者胆管梗阻,改善肝功能,提高患者生活质量,延长生存时间。临床根据病情选择合适的胆道支架置入方式,达到个体化治疗,以提高胆道支架置入的安全性、有效性。
胆道支架;恶性胆管梗阻;外科;内窥镜逆行胰胆管造影术
胆道恶性梗阻不单指原发性胆管腺癌所致的胆管梗阻,还包括胆囊癌、肝细胞癌、壶腹癌、胰头癌以及其他转移癌对肝胆管的侵犯,可引起进行性加重的梗阻性黄疸,导致肝脏功能迅速恶化,并易发生肝功能衰竭、严重感染、胃肠道出血和肾功能衰竭,可严重影响患者的生活质量,并可加速病情的发展,病死率极高。1978年Cameron等[1]报道了经皮肝穿用大孔硅胶支架治疗胆道的良恶性狭窄,并取得了良好的疗效,是比PTCD更合理的内引流,它保留了胆汁的生理功能。目前胆道支架置入是解决胆道梗阻性疾病的重要方法,特别在晚期恶性肿瘤所致胆管梗阻的姑息治疗中应用日渐广泛,并形成多种支架置入方式。本文回顾性分析了我院2010年5月至2014年5月对无法根治的恶性胆道梗阻分别进行的开腹手术置入、内镜下置入NiTi形状记忆合金胆道支架35例患者,探讨开腹手术放置胆道支架与内镜下支架置入在恶性梗阻性黄疸患者临床治疗中的应用价值及适应症选择,总结如下。
1 资料与方法
1.1 临床资料 本组中男15例,女20例;年龄37~84岁,平均56±25岁。35例中胰头癌17例,肝门部胆管癌8例,壶腹部癌7例,鼻咽癌肝门部转移1例,胆囊癌并肝门部侵犯2例。
1.2 材料与方法
1.2.1 材料 采用南京微创医学科技有限公司生产的MTN型NiTi形状记忆合金胆道支架(图1~图3),直径6~10mm,长度40~100mm,并配有一次性腔道支架置入器(图4)。

图1 胆道支架套装

图2 胆道支架

图3 胆道支架局部结构

图4 一次性腔道支架置入器,①、②为支架释放过程
1.2.2 方法
1.2.2.1 经术中胆道内撑支架置入 术中探查无法行根治手术,纵行切开胆总管前壁1.0~1.5 cm,经胆道探条探查胆总管末端,若3号探条能通过十二指肠乳头进入十二指肠腔,则可置入胆道内撑支架,根据肿瘤压迫胆总管的部位及长度,选用6F或8F镍钛形状记忆合金支架置入胆总管内,支架远端进入十二指肠腔内1~2 cm,支架近端需位于肿瘤上方。支架放置至预定位置后固定管芯,向后退出外鞘,至网状支架完全撑开固定于胆总管内,再次检查支架远端位置是否符合要求,退出支架内芯,放置好支架近端。胆总管切开处根据支架长短采用直接间断缝合或放置T管后缝合。术后2周可行造影检查,观察支架位置及胆道情况。5例肝门部胆管癌术中探查无法行根治手术,胆道探子探查并找到狭窄段胆管。根据术前影像学检查和手术探查来判断狭窄胆管的长度和位置,若3号探条能通过该狭窄段胆管,则可置入胆道内撑支架,根据术前影像学检查和手术探查来判断狭窄胆管的长度和部位,选用6F或8F镍钛形状记忆合金支架置入狭窄胆管的位置,将装有支架的套管置于狭窄胆管的位置,固定管芯退出外鞘,支架可自行扩张置于狭窄段胆管内,支架远端上、下端均超出2-3cm,以防早期肿瘤生长再次阻塞胆管,再次检查支架远端位置是否符合要求,退出支架内芯,放置好支架近端。胆总管切开处根据支架长短采用直接间断缝合或放置T管后缝合。术后2周可行造影检查,观察支架位置及胆道情况。3例肝总管肿瘤行右肝管一肝总管支架置入;1例右肝管受累行右肝管一肝总管支架置入;1例左右肝管同时受累,因经济原因仅行右肝管一肝总管支架置入。本组有23例行术中胆道内支架置入(开腹手术组),其中胰头癌l1例,肝门部胆管癌5例,壶腹部癌4例,鼻咽癌肝门部转移1例,胆囊癌并肝门部侵犯2例。
1.2.2.2 经ERCP胆道内撑支架置入 操作前常规肌肉注射安定5 mg(或度冷丁50 mg)及654-2 10 mg。采用Olympus JF一240电子十二指肠镜.用带导丝的弓状刀先行ERCP检查.结合临床症状、体征及B超、CT、MRCP检查,在十二指肠镜下观察十二指肠乳头病变情况,行胆管插管造影成功后,判断胆管梗阻部位及长度,选用适当长度的支架,逆行置入胆道支架(图 5),可见胆汁引出。本组有12例行ERCP胆道内撑支架置入(ERCP组),其中胰头癌6例,胆管癌3例,壶腹部癌3例。
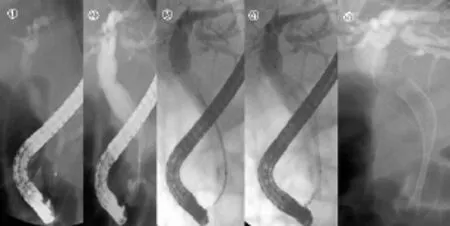
图5 ①为内镜逆行胰胆管造影,显示胰头癌致胆总管下端梗阻,呈“鼠尾样”,②~④判断胆管梗阻的部位及长度,选用适当长度的支架,⑤逆行置入胆道支架。
2 结果
2.1 术后各组肝功能变化 结果见表1。术后第1周各组血清BIL、GOT、AKP及GT均较术前明显降低,术后BIL均在术后第l周内下降约100 μmol/L左右(图6),黄疸消退明显,胆道内撑支架置入可解除胆管梗阻,改善肝功能。两者比较差异有显著性意义(P<0.01)。手术组比内镜组肝功能改善好,GPT、GOT、AKP、GT相比有统计学意义,这个结果可能与病例选择有关。综合所有患者术前及术后肝功能数据(表2),术后第一周BIL降最明显,第二周BIL下降较前缓慢(图7)。术后全组血清BIL、GOT、AKP及GT均较术前明显降低,有统计学意义(P<0.05)。
2.2 术后并发症 术后并发症有轻度胆管炎2例,胰腺炎2例,胆道出血3例,无穿孔及死亡病例。胆管炎均为轻型,主要表现右上腹疼痛,轻度反跳痛,无寒战、高热,经抗生素治疗好转。胰腺炎均轻型,主要表现轻度腹痛、腹胀,伴血尿淀粉酶增高,予禁食、胃肠减压、抑酶、抗炎、营养支持对症等治疗,3—5天恢复正常。胆道出血主要表现在柏油样便,无呕血,生命体征平稳,经止血药物治疗得到控制。
表1 两组患者术前及术后第1周肝功能变化情况(±s)
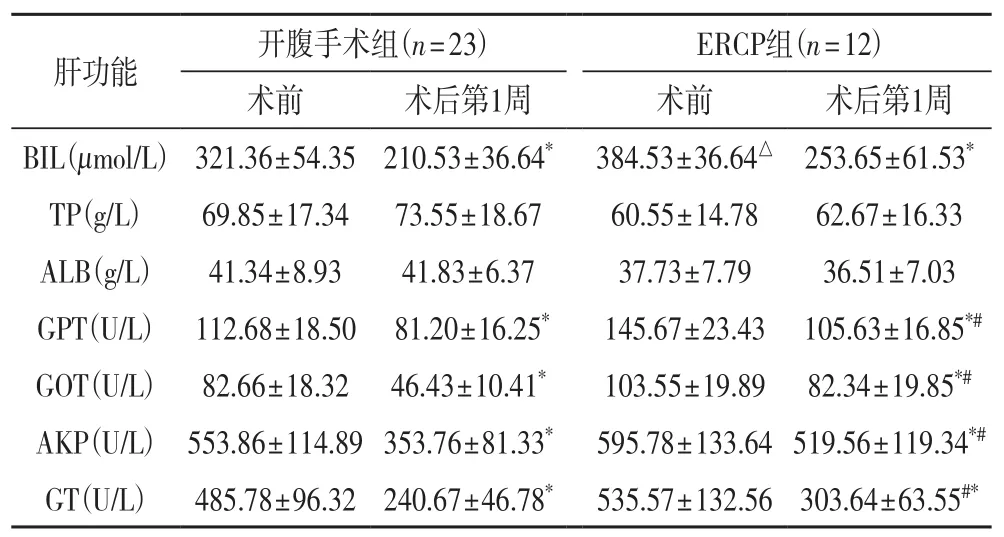
表1 两组患者术前及术后第1周肝功能变化情况(±s)
与同组术前比较,* P<0.05;与开腹手术组术前比较,△P<0.05;与开腹手术术后第1周比比较,# P<0.05
开腹手术组(n=23) ERCP组(n=12)肝功能 术前 术后第 术前 术后第1周 1周BIL(μmol/L) 321.36±54.35 210.53±36.64* 384.53±36.64△ 253.65±61.53*TP(g/L) 69.85±17.34 73.55±18.67 60.55±14.78 62.67±16.33 ALB(g/L) 41.34±8.93 41.83±6.37 37.73±7.79 36.51±7.03 GPT(U/L) 112.68±18.50 81.20±16.25* 145.67±23.43 105.63±16.85*#GOT(U/L) 82.66±18.32 46.43±10.41* 103.55±19.89 82.34±19.85*#AKP(U/L) 553.86±114.89 353.76±81.33* 595.78±133.64 519.56±119.34*#GT(U/L) 485.78±96.32 240.67±46.78* 535.57±132.56 303.64±63.55#*
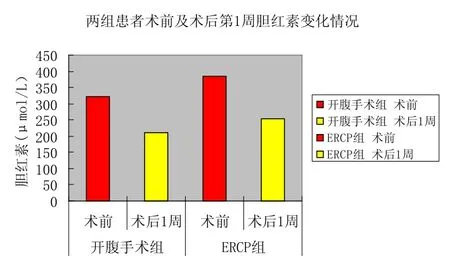
图6 两组患者术前及术后第1周胆红素变化情况
表2 全组患者术前及术后2周肝功能变化情况(±s)
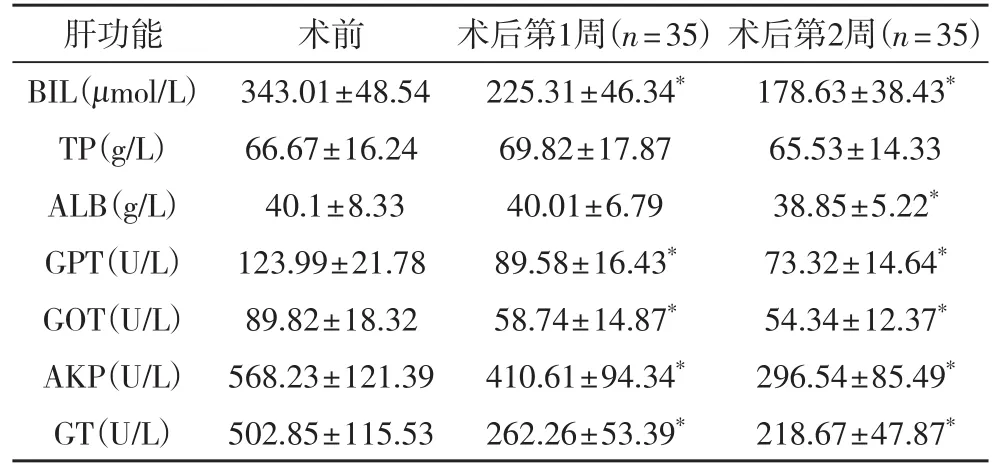
表2 全组患者术前及术后2周肝功能变化情况(±s)
与同组术前比较,*P<0.05
肝功能 术前 术后第1周(n=35)术后第2周(n=35)BIL(μmol/L) 343.01±48.54 225.31±46.34* 178.63±38.43*TP(g/L) 66.67±16.24 69.82±17.87 65.53±14.33 ALB(g/L) 40.1±8.33 40.01±6.79 38.85±5.22*GPT(U/L) 123.99±21.78 89.58±16.43* 73.32±14.64*GOT(U/L) 89.82±18.32 58.74±14.87* 54.34±12.37*AKP(U/L) 568.23±121.39 410.61±94.34* 296.54±85.49*GT(U/L) 502.85±115.53 262.26±53.39* 218.67±47.87*
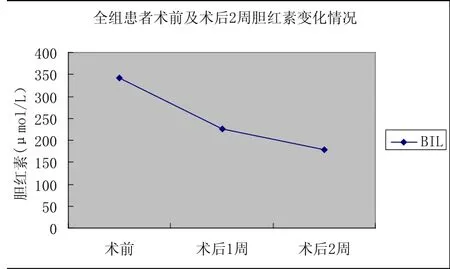
图7 全组患者术前及术后2周胆红素变化情况
3 讨论
对不能根治的恶性肿瘤,如胰头癌、壶腹部癌、肝门部胆管癌等,若肿瘤未封闭肝门,仍能显露肝总管或胆总管,可行胆总管或肝总管切开,我们通常使用胆道镜观察胆管梗阻情况,用金属探条试探胆道,若能允许探条通过并进入十二指肠,通常可置入支架。本组有23例行术中胆道内支架置入,术后1周减黄效果明显,两者比较差异有显著性意义。其中手术组与内镜组术后1周减黄效果差异无显著意义,手术组比内镜组肝功能改善好,GPT、GOT、AKP、GT相比有统计学意义,这个结果可能与病例选择有关。手术中胆道支架置入并不增加患者并发症发生率或死亡率。由于支架放置于胆管下端,胆汁仍能保持正常流向,可维持正常生理状态,既可使黄疸减退、改善肝功能,又可使肠道功能得以改善,维护机体的营养状态和免疫功能,维持肠肝循环并进一步改善肝功能[2]。本组23例开腹手术中,发生胆管炎轻型者有2例,通过抗生素治疗均获控制。胆道出血2例主要表现在柏油样变,无呕血,生命体征平稳,经止血药物治疗得到控制。无肝功能衰竭发生。与内镜组相比开腹手术放置支架有以下优点:①手术引流可以术中探查肿瘤,能更准确判断肿瘤的分期,避免对部分还有手术切除机会的病人行单纯引流手术;②术中可以取组织送病理检查,以明确病理性质,有利于手术后的进一步治疗;③操作容易,同时开腹手术时可直视支架释放的全部过程,协助定位调整支架与狭窄上下端及乳头外口的位置;④手术方式不受限制,探查彻底可即时决定是否能行根治性切除,从而减少了术前仅依靠影像学资料评估是否可以根治的盲目性,大大提高了恶性梗阻性黄疽的生存率和生存质量[3]。本组病例中行开腹手术患者掌握较严格指征:无严重心、肺功能障碍,无贫血,血清Alb>30g/L。
本组有12例为经ERCP胆道支架置入,术后胆道引流通畅,黄疸逐渐减退,疗效满意。ERCP并发症包括早期并发症及晚期并发症,早期并发症有出血、穿孔、胰腺炎或高淀粉酶血症、胆管炎等[4,5],晚期并发症有支架的阻塞、移位、滑脱,甚至有报告因支架移位而损伤肠道引起穿孔[6]。本组并发症发生率较低,与文献[7,8]报道相似。本组病例与开腹手术组相比指征稍宽:有少量腹水和肝功能变化合并轻度凝血功能下降的患者仍可谨慎实施,但合并严重心、肺功能障碍或有上消化道梗阻,内镜不能进入十二指肠者应视为禁忌,我们通常对不能进行根治者或能根治但不愿意接受手术的患者选择此术式。Andersen等[9],曾报道手胆肠吻合减黄与内镜下支架减黄二者之间的患者生存时间相同,早期并发症发生率相同,但后者的住院时间明显缩短。然而胆道支架有一定阻塞率。据报道,可膨性金属支架的平均通畅时间为169天,朔料支架位126天,支架阻塞严重影响了内置管治疗的效果[10],造成胆道内支架堵塞的主要原因是胆泥形成、支架腔内的肉芽组织增生以及胆道恶性肿瘤的浸润性生长。经观察发现[11,12],可膨式金属胆道支架置入术后减黄失效多为浸润性肿瘤向支架网眼生长或纵向发展超出支架端部引起。近年有报道[13-15]内镜下同期置入多点位支架治疗胆管恶性梗阻,取得较好的临床疗效。但此操作技术难度较高,多点位支架置入的成功率受到影响。此外有研究[16,17]认为胆道恶性梗阻支架置入后的腔内放射治疗,能抑制肿瘤生长,延长支架通畅时间。
目前对于胆道恶性梗阻的治疗仍以外科手术为主,对于不能根治的晚期恶性梗阻性黄疸患者,胆道支架置入是有效解除胆道梗阻的方法。对于金属胆道支架置入指征:McDougall等[18]认为使用金属支架的应用指征为:(1)临床或病理诊断为恶性胆道梗阻,如胆管癌、胰腺癌或胆道转移癌等;(2)根据临床表现或CT等影像检查认为无外科手术指征者;(3)预计患者至少可生存3个月;(4)无合并其它重大疾病。胡冰等[19]提出选择金属支架指征为:(1)不能根治性切除的恶性胆道梗阻;(2)引流胆系较丰富,估计引流效果理想;(3)无其它重要脏器功能障碍;(4)预计可生存3个月以上;(5)经济条件许可。我们金属支架放置指征与上述观点基本一致,不主张放置金属支架处理良性胆道梗阻。本组研究中手术组、内镜组术后减黄效果满意,对恶性梗阻性黄疸患者可有效解除梗阻,减轻患者痛苦,提高患者生活质量,延长生存时间。胆道支架置入有多种方式,各种方式各有优、缺点[7],根据病情选择合适的胆道支架置入方式,达到个体化治疗、联合治疗,提高胆道支架置入的安全性、有效性。
[1] JL Cameron, BW Gayler, GD Zuidema. The use of silastic transhepatic stents in benign and malignant biliary strictures. Ann Surg, 1978,188(4): 552-561.
[2] Koyama K, Takagi Y, Ito K, et al. Experimental and clinical studies on the effect of biliary drainage in obstructive jaundice. Am J Surg, 1981;142(2): 293-229.
[3] 王欣, 孙志为, 李新宇. 开腹手术放置胆道支架治疗晚期恶性梗阻性黄疸疗效观察. 中国误诊学杂志, 2005, 5(12): 2252-2253.
[4] 叶丽萍, 许国铭, 孙振兴, 等. 诊断与治疗性逆行胰胆管造影并发胰腺炎危险因素分析. 中华消化杂志, 2001, 21(5): 284-286.
[5] Hatzidakis AA, Tsetis D, Chrysou E, et a1. Nitinol stents for palliative treatment of malignant obstructive jaundice: should we stent the sphincter of CIddi in every case? Cardiovasc Intervent Radiol, 2001, 24(4): 245-248.
[6] 张建生, 张月寒, 康喜荣. 胆总管猪尾形内支架引流致十二指肠穿孔1例. 中国内镜杂志, 2004, 10(8): 60.
[7] 夏焱, 朱玉华, 张彪. 经内镜放置自膨式不带膜金属支架治疗胆管中下段恶性狭窄的疗效观察. 中国普外基础与临床杂志, 2004,11(2): 151-153.
[8] 李晓林, 崔毅, 李初俊, 等. 内镜下置入金属支架对恶性胆道梗阻的姑息治疗. 中国内镜杂志, 2003, 11(3): 288-290.
[9] Andersen JR, Sorensen SM, Kruse A, et a1. Randomised trial of endoscopic endoprosthesis versus operative bypass in malignant obstructive jaundice. Gut, 1989, 30(8): 1132-1135.
[10] Cheng JL, Bruno MI, Bergman JJ, eta1. Endoscopic palliation of patients with biliary obstruction caused by nonresectable hilar cholangiocarcinoma: efficacy of self-expandable metallic Wallstents. Gastrointest Endosc, 2002, 56(1): 33-39.
[11] Kahaleh M, Tokar J, Conaway MR, et a1. Efficacy and complications of covered Wallstents in malignant distal biliary obstruction. Gastmintest Endosc, 2005, 61(4): 528-533.
[12] 郭英辉, 张啸张, 筱凤. 恶性胆道梗阻金属内支架治疗后堵塞的处理. 中华消化内镜杂志, 2006, 23(5): 359-361.
[13] 李兆申, 许国铭, 孙振兴, 等. 胆胰管良恶性梗阻的双支架联合引流. 中华消化内镜杂志, 2002, 19(1): 15-17.
[14] 刘鹏, 周会新, 龚彪, 等. 胆胰管良恶性梗阻的多点位引流治疗. 中国内镜杂志, 2007, 13(12): 1259-1262.
[15] 王拥军, 冀明, 俞力, 等. 肝门部胆管恶性梗阻双侧支架引流. 临床和实验医学杂志2006, 5(4): 313-315.
[16] Bruha R, Petrtyl J, Kubeeova M, et a1. Intraluninal brachytherapy and selfexpandable stents in nonresectable billary malignancies—the question of long—term paliation. Hepatogastroenterology, 2001, 18(39): 631-637.
[17] Virendra Singh, Rakesh kapoor, Kaldip Kumar Solanki, et al. Endoscopic intraluminal brachytherapy and metal stent in malignant hilar biliary obstruction: a pilot study. Liver International, 2007,27(3).347-352.
[28] McDougall NL, Edmunds SE. An audit of metal stent palliation for malignant biliary obstruction. J Gastroenterol Hepatol, 2001, 16(9): 1051-1054.
[25] 胡冰, 周岱云, 龚彪. 可膨式金属胆道支架解除恶性胆管梗阻的临床应用及其疗效分析. 中华外科杂志, 1999, 37(5): 282-285.
Comparative analysis of the treatment of advanced malignant obstructive jaundice and abdominal endoscopic biliary stenting
Jiang Xiang
(Huai’an First People’s Hospital, Huai’an 223000, China)
Objective To discuss the value of biliary stent in treatment of the unresectable malignant biliary obstruction with endoscopic stent insertion and operation stent insertion. Methods thirty-five cases of malignant biliary obstruction whose biliary stent insertions were through operation(n=23), ERCP(n=7)respectively were reviewed retrospectively. Results The bile duct stents were successfully inserted in all patients through the malignantobstruction and achieved internal biliary drainage. Compared with the level of the bilirubin before operation, it decreased about 100 μmol/L one week after the stent insertion in all patients. Compared with the levels of glutamic oxalacetic transaminase, glutamic pyruvic transaminase, alkaline phosphatase and glutamyltranspeptidase before operation, they decreased 1 week after the stent insertion. Complications included 2 cases of cholangitis, 2 cases of pancreatitis and 3 cases of bile duct hemorrhage. Conclusion The bile duct stent insertions through operation and ERCP are all effective in relieving the bile duct construction with malignant biliary obstruction. Each method should be chosed according to the systemic and local condition for every patient so as to improve the safety and efficiency, and to decrease the occurrence of complications.
biliary stent; malignant biliary obstruction; operation; endoscopic retrograde cholangiopancreatography
R730.5
A
1673-016X(2016)04-0058-04
2016-03-04
蒋翔,E-mail:3482891398@qq.com

