糖尿病心肌PTEN蛋白表达变化及其在糖尿病心肌IPo中的影响
梁德贤 李庆军 陈康荣
广东省湛江中心人民医院心血管内科, 广东 湛江 524037
糖尿病心肌PTEN蛋白表达变化及其在糖尿病心肌IPo中的影响
梁德贤李庆军陈康荣
广东省湛江中心人民医院心血管内科, 广东湛江524037
目的:分析糖尿病心肌PTEN 蛋白表达变化及其在糖尿病心肌IPo 中的作用。方法:选取健康成年SD 大鼠,腹腔注射1%链脲佐菌素(STZ)(60mg/kg)诱导糖尿病模型。对照组给予等量的生理盐水。将糖尿病大鼠和非糖尿病大鼠随机分为3组:假手术组(Sham);缺血/再灌注组(IR);缺血后处理组(IPo)。部分亚组糖尿病大鼠在缺血前1h 用PTEN 抑制剂BPV(HOpic)干预后再进行缺血/再灌注损伤实验。免疫组化方法分析心肌PTEN、PI-3K、p-Akt 的表达;TTC 法检测心肌梗死面积;TUNEL 法检测心肌细胞凋亡。比较非糖尿病与糖尿病组及BPV 干预前后糖尿病各组相应指标的变化。结果:IPo明显降低了非糖尿病鼠心肌细胞中PTEN的表达,增加了PI-3K 和p-Akt 的表达,但未能减少PTEN在糖尿病鼠心肌中的表达,相应的PI-3K 和p-Akt 的表达也无明显改变。与N+S 组相比,N+IR 及N+IPo 组的凋亡指数增高(P<0.05)。但是经后处理干预后N+IPo组的凋亡指数低于N+IR 组(P<0.05)。与DM+S组相比,DM+IR及DM+IPo组的凋亡指数增高(P<0.05),但后处理并没有减少糖尿病心肌的凋亡指数。与N+IR 相比,N+IPo的梗死面积减少(P<0.05)。然而,DM+IR组与DM+IPo组的梗死面积无统计学差异(P>0.05)。BPV干预各组的心肌PI-3K 及P-Akt 的表达高于未干预各组(P<0.05)。与未经BPV干预的各组相比,被干预各组的心肌凋亡细胞减少。心肌梗死面积比较BPV干预的各组心肌梗死减少。结论:高血糖导致心肌PTEN 高表达使PI-3K/Akt 信号通路失活,是导致IPo对心肌IRI保护作用丧失的一个重要原因。
糖尿病;缺血再灌注损伤;缺血后处理;PTEN;BPV
有研究发现PTEN(Phosohatase and tensin homologdeleted on chromosometen, PTEN)是PI-3K/Akt信号通路的负性调控因子[1-2]。它起初被发现是一种肿瘤抑制基因。后来越来越多的研究发现它在调节细胞增殖、生长和凋亡中也起到重要作用[3-4]。有研究显示,与非糖尿病大鼠相比,糖尿病大鼠体内PTEN的表达明显增多,并会随着病程的延长增加其表达的程度[5]。增加PTEN的活性会使胰岛素的敏感性下降,并且会增加2型糖尿病的风险[6]。Mensah等人[7]实验证明,通过阿托伐他汀进行IPC,可通过激活PI-3K/Akt信号通路,对非糖尿病大鼠心肌IRI产生保护作用,但对糖尿病大鼠心肌IRI的疗效显著降低,其主要原因是由于PTEN的拮抗作用。Crackower[8]等人通过对PTEN半量表达的PTEN+/-小鼠离体心脏的研究表明,在PTEN+/-的小鼠体内,Akt的活性明显增加,经4周期的预处理PTEN+/-组的心肌梗死面积明显小于6周期预处理的PTEN+/+对照组。因此可以看出PTEN在糖尿病心肌IRI中也扮演着重要的角色。然而关于PTEN 在缺血后处理(Ischemic postconditioning, IPo)的作用机制中发挥着怎样的作用,以及IPo 对糖尿病心肌IRI 保护作用的消失是否与糖尿病心肌中PTEN 高表达有关,现在还不十分清楚。因此,本研究拟探讨糖尿病心肌PTEN 蛋白表达变化及其在糖尿病心肌IPo中的作用。对比IPo对糖尿病和非糖尿病心肌PTEN/PI-3K/Akt信号通路的影响情况,及其对心肌IRI 的改善情况;观察抑制PTEN 的表达是否能改善糖尿病心肌的损伤程度;证明糖尿病心肌PTEN 的高表达是导致心肌IRI 耐受力降低和IPo 保护作用消失的重要原因。
1 材料与方法
1.1材料实验动物:220~280g 成年SD 大鼠130 只,由湖南斯莱克景达实验动物有限公司提供。主要试剂及仪器:SureStep血糖仪、血糖试纸(美国强生公司);Bene View T5型监护仪(西安巨田医疗设备有限公司);DW-2000型动物呼吸机(上海嘉鹏科技有限公司);高精度电子天平(精度0.0001g,上海越平科学仪器有限公司);SHHW21Gr600恒温水浴箱(北京长安科学仪器厂);Olympus显微镜(日本Olympus公司);Olympus BX50显微摄影系统(日本Olympus公司);EPSON-V30扫描仪(日本Epson公司);Image-ProPlus6.0计算机图像分析软件(美国Media Cybernetics);链脲佐菌素(Streptozocin,STZ),美国Sigma公司;戊巴比妥钠(Pentobarbital),美国Sigma公司;伊文氏蓝(Evans blue),美国Sigma公司;三苯基氯化四氮唑(TTC),美国Sigma公司;Bpv(HOpic),瑞士Alexis公司;PTEN单克隆抗体,北京博奥森生物技术有限公司;PI3K(P85α亚型)单克隆抗体,北京博奥森生物技术有限公司;P-Akt(Ser-473)单克隆抗体,北京博奥森生物技术有限公司;免疫组化试剂盒,武汉博士德生物制品有限公司;TUNEL试剂盒,南京建成生物工程研究所。
1.2方法糖尿病大鼠及非糖尿病大鼠模型的建立:220~280g 成年SD 大鼠130只,喂养一周后,随机分为糖尿病组(n=90)和非糖尿病组(n=40),所有大鼠禁食12小时。腹腔注射1%STZ 60mg/kg 诱导糖尿病模型,非糖尿病组的大鼠腹腔注射等量的生理盐水,其余操作同糖尿病组大鼠。72h 后禁食4h,断尾取血测空腹血糖。当血糖浓度≥16.7mmol/L,并且出现多饮、多食、多尿的症状表示糖尿病鼠模型诱导成功。模型成功后监测大鼠血糖和体重,每2周一次。所有大鼠普食喂养8周。8周后进行手术。淘汰标准:①血糖浓度<16.7mmol/L 的大鼠,②饲养过程中死亡的大鼠。
实验分组:造模成功的糖尿病和非糖尿病大鼠随机分为9 组,实验过程中剔除造模未成功和手术过程中死亡的模型,具体实验分组如下:非糖尿病+假手术组(N+S 组):n=9;糖尿病+假手术组(DM+S 组):n=9;非糖尿病+缺血再灌注组(N+IR 组)*:n=15;糖尿病+缺血再灌注组(DM+IR 组)*:n=15;非糖尿病+缺血后处理组(N+IPo组)*:n=15;糖尿病+缺血后处理组(DM+IPo组)*:n=15;糖尿病+假手术组+抑制剂组(B+DM+S 组)*:n=9;糖尿病+缺血再灌注+抑制剂组(B+DM+IR 组)*:n=15;糖尿病+缺血后处理+抑制剂组(B+DM+IPo 组)*:n=15。以上标有“*”的各组中6 个心脏标本用于TTC,另外9 个和非“*”的各组标本全部用于组织包埋。
组织学方法(HE 染色):心脏组织切片放入二甲苯中脱蜡10min,无水酒精洗去二甲苯。经苏木精染色3min,1%盐酸酒精分化20s,1%稀氨水返蓝30s,伊红水溶液复染1min 后完成染色。染色好的玻片经过梯度酒精脱水,二甲苯透明后用中性树胶封片。最后光镜下观察染色结果:细胞核呈兰色, 胞浆呈红色。
PTEN、PI-3K、p-Akt(Ser473)免疫组化测定及TUNEL 法检测心肌细胞凋亡。实验步骤严格按照免疫组化试剂盒说明书进行。
心肌梗死面积检测(TTC 法):参照文献[9]方法进行,用Image-ProPlus6.0图像分析软件勾勒出每片薄片的缺血区、梗死区及总面积,得出的梗死面积百分比。心梗死面积百分比=心肌梗死区面积/心肌缺血区面积×100%。

2 结果
2.1糖尿病大鼠与非糖尿大鼠血糖水平及体重比较两组大鼠在相同的环境下饲养8 周,其中有7 只糖尿病大鼠和1 只非糖尿病大鼠在饲养的过程中死亡,5 只大鼠糖尿病造模未成功,因此予以淘汰。8 周后糖尿病与非糖尿病大鼠在外观形态上已有明显区别。糖尿病大鼠毛色暗黄、精神欠佳、行动迟缓、体型明显小于非糖尿病大鼠,并表现出多饮、多食、多尿的症状。非糖尿病大鼠体重明显增加,毛色亮白,行动灵敏且活跃。饲养8 周后的糖尿病大鼠平均体重为(257.30±47.68)g,4h 平均空腹血糖为(27.17±3.36)mmol/L;非糖尿病大鼠平均体重为(476.46±23.45)g,4h 平均空腹血糖为(3.77±0.33)mmol/L。两组大鼠的平均体重及平均空腹血糖浓度差异有统计学意义(P<0.05),具有可比性。2.2心肌组织病理学变化HE 染色后光镜下观察,N+S 组大鼠的心肌细胞排整齐有序,结构清晰,细胞颜色均匀,无细胞变性、坏死;DM+S 组大鼠的心肌细胞表现出轻度肿胀,排列紊乱,肌原纤维断裂,并有炎性细胞浸润,部分心肌中出现少量脂肪颗粒;N+IR组大鼠的心肌细胞明显肿胀,并有局灶性的出血、坏死,坏死灶周围多伴有大量炎性细胞浸润。N+IPo 组大鼠的心肌细胞虽也有肿胀、局灶性变性、坏死及炎性细胞浸润,但程度稍轻于N+IR 组;DM+IR 组及DM+IPo 组大鼠心肌的损伤程度明显高于其它各组。心肌细胞明显水肿,排列严重紊乱,大量变性、坏死,肌纤维严重断裂,部分心肌细胞出现脂肪颗粒,间质充血水肿并伴有大量炎性细胞浸润,两组大鼠间心肌的病理变化形态学显差异。见图1。

2.3各组心肌细胞中PTEN、PI-3K、p-Akt(Ser473)的表达情况与非糖尿病各组相比,未用抑制剂的糖尿病各组PTEN的表达明显增高差异具有统计学意义(P<0.05)。IPo 明显降低了非糖尿病鼠心肌细胞中PTEN 的表达,并增加了PI-3K和p-Akt 的表达差异具有统计学意义(P<0.05),但未能减少PTEN 在糖尿病鼠心肌中的表达,相应PI-3K 和p-Akt 的表达也无统计学差异(P>0.05)。由此可以看出,糖尿病心肌PTEN 的表达明显高于非糖尿病心肌;PI-3K/Akt 信号通路在IPo 的非糖尿病心肌中被激活,而在糖尿病心肌中处于被抑制状态。见表1。


分组PTENPI-3KP-AktN+S0.101±0.0100.076±0.0200.65±0.020DM+S0.129±0.0130.104±0.0260.102±0.017N+IR0.148±0.023*0.112±0.020*0.115±0.021*DM+IR0.169±0.009☆0.085±0.018☆0.085±0.021☆N+IPo0.134±0.024#0.142±0.027#0.137±0.020#DM+IPo0.160±0.0110.084±0.0120.096±0.164
注:与N+S 相比,*P<0.05;与N+IR 组相比,#P<0.05;与DM+S 组相比,☆P<0.05。
2.4心肌细胞凋亡指数与N+S 组相比,N+IR 及N+IPo 组的凋亡指数增高具有统计学意义(P<0.05),但是经后处理干预后N+IPo 组的凋亡指数低于N+IR组,差异具有统计学意义(P<0.05)。与DM+S 组相比DM+IR及DM+IPo组的凋亡指数明显增高,差异具有统计学意义(P<0.05),但与非糖尿病组相反,后处理并没有减少糖尿病IRI的凋亡指数差异无统计学意义(P>0.05),由此可见,IPo 并没有改善IRI 所致的糖尿病心肌细胞凋亡的情况。见表2。2.5心肌梗死面积比较与N+IR 相组比,N+IPo组的梗死面积明显减少,差异具有统计学意义(P<0.05),说明IPo 可以明显减少非糖尿病鼠心肌缺血/再灌注后的梗死面积。然而IPo 却未能减少糖尿病鼠心肌的心梗面积,DM+IR 组与DM+IPo 组的心肌梗死面积无统计学差异(P>0.05)。见表2。

表2 糖尿病(无BPV 干预)和非糖尿病各组凋亡指数和心梗面积的比较 ±s)
注:与N+S 组相比,☆P<0.05;与DM+S 组相比,#P<0.05;与N+IR 组相比,*P<0.05。
2.6糖尿病BPV干预组及无干预组实验结果的比较,B+DM+IR 组及B+DM+IPo 组大鼠心肌细胞比未经抑制剂干预组大鼠的心肌细胞的损伤程度均有所改善。虽然也有细胞水肿,坏死,心肌纤维断裂、排列紊乱。但程度略轻于未经BPV 干预组。还观察到炎性细胞也相对减少。见图2。经过BPV 干预后,B+DM+S 组中有5 例(占该组的56%),B+DM+IR 组中有6 例(占该组的67%)B+DM+IPo 组中有4例(占该组的44%)PTEN 表达在细胞核,胞浆中几乎没有什么表达。而未经BPV干预的各组PTEN 均表达在胞浆。见图3。


BPV干预各组的心肌PI-3K及P-Akt的表达明显高于未干预各组,差异具有统计学意义(P<0.05)。BPV干预后的缺血/再灌注组与后处理组之间无统计学差异(P>0.05)。但在B+DM+S 组心肌PI-3K 及P-Akt 的表达还是高于这两组。从这一结果可以看出,BPV 对PTEN功能的抑制作用可明显增加PI-3K、P-Akt 的表达;BPV干预后的各组PI-3K 和P-Akt的表达仍然维持原有的趋势,所以BPV 可能并没有完全阻断PTEN 的作用。见表3。


分组PI-3KP-AktDM+S0.106±0.0200.105±0.020DM+IR0.074±0.026*0.082±0.017*DM+IPo0.072±0.020*0.075±0.021*B+DM+S0.175±0.018#0.178±0.021☆B+DM+IR0.148±0.027△0.153±0.020#B+DM+IPo0.144±0.012△0.146±0.164△
注:与DM+S组相比,#P<0.05;与标有“*”的组相比,△P<0.05。
与未经BPV 干预的各组相比,被干预各组的心肌凋亡细胞明显减少(P<0.05)。 B+DM+IR 与B+DM+IPo 组相比凋亡指数无明显区别(P>0.05)。B+DM+S 组的凋亡指数明显低于其他各组。见表4。
表4糖尿病BPV干预和未干预各组细胞凋亡指数、心肌梗死面积比较
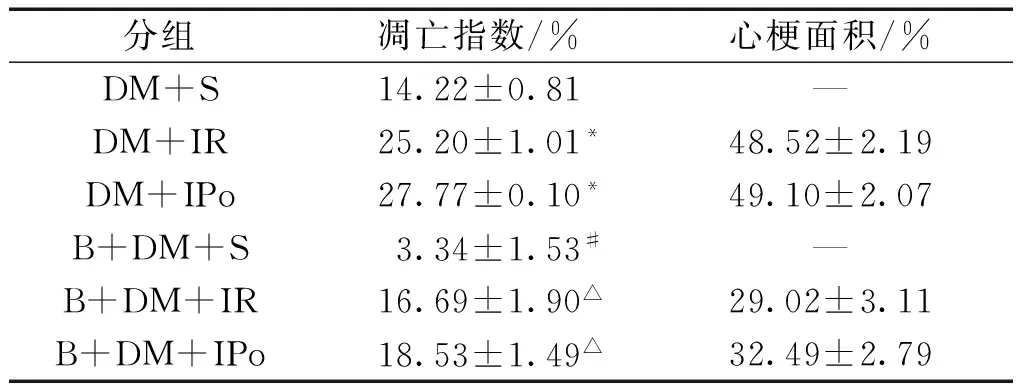
分组凋亡指数/%心梗面积/%DM+S14.22±0.81—DM+IR25.20±1.01*48.52±2.19DM+IPo27.77±0.10*49.10±2.07B+DM+S3.34±1.53#—B+DM+IR16.69±1.90△29.02±3.11B+DM+IPo18.53±1.49△32.49±2.79
注:与DM+S 相比,#P<0.05;与标有“*”的组相比,△P<0.05。
BPV 干预的各组心肌梗死面积明显减少(P<0.05)。而BPV干预的两组之间的心肌梗死面积无明显区别。见表4。
3 讨论
研究发现,支配缺血心肌的血管如果再通后反而会对缺血心肌造成再次损伤,即心肌缺血再灌注损伤(ischemia-reperfusion injury, IRI),这反而加重了心肌细胞的凋亡和坏死,是再灌注的血液对缺血心肌造成的一种不可逆损伤[9]。糖尿病患者对这种损伤的敏感程度更为明显。临床研究显示,在心肌缺血再灌注治疗后,有30~70%的糖尿病患者比非糖尿病患者的心肌梗死面积大[10],与实验结果一致。与非糖尿病大鼠相比,缺血再灌注对糖尿病大鼠心肌的损害程度更明显。促使糖尿病心肌IRI加重一个重要原因就是PI-3K/Akt信号通路的失活[11]。糖尿病不但会使心肌细胞缺血再灌注后的损伤程度更加严重,还会使其保护性干预(IPo、IPC等)的效果减弱或消失[12]。缺血后处理(Ischemic postconditioning,IPo)是一种通过激发机体内源性保护机制来对抗心肌IRI的方法。由于它操作简便且效果显著,现在已被越来越频繁地应用于临床治疗。在IPo的作用机制中,PI-3K/Akt信号通路的激活发挥着重要的作用。然而有研究认为,IPo对糖尿病患者心肌IRI的保护作用明显很弱,甚至消失。这可能与糖尿病患者的血糖水平相关[13]。本研究的结果和Ferdinandy都认为PI-3K/Akt信号转导通路功能障碍是IPo对糖尿病患者保护效应丧失的原因[14]。除此之外本研究还发现,PTEN的高表达是导致PI-3K/Akt信号转导通路功能障碍,进而使心肌对IRI耐受力降低和对IPO保护作用敏感性降低的重要原因。
10号染色体缺失的磷酸酶及张力蛋白同源物(Phosphatase and tensin homolog deleted on chromosome ten, PTEN)是PI-3K/Akt信号通路的负性调控因子,它最早是作为一种抑癌基因在1997年被发现的。其转录产物是一种膜结合型脂质磷酸酶,作为肿瘤抑制因子在多种系统中下调PIP3的表达,并在胚胎发育、细胞生长、分化、凋亡和迁移的调控中发挥重要的作用。PTEN具有PI-3K活性,能拮抗PI-3K的作用,通过催化PIP3的3位脱磷酸下调PIP3的水平。然而在心肌细胞中PI-3K/PTEN传导系统无论在空间结构及功能上均能相互制约。有研究发现[25],缺血缺氧可导致神经细胞中PTEN的表达增高,并导致一定程度的神经损伤,而抑制PTEN的表达可产生明显的神经保护作用。因此我们可以看出,PTEN在IRI中也扮演着重要角色。
本研究发现,在非糖尿病模型中,缺血/再灌注虽然能激活PTEN/PI-3K/Akt信号通路而产生心肌损伤,但IPo可通过拮抗PTEN/PI-3K/Akt信号通路,改善心肌IRI的情况。在糖尿病模型中,PTEN在心肌中的表达高于非糖尿病组(P<0.05);IPo对PTEN/PI-3K/Akt信号通路并没有表现出抑制作用,PTEN在糖尿病心肌中依然呈现出高表达的状态,心肌IRI的情况也没有得到改善。因此我们设想,PTEN的持续高表达就是导致糖尿病心肌对IPo敏感性降低的重要原因,抑制糖尿病心肌中PTEN蛋白的活性有助于恢复糖尿病心肌对IPo的敏感性。
PTEN普遍存在于正常细胞中,其表达的程度和活性取决于它在细胞中的水平及其与其它蛋白或脂质的相互作用。有人认为PTEN磷酸化后会产生与之前相反的作用。BPV(HOpic)是PTEN特异性的抑制剂,它是一种钒的化合物,它的主要作用是结合到PTEN酪氨酸的磷酸位点上,使PTEN磷酸化。从而恢复PI-3K/Akt信号通路的活性。Keyes等[9]人研究了BPV(HOpic)在心肌缺血再灌注大鼠模型中抑制PTEN的最佳时间点和最佳剂量,发现在缺血前1h静脉注射BPV1mg/kg可以最大限度的抑制PTEN在心肌中的表达。笔者在糖尿病模型上使用了相同的方法,发现抑制PTEN的表达可以重新恢复PI-3K/Akt信号通路的活性,并且减少心梗面积和心肌细胞的凋亡。因此笔者认为,糖尿病心肌中PTEN的高表达是导致心肌IRI损伤及IPo作用丧失的重要原因。在实验中笔者还意外的发现,经抑制剂干预后的糖尿病心肌,PTEN蛋白有明显向细胞核内转移的趋势。然而这一现象的产生是否与其产生的心肌保护作用有关,还有待进一步的研究。
本实验通过对比IPo对正常大鼠和糖尿病大鼠心肌缺血/再灌注的保护作用,发现经IPo干预后的糖尿病心肌PTEN仍然持续高表达,糖尿病状态下心肌对IPo敏感性降低与PTEN增高所导致的PI-3K/Akt信号通路失活有关,抑制心肌PTEN的活性可恢复糖尿病心肌对IPo的敏感性。探讨PTEN在糖尿病心肌IPo中的作用和机制为进一步研究糖尿病心肌缺血再灌注损伤及缺血后处理的相关机制提供了理论依据。
[1]Smith K B, Tran L M, Tam B M, et al. Novel Dedifferentiated Liposarcoma Xenograft Models Reveal PTEN Down-Regulation as a Malignant Signature and Response to PI3K Pathway Inhibition[J]. Am J Pathol,2013.
[2]Jang H D, Noh J Y, Shin J H, et al. PTEN regulation by the Akt/GSK-3beta axis during RANKL signaling[J]. Bone,2013.
[3]Moon S H, Kim D K, Cha Y, et al. PI3K/Akt and Stat3 signaling regulated by PTEN control of the cancer stem cell population, proliferation and senescence in a glioblastoma cell line[J]. Int J Oncol,2013,42(3):921-928.
[4]Luo L, Gong Y Q, Qi X, et al. Effect of tumor suppressor PTEN gene on apoptosis and cell cycle of human airway smooth muscle cells[J]. Mol Cell Biochem,2013,375(1-2):1-9.
[5]Wang B, Raedschelders K, Shravah J, et al. Differences in myocardial PTEN expression and Akt signalling in type 2 diabetic and nondiabetic patients undergoing coronary bypass surgery[J]. Clin Endocrinol (Oxf),2011,74(6):705-713.
[6]Buja L M. Myocardial ischemia and reperfusion injury[J]. Cardiovasc Pathol,2005,14(4): 170-175.
[7]Mensah K, Mocanu M M, Yellon D M. Failure to protect the myocardium against ischemia/reperfusion injury after chronic atorvastatin treatment is recaptured by acute atorvastatin treatment: a potential role for phosphatase and tensin homolog deleted on chromosome ten[J]. J Am Coll Cardiol,2005,45(8):1287-1291.
[8]Crackower MA. Regulation of myocardial contractility and cell size by distinct PI3K-PTEN signaling pathways.Cell, 2002, 110(6):737-749.
[9]Domanski M J, Mahaffey K, Hasselblad V, et al. Association of myocardial enzyme elevation and survival following coronary artery bypass graft surgery[J]. JAMA,2011,305(6):585-591.
[10]Marso S P, Miller T, Rutherford B D, et al. Comparison of myocardial reperfusion in patients undergoing percutaneous coronary intervention in ST-segment elevation acute myocardial infarction with versus without diabetes mellitus (from the EMERALD Trial)[J]. Am J Cardiol,2007,100(2):206-210.
[11]Wu Y, Xia ZY, Dou J, et al. Protective effect of ginsenoside Rb1 against myocardial ischemia/reperfusion injury in streptozotocin-induced diabetic rats[J]. Molecular Biology Rep, 2011, 38(7): 4327-4335.
[12]Ren J Y, Song J X, Lu M Y, et al. Cardioprotection by ischemic postconditioning is lost in isolated perfused heart from diabetic rats: Involvement of transient receptor potential vanilloid 1, calcitonin gene-related peptide and substance P[J]. Regul Pept,2011,169(1-3): 49-57.
[13]Miki T, Itoh T, Sunaga D, et al. Effects of diabetes on myocardial infarct size and cardioprotection by preconditioning and postconditioning[J]. Cardiovasc Diabetol,2012,11:67.
[14]Ferdinandy P, Schulz R, Baxter G F. Interaction of cardiovascular risk factors with myocardial ischemia/reperfusion injury, preconditioning, and postconditioning[J]. Pharmacol Rev,2007, 59(4):418-458.
[15]Howitt J, Lackovic J, Low L H, et al. Ndfip1 regulates nuclear Pten import in vivo to promote neuronal survival following cerebral ischemia[J]. J Cell Biol,2012,196(1):29-36.
(编辑:梁志庆)
To investigate the changes of PTEN protein expression in diabetic myocardium and its effect on IPo in diabetic myocardium
LIANG DexianLI QingjunCHEN Kangrong
Cardiovascular department of internal medicine, Zhanjiang People′s Central Hospital,ZhanJiang 524037,China
Objective Explore the expression of PTEN protein in diabetic myocardium and the role of PTEN protein in IPo of the diabetes myocardial.Method This experiment used healthy adult male SD rats .The diabetic model was induced by intraperitoneal injection of 1% streptozotocin(STZ) (60mg/kg). The control group was given equivalent liposomes saline.The changes of blood glucose and body weight were measured after 8 week.The diabetes and non-diabetic rats were randomly divided into 3 groups: sham operated group(S); ischemia reperfusion group(IR); ischemic postconditioning group(IPo).Some of diabetes rats are first intervene by PTEN inhibitors 1 hours before ischemia.Immunohistochemical method was for the determination of PTEN, PI-3K,P-Akt expression.Infarct size was assessed by triphenyl-tetrazolium-chloride (TTC) staining. Cardiomyocyte apoptosis was detected by TUNEL method.After the experiment, measure compare and analyse the changes of the relevant indicators.Result IPO significantly reduced the expression of PTEN in non diabetic rat myocardial cells, increased PI-3K and p-Akt expression, but can not decrease the expression of PTEN in the myocardium of diabetic rats and corresponding PI-3K and p-Akt expression no obvious change. Compared with the N+S group, the apoptotic index of N+IR and N+IPo group were significantly higher (P<0.05). However, the apoptotic index of N+IPo group was significantly lower than that of N+IR group (P<0.05). Compared with the DM+IR group, the apoptotic index of DM+S and DM+IPo groups was significantly higher (P<0.05), but the latter did not reduce the myocardial apoptosis index of diabetic patients. Compared with N+IPo, the infarct size of N+IR was significantly decreased (P<0.05). However, there was no significant difference in infarct size between DM+IR group and DM+IPo group (P>0.05). The expression of PI-3K and P-Akt in the myocardium of BPV intervention group were significantly higher than those in the intervention group. Compared with the untreated group, the apoptotic cells were significantly decreased in the groups of BPV. Myocardial infarct size was significantly reduced in all groups of BPV intervention.Conclusion The high expression of myocardial PTEN caused by high blood sugar is an important factor to cause the inactivate PI-3K/Akt signaling pathway and lead to the declined protection of IPo on myocardial IRI.
Diabetes; Ischemia-reperfusion Injury;Ischemic Postconditioning; PTEN; BPV
2016-05-11
湛江市科技攻关计划项目,NO:2013B01031。
梁德贤(1971-),本科,研究方向为心血管疾病的诊疗。E-mail:fhq000@126.com
R587.1
A
1007-8517(2016)17-0032-05

