制药企业新增药品包装用铝箔供应商的管理
北京北大维信生物科技有限公司(100094)王晓峰 齐红 李轶
在我厂产品质量回顾中,识别了“药品包装用铝箔”的供应商仅有1家,为降低采购风险,保证生产,拟增加“药品包装用铝箔”的供应商。《供应商管理规程》管理情况包括以下三个方面:①对供应商的资质、基本情况、质量保障情况进行审计,由质量管理部批准是否作为备选供应商;②对于供应商运输服务情况、到货情况、产品检验合格情况进行评估,确定是否作为供应商;③将供应商的资质、质量/环境/职业健康安全协议、质量标准、药品检验数据和报告、供应商的检验报告整理成《供应商质量档案》,归档于质量管理部。
根据上述规定,质量管理部、生产部、物料管理部以风险管理的方法,识别新增包装材料供应商的风险,制定了新增包材供应商计划,并向质量管理部申请变更,由质量管理部和质量管理负责人审核批准后,执行新增包装材料的变更计划。
1 新增供应商质量风险因素确认
根据GMP“质量风险管理”的规定:采用前瞻方式对新增供应商的质量风险进行识别,进而进行评估,根据评估的风险等级进行控制。
1.1 质量风险识别 经识别,此过程包括如下风险,详见附表1。
1.2 质量风险评估 经过评估,风险按照高低等级排列如下。详见附表2。
1.3 质量风险管理措施 按照公司供应商管理规定要求,以及上述风险识别和分析,此次新增包装材料供应商应采取以下管理方案和措施,对参评的2家供应商进行评审,简称供应商A、B。详见附表3。

附表1 质量风险因素确认表
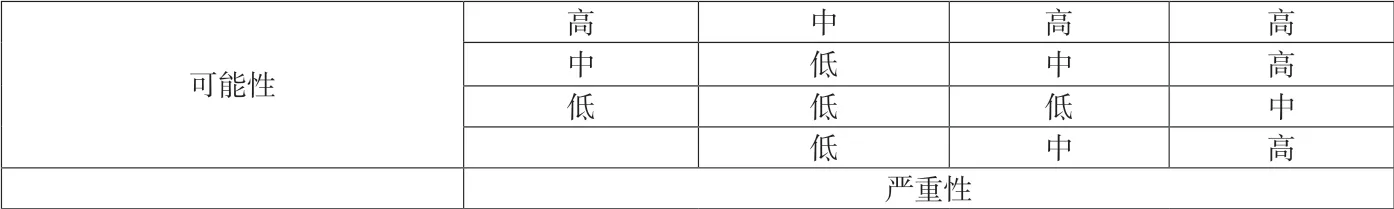
附表2 风险排列和过滤矩阵

严重性 可能性 风险评价供应商风险 高 中 高上机风险 高 中 高操作风险 中 中 中药品稳定性风险 高 低 中法规风险 低 低 低
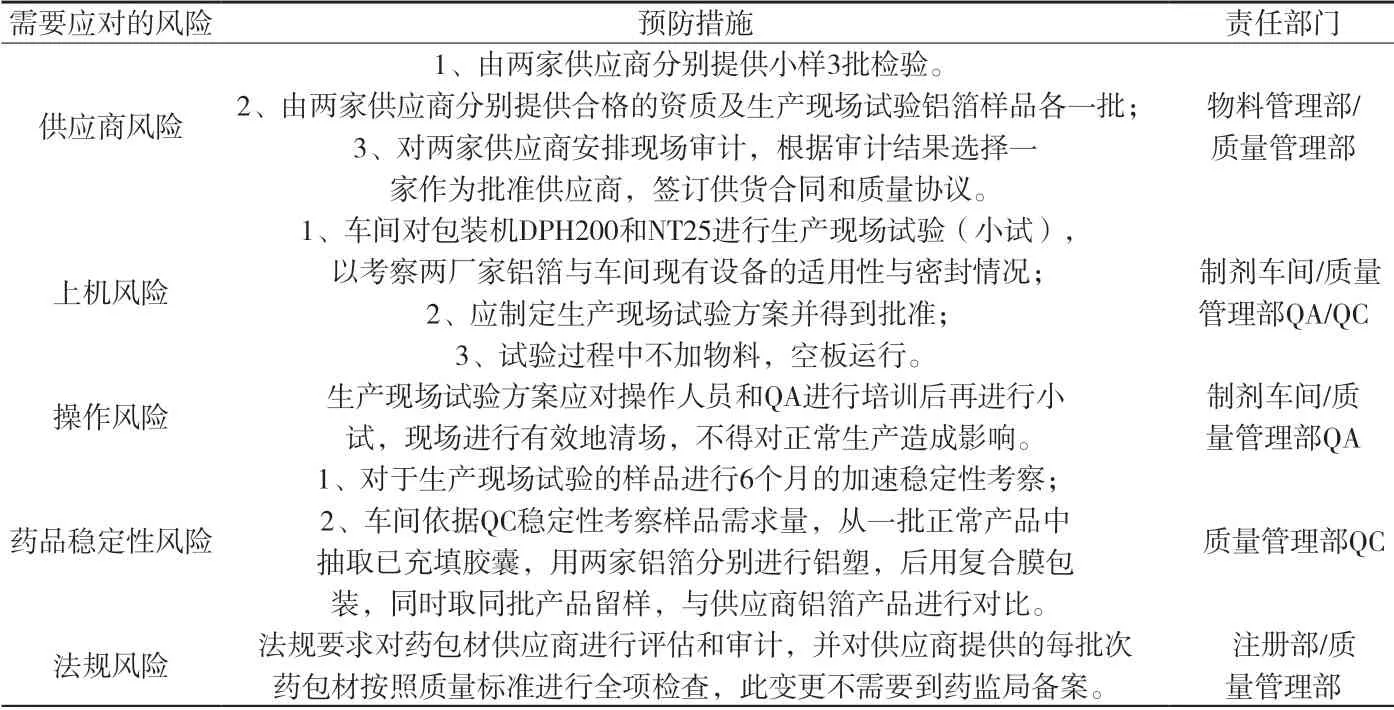
附表3 风险应对措施及评价表
2 新增包材供应商质量风险管理措施的执行情况
2.1 供应商管理
2.1.1 QC小样检验 由2个供应商分别提供小样3批,QC按照质量标准进行全项检查结果如下,两家检验均无问题,详见附表4。
2.1.2 厂家提供合格现场试验产品、厂家资质 由两家供应商分别提供合格的资质及生产现场试验铝箔样品各一批。详见附表5。
2.1.3 现场审计 对两家供应商安排现场审计,根据审计结果选择一家作为批准供应商,签订供货合同和质量协议。经审计供应商B的铝箔生产工艺与我公司设备要求不符合,因此选择供应商A为暂定供货商进行后续试验,如供应商A在后续试验中不合格,则重新选择2家供应商进行评估。详见附表6。
2.2 铝箔上机管理 车间对铝塑包装机DPH200和NT25分别进行供应商A铝箔的生产现场试验(小试),以考察铝箔与车间现有设备的适用性与密封情况,结果如下,详见附表7。

附表4 小样检验情况

附表5 试验产品、供应商资质情况
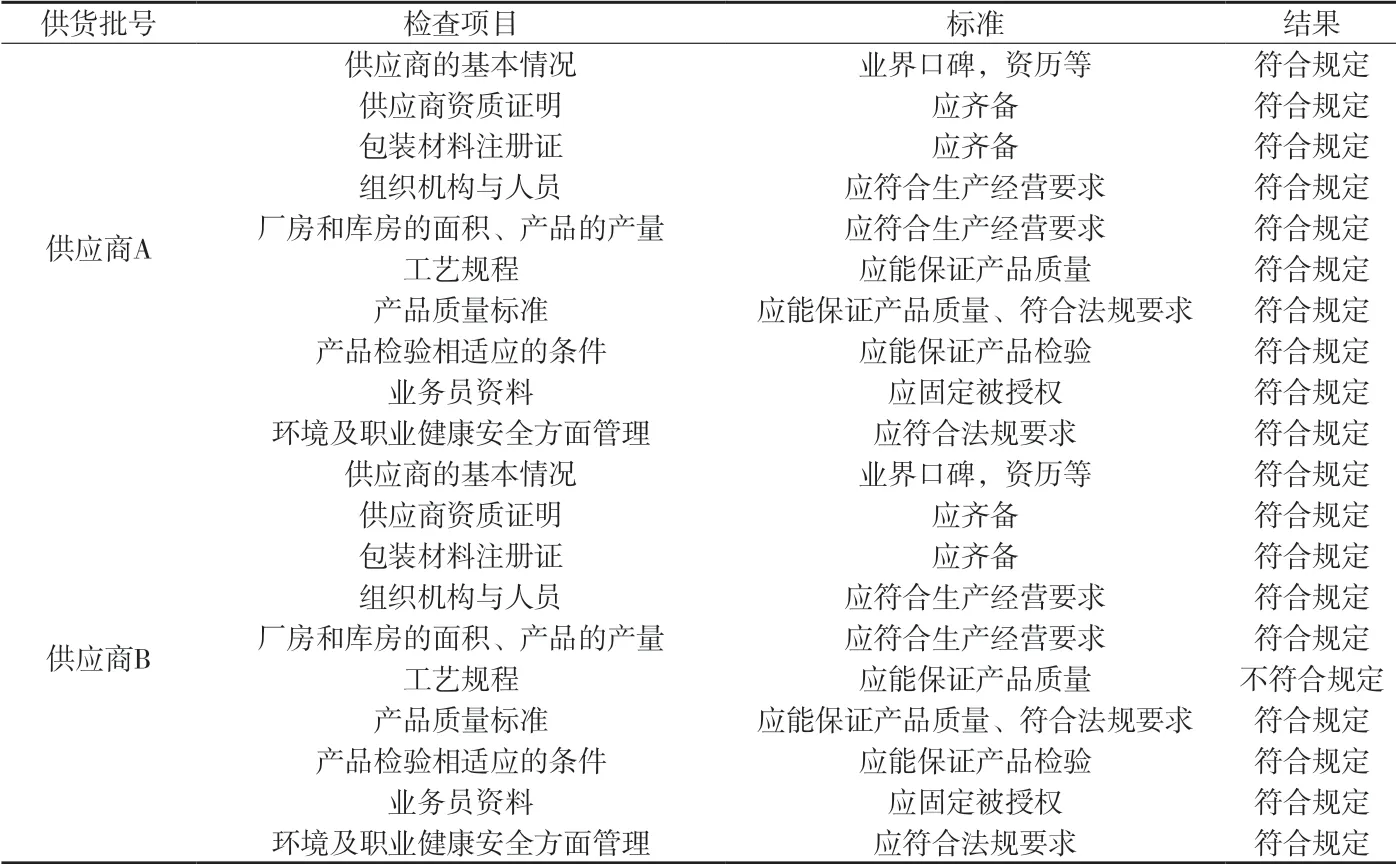
附表6 供应商审计情况

附表7 供应商A现场试验情况
2.3 现场操作管理 生产现场试验方案应对操作人员和QA进行培训后再进行小试,现场进行有效地清场,未对正常生产造成影响。
2.4 QC稳定性考察管理 对于生产现场试验的样品进行6个月的加速稳定性考察:性状、鉴别、装量差异、微生物限度检查均符合规定。崩解时限均为8分钟;水分最低4.6%,最高5.6%,RSD值5%;指纹图谱相对保留时间均为0.52,相似度最低0.96,最高0.98,供应商A与原供应商5次检验结果一致;洛伐他汀含量最低3.1mg/粒,最高3.5mg/粒,RSD值3.1%。崩解时限、水分、指纹图谱、洛伐他汀含量均符合规定。说明新增铝箔供应商提供的铝箔与原铝箔生产的产品在加速稳定性试验条件下(温度40℃±2℃、相对湿度≤75%±5%)贮存,6个月内均质量稳定合格,无显著差异。
2.5 法规风险控制管理 法规要求对药包材供应商进行评估和审计,并对供应商提供的每批次药包材按照质量标准进行全项检查,此变更不需要到药监局备案。
3 结果
根据上述措施结果,确定供应商A为新增药品包装用铝箔的供应商,并进行后续文件管理。
3.1 文件管理 铝箔新增供应商批准后修订《药品包装用铝箔质量标准》及《合格供应商列表》。
4 结论
经过我厂质量管理部QA的供应商审计、质量管理部QC的3批小量样品的全项检查,生产车间的药品包装用铝箔适用性检查,质量管理部QC的包装后药品的稳定性考察,以及修订相关的文件,共历时约1年,完成了整个新增药品包装用铝箔供应商的管理过程。将供应商风险、机器配合性风险、药品稳定性风险、法规风险降至可接受的水平,保证了我厂药品的质量。

