QuEChERS-超高效液相色谱-串联质谱法测定云南野生菌中甲拌磷及其代谢物
林 涛,樊建麟,魏茂琼,杨东顺,刘兴勇,李彦刚,刘宏程*
(1.云南省农业科学院质量标准与检测技术研究所,云南昆明 650223;2.农业部农产品质量安全风险评估实验室(昆明),云南昆明 650223)
野生菌因其营养丰富、味道鲜美而受到了国内外消费者的喜爱,但食用菌易长虫,储藏时间短,而在食用菌上喷洒杀虫剂、防腐剂等可以延长货架期。目前,食用菌中检出农药的现象时有发生[1]。甲拌磷(Phorate)属高毒农药,是目前在食用菌中常检出的杀虫剂之一,过量摄入后会导致神经系统紊乱,呼吸衰竭等危险[2]。甲拌磷在自然条件下经过氧化反应后会生成毒性更大的甲拌磷砜(Phorate Sulfone)和甲拌磷亚砜(Phorat-sulfoxide)[3]。甲拌磷及其代谢物的测定通常采用气相色谱[4]和气-质联用[5,6]的方法,但是这些方法的前处理复杂、分析时间较长,不利于甲拌磷及其代谢物的快速筛查。近年来,超高效液相色谱-串联质谱法因其快速方便、前处理简单而广泛应用于甲拌磷的快速筛查中[7,8],但是目前还没有野生菌中甲拌磷及其代谢物等的快速测定方法。
目前,云南野生菌中还未出现甲拌磷检出的情况,但野生菌常生长在树丛中,周围通常都会种植经济植物,其在种植过程中使用的农药可能会随着雨水、风等自然作用而迁移至野生菌上;另一方面,野生菌的基质比常规食用菌复杂,甲拌磷在野生菌的复杂基质中可能会快速转化成代谢物而不易检出,而目前对于有机磷农药的检测标准中都未对甲拌磷的代谢物进行规定。因此,建立野生菌中甲拌磷及其代谢物的超高效液相色谱-串联质谱检测方法十分重要。
本实验选取松茸、牛肝菌和鸡枞等典型的云南野生菌为研究对象,优化了QuEChERS法,结合质谱理论研究了甲拌磷及其代谢物的断裂机理,利用超高效液相色谱-串联质谱,建立快速准确的云南野生菌中甲拌磷及其代谢物的测定方法。可为云南野生菌中高毒农药的测定提供理论依据,也为云南野生菌的顺利出口提供技术支持。
1 实验部分
1.1 主要仪器与试剂
API4000三重四极杆质谱仪(美国,AB公司);1290超高效液相色谱仪(美国,Agilent公司);AE100电子分析天平(瑞士,Mettler Toledo公司);TGL-15B高速台式离心机(上海安亭科学仪器厂);涡旋振荡器(美国,Thermo Scientific公司)。
甲拌磷、甲拌磷砜、甲拌磷亚砜标准溶液(100 μg/mL,1 mL,中国百灵威科技)。分别将甲拌磷、甲拌磷砜和甲拌磷亚砜标准溶液,用甲醇稀释成10 μg/mL的标准储备液。准确吸取1 mL各标准储备液于10 mL容量瓶,用甲醇定容得到1 μg/mL的甲拌磷及其代谢物的混合标准溶液,-20 ℃下避光保存。无水MgSO4、NaCl、NH4Ac(分析纯,国药集团化学试剂北京有限公司);HAc(色谱纯,美国Fluka公司);甲醇、乙腈(色谱纯,德国Merck公司);ProElut PSA、NH2、C18、Florisil填料(50 μm,中国迪马科技)。纯净水(杭州娃哈哈公司)。
1.2 实验方法
1.2.1样品提取与净化在50 mL离心管中,准确称取经食品粉碎机粉碎混匀后的野生菌样品10 g,加入20 mL的1% HAc-乙腈,1 g NaCl和4 g无水MgSO4,涡旋提取5 min后5 000 r/min下离心3 min,取上清液2 mL于预先加入60 mg PSA和50 mg无水MgSO4的离心管中,涡旋提取15 s,取上层提取液过0.22 μm滤膜,待分析。
1.2.2仪器条件色谱条件:Agilent ZORBAX RRHD色谱柱(50×2.1 mm,1.8 μm);流动相A为甲醇,流动相B为1 mmol/L NH4Ac水溶液(含0.1%甲酸)。梯度洗脱条件:0~5.00 min,20%~90%A;5.00~6.00 min,90%A;6.00~6.10 min,90%~20%A;6.10~7.00 min,20%A。流速:0.2 mL/min;柱温:35 ℃;进样体积:1 μL。质谱条件:ESI源,气帘气流速为20 L/min,雾化气流速为55 L/min,辅助气流速为55 L/min,辅助加热气温度为550 ℃,喷雾电压为5 500 V,正离子多反应监测模式(MRM)检测。
1.2.3定性和定量测定在上述相同的色谱和质谱条件下进行样品测定时,当检出的色谱峰与标准品保留时间一致时,所选择的离子均出现,而且所选择的离子丰度比与标准品的离子丰度比相一致时(相对丰度>50%时,允许±20%偏差;相对丰度>20%~50%时,允许±25%偏差;相对丰度>10%~20%时,允许±30%偏差;相对丰度≤10%时,允许±50%偏差),则可判断野生菌样品中存在甲拌磷及其代谢物。定量测定时采用外标法进行。
2 结果与分析
2.1 质谱和色谱条件的优化
将甲拌磷及其代谢物的标准溶液稀释至适当的浓度,利用针泵进样,分别进行一级质谱及二级质谱的扫描,确定其母离子和子离子,并优化其解簇电压(DP)和碰撞能量(CE),以达到最大的响应值。甲拌磷及其代谢物的监测离子对及相关电压如表1所示。
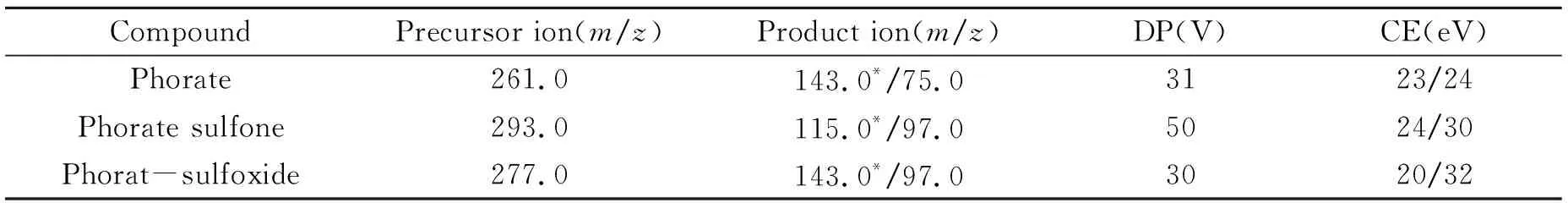
表1 甲拌磷及其代谢物的监测离子对及相关电压
* Quantitative ion.
实验中首先采用甲醇-水作为流动相,发现甲拌磷及其代谢物的峰形不太对称,当在水相中加入1 mmol/L 的NH4Ac(含0.1%的甲酸)后,甲拌磷及其代谢物的峰形变得对称且较之前响应值明显增大,分析原因可能为甲酸的加入可以使溶液环境中的H+增多,促进目标化合物带正电荷,同时NH4Ac的加入也可抑制[M+Na]+而促进[M+H]+的产生,提高化合物的离子化效率,利于二级碎片的产生;同时NH4Ac的加入也在一定程度上调节了流动相环境中的离子强度,使色谱峰形更对称,从而提高了色谱峰的响应值,甲拌磷及其代谢物的色谱图如图1所示。
2.2 子离子断裂方式推导
甲拌磷和甲拌磷亚砜的结构中都含有C-S键,且甲拌磷亚砜比甲拌磷在结构上多了一个S=O,因此在ESI源的碰撞电压作用下,甲拌磷和甲拌磷亚砜中共有的C-S键断裂而生成共同的m/z143.95的二级碎片;同时,甲拌磷亚砜和甲拌磷砜中都含有S-C键和P-O键等不稳定的化学键,在碰撞电压的作用下,甲拌磷亚砜和甲拌磷砜中共有的S-C键和P-O键断裂,因而都产生了m/z96.93的二级碎片,可能的断裂方式推导如图2所示。
2.3 QuEChERS的优化
2.3.1提取溶剂酸性的选择实验中比较了乙腈与1% HAc-乙腈作为提取溶剂的不同效果,如图3所示,乙腈对于甲拌磷及其代谢物的提取效果较差,当在乙腈中加入1%的HAc后,提取率明显上升,表明甲拌磷及其代谢物在溶液中呈现出一定的酸性,根据相似相溶的原理,酸性乙腈能够充分的溶解甲拌磷及其代谢物,从而提高了提取效率。因此,本实验中选择1%HAc-乙腈作为甲拌磷及代谢物的提取溶剂。
2.3.2净化填料的选择实验中比较了PSA、NH2、C18和Florisil对于野生菌中甲拌磷及其代谢物的不同净化效果,如图4所示。结果表明,4种填料对于甲拌磷砜的提取效果都较好。对于甲拌磷亚砜,除C18的提取效果较差,其余3种的提取效果较好;而对于甲拌磷,只有PSA的提取效果较好,能够达到70%以上。综合考虑,选择PSA作为野生菌中甲拌磷及其代谢物的净化填料。
2.3.3净化填料加入量的选择比较了不同PSA的加入量对于甲拌磷及其代谢物提取效果的影响,如图5所示。结果表明,不同的PSA加入量对于甲拌磷和甲拌磷亚砜的提取效果影响不大,但是对于甲拌磷砜的影响较大,当加入量较少时,不能完全吸附干扰的杂质而存在一定的基质增强效应,而当加入量过多时,又会对目标化合物具有一定程度的吸附,从而影响了提取效率。综合考虑,选择PSA的加入量为60 mg为最佳。
2.3.4无水MgSO4加入量的选择本实验中还分别比较了分别加入50、100、200、300、400 mg无水MgSO4时对于野生菌中甲拌磷及其代谢物提取效果的影响。结果表明,不同无水MgSO4加入量对于甲拌磷的提取效果相差不大,因此选择无水MgSO4的加入量为50 mg,以节省试剂。
2.4 野生菌样品中甲拌磷及其代谢物的定量方法
2.4.1线性范围、检出限和定量限分别将甲拌磷及其代谢物的标准溶液利用甲醇稀释成不同的浓度,以峰面积对其各自的浓度进行线性范围的考察;利用野生菌的空白基质,通过甲拌磷及其代谢物标准添加的方法,以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)分别确定检出限和定量限。如表2所示,甲拌磷及其代谢的相关系数较好,且检出限较低,满足日常检测中对于农药残留分析的要求。
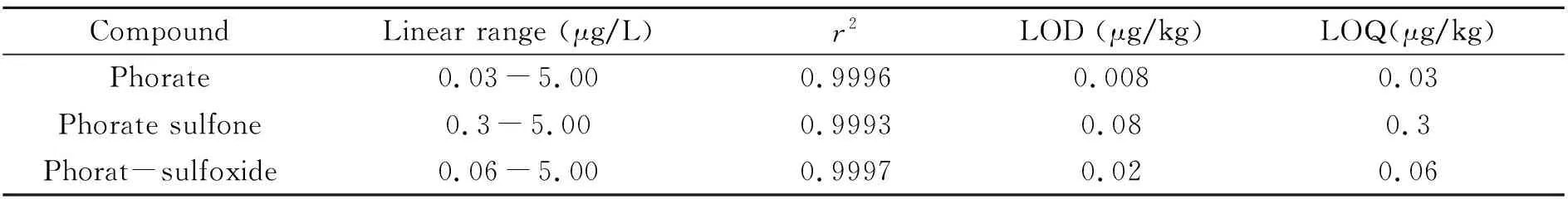
表2 甲拌磷及其代谢物的线性范围、相关系数(r2)、检出限和定量限
2.4.2方法的精密度和准确度本实验中分别以松茸、牛肝菌和鸡枞作为实验对象,分别以1倍、5倍和10 倍定量限作为3个添加浓度进行回收试验,每个浓度做6次平行试验。结果如表3所示,甲拌磷及其代谢物的平均回收率范围为73.3%~98.5%,相对标准偏差范围为4.4%~9.9%。
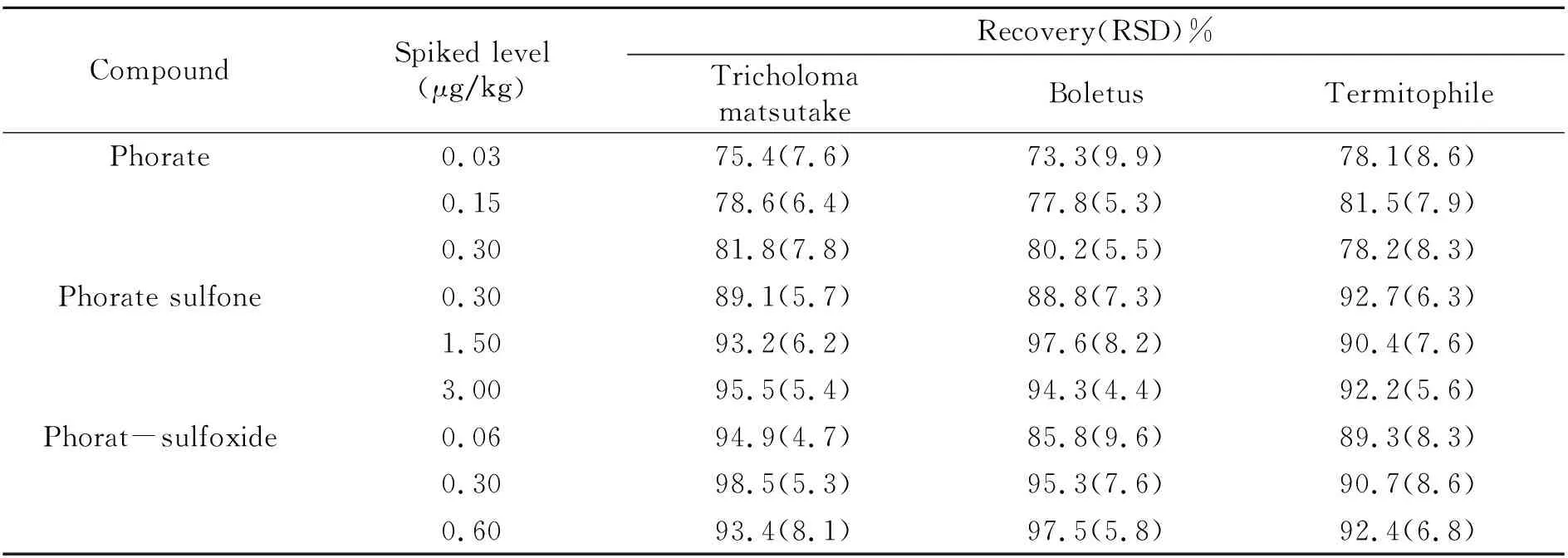
表3 甲拌磷及其代谢物的回收率和相对标准偏差(n=6)
2.4.3实际样品的测定通过对云南省内采集的60个野生菌样品(其中松茸、牛肝菌和鸡枞各20个)进行甲拌磷及其代谢物的测定,测定结果表明,60个样品均未检测出甲拌磷及其代谢物,表明目前在云南省内所采集的野生菌安全性较好。
3 小结
本文利用超高效液相色谱-串联质谱,结合QuEChERS法,建立了云南野生菌中甲拌磷及其代谢物的快速提取和测定方法。以1% HAc-乙腈作为提取溶液,PSA填料净化,采用正离子MRM模式监测,外标法定量,方法具有较好的准确度和精确度,适合云南野生菌中甲拌磷及其代谢物的快速分析测定。

