混料设计运用于银杏内酯A、B水凝胶骨架缓释片的处方优化及释药机制研究
侯莉,张国松,2,封传华,刘晓谦,李东勲,2,王跃生,范玫玫
1.中药固体制剂制造技术国家工程研究中心,江西 南昌 330006;2.江西中医药大学,江西 南昌 330004;3.中国人民解放军第九四医院,江西 南昌 330002;4.中国中医科学院中药研究所,北京 100700
·中药研究与开发·
混料设计运用于银杏内酯A、B水凝胶骨架缓释片的处方优化及释药机制研究
侯莉1,张国松1,2,封传华3,刘晓谦4,李东勲1,2,王跃生4,范玫玫1
1.中药固体制剂制造技术国家工程研究中心,江西 南昌 330006;2.江西中医药大学,江西 南昌 330004;3.中国人民解放军第九四医院,江西 南昌 330002;4.中国中医科学院中药研究所,北京 100700
目的优化银杏内酯 A、B水凝胶骨架缓释片的处方组成,并对其体外释药机制进行研究。方法在单因素考察的基础上,采用混料设计对缓释片的处方进行优化。通过考察体外释放度,以累积释放度对时间进行线性拟合,对银杏内酯A、B水凝胶骨架缓释片的释药机制进行分析。结果确定银杏内酯A、B缓释片的最优处方组成为:药粉∶HPMC∶乳糖=23∶24∶53。结论混料设计用于优化银杏内酯A、B缓释片的最佳处方结果准确,以此比例制备的缓释片以非Fick模式释药,释药符合零级释放。
银杏内酯A;银杏内酯B;水凝胶骨架缓释片;混料设计;处方优化;释药机制
银杏Ginkgo biloba L.为银杏科Ginkgo aceae银杏属落叶乔木。银杏作为药用,最早见于元代吴瑞的《日用本草》[1]。20世纪60年代以来,国内外学者对银杏叶的化学结构、药理作用等进行了大量研究。银杏叶提取物GBE761(主要有效成分为黄酮苷和内酯类化合物),用于治疗脑损伤后遗症及老年性大脑、心血管系统机能衰退等症[2]。药理研究发现,银杏内酯具有专属性的抗血小板活化因子(PAF)活性,是天然的PAF拮抗剂,其中尤以银杏内酯B(GB)的活性最高[3-5],同时银杏内酯A(GA)、GB的组合物抗血小板聚集强度明显强于单一的 GA、GB成分,二者具有显著的协同作用,是一种治疗心脑血管疾病理想的药物组合。
由于心脑血管疾病发生意外的时间不确定,普通片剂不能持续保持有效的血药浓度,将 GA、GB组合物制成亲水凝胶骨架缓释片,有助于保持有效的血药浓度,降低心脑血管疾病的发病风险,减少服药次数,增强患者长期服药的顺应性。市场上银杏叶片(深圳海王和浙江康恩贝制药股份有限公司)中内酯的含量为2.4 mg/片,2片/次,每日3次,共14.4 mg。本试验拟设计含内酯15 mg、12 h释放完全的亲水凝胶骨架缓释片,通过单因素考察与混料均匀设计相结合优化GA、GB水凝胶骨架缓释片的处方及工艺参数,并对其释药机制进行探讨。
1 仪器与试药
Agilent 1100系列高效液相色谱仪(美国),Agilent ELSD检测器(美国),RCZ-8A智能药物溶出仪(天津天大天发),赛多利斯BS2000S分析天平(德国),SHZ-82气浴恒温震荡器(上海)。
GA、GB,自制;羟丙基甲基纤维素 K4M (HPMCK4M)、羟丙基甲基纤维素E-50(HPMCE-50)、羟丙基甲基纤维素K15M(HPMCK15M)、羟丙基甲基纤维素K100M(HPMCK100M),均由Colorcon公司赠送;乳糖,北京永康格林科技有限公司;硬脂酸镁、微粉硅胶,山东聊城阿华制药有限公司;GA对照品(批号 1016-060126)、GB对照品(批号 1017-060110),中药固体制剂制造技术国家工程研究中心,供含量测定用;甲醇(色谱纯),上海振兴化工一厂;其他试剂均为分析纯。
2 方法与结果
2.1水凝胶骨架缓释片的制备
GA、GB提取物(GA:21.97%,GB:58.18%)15 mg,选择HPMC为阻滞剂,乳糖为填充剂,硬脂酸镁为润滑剂,微粉硅胶为助流剂,直接压片。
2.2释放度分析方法的建立
2.2.1色谱条件色谱柱:Hypersil ODS(250 mm× 4.6 mm,5 μm);流动相:甲醇-水(30∶70);流速:1.0 mL/min;漂移管温度:104 ℃;载气流速:2.9 L/min;柱温:25 ℃。
2.2.2对照品溶液的制备精密称取GA、GB对照品适量,用甲醇溶解并定量稀释成每1 mL含GA 1 mg、GB 1 mg的对照品溶液,置冰箱中保存备用。
2.2.3标准曲线的绘制取对照品溶液,依次进样2、5、10 μL。以进样量的自然对数为横坐标,峰面积的自然对数为纵坐标,进行线性回归。回归方程分别为:GA Y=1.497 5X+3.824 1,r=0.999 9;GB Y= 1.582 3X+3.752 5,r=0.999 9。
2.2.4释放介质的选择依据2010年版《中华人民共和国药典》(二部)附录XIX缓释、控释、迟释制剂指导原则的要求,分别选用水、0.1 mol/L盐酸、pH 4.5磷酸盐缓冲溶液、pH 6.8磷酸盐缓冲溶液4种释放介质进行 GA、GB缓释片释放度预试验。测定各时间点的累积释放度,比较各种介质对释放度的影响。结果表明,不同释放介质对本品的释药特性影响较大,GA、GB在0.1 mol/L盐酸中释放性能最佳。因而选择0.1 mol/L盐酸作为释放介质。
2.2.5搅拌桨转速的影响测定50、75、100 r/min转速下 GA、GB缓释片不同时间点的累积释放度。结果表明,在3种不同转速下,GA、GB从缓释片中释放出来的速率没有明显差别。
2.2.6精密度试验精密称取 GA、GB提取物约15 mg,按处方加入其他辅料,置于100 mL容量瓶中,加0.1 mol/L盐酸至刻度,摇匀,过滤。每次进样10 μL,连续进样5次,分别测定峰面积,计算得GA、GB的RSD分别为1.69%、0.48%,表明精密度良好。
2.2.7加样回收率试验按缓释片处方,称取不同量GA、GB提取物(GA:21.97%,GB:58.18%),按比例加入片剂中的各种辅料,制备高、中、低3个浓度的GA、GB样品。以0.1 mol/L盐酸按“2.2.6”项下方法制备供试品溶液,测定含量,重复进样3次。结果GA的平均回收率为99.82%,GB的平均回收率为99.45%。
2.2.8释放度测定采用2010年版《中华人民共和国药典》(二部)附录XD第一法,以0.1 mol/L盐酸100 mL作为释放介质,转速75 r/min,温度(37± 0.5)℃,于0.5、1、2、4、6、8、12、13 h定时取样1 mL(及时补加等量同温介质),经0.45 μm微孔滤膜过滤,取续滤液10 μL注入液相色谱仪,测定峰面积,代入标准曲线方程,计算累积释放度。
2.3单因素考察水凝胶骨架缓释片的释药影响因素
固定片重和主药、助流剂、润滑剂用量不变,分别加入不同比例、不同黏度的HPMC,按片剂制备方法制备 GA、GB缓释片,测定并比较释药速率;另外以压力分别为7、9、11 kg制成不同硬度的缓释片,测定各个时间点的释放度。结果见图1~图3。
结果表明,HPMCK15M和HPMCK100M制成的缓释片其体外释药速率无明显差异,HPMCE-50和HPMCK4M 制成的缓释片药物释放速度较快,但HPMCE-50制成的缓释片在6 h时即完全溶蚀,GA、GB释放度超过90%,故选用HPMCK4M作为缓释片的骨架材料。GA、GB的释放速率随HPMC用量的增加而减慢。这是由于随着骨架材料增加,其吸水后产生的凝胶屏障层增厚,使药物的扩散减慢。当压力为7 kg时,4 h时GA释放度为42.7%,GB释放度为56.3%,8 h时GA、GB释放度均已超过80%,释放速率过快,难以达到缓释要求,但当压力为9~11 kg时,压力的改变对缓释片的释药无明显影响,因此选择压片压力为9~11 kg。
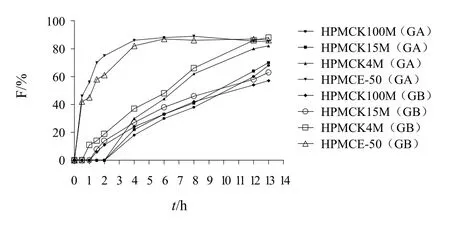
图1 HPMC黏度对GA、GB释药性能的影响
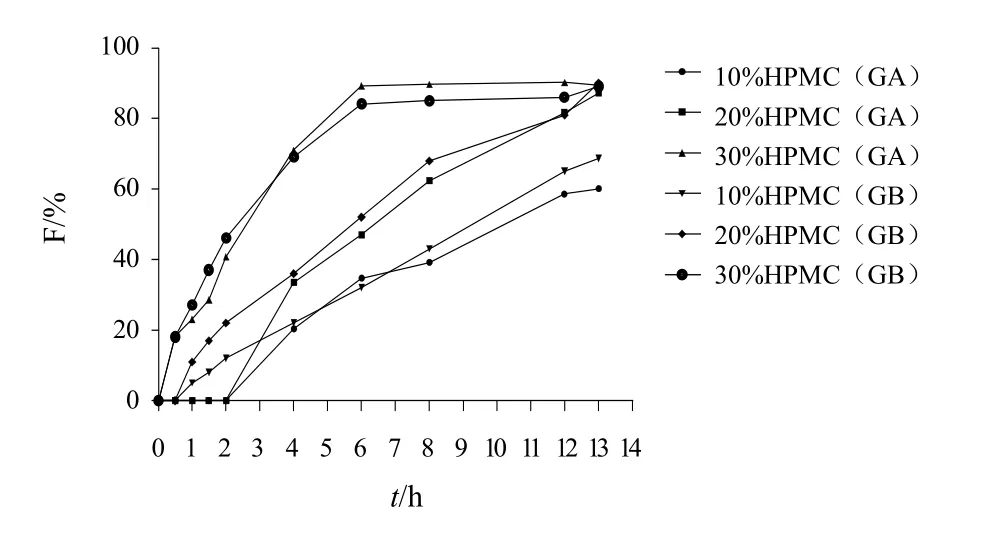
图2 HPMC用量对GA、GB释药性能的影响
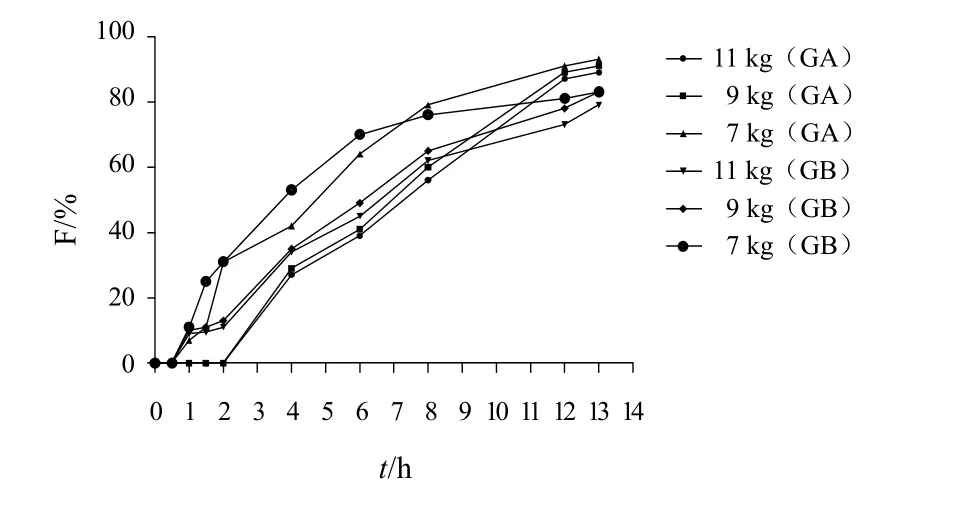
图3 压片压力对GA、GB释药性能的影响
2.4混料设计法优化处方的研究
2.4.1混料设计的参数设置在单因素考察确定HPMC黏度的基础上[6-7],采用混料设计法对缓释片的处方进行优化,混料设计的因素和水平见表1。
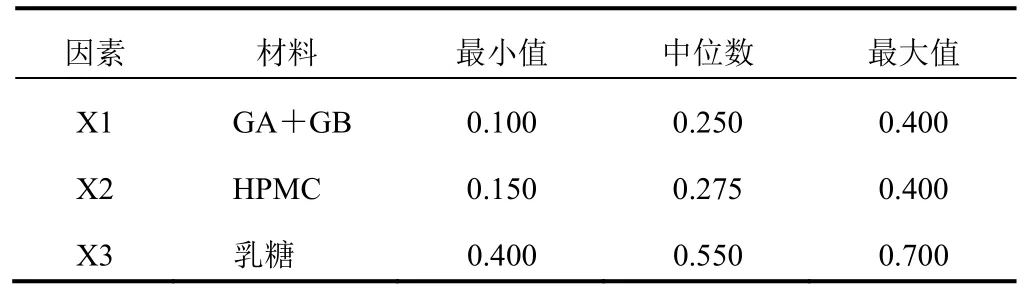
表1 混料设计参数设置
2.4.2混料试验安排经 SAS统计软件设计,共给出7组混合试验,试验安排见表2。根据所给出的试验方案,按确定的方法制备 GA、GB水凝胶骨架缓释片。
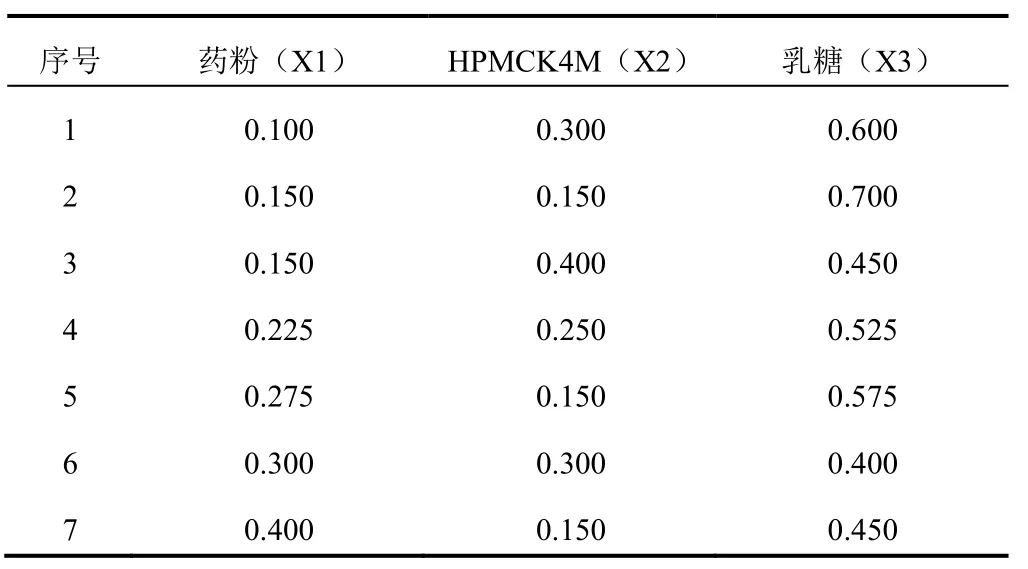
表2 混料设计试验安排
2.4.3数据处理及分析由于GA、GB的药代动力学参数显示其半衰期较短,结合缓释片的释放度考察要求[8-10],设计缓释片的3个时间点对应的Qt值分别为Q3h=30%,Q6h=50%,Q12h=90%。
2.4.3.1多指标法采用多指标法,分别对3、6、12 h的实际累积释放度与设计释放度的相似因子计算,标记为Y1、Y2、Y3。同时对各处方的累积释放度曲线进行模型拟合。为减少参数,对 GA、GB的释放度曲线进行相似性评价,结果发现 GA、GB的释放曲线基本一致,可以选用任一指标替代。
2.4.3.2多指标法最优解
2.4.3.2.1处方最优回归子集自变量药粉(X1)、HPMC(X2)、乳糖(X3)对因变量Y1、Y2、Y3分别进行回归,结果见表3。并得出回归方程。
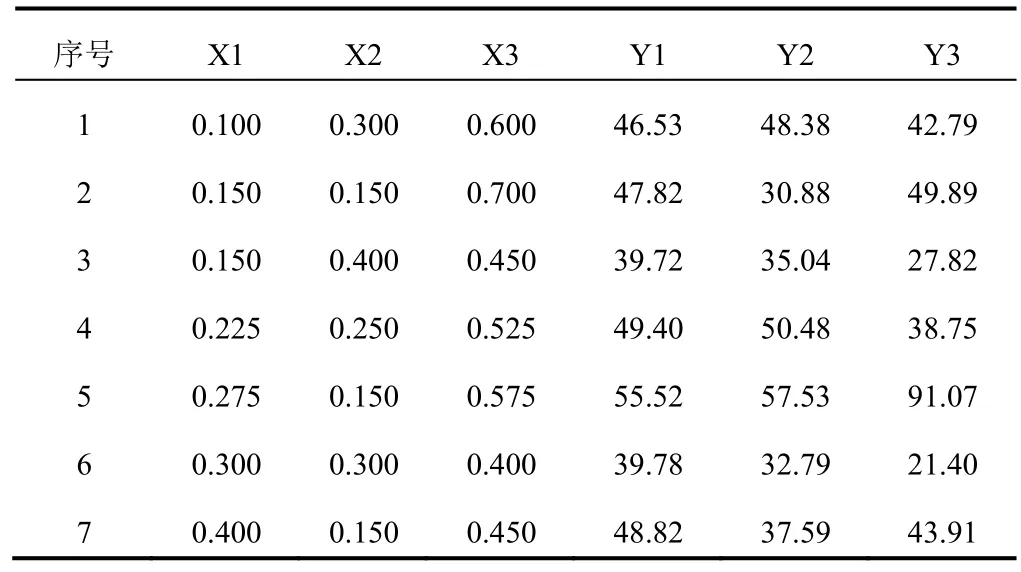
表3 混料设计回归结果
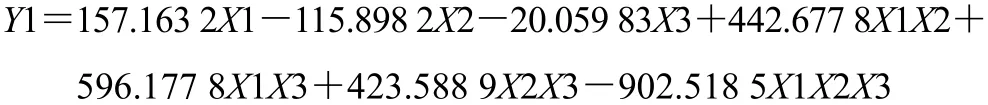
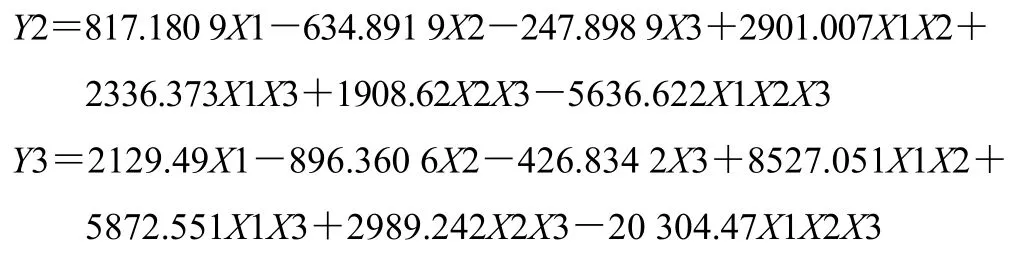
对回归结果进行进一步分析:随着药粉比例的增加,缓释片的前期释药速率增加。HPMC比例增加,各时间点的释药速率均降低。随着乳糖比例增大,药物的释放速率增大。与单因素考察结果一致。其中HPMC用量对释药速率的影响最大,见图4。药粉用量在0.105~0.356、HPMC用量在0.172~0.265、乳糖用量在0.472~0.667范围内制备的缓释片其释药性能接近设计值,见图5。
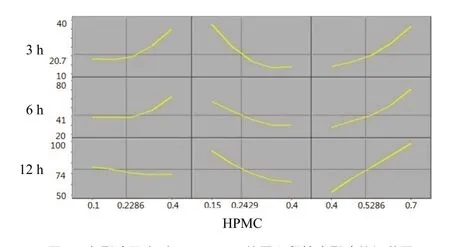
图4 各影响因素对3、6、12 h的累积释放度影响的概貌图
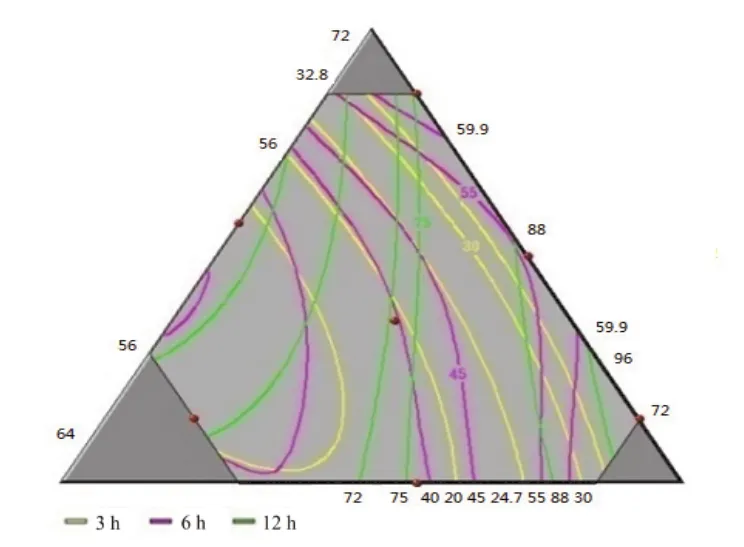
图5 各影响因素对各时间点释放度的等值线图
2.4.3.2.2最优回归子集模型求最优解据各因变量最优回归子集模型进行多变量综合分析,得出的最优处方组成为:药粉量为 22.86%,HPMC用量为24.29%,乳糖用量为 52.86%。在此配比条件下缓释片Y1=51.40,Y2=52.96,Y3=40.80。
2.4.3.3数学模型和释药机制研究7个不同处方样品累积释放度分别用零级方程、一级方程、Higuchi方程、Hixcon-Crowell方程、Weibull方程、Peppas方程拟合。
处方1以零级方程拟合拟合度最高,同时由于Peppas方程中nA=1.030 4、nB=0.998 1,均>0.89,故推断主药以骨架溶蚀机制释药;
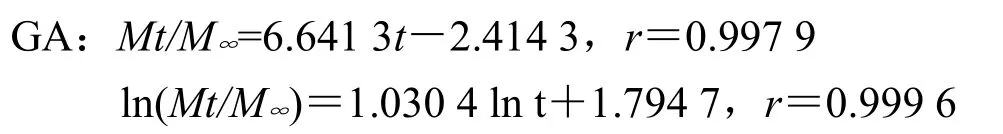
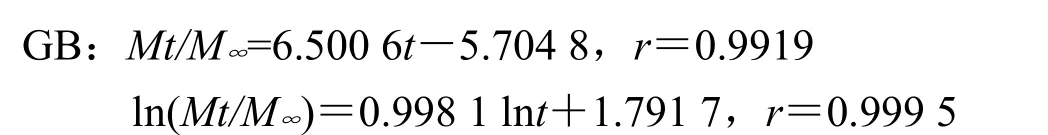
处方2以Peppas方程拟合拟合度最高,同时由于Peppas方程中nA=0.762 5、nB=0.828 6,均0.45<n<0.89,故推断主药以非Fick扩散(扩散+溶蚀)机制释药;
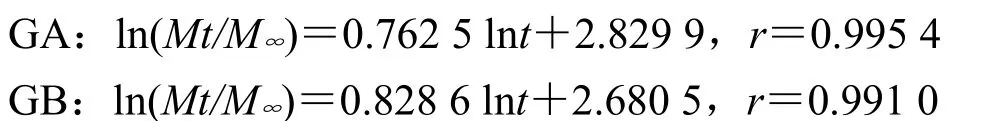
处方3以零级方程拟合拟合度最高,同时由于Peppas方程中nA=1.293 8、nB=1.396 6,均>0.89,故推断主药以溶蚀机制释药;

处方4以Hixcon-Crowell方程拟合拟合度最高,同时由于Peppas方程中nA=1.180 1、nB=1.178 1,均>0.89,故主药以溶蚀机制释药;
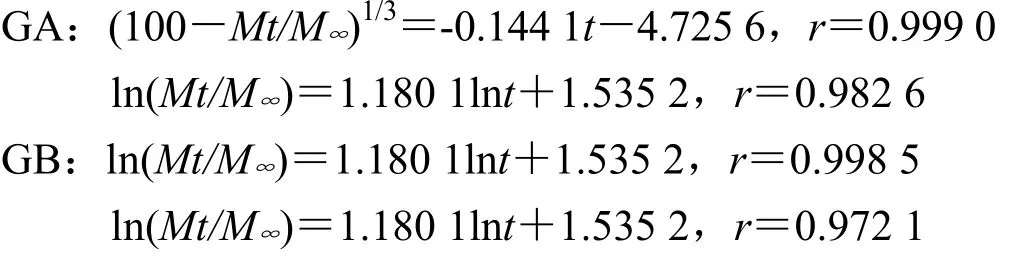
处方5以Hixcon-Crowell方程拟合拟合度最高,同时由于Peppas方程中nA=0.635、nB=0.627,均0.45<n<0.89,故推断主药以非 Fick扩散(扩散+溶蚀)机制释药;
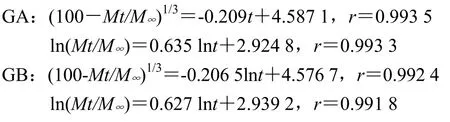
处方6以零级方程拟合拟合度最高,同时由于Peppas方程中nA=1.219 1、nB=1.182 3,均>0.89,故推断主药以溶蚀机制释药;

处方7以Peppas方程拟合拟合度最高,同时由于Peppas方程中nA=0.509 4、nB=0.499 5,均0.45<n<0.89,故推断主药以非Fick扩散(扩散+溶蚀)机制释药:
综上所述,以HPMCK4M为骨架材料制备的缓释片在设定的比例范围内都能基本达到零级或近似零级释药。
2.4.4最优处方验证对多指标法所得的最优解进行验证试验。按照最优处方组成,制备3批GA、GB亲水凝胶骨架缓释片,测定各时间点的累积释放度,结果见图6。
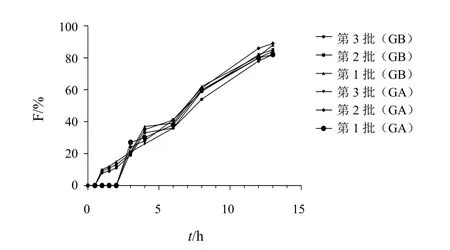
图6 3批样品GA、GB在0.1 mol/L盐酸中的溶出曲线
通过Peppas方程拟合,得GA、GB的拟合方程分别为:
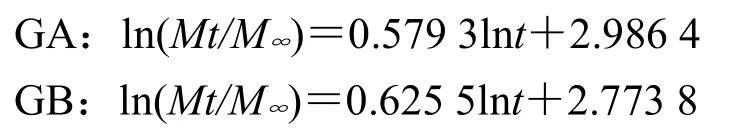
nA=0.579 3、nB=0.625 5,均0.45<n<0.89,故主药以非Fick扩散(扩散+溶蚀)机制释药。
3 讨论
由于心脑血管疾病发作的特殊性,缓释制剂相对于普通片剂在临床用药的有效性、顺应性等方面具有明显的优势。本研究在单因素考察的基础上,采用混料均匀设计,考察了影响 GA、GB水凝胶骨架片的多个因素,进行了处方的优化设计,获得了最优的处方。经体外释放度考察,表明所制备的GA、GB水凝胶骨架缓释片符合体外释放度的要求,且体外释药速率基本符合零级速率;同时对体外释放机制进行了探讨,结果所制备的GA、GB亲水凝胶骨架缓释片以非 Fick模式释药。本研究为GA、GB水凝胶骨架缓释片下一步的体内研究做好了前期准备,也可为中药缓控释制剂的工艺研究提供参考。
[1] 梁宝.中日当代银杏大全[M].北京:北京农业大学出版杜,1993:18.
[2] 郑卫平,楼凤昌.银杏内酯的研究概况[J].药学进展,1999,23(2):85.
[3] Braquet P. The ginkgolides:potent platelet-activating factor antagonists isolated from Ginkgo biloba L: chemistry,pharmacology and clinical alications[J]. Drugs Future,1987,12(7):643-699.
[4] 韩金玉,李海静.天然药物银杏内酯研究进展[J].化工进展,2000,19(2):23.
[5] HAN J Y, WANG H, CHANG H Y, et al. Isolation and preparative purification for Ginkgolides A and B[J]. Chinese J Chem Eng,2003,11(2):125-129.
[6] 叶磊,王义明,罗国安,等.混料均匀设计法优化对乙酰氨基酚口腔崩解片处方[J].中国医药工业杂志,2005,36(1):24-26.
[7] 武孔云,黄勇其,李星,等.混料均匀设计法优化七缬和胃胶囊处方[J].贵州科学,2007,25(增刊):427-430.
[8] 安国红,刘明言.混料均匀设计法优化辛伐他汀口腔崩解片处方[J].中国药业,2007,16(8):39-40.
[9] 刘清飞,罗国安,王义明.混料均匀设计法在灯盏花素骨架片处方配比中的应用研究[J].中成药,2006,28(5):632-635.
[10] 王跃生,查青林,王金钱,等.混料设计在 SAS软件中的实现及其在优化断血流分散片处方配比中的应用[J].江西中医学院学报,2007,19(1):61-63.
Application of Mixture Uniform Design in Optimizing the Proportion and Releasing Mechanism Study of GA and GB Hydrophilic Gel Matrix Tablets
HOU Li1, ZHANG Guo-song1,2,FENG Chuan-hua3, LIU Xiao-qian4, LI Dong-xun1,2, WANG Yue-sheng4, FAN Mei-mei1
(1. The National Pharmaceutical Engineering Center for Solid Preparation in Chinese Herbal Medicine, Nanchang 330006, China;2. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China; 3. No.94 Hospital of PLA,Nanchang 330002, China; 4. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences,Beijing 100700, China)
Objective To optimize the prescription of GA and GB hydrophilic gel matrix tablets; To study the in vitro release mechanism. Methods On the basis of the results of the mono-factor investigation, mixture uniform design was used to optimize the handicraft molding prescription of GA and GB hydrophilic gel matrix tablets. The release mechanism was investigated by the vitro of the GA and GB hydrophilic gelmatrix tablets to accumulate releasing rate to conduct linear fitting. Results The optimized prescription of GA and GB hydrophilic gel matrix tablets was∶ powder∶ HPMC∶ lactose=23∶24∶53. Conclusion Mixture uniform design can be used to optimize the prescriptions of GA and GB hydrophilic gel matrix tablets, and the results are accurate. The hydrophilic gelmatrix tablets release medicine by non-Fick mechanism, and the medicine release is in accordance with zero-order.
GA; GB; hydrophilic gel matrix tablets; mixture uniform design; preparation optimization; release mechanism
R283.5
A
1005-5304(2016)10-0082-05
2015-06-11)
(
2015-11-06;编辑:陈静)
江西省科技支撑计划(2008ZY148)
张国松,E-mail:zhgs81411@aliyun.com
DOl:10.3969/j.issn.1005-5304.2016.10.019

