抵挡汤早期干预对糖尿病大鼠腺苷酸活化蛋白激酶信号通路的影响
任单单,李晶,常柏,李春深,朱子昭
1.天津医科大学代谢病医院,天津 300070;2.天津中医药大学,天津 300193
抵挡汤早期干预对糖尿病大鼠腺苷酸活化蛋白激酶信号通路的影响
任单单1,2,李晶1,常柏1,李春深2,朱子昭1
1.天津医科大学代谢病医院,天津 300070;2.天津中医药大学,天津 300193
目的观察不同时期给予抵挡汤干预对糖尿病大鼠血管内皮细胞腺苷酸活化蛋白激酶(AMPK)信号通路相关因子的变化,探讨其调控AMPK信号通路介导的线粒体能量代谢对糖尿病大血管病变防御功能的作用机制。方法采用尾静脉注射链脲佐菌素配合高脂饲料喂养制作糖尿病大鼠模型。实验大鼠随机分为正常组、模型组、二甲双胍组、辛伐他汀组和抵挡汤早、中、晚期组,Western blot检测胸主动脉内皮细胞AMPKα1、过氧化物酶体增殖活化受体γ共激活因子-1α(PGC-1α)的蛋白表达,ELISA检测细胞内一磷酸腺苷(AMP)、三磷酸腺苷(ATP)水平,实时荧光定量PCR检测胸主动脉组织Caspase-3、内皮型一氧化氮合酶(eNOS)、Bcl-2的基因表达。结果与模型组比较,抵挡汤早、中期组和辛伐他汀组大鼠胸主动脉 AMPKα1、PGC-1α蛋白表达明显升高(P<0.05);抵挡汤早期组和辛伐他汀组Bcl-2、eNOS基因表达明显升高(P<0.05),Caspase-3基因表达明显降低(P<0.05);抵挡汤早期组和辛伐他汀组ATP水平明显升高(P<0.05),AMP水平明显降低(P<0.05),其中以抵挡汤早期组效果最显著。结论抵挡汤早期干预可通过调控AMPK信号通路,增强血管内皮细胞线粒体的能量代谢,从而加强血管内皮的防御功能。
抵挡汤;腺苷酸活化蛋白激酶;Caspase-3;能量代谢;早期干预;大鼠
大血管病变是2型糖尿病患者常见的动脉病变,但临床观察部分患者在血糖控制理想的情况下,仍发生严重的大血管病变[1]。抵挡汤在《伤寒论》《金匮要略》中均有记载,具有破血逐瘀的功效。本研究组前期实验发现,早期应用抵挡汤能降低单核细胞趋化蛋白-l、巨噬细胞 CD68、E-选择素的表达,影响单核/巨噬细胞活化、迁移、黏附,且能降低细胞间黏附分子-1、血管细胞黏附分子-1、血管内皮生长因子、人转化生长因子-β1和蛋白激酶C-β2的mRNA在视网膜组织的表达,抑制糖尿病微血管病变的炎症反应[2-3]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)为能量变化感受器,在糖尿病患者体内可观察到内皮祖细胞活性功能受损并伴有AMPK磷酸化减少[4]。本实验从调节AMPK信号通路介导的血管内皮细胞能量代谢的角度,在给予干预的不同时期观察血管内皮细胞 AMPK信号通路相关因子的变化,探讨其调控 AMPK通路介导的线粒体能量代谢对糖尿病大血管病变防御功能的作用机制。
1 实验材料
1.1动物
健康雄性SD大鼠150只,普通级,4周龄,体质量(200.4±2.2)g,天津实验动物中心,合格证号SCXK(津)2014-0001。饲养环境干燥、通风,室温25 ℃,相对湿度 60%,自然昼夜光线照明,自由进食饮水。
1.2药物
抵挡汤(桃仁10 g,大黄6 g,水蛭10 g,虻虫10 g),饮片购于天津中医药大学第一附属医院药剂科,按传统工艺制备成水煎剂,减压浓缩至含原药材1 g/mL,4 ℃冰箱保存备用。盐酸二甲双胍片,上海施贵宝公司,0.5 g/片,批号20140509;辛伐他汀片,西安杨森制药有限公司,20 mg/片,批号20140902。
1.3主要试剂与仪器
链脲佐菌素(STZ),美国Sigma公司;PCR试剂盒,北京康为世纪生物科技有限公司。血糖仪(拜耳公司),胰岛素放免测定试剂盒(天津九鼎医学生物工程有限公司),显微镜、全自动图像分析仪(日本奥林巴斯公司),切片机(德国徕卡 Microststems Mussloch公司),荧光定量PCR仪(Applied Biosystems公司),台式低俗高速离心机(德国Eppendorf公司),电泳仪(北京六一仪器厂),HPIAS-2000型图像分析软件(同济千屏影像工程公司)。
2 实验方法
2.1分组和造模
大鼠正常适应性喂养1周,随机抽取15只作为正常组,其余为造模组。采用高脂饲料(20%蔗糖、1%胆固醇、10%猪油、5%蛋黄粉、0.2%胆酸钠、63.8%普通饲料)喂养8周,内眦静脉取血,检测空腹血糖和血清胰岛素,任选胰岛素抵抗大鼠(HOMA-IR指数判断大鼠胰岛素抵抗)20只为抵挡汤早期组;其余大鼠至12周后,空腹24 h,尾静脉注射STZ,1周后随机血糖值>16.9 mmol/L为2型糖尿病模型制备成功(成模率约 80%),按体质量、血糖分层随机分为抵挡汤早期组、抵挡汤中期组、抵挡汤晚期组、二甲双胍组、辛伐他汀组和模型组。
2.2干预及标本采集
正常组、模型组予等量无菌饮用水灌胃,抵挡汤早期组于成模前4周予抵当汤原药材3.24 g/kg灌胃,抵挡汤中期组(3.24 g/kg)、二甲双胍组(0.36 mg/kg)、辛伐他汀组(2.67 mg/kg)均于成模时(即第12周)灌胃给药,抵挡汤晚期组(3.24 g/kg)于成模后4周灌胃给药,每日1次,给药体积均为1 mL/100 g。至实验24周结束,脱颈处死大鼠,迅速剖取大鼠胸主动脉组织,一部分以4%多聚甲醛溶液4 ℃固定,用于普通光学显微镜和透射电镜检查,另一部分分别放于不同的冻存管中,置于液氮1 d后转移至-80 ℃冰箱保存,用于Western blot、PCR和ELISA检测。
2.3基本指标检测
观察大鼠一般状况,如精神状态、皮毛、自由饮食、饮水情况,记录各组大鼠的体质量,并尾静脉取血检测随机血糖。
2.4Western blot检测腺苷酸活化蛋白激酶α1和过氧化物酶体增殖活化受体γ共激活因子-1α蛋白表达
用 SDS碱裂解法裂解大鼠主动脉组织,提取总蛋白,用考马斯亮蓝法测定各细胞样本蛋白含量;加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液,将样品至于凝胶孔中,接通电源进行电泳;将蛋白转移到聚偏二氟乙烯膜上,半干转膜后封闭;加1∶200稀释的AMPKα1和过氧化物酶体增殖活化受体γ共激活因子-1α(PGC-1α)一抗及辣根过氧化物酶标记的二抗(稀释度为1∶3000)进行结合,洗膜,放入暗盒曝光显影,用Image J软件分析灰度值。
2.5实时荧光定量PCR检测Caspase-3、内皮型一氧化氮合酶和Bcl-2基因表达
取约100 mg主动脉组织,超纯RNA提取试剂盒提取组织总RNA,取5 μL RNA用1%琼脂糖凝胶进行电泳,以检测RNA的完整性。引物序列:Caspase-3上游5'-TACTGCCGGAGTCTGACTG-3',下游5'-CTC CAGGAATAGTAACCAGG-3',产物长度142 bp;内皮型一氧化氮合酶(eNOS)上游5'-ACCTACGTGCA AGACCTCC-3',下游5'-GCTTCATCCAGCTCCATG-3',产物长度133 bp;Bcl-2上游5'-TGCCACCTGTGGT CCATCTG-3',下游5'-TGAAGAGTTCCTCCACCA-3',引物长度112 bp。用HiFi-MMLVcDNA第一链合成试剂盒进行反转录,反应条件:95 ℃预变性10 min,1个循环;95 ℃、15 s,60 ℃、20 s,72 ℃、30 s,共45个循环。扩增完毕后,60~95 ℃进行融解曲线分析,荧光定量分析仪自动采集给出目的基因和对照基因的Ct值,采用2-ΔΔCt法计算基因表达量。
2.6ELISA检测一磷酸腺苷、三磷酸腺苷
将加入一定量PBS(pH 7.4)的标本,弃培养液,PBS洗2遍,胰酶消化后吹打成单细胞悬液,按试剂说明进行操作,绘制标准曲线,按曲线方程计算各样本的浓度值,再乘以稀释倍数,即为样品的实际浓度。每组取6个样本,取其平均值。
3 统计学方法
4 结果
4.1一般状况结果
正常组大鼠灵敏、活泼,皮肤有弹性,毛发光亮柔顺;模型组大鼠精神萎靡,倦怠懒惰,反应迟钝,皮肤松弛,毛发无光泽,并出现多饮、多尿、多食等表现;其他组一般状况较模型组好转。
4.2抵挡汤对模型大鼠血糖的影响
与正常组比较,模型组大鼠血糖明显升高(P<0.01),并出现糖尿病“三多一少”症状,提示造模成功;与模型组比较,二甲双胍组大鼠血糖明显降低(P<0.05),其他各组血糖变化不明显,提示抵挡汤和辛伐他汀对血糖影响不大。结果见表1。
表1 各组大鼠血糖比较(±s,mmol/L)
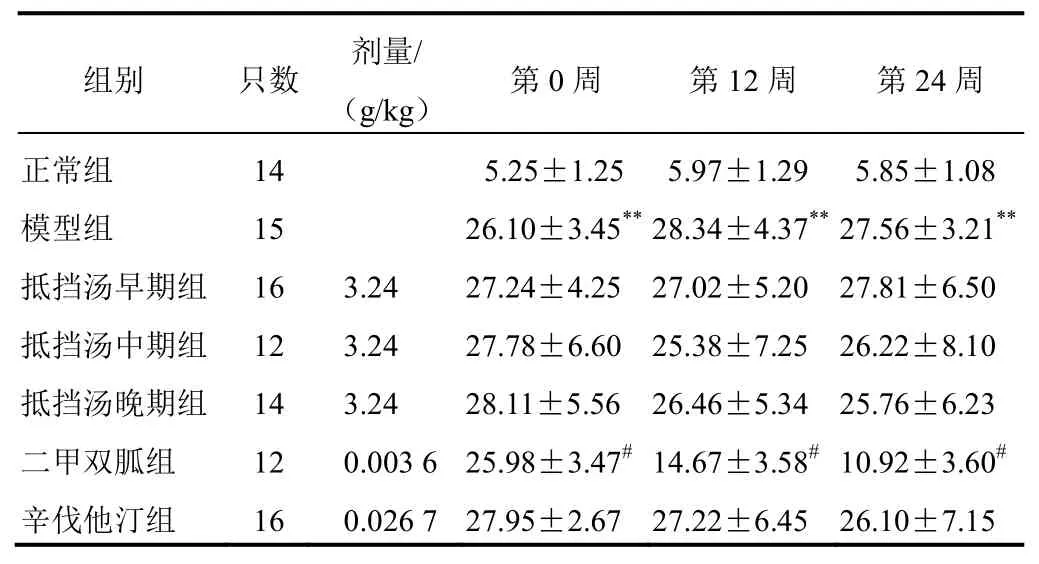
表1 各组大鼠血糖比较(±s,mmol/L)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05
组别 只数 剂量/ (g/kg) 第0周 第12周 第24周正常组 14 5.25±1.25 5.97±1.29 5.85±1.08模型组 15 26.10±3.45**28.34±4.37**27.56±3.21**抵挡汤早期组 16 3.24 27.24±4.25 27.02±5.20 27.81±6.50抵挡汤中期组 12 3.24 27.78±6.60 25.38±7.25 26.22±8.10抵挡汤晚期组 14 3.24 28.11±5.56 26.46±5.34 25.76±6.23二甲双胍组 12 0.003 6 25.98±3.47#14.67±3.58#10.92±3.60#辛伐他汀组 16 0.026 7 27.95±2.67 27.22±6.45 26.10±7.15
4.3抵挡汤对模型大鼠胸主动脉病理形态的影响
光镜观察结果显示,正常组动脉内膜相对光滑、完整,内皮下有少量脂质沉积,中膜平滑肌细胞排列相对整齐,极少量平滑肌细胞变性、坏死,炎细胞浸润;模型组动脉内膜不完整,内皮细胞大部分缺失,脂质沉积,中膜排列紊乱,大量平滑肌细胞变性、坏死,炎细胞浸润;抵挡汤早期组和辛伐他汀组动脉内膜相对光滑,内皮细胞局部缺失,其下有脂质沉积,中膜排列整齐,平滑肌变性、坏死少见;抵挡汤中、晚期组和二甲双胍组动脉内膜相对完整,有不同程度的内皮细胞缺失及中膜排列稍紊乱,少量平滑肌细胞变性、坏死。结果见图1。

图1 各组大鼠胸主动脉病理形态(HE染色,×400)
4.4抵挡汤对模型大鼠胸主动脉内皮细胞病理形态的影响
透射电镜观察结果显示,正常组内皮细胞形态规则,弹力膜均匀,平滑肌细胞正常,线粒体结构无异常;模型组可见细胞质碎片和空泡,甚至内皮细胞溶解消失,弹力膜界限不清排列混乱,平滑肌细胞核不清晰;除二甲双胍组较模型组改善不明显,其余各干预组电镜下呈现细胞的溶解、弹力膜增厚断裂得到不同程度的改善,线粒体的结构得到不同程度的恢复,其中辛伐他汀组和抵挡汤早期组改善最明显。结果见图2。
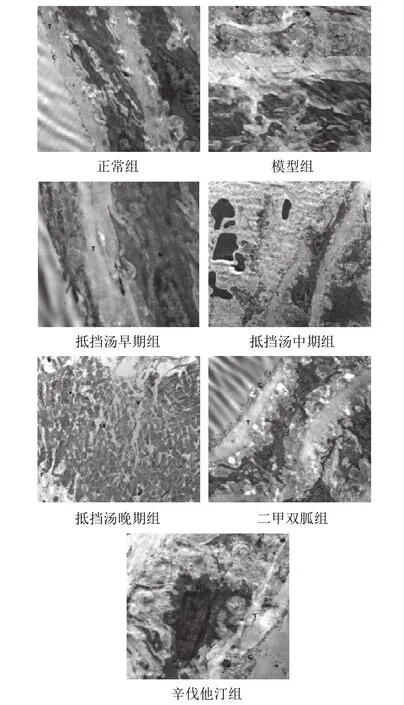
图2 各组大鼠胸主动脉内皮细胞病理形态(Bar=2 μm)
4.5抵挡汤对模型大鼠胸主动脉一磷酸腺苷活化蛋白激酶α1和过氧化物酶体增殖活化受体γ共激活因子-1α蛋白表达的影响
与正常组比较,模型组大鼠AMPKα1和PGC-1α蛋白表达明显降低(P<0.01);与模型组比较,抵挡汤早、中期组和辛伐他汀组AMPKα1和PGC-1α蛋白表达明显升高(P<0.05),抵挡汤早期组变化较明显(P<0.05)。结果见图3、表2。

图3 各组大鼠胸主动脉AMPKα1和PGC-1α蛋白表达免疫印迹电泳图
表2 各组大鼠胸主动脉AMPKα1和PGC-1α蛋白表达比较(±s)
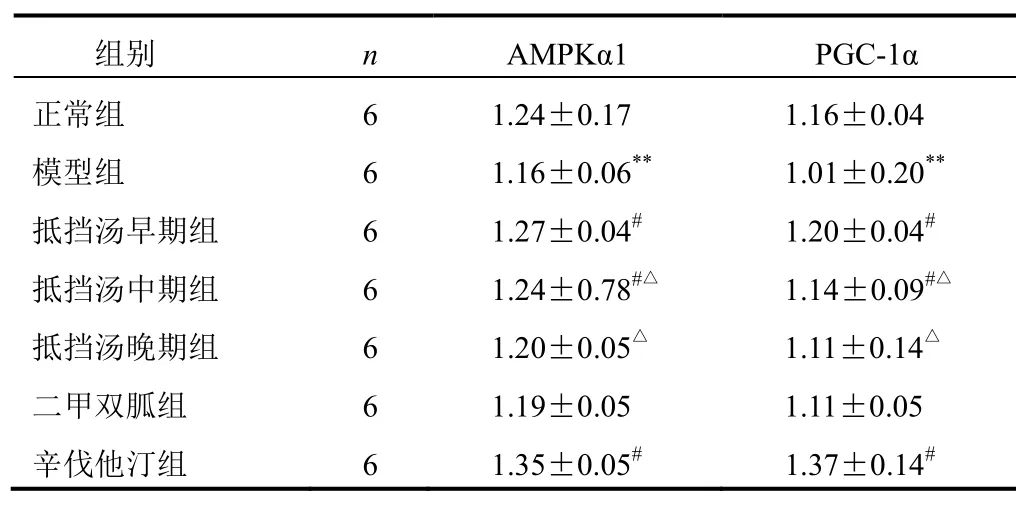
表2 各组大鼠胸主动脉AMPKα1和PGC-1α蛋白表达比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05;与抵挡汤早期组比较,△P<0.05
组别 n AMPKα1 PGC-1α正常组 6 1.24±0.17 1.16±0.04模型组 6 1.16±0.06** 1.01±0.20**抵挡汤早期组 6 1.27±0.04# 1.20±0.04#抵挡汤中期组 6 1.24±0.78#△ 1.14±0.09#△抵挡汤晚期组 6 1.20±0.05△ 1.11±0.14△二甲双胍组 6 1.19±0.05 1.11±0.05辛伐他汀组 6 1.35±0.05# 1.37±0.14#
4.6抵挡汤对模型大鼠胸主动脉Caspase-3、内皮型一氧化氮合酶和Bcl-2基因表达的影响
与正常组比较,模型组大鼠eNOS和Bcl-2基因表达明显降低(P<0.01),Caspase-3基因表达明显升高(P<0.01);与模型组比较,抵挡汤早、中期组和辛伐他汀组eNOS和Bcl-2基因表达明显升高(P<0.05),Caspase-3基因表达明显降低(P<0.05),抵挡汤早期组变化较明显(P<0.05),见表3。各基因实时扩增曲线及产物融解曲线见图4~图7。
4.7抵挡汤对模型大鼠胸主动脉一磷酸腺苷、三磷酸腺苷水平的影响
与正常组比较,模型组大鼠胸主动脉AMP水平明显升高(P<0.01),ATP水平明显降低(P<0.01);与模型组比较,抵挡汤早、中期组和辛伐他汀组AMP水平明显降低(P<0.05),ATP水平明显升高(P<0.05),抵挡汤早期组变化较明显(P<0.05)。结果见表4。
表3 各组大鼠胸主动脉Caspase-3、eNOS、Bcl-2基因表达比较(±s)
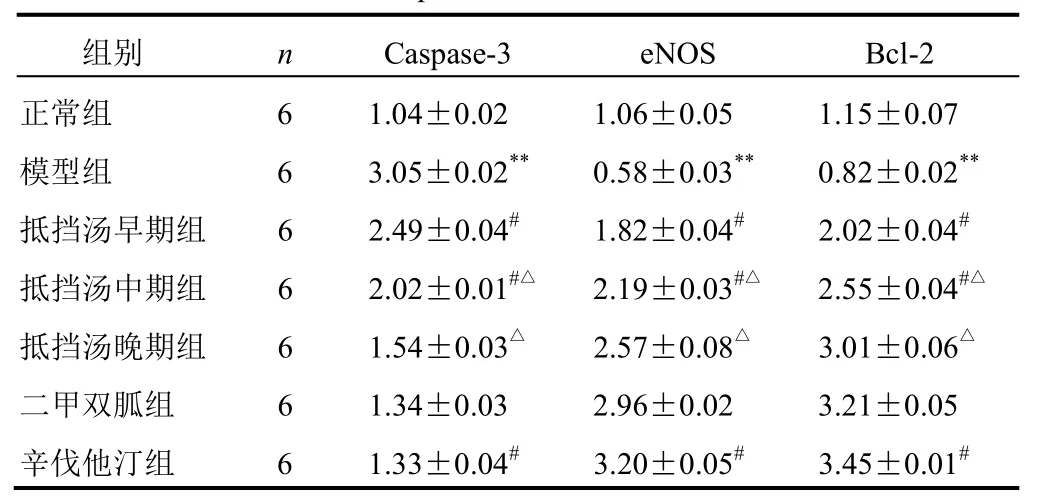
表3 各组大鼠胸主动脉Caspase-3、eNOS、Bcl-2基因表达比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05;与抵挡汤早期组比较,△P<0.05
组别 n Caspase-3 eNOS Bcl-2正常组 6 1.04±0.02 1.06±0.05 1.15±0.07模型组 6 3.05±0.02** 0.58±0.03** 0.82±0.02**抵挡汤早期组 6 2.49±0.04# 1.82±0.04# 2.02±0.04#抵挡汤中期组 6 2.02±0.01#△ 2.19±0.03#△ 2.55±0.04#△抵挡汤晚期组 6 1.54±0.03△ 2.57±0.08△ 3.01±0.06△二甲双胍组 6 1.34±0.03 2.96±0.02 3.21±0.05辛伐他汀组 6 1.33±0.04# 3.20±0.05# 3.45±0.01#
图4 Bcl-2基因实时扩增曲线和产物融解曲线

图5 eNOS基因实时扩增曲线和产物融解曲线
图6 Caspase-3基因实时扩增曲线及产物融解曲线
图7 内参基因实时扩增曲线及产物融解曲线
表4 各组大鼠胸主动脉AMP、ATP水平比较(±s)

表4 各组大鼠胸主动脉AMP、ATP水平比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05;与抵挡汤早期组比较,△P<0.05
正常组 6 106.7±14.4 60.1±5.5 1.40~2.21模型组 6 136.4±25.3** 42.9±2.4** 2.45~3.99抵挡汤早期组 6 90.2±17.4# 70.2±4.2# 0.97~1.63抵挡汤中期组 6 110.8±18.0#△ 60.8±9.4#△ 1.29~2.50抵挡汤晚期组 6 106.0±17.6△ 54.8±6.1△ 1.20~2.22二甲双胍组 6 103.0±22.4 58.7±4.0 1.28~2.30辛伐他汀组 6 90.7±26.2# 72.1±6.0# 0.82~1.76组别 n AMP ATP AMP/ATP
5 讨论
血管内皮细胞在维持血管张力、改善炎症状态和平滑肌细胞增殖方面起着关键作用,糖尿病相关的代谢综合征导致的内皮细胞功能障碍是大血管病变发展的重要原因。
AMPK是细胞的能量变化感受器,包括α、β、γ亚基,α亚基起催化作用,主要受 AMP/ATP比值的调节,AMP/ATP升高,苏氨酸-172(Thr-172)被上游蛋白磷酸化,同时抑制 Thr-172被丝氨酸磷酸酶PP2Cα去磷酸化,导致AMPK变构激活[5-6]。有研究表明,AMPKα2缺失或活性降低对于血管损伤后新生内膜的形成发挥着关键作用,这有利于血管平滑肌细胞增殖[7-8]。而AMPKα1占总AMPKα活性的大部分,是血管平滑肌细胞主要的亚型,可导致eNOS减少,降低与抗氧化防御相关基因的表达,增加内皮细胞活性氧[9]。其使内皮细胞存活的机制为增加细胞内ATP含量,从而参与内皮细胞屏障修复和血管内皮形成[10]。
一氧化氮(NO)是血管内皮细胞的重要递质,主要受eNOS调节,eNOS生物活性降低会导致内皮细胞功能障碍、血管收缩、舒张失衡,促使内皮细胞渗透性增加、血小板聚集等,引起动脉粥样硬化病变[11]。eNOS位于AMPK的下游,是AMPK参与介导血管内皮功能改善过程的又一个重要靶点[12-13]。AMPK通过调节PGC-1α-核呼吸因子1通路,激活编码线粒体蛋白的核基因和线粒体DNA的转录复制,从而线粒体得以表达,修复受损内皮细胞[14]。线粒体通路和死亡受体通路是血管内皮细胞凋亡的主要信号转导通路,这两条通路最终末端都需激活Caspase-3才能引起凋亡,表现为经典的染色质凝结和DNA裂解。在线粒体通路中,累积活性氧、活化的促凋亡蛋白等导致线粒体膜渗透功能改变,引起释放的细胞色素 C(Cyt c)与凋亡蛋白酶活化因子 1、ATP/dATP结合,活化的Caspase-9再激活下游Caspase-3,引起细胞凋亡[15]。
AMPK激活可抑制高糖引起的血管内皮细胞中Caspase-3的活性,减少细胞凋亡[16]。而Bcl-2家族通过与其他凋亡因子相互作用而控制线粒体结构与功能,发挥细胞凋亡的主开关作用,其中Bcl-2保持线粒体外膜完整性,增加线粒体质子的外流,阻止Cyt c穿过线粒体膜进入细胞质,也发挥抗凋亡的作用[17]。
由此可见,AMPK信号通路的作用较为复杂,涉及大量因子的调控作用,而AMP、ATP、AMPKα1、Caspase-3、eNOS、PGC-1α和Bcl-2则在通路中作为多个关键调控点发挥着重要作用。
抵挡汤主要用于太阳病之下焦蓄血证,《注解伤寒论》载“苦走血,咸胜血,虻虫、水蛭之咸苦以除蓄血;甘缓结,苦泄热,桃仁、大黄之苦以下结热”。本研究采用久煎大黄法,以减轻其泻下作用而增加活血化瘀的功效。现代药理研究显示,水蛭和虻虫具有抗凝血、抗血栓和抗炎的作用;大黄具有很强的抗感染、调节免疫、降脂抗炎、止血等多种作用;桃仁可降低血管阻力、改善血流动力学,抗血栓形成,其抗炎镇痛作用显著[18]。
糖尿病属中医学“消渴”范畴,其发病过程以阴虚为本,燥热为标。阴虚内热,损津耗液,则血脉为之虚涩而成血瘀,瘀血阻络,导致脏腑气机失调,其引起的心血管并发症以动脉粥样硬化最为常见,这是糖尿病患者致死致残的主要原因,源自糖尿病的心血管事件导致的死亡率是非糖尿病患者的2~4倍[19]。血管内皮参与构成血管壁选择通透性的屏障,还可分泌多种血管活性物质,调节血管功能[20]。
本实验结果显示,抵挡汤早期干预可通过调控AMP/ATP比值,增加AMPKα1活性,从而开启AMPK激酶系统,引起eNOS磷酸化,PGC-1α级联反应,同时抑制Caspase-3活性,升高Bcl-2活性。这可能是抵挡汤调节大血管内皮细胞的能量代谢,减少内皮细胞的凋亡,促进线粒体生成,增强大血管内皮防御功能的作用,延缓糖尿病血管并发症的发生发展的内在机制。然而,由于 AMPK信号通路调控机制较为复杂,涉及大量因子在其中发挥多方面的作用,抵挡汤是否会通过调节其他关键因子而影响糖尿病血管功能改变,则需要进一步深入研究。
[1] EMOFSSON M, SIEGBANN A. Platelet-derived growth factor-BB and monocyte chemotactic protein-1 induce human peripheral blood monocytes to express tissue factor[J]. Thromb Res,1996,83(4):307-320.
[2] 常柏,潘从清,孟东,等.抵挡汤对2型糖尿病患者血管内皮功能影响的临床研究[J].天津中医药,2011,28(6):457-458.
[3] 李春深,常柏,苗戎,等.抵挡汤早期干预对糖尿病大鼠视网膜 ICAM-1 和VCAM-1表达的影响[J].北京中医药,2013,32(2):129-134.
[4] WANG X R, ZHANG M W, CHEN D D, et al. AMP-activated protein kinase rescues the angiogenic functions of endothelial progenitor cells via manganese superoxide dismutase induction in type 1 diabetes[J]. Am J Physiol Endocrinol Metab,2011,300(6):E1135-E1145.
[5] HATTORI Y, NAKANO Y, HATTORI S, et al. High molecular weight adiponectin activates AMPK and suppresses cytokine-induced NF-κB activation in vascular endothelial cells[J]. FEBS Letters,2008,582(12):1719-1724.
[6] LAGE R. AMPK:a metabolic gauge regulating whole-body energy homeostasis[J]. Trends Mol Med,2008,14(12):539-549.
[7] SONG P, WANG S, HE C, et al. AMPKα2 deletion exacerbates neointima formation by upregulating skp2 in vascular smooth muscle cells[J]. Circ Res,2011,109(11):1230-1239.
[8] HAN D, YANG B, OLSON L K, et al. Activation of autophagy through modulation of 5'-AMP-activated protein kinase protects pancreatic beta-cells from high glucose[J]. Biochem J,2010,425(3):541-551.
[9] MA X, ZHANG J, DENG R, et al. Synergistic effect of smoking with genetic variants in the AMPKα1 gene on the risk of coronary artery disease in type 2 diabetes[J]. Diabetes Metab Res Rev,2014,30(6):483-488.
[10] CREIGHTON J, JIAN M, SAYNER S, et al. Adenosine mono- phosphate activated kinaseα1 promotes endothelial barrier repair[J]. FASEB J,2011,25(10):3356-3365.
[11] DUDZINSKI D M, MICHEL T. Michel Life history of eNOS:partners and pathways[J]. Cardiovasc Res,2007,75(2):247-260.
[12] CHEN Z, PENG I C, SUN W, et al. AMP-activated protein kinase functionally phosphorylates endothelial nitric oxide synthase ser633[J]. Circ Res,2009,104(4):496-505.
[13] CHEN Z P, MITCHELHILL K I, MICHELL B J, et al. AMP-activated protein kinase phosphorylation of endothelial NO synthase[J]. FEBS Lett,1999,443(3):285-289.
[14] BERGERON R, REN J M, CADMAN K S, et al. Chronic activation of AMP kinase results in NRF-1 activation and mitochondrial biogenesis[J]. Am J Physiol Endocrinol Metab,2001,281(6):1340-1346.
[15] SNIGDHA S, SMITE D H, PRIETO G A, et al. Caspase-3 activation as a bifurcation point between plasticity and cell death[J]. Neurosci Bull,2012,28(1):14-24.
[16] SUKRITI S, TAUSEEF M, YAZBECK P, et al. Mechanisms regulating endothelial permeability[J]. Pulmonary Circulation,2014,4(4):535-551.
[17] HAYASHI T, SAKURAI M, ABE K, et al. Apoptosis of motorneurons with induction of caspases in the spinal cord after ischemia[J]. Stroke,1998,29(5):1007-1013.
[18] 沈丕安.中药药理与临床运用[M].北京:人民卫生出版社,2006:407-669.
[19] DEVEREUX R B, ROMAN M J, PARANICAS M, et al. Impact of diabetes on cardiac structure and function:the strong heart study[J]. Circulation,2000,101(19):2271-2276.
[20] RUBANYI G M. The role of endothelium in cardiovascular homeostasis and diseases[J]. J Cardiovasc Pharmacol,1993,22(Suppl 4):S1-14.
Effects of Early Intervention of Didang Decoction on AMP-activated Protein Kinase Signaling Pathway in Diabetic Rats
REN Dan-dan1,2, LI Jing1, CHANG Bai1, LI Chun-shen2, ZHU Zi-zhao1
(1. Metabolic Diseases Hospital, Tianjin Medical University, Tianjin 300070, China; 2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China)
Objective To observe the effects of the intervention of Didang Decoction at different times on changes of AMPK signaling pathway related factors in macrovascular endotheliocytes of diabetic rats; To discuss the mechanism of mitochondria energy metabolism regulating the AMPK signaling pathway for macrovascular endothelial defense function. Methods Injection of STZ into the caudal vein and administration of high fat diet wer used to generate diabetic rat model. All rats were randomly divided into the following 7 groups∶ control, model,metformin, simvastatin, early-, middle-, and late-stage Didang Decoction group. Western blot was used to detect the expressions of APMKα1 and PGC-1α in rat aortic endothelial cells. Changes in the intracellular AMP and ATP levels were detected by ELISA. Real time fluorescence quantitative PCR was used to detected mRNA expressions of Caspase-3, eNOS, and Bcl-2 in tissue of thoracic aorta. Results Compared with the model group, the expressions of AMPKα1 and PGC-1α in the early-stage and middle-stage Didang Decoction group and simvastatin group increased (P<0.05); the gene expressions of Bcl-2, and eNOS significantly increased in the early-stage Didang Decoction group and simvastatin group (P<0.05), while the expressions of Caspase-3 decreased significantly (P<0.05). The expression of ATP increased significantly and the expression of AMP decreased significantly in the early-stage Didang Decoction group and simvastatin group (P<0.05), and the best effects were shown in the early-stage Didang Decoction group. Conclusion Early intervention of Didang Decoction can enhance energy metabolism in the mitochondria ofmacrovascular endothelial cells by regulating the AMPK signaling pathway, and then plays a role in strengthening the defense function of macrovascular endothelial cells.
Didang Decoction; AMP-activated protein kinase; Caspase-3; energy metabolism; early intervention; rats
R285.5
A
1005-5304(2016)10-0072-06
2015-12-19)
(
2016-01-05;编辑:华强)
国家自然科学基金(81473622、81273914);天津市中医药管理局中医中西医结合科研课题(13111)
常柏,E-mail:changbai1972@126.com
DOl:10.3969/j.issn.1005-5304.2016.10.017

