复方钩藤降压片对自发性高血压大鼠血管重塑单核细胞趋化蛋白-1和基质金属蛋白酶-9表达的影响
冯进,张稳,卿俊,刘惠敏,谭元生,4
1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南省中医药研究院附属医院,湖南 长沙 410006;3.湖南中医药大学,湖南 长沙 410208;4.湖南省中医药研究院,湖南 长沙 410208
·实验研究·
复方钩藤降压片对自发性高血压大鼠血管重塑单核细胞趋化蛋白-1和基质金属蛋白酶-9表达的影响
冯进1,张稳1,卿俊2,刘惠敏3,谭元生3,4
1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南省中医药研究院附属医院,湖南 长沙 410006;3.湖南中医药大学,湖南 长沙 410208;4.湖南省中医药研究院,湖南 长沙 410208
目的观察复方钩藤降压片对自发性高血压大鼠(SHR)血管重塑单核细胞趋化蛋白-1(MCP-1)、基质金属蛋白酶-9(MMP-9)表达的影响,探讨其可能的作用机制。方法24只12周龄雄性SHR随机分为模型组、复方钩藤降压片组和阳性药组,每组8只,另设8只WKY大鼠为空白对照组。各给药组给予相应药物灌胃,连续6周。无创尾动脉测压法观测血压;HE染色观察大鼠胸主动脉、肾动脉形态学变化;免疫组化检测胸主动脉内皮细胞MCP-1、MMP-9的蛋白表达。结果模型组胸主动脉壁MCP-1、MMP-9蛋白表达明显高于空白对照组(P<0.01);与模型组比较,各给药组胸主动脉壁 MCP-1、MMP-9蛋白表达显著降低(P<0.05,P<0.01);复方钩藤降压片组与阳性药组比较,胸主动脉壁内皮细胞MCP-1、MMP-9蛋白表达无明显差异。结论复方钩藤降压片具有降低SHR血压,减轻炎症反应,调控血管重塑的作用,其机制可能与下调SHR胸主动脉壁内皮细胞MCP-1、MMP-9蛋白表达有关。
复方钩藤降压片;自发性高血压大鼠;血管重塑;单核细胞趋化蛋白-1;基质金属蛋白酶-9
高血压病是一种由多种病因相互作用导致的、复杂的、进行性的心血管综合征。近年来,炎症因素在高血压病的发生、发展及转归中的作用受到关注。有研究认为,高血压病是一个慢性炎症过程,可以产生炎症因子,影响血压水平,损伤血管内皮功能,加速血管重塑。前期研究表明,复方钩藤降压片具有降低血压,逆转心脏、肾脏的超微结构,减少血管的损伤,减轻高血压炎症反应等作用[1-5]。本实验通过观察复方钩藤降压片对自发性高血压大鼠(SHR)血管重塑相关炎症因子单核细胞趋化蛋白-1(MCP-1)、基质金属蛋白酶-9(MMP-9)蛋白表达的影响,探讨其可能的作用机制。
1 实验材料
1.1动物
SHR 24只、WKY大鼠8只,清洁级,雄性,体质量180~220 g,鼠龄12周,北京维通利华实验技术有限公司,动物合格证号SCXK(京)2012-0001。分8笼饲养,每笼4只,室温22 ℃~25 ℃、湿度50%~60%,人工光照时间明暗各半、环境安静。喂饲相同标准饲料(湖南斯莱克景达实验动物有限公司)、实验用三级用水(湖南中医药大学东塘校区综合楼实验室)。
1.2药物
复方钩藤降压片,湖南中医药大学第一附属医院药剂制剂中心,0.4 g/片,批号131209;厄贝沙坦片,法国赛诺菲制药公司,150 mg/片,批号4A449。
1.3主要试剂与仪器
血清MCP-1、MMP-9免疫组化试剂盒,长沙丽欣生物技术有限公司;BP98A无创血压检测仪,北京软隆科技有限责任公司;TDZ4 WS低速台式离心机,长沙湘仪仪器厂;LEICA DM LB2型双目显微镜,德国LEICA公司;Motic B5显微摄像系统,麦克奥迪实业集团公司;MIAS医学图象分析系统,北航公司;Shandon325型石蜡切片机,英国Shandon公司。
2 实验方法
2.1分组与给药
先将SHR按血压分层,随机将24只SHR分为模型组、复方钩藤降压片组、阳性药组,每组8只。以8只WKY大鼠为空白对照组。按成人体质量70 kg折算,按成人临床用药剂量折合大鼠等效剂量。复方钩藤降压片组:用蒸馏水将复方钩藤降压片配成混悬液,予439.77 mg/(kg·d)灌胃;阳性药组:用蒸馏水将厄贝沙坦片配成混悬液,予13.74 mg/(kg·d)灌胃;模型组和空白对照组给予等量蒸馏水灌胃。每日9∶00按10 mL/kg给药,连续6周。
2.2标本采集
第6周测完血压后,大鼠10%水合氯醛(4 mL/kg)腹腔注射麻醉,打开胸腔、腹腔,取血后分离胸主动脉、肾动脉,置于10%甲醛固定24 h。
2.3观察指标
2.3.1大鼠尾动脉收缩压测量各组于灌胃后 2 h开始专人测量血压,每周1次,保持环境安静、恒温(25 ℃)、清醒非激怒状态下测量大鼠尾动脉收缩压,将大鼠固定装置和测量主机电预热30 min,大鼠置于固定网套中通过尾套固定,预热10 min,使尾部动脉扩张,再将压脉套套至大鼠尾部近心端,1/3在大鼠尾,打开脉冲波形记录系统,充气使压力上升到动脉搏动消失,然后慢慢放气,读取血压值,此即尾动脉收缩压,重复测量3次,取平均值。
2.3.2胸主动脉、肾动脉组织形态学观察用75%~100%乙醇梯度脱水;浸蜡、包埋、切片(4 μm),60 ℃烤片机烘烤12 h,置于4 ℃冰箱中备用。切片脱蜡至水、HE染色、二甲苯透明中性树胶封片,待玻片干后,从低倍镜至高倍镜各拍取1张,光学显微镜下观察组织病理变化。
2.3.3胸主动脉壁内皮细胞单核细胞趋化蛋白-1、基质金属蛋白酶-9蛋白表达测定按免疫试剂盒说明方法进行操作。先将组织切片在二甲苯中脱蜡,持续10~15 min,然后放在100%、95%、80%梯度乙醇脱水,脱水时间为每个浓度10 min,然后用蒸馏水洗涤2次×5 min。再封闭内源性过氧化物酶、微波炉加热修复抗原、正常羊血清封闭液滴添加到每张切片进行非特异性抗原封闭、滴加第一抗体、滴加生物素化抗小鼠IgG、DAB显色、蒸馏水终止显色、脱水、透明等处理,采集图像。应用MOTIC图像分析软件对所取图片定量分析,阳性信号为胞质或胞核呈现棕黄色颗粒,测定阳性颗粒的平均光密度(AOD)值。AOD值越大阳性越强,AOD值越小阳性越弱。
3 统计学方法
4 结果
4.1复方钩藤降压片对模型大鼠尾动脉收缩压的影响
与空白对照组比较,模型组SHR尾动脉收缩压明显升高(P<0.01);与模型组比较,除第0周外,各给药组SHR尾动脉收缩压明显降低(P<0.05,P<0.01),但阳性药组较复方钩藤降压片组降低明显(P<0.05)。结果见表1。
表1 各组大鼠尾动脉收缩压比较(±s,mm Hg)
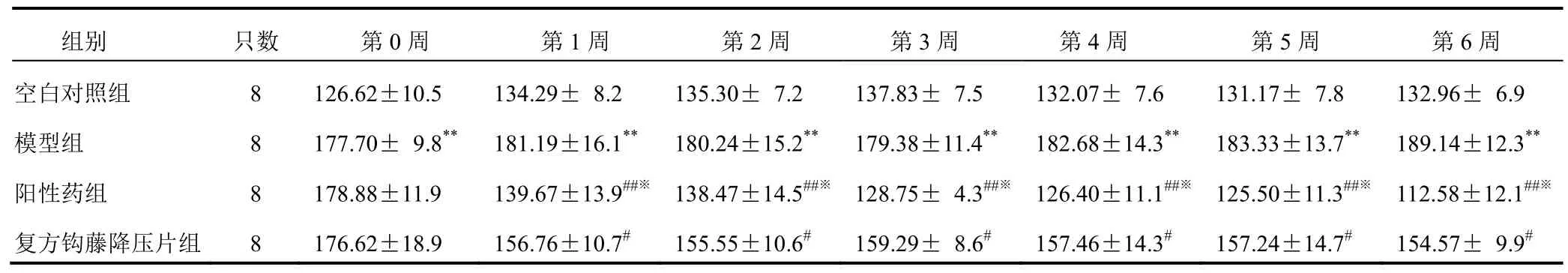
表1 各组大鼠尾动脉收缩压比较(±s,mm Hg)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与复方钩藤降压片组比较,※P<0.05
组别 只数 第0周 第1周 第2周 第3周 第4周 第5周 第6周空白对照组 8 126.62±10.5 134.29± 8.2 135.30± 7.2 137.83± 7.5 132.07± 7.6 131.17± 7.8 132.96± 6.9模型组 8 177.70± 9.8** 181.19±16.1** 180.24±15.2** 179.38±11.4** 182.68±14.3** 183.33±13.7** 189.14±12.3**阳性药组 8 178.88±11.9 139.67±13.9##※138.47±14.5##※128.75± 4.3##※126.40±11.1##※ 125.50±11.3##※112.58±12.1##※复方钩藤降压片组 8 176.62±18.9 156.76±10.7# 155.55±10.6# 159.29± 8.6# 157.46±14.3# 157.24±14.7# 154.57± 9.9#
4.2复方钩藤降压片对模型大鼠胸主动脉病理形态的影响
空白对照组胸主动脉内膜与内膜上皮完整,中膜平滑肌细胞核、弹性纤维完整,外膜与中膜分界明显;模型组胸主动脉内膜与内膜上皮局部有斑块,内膜上有少量炎症细胞附着,内皮细胞不完整,中膜外层平滑肌细胞核、弹性纤维排列不整齐,外膜与中膜分界欠佳;阳性药组胸主动脉内膜与内膜上皮基本完整,内膜上有单个炎症细胞附着,中膜平滑肌细胞核、弹性纤维排列整齐,外膜与中膜分界欠佳,外膜正常;复方钩藤降压片组胸主动脉内膜与内膜上皮完整,中膜平滑肌细胞核、弹性纤维排列整齐,外膜与中膜分界清楚。结果见图1。
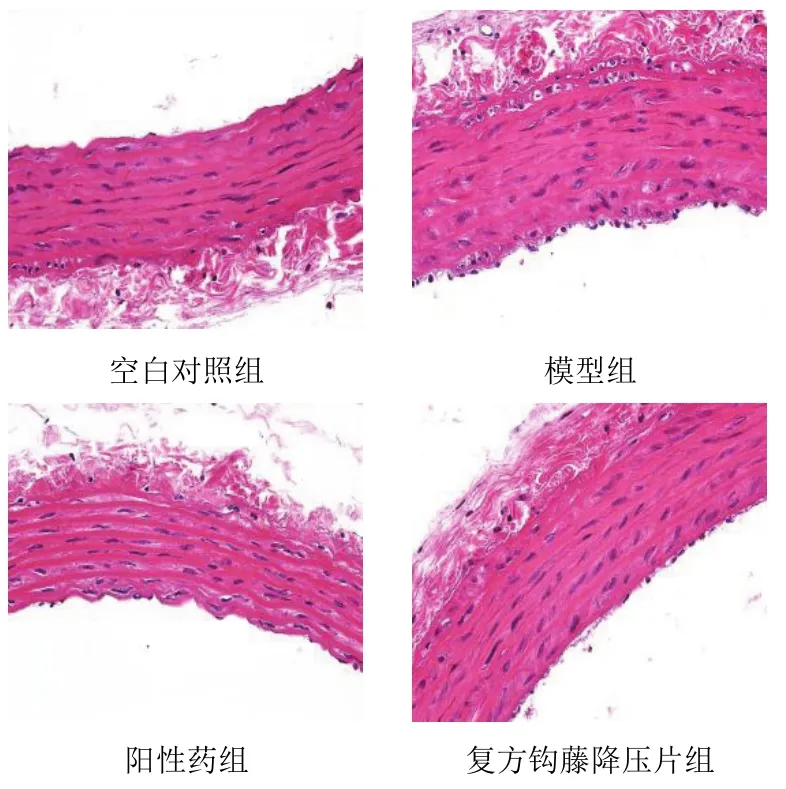
图1 各组大鼠胸主动脉病理形态(HE染色,×400)
4.3复方钩藤降压片对模型大鼠肾动脉病理形态的影响
空白对照组肾动脉内膜与内膜上皮完整,中膜平滑肌细胞核、纤维完整,外膜正常;模型组肾动脉内膜与内膜上皮大多数完整,局部有缺损,中膜平滑肌细胞核、纤维排列紊乱,外膜正常;阳性药组肾动脉内膜与内膜上皮完整,中膜平滑肌细胞核、纤维基本正常,外膜正常;复方钩藤降压片组肾动脉内膜与内膜上皮完整,中膜平滑肌细胞核、纤维排列正常,外膜正常。结果见图2。
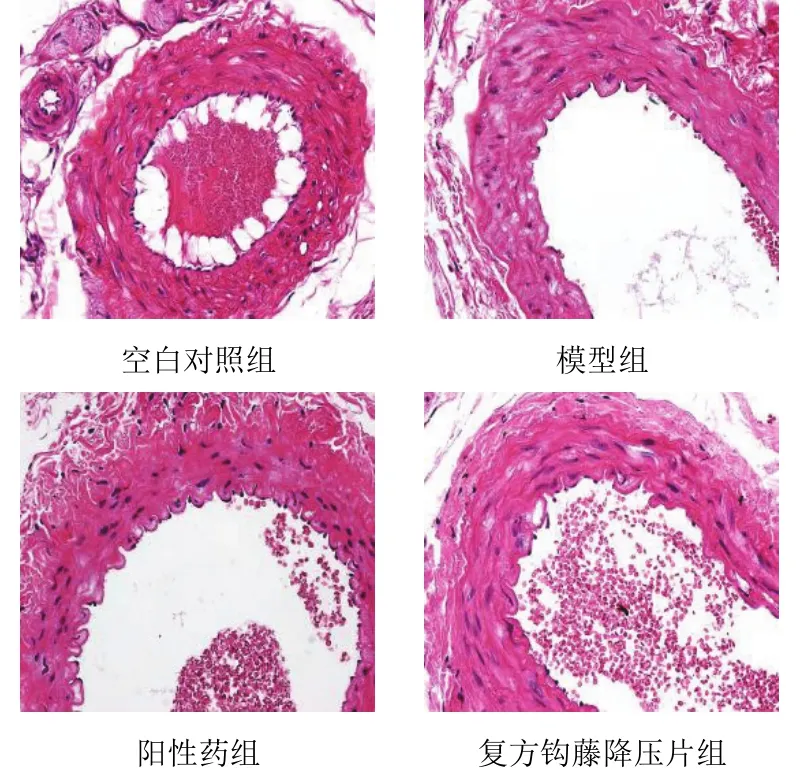
图2 各组大鼠肾动脉病理形态(HE染色,×400)
4.4复方钩藤降压片对模型大鼠胸主动脉壁单核细胞趋化蛋白-1、基质金属蛋白酶-9蛋白表达的影响
空白对照组胸主动脉壁内膜与内膜上皮弱阳性,中膜小部分平滑肌细胞核弱阳性,外膜纤维部分弱阳性;模型组胸主动脉壁内膜与内膜上皮阳性,中膜部分平滑肌细胞核阳性,外膜纤维阳性;阳性药组胸主动脉壁内膜与内膜上皮轻度阳性,中膜少量平滑肌细胞核弱阳性,外膜纤维部分弱阳性;复方钩藤降压片组胸主动脉壁内膜与内膜上皮轻度阳性,中膜少量平滑肌细胞核弱阳性,外膜纤维部分弱阳性。阳性颗粒为棕黄色,主要位于细胞核中,见图3。空白对照组胸主动脉内膜与内膜上皮强阳性,中膜少数平滑肌细胞核弱阳性,外膜纤维强阳性;模型组胸主动脉内膜与内膜上皮强阳性,中膜部分平滑肌细胞核、胞质弱阳性,外膜纤维强阳性;阳性药组胸主动脉内膜与内膜上皮强阳性,中膜少量平滑肌细胞核弱阳性,外膜纤维强阳性;复方钩藤降压片组胸主动脉内膜与内膜上皮强阳性,中膜近内膜部平滑肌细胞核弱阳性,外膜纤维强阳性。阳性颗粒为棕黄色,主要位于细胞核、细胞质中,见图4。与空白对照组比较,模型组胸主动脉壁内皮细胞MCP-1、MMP-9蛋白表达显著升高,差异有统计学意义(P<0.01);与模型组比较,各给药组胸主动脉壁内皮细胞MCP-1、MMP-9蛋白表达显著降低,差异有统计学意义(P<0.05,P<0.01)。见表2。
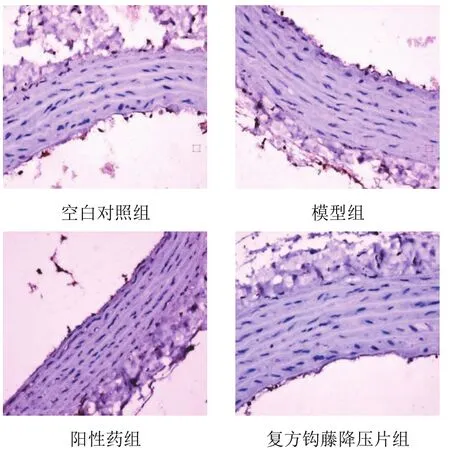
图3 各组大鼠胸主动脉壁内皮细胞MCP-1病理形态(免疫组化染色,×400)
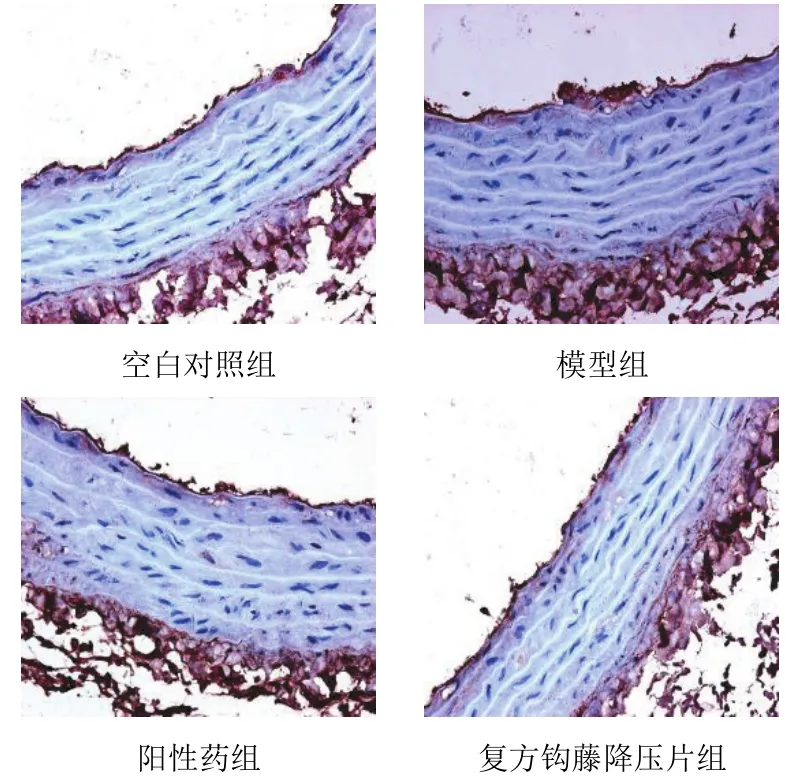
图4 各组大鼠胸主动脉壁内皮细胞MMP-9病理形态(免疫组化染色,×400)
表2 各组大鼠胸主动脉壁内皮细胞MCP-1、MMP-9蛋白表达比较(±s,AOD值)
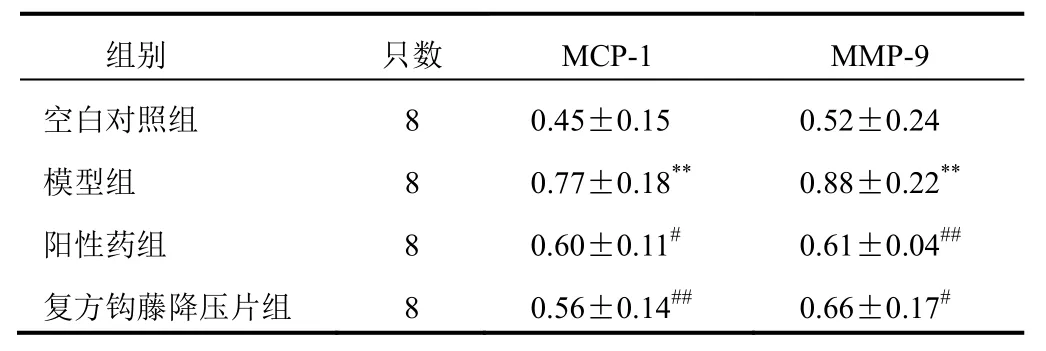
表2 各组大鼠胸主动脉壁内皮细胞MCP-1、MMP-9蛋白表达比较(±s,AOD值)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 只数 MCP-1 MMP-9空白对照组 8 0.45±0.15 0.52±0.24模型组 8 0.77±0.18** 0.88±0.22**阳性药组 8 0.60±0.11# 0.61±0.04##复方钩藤降压片组 8 0.56±0.14## 0.66±0.17#
5 讨论
血管重塑是心血管疾病的靶器官损害的共同病理基础,贯穿于高血压病发生、发展的整个过程。有研究者利用自发性高血压卒中型大鼠脑模型研究血管重塑,发现动脉壁平滑肌细胞重新排列和平滑肌细胞增生,血管反应性的改变直接侵犯管腔等均可导致血管扩张、管壁肥厚、血管重塑[6]。
有研究显示,MCP-1、MMP-9等炎症因子与高血压病血管重塑密切相关[7]。MCP-1属于趋化因子,在众多SHR模型中,检测到靶器官内MCP-1表达均增强;有研究显示,MCP-1对单核/巨噬细胞及T淋巴细胞有强烈化学趋化性[8]。MMP-9是基质金属蛋白酶家族成员中明胶酶的一种,是一种炎症标记物。高血压时,血压异常波动容易导致血管内皮功能受损,并伴有大量的炎性细胞因子参与炎症因子的表达,可刺激MMP-9增强[7];研究表明,增强MMP-9的表达和活性,将影响众多心血管疾病的发生和发展,尤其与高血压相关[9-11];Derosa等[12]发现高血压病患者心脏和血液中MMP-9、MMP-2表达均上调;Tayebjee等[13]研究发现,高血压病患者血浆MMP-9水平在治疗前显著升高,标准治疗后均下降,且血浆 MMP-9浓度与心血管危险呈正相关趋势。
高血压病属中医学“眩晕”范畴,多为本虚标实之证,肝肾亏虚为其本,风、瘀为其标。复方钩藤降压片是基于阴虚-阳亢-络阻机制而设立,方中钩藤清热平肝、熄风定惊,为君药。川芎活血化瘀、行气止痛;麦冬养阴生津、滋补肝阴,使肝阳平复,肝风自灭,与川芎共为臣药。诸药合用,共奏养阴、清热、柔肝、活血通络之效。本研究结果显示,模型组较空白对照组 MCP-1、MMP-9表达呈上升趋势,提示MCP-1、MMP-9参与高血压病血管重塑。叶氏等[14]发现复方钩藤降压片能有效地降低 SHR血压及逆转左室肥厚;能明显降低胸主动脉中膜厚度,抑制胸主动脉血管重塑;显著促进血管内皮依赖性舒张功能,抑制血管重构。本研究表明,复方钩藤降压片对SHR具有较好的降压效果,与前期实验结果一致,降压温和、平稳。该方能减轻炎症反应,调控血管重塑,保护靶器官。此作用可能是通过下调胸主动脉壁内皮细胞MCP-1、MMP-9蛋白表达而实现的。
[1] 谭元生,王宇红.复方钩藤降压片对自发性高血压大鼠的降压作用及其机制[J].中国中医急症,2012,21(1):52-54.
[2] 张稳,范建民,唐莹,等.复方钩藤降压片对2K1C-RHR血压及RAAS的影响[J].医学信息,2013,26(7):85-86.
[3] 叶舒婷,谭超,黄娟娟,等.复方钩藤降压片治疗高血压病左室肥厚(阴虚阳亢、瘀血阻络证)31例临床观察[J].中医药导报,2013,19(5):8-10.
[4] 黄娟娟,谭元生.复方钩藤降压片治疗原发性高血压阴虚阳亢挟瘀证疗效及对 Cys C、hs-CRPr的影响[J].湖南中医药大学学报,2013,33(7):72-75.
[5] 张稳.基于RAAS系统探讨复方钩藤降压片对2K1C-RHR作用效果的实验及临床研究[D].长沙:湖南中医药大学,2011.
[6] 许康.高血压血管重塑机制研究进展[J].实用医学杂志,2010,26(20):3827-3829.
[7] YASMIN, MCENIERY C M, WALLACE S, et al. Matrix metalloproteinase-9 (MMP-9), MMP-2, and serum elastase activity are associated with systolic hypertension and arterial stiffness[J]. Arterioscler Thromb Vasc Biol,2005,25(2):372.
[8] 吴文娜.MCP-1的表达与高血压病动脉粥样硬化的关系[J].实用医学杂志,2011,27(15):2876-2879.
[9] GASANOV A G, BERSHOVA T V. The role of changes of matrix metalloproteinase in cardiovascular diseases[J]. Biomed Khim,2009,55(2):155-168.
[10] BERK B C, FUJIWARA K, LEHOUX S. ECM remodeling in hypertensive heart disease[J]. Clin Invest,2007,117(3):568-575.
[11] SUNDSTROM J, EVANS J C, BENJAMIN E J, et al. Relations of plasma matrix metalloproteinase-9 to clinical cardiovascular risk factors and echocardiographic left ventricular measures:the Framingham Heart Study[J]. Circulation,2004,109(23):2850-2856.
[12] DEROSA G, D'ANGELO A, CICCARELLI L. Matrix metalloproteinase-2, -9 and tissue inhibitor of metalloproteinase-1 in patients with hypertension[J]. Endothelium,2006,13(3):227-231.
[13] TAYEBJEE M H, NADAR S, BLANN A D, et al. Matrix metalloproteinase-9 and tissue inhibitor of metal oproteinase-1 in hypertension and their relationship to cardiovascular risk and treatment:a substudy of the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT)[J]. Am J Hyperterm,2009,17(9):764-769.
[14] 叶舒婷,谭超,黄娟娟,等.复方钩藤降压片治疗高血压病左室肥厚(阴虚阳亢、瘀血阻络证)31例临床观察[J].中医药导报,2013,19(5):8-10.
Effects of Compound Uncaria Hypotensive Tablets on Expressions of MCP-1 and MMP-9 of Vascular Remodeling in Spontaneously Hypertensive Rats
FENG Jin1,
ZHANG Wen1, QING Jun2,LIU Hui-min3, TAN Yuan-sheng3,4
(1. The First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha 410007, China; 2. Affiliated Hospital of Hunan Academy of Chinese Medicine, Changsha 410006, China;3. Hunan University of Chinese Medicine, Changsha 410208, China; 4. Hunan Academy of Chinese Medicine,Changsha 410208, China)
Objective To observe the effects of Compound Uncaria Hypotensive Tablets on expressions of MCP-1 and MMP-9 of vascular remodeling in spontaneously hypertensive rats (SHR); To discuss it possible mechanism of action. Methods Totally 24 12-week old male SHR were randomly divided into SHR model group, Compound Uncaria Hypotensive Tablets group, and positive medicine group, with 8 rats in each group. Another 8 WKY rats were set as normal control group. Medication groups were given relevant medicine for gavage for successive 6 weeks. Noninvasive tail cuff method was used to observe blood pressure; morphological changes in thoracic aorta and renal artery were observed by HE staining; immunohistochemistry was used to detect the protein expressions of MCP-1 and MMP-9 in thoracic aortic wall. Results Protein expressions of MCP-1 and MMP-9 in thoracic aortic wall of SHR model group were significantly higher than those of normal control group (P<0.01); Compared with the SHR model group, protein expressions of MCP-1 and MMP-9 in thoracic aortic wall decreased significantly in the medication groups (P<0.05, P<0.01); Compared the Compound Uncaria Hypotensive Tablets group and positive medicinegroup, there was no obvious difference in protein expressions of MCP-1 and MMP-9 in thoracic aortic wall. Conclusion Compound Uncaria Hypotensive Tablets can reduce the blood pressure of SHR, reduce inflammation reaction, and regulate vascular remodeling, which mechanism may be related to down-regulation of expressions of MCP-1 and MMP-9 in SHR aortic endothelial cells.
Compound Uncaria Hypotensive Tablets; spontaneously hypertensive rats; vascular remodeling;MCP-1; MMP-9
R285.5
A
1005-5304(2016)10-0051-05
2016-01-10)
(
2016-02-26;编辑:华强)
国家自然科学基金(81473616);湖南省科技厅重点项目(2013SK2025);湖南省教育厅重点项目(15A142);湖南省中医药管理局重点项目(201403);湖南省中药粉体与创新药物省部共建国家重点实验室开放基金(ZYFT201503)
谭元生,E-mail:tys702@126.com
DOl:10.3969/j.issn.1005-5304.2016.10.013

