西番莲离体快繁研究
董丽兰,岑秀芬,韦鹏霄
(1.广西贺州市平桂管理区水果生产办公室,广西贺州 542827;2.广西大学农学院,广西南宁 530005)
西番莲离体快繁研究
董丽兰1,岑秀芬2*,韦鹏霄2
(1.广西贺州市平桂管理区水果生产办公室,广西贺州 542827;2.广西大学农学院,广西南宁 530005)
[目的] 建立西番莲快速高效的离体再生系统。[方法]采用西番莲一年生茎段、叶片及叶柄为离体培养材料,对诱导部位的选择、不同取材时间、愈伤组织诱导与分化、不定芽继代增殖、生根诱导等方面进行研究。[结果]MS+6-BA 1.0 mg/L+NAA 0.2 mg/L +TDZ 0.05 mg/L组合较优,其嫩茎尖诱导率为96.6%,嫩叶柄为88.4%,嫩叶片为83.5%;MS+6-BA 1.0 mg/L +NAA 0.5 mg/L +TDZ 0.05 mg/L组合为最优组合,分化丛生芽率为92.8%;MS+6-BA 2 mg/L +NAA 0.2 mg/L +TDZ 0.05 mg/L组合不定芽诱导率达90.9%;MS+6-BA 2.5 mg/L +NAA 0.2 mg/L组合芽增殖倍数为2.91;1/2MS+NAA 2 mg/L +PP3330.5 mg/L组合平均生根数为1.3条;1/2MS+NAA 2 mg/L +ABT 0.5 mg/L组合生根率为95.4%;1/2MS+NAA 2 mg/L +IBA 0.5 mg/L组合平均根长为1.23 cm。[结论]该研究为今后西番莲的选育及综合利用奠定基础。
西番莲;组织培养;快速繁殖
西番莲(Passifloraedulis),俗称百香果、鸡蛋果、热情之果,属西番莲科西番莲属多年生草质到半木质藤本攀缘性热带及亚热带果树[1-2],主要分布于台湾、广西、云南、福建、广东、浙江及西川等省[3]。西番莲果实中富含VC等多种维生素、矿物质元素、还原糖、蛋白质及人体需要的17种氨基酸等,其根、茎、叶、花均可入药,集果用、药用、油用和绿化观赏为一体,经济价值非常高。近年来西番莲生产规模不断扩大,生产发展迅速,被称为第3代新兴果树[4]。
西番莲的繁殖方式以有性繁殖和无性繁殖为主。有性繁殖主要是种子繁殖。用种子繁殖出来的实生苗木,虽然根系较强大,抗逆性较强,但存在营养生长偏旺,开花结果较少、较迟,变异较大,产量不稳定,果实大小不均匀,果实内可溶性固形物含量降低,风味变差,香味变淡以及出汁率变低等问题。无性繁殖主要是用蔓条扦插繁殖。由于不加选择地随意压藤繁殖,加快了品种的退化,极易感染茎腐病,产量大大降低。而组织培养作为细胞水平的一种现代生物技术,具有繁殖系数大、繁殖周期短、去除病毒迅速、可周年生产等优点。笔者从外植体的选择、灭菌、不同激素种类的选择等方面,研究西番莲离体培养快繁技术,以期为其工厂化育苗提供技术参考。
1 材料与方法
1.1试验材料西番莲取自广西大学农学院植物组织培养中心顶楼苗圃。选取当年新抽、无病虫危害、生长健壮的紫果西番莲作为外植体。
1.2试验方法
1.2.1外植体的灭菌。将取回的嫩枝用自来水冲洗干净,置于饱和洗洁精溶液中浸泡10 min并用软毛刷刷洗表面灰尘,然后用流水冲洗30 min,将冲洗好的材料置于超净工作台上。先用75%乙醇棉球擦试材料表面,然后按叶片、叶柄、茎段分别剪切并放置于各个灭菌瓶中,最后用0.1%HgCl214 min+10%NaClO 10 min 2种灭菌剂组合进行灭菌处理,在灭菌过程中为保证灭菌剂全面浸透外植体,要不断地摇晃灭菌瓶。灭菌完毕后用无菌水冲洗4~5次,每次间隔1~2 min,最后用无菌滤纸吸干外植体表面的水分备用。
1.2.2愈伤组织的诱导。将西番莲嫩茎尖、嫩叶柄及嫩叶片接入2,4-D、NAA、KT、CPPU、TDZ激素的不同组合及浓度的MS培养基中,设置5个处理,每个处理8瓶,每瓶接种3个,3次重复,统计愈伤组织平均诱导率,探讨不同激素组合对西番莲外植体愈伤组织诱导的影响。
1.2.3愈伤组织分化丛生芽的诱导。将西番莲叶柄、叶片及无节茎3个不同部位诱导出的愈伤组织接入6-BA、NAA、KT、CPPU、TDZ激素的不同组合及浓度的MS培养基中,设置5个处理,每个处理8瓶,每瓶接种3个,3次重复,统计成活率,探讨不同激素组合对西番莲愈伤组织分化丛生芽的影响。
1.2.4茎段初代培养不定芽诱导。将西番莲初代诱导的不定芽接入6-BA、NAA、KT、TDZ激素的不同组合及浓度的MS培养基中,设置5个处理,每个处理8瓶,每瓶接种3个,3次重复,统计成活率,探讨不同激素组合对不定芽诱导效果的影响。
1.2.5不定芽的继代增殖。将诱导、分化培养所得的不定芽分成单株,转接至不同浓度6-BA的培养基中诱导。设置5个处理,每个处理8瓶,每瓶接种3个,3次重复,计算芽增殖倍数,探讨不同激素组合对不定芽增殖的影响。
1.2.6组培苗生根培养。将继代增殖培养所得的无根芽苗分成单株,接种至NAA、PP333、IBA激素的不同组合及不同浓度的1/2MS培养基中,设置5个处理,每个处理8瓶,每瓶接种1个,3次重复,测定平均根长和平均生根数,统计生根率,探讨激素组合对生根诱导效应的影响。
2 结果与分析
2.1不同激素组合对愈伤组织诱导的影响由表1可知,不同激素组合对西番莲愈伤组织诱导有很大差异。在E1~E12处理中,E6愈伤组织诱导率最低,只有64.2%,E10愈伤组织诱导率最高为96.6%,除处理E1和E12差异不显著外,其他处理间诱导率差异达极显著水平。以MS+6-BA 1.0 mg/L +NAA 0.2 mg/L +TDZ 0.05 mg/L组合对嫩茎尖愈伤组织诱导效果最好,诱导率最高。
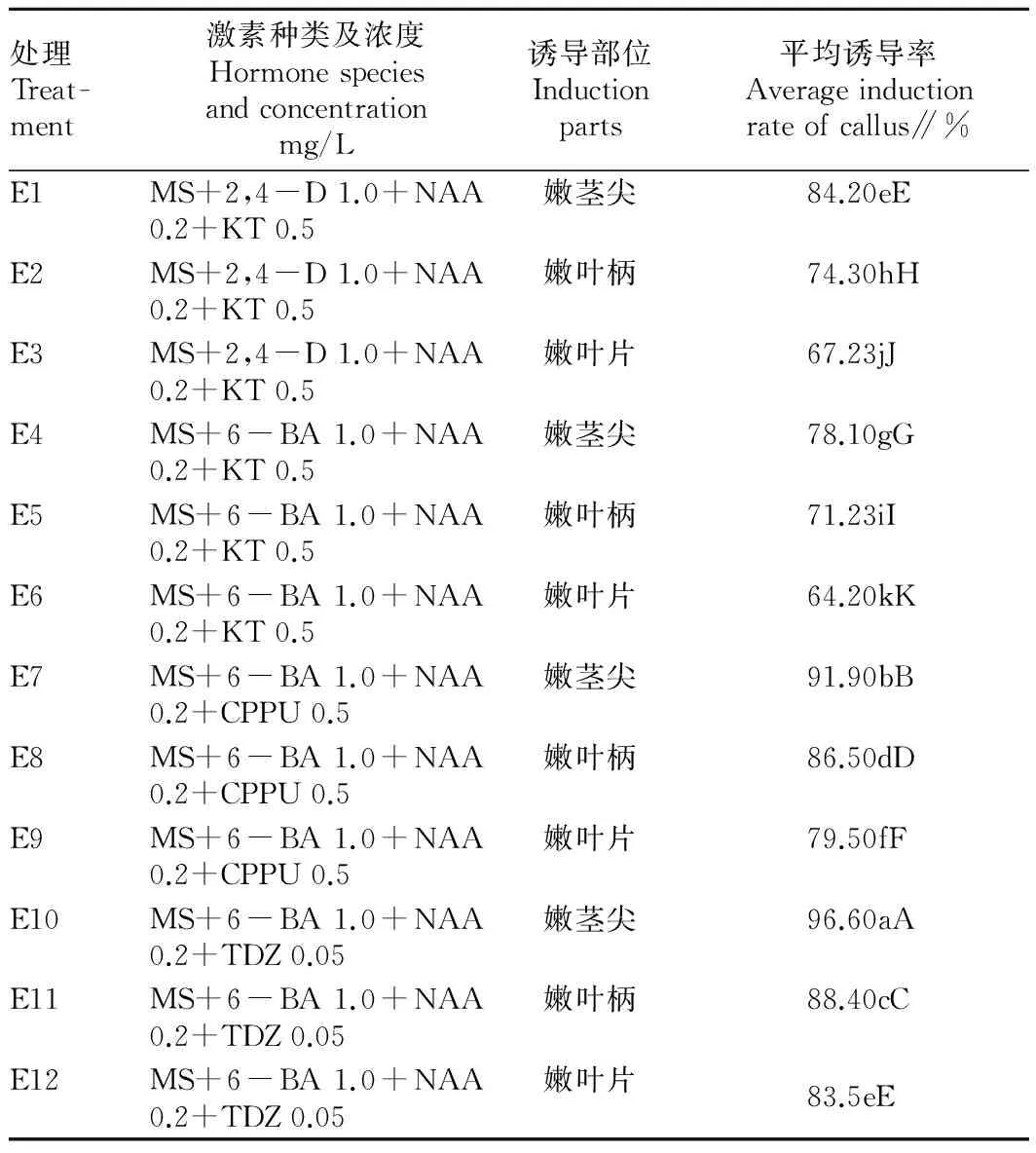
表1 不同外植体部位对愈伤组织诱导的影响
2.2不同激素组合对愈伤组织分化丛生芽的影响由表2可知,不同激素组合对西番莲愈伤组织分化丛生芽有很大差异。在F1~F5处理中,F1(CK)愈伤组织分化率最低为70.23%,F5愈伤组织分化率最高为92.8%,各处理分化率由高到低依次为F5、F4、F3、F2、F1(CK组),不同处理间分化率差异达极显著水平,以MS+6-BA 1.0 mg/L+NAA 0.5 mg/L +TDZ 0.05 mg/L对愈伤组织分化效果最好,分化率最高。2.3不同激素组合对不定芽诱导效果的影响由表3可知,在西番莲初代培养中,不同激素组合对不定芽诱导有不同的效果,在6个处理中,同一激素组合不同浓度其以高浓度的诱导效果优于低浓度不定芽诱导效果。从激素的生理效应看,6-BA>KT,以MS+6-BA 2 mg/L +NAA 0.2 mg/L+TDZ 0.05 mg/L组合对不定芽诱导成活率最高,诱导率为90.9%,组合之间不定芽诱导成活率由高到低依次为G5、G2、G1、G6、G4、G3,除G1和G6之间诱导率差异显著外,其他处理均达极显著差异。
表2不同激素组合对愈伤组织分化丛生芽的影响
Table 2Effects of different hormone combinations on callus differentiated shoots
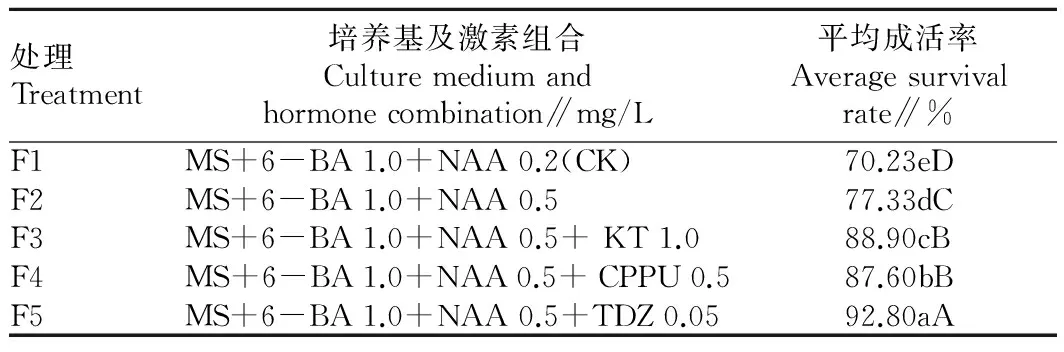
处理Treatment培养基及激素组合Culturemediumandhormonecombination∥mg/L平均成活率Averagesurvivalrate∥%F1MS+6-BA1.0+NAA0.2(CK)70.23eDF2MS+6-BA1.0+NAA0.577.33dCF3MS+6-BA1.0+NAA0.5+KT1.088.90cBF4MS+6-BA1.0+NAA0.5+CPPU0.587.60bBF5MS+6-BA1.0+NAA0.5+TDZ0.0592.80aA
表3不同激素组合对不定芽诱导效果的影响
Table 3Effects of different hormone combinations on induction of adventitious buds
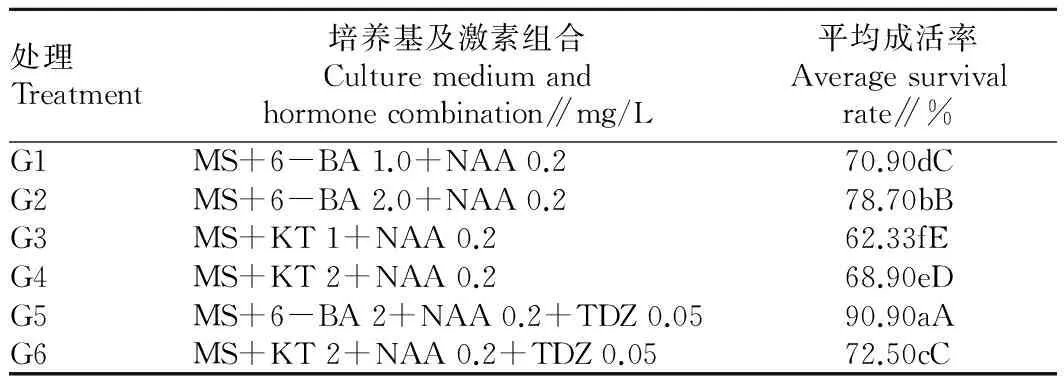
处理Treatment培养基及激素组合Culturemediumandhormonecombination∥mg/L平均成活率Averagesurvivalrate∥%G1MS+6-BA1.0+NAA0.270.90dCG2MS+6-BA2.0+NAA0.278.70bBG3MS+KT1+NAA0.262.33fEG4MS+KT2+NAA0.268.90eDG5MS+6-BA2+NAA0.2+TDZ0.0590.90aAG6MS+KT2+NAA0.2+TDZ0.0572.50cC
2.4不同浓度6-BA与NAA组合对不定芽增殖的影响由表4可知,不同浓度6-BA与NAA组合对西番莲不定芽增殖有不同的影响。当NAA固定浓度0.2 mg/L分别与6-BA 0.5~2.5 mg/L等梯度的5个浓度配合使用时,不定芽增殖倍数随着6-BA浓度的增大而增大,各浓度处理中芽增殖倍数差异达极显著水平,以MS+6-BA 2.5 mg/L +NAA 0.2 mg/L组合效果最佳,芽增殖倍数达2.91。
表4不同浓度6-BA与NAA组合对不定芽增殖的影响
Table 4Effects of different concentration of 6-BA and NAA combination on adventitious buds proliferation ofP.caerulea

处理Treatment6-BA浓度6-BAconcentration∥mg/L芽增殖倍数BudproliferationtimesH10.51.20aAH21.01.68bBH31.52.08cCH42.02.50dDH52.52.91eE
2.5不同激素组合对生根诱导效应的影响由表5可知,不同激素组合对生根诱导有不同的效果。在5个处理中,组合之间平均生根数由多到少依次为I3、I5、I4、I2、I1,处理间差异显著,但平均根数达1.3条的组合1/2MS+NAA 2 mg/L +PP3330.5 mg/L生根率只有88.4%,平均长度只有0.93 cm,而生根率最高95.4%的组合为1/2MS+NAA 2 mg/L +ABT 0.5 mg/L,平均根长最长1.23 cm的组合为1/2MS+NAA 2 mg/L +IBA 0.5 mg/L
表5不同激素组合对生根诱导效应的影响
Table 5Effects of different hormone combinations on rooting induction
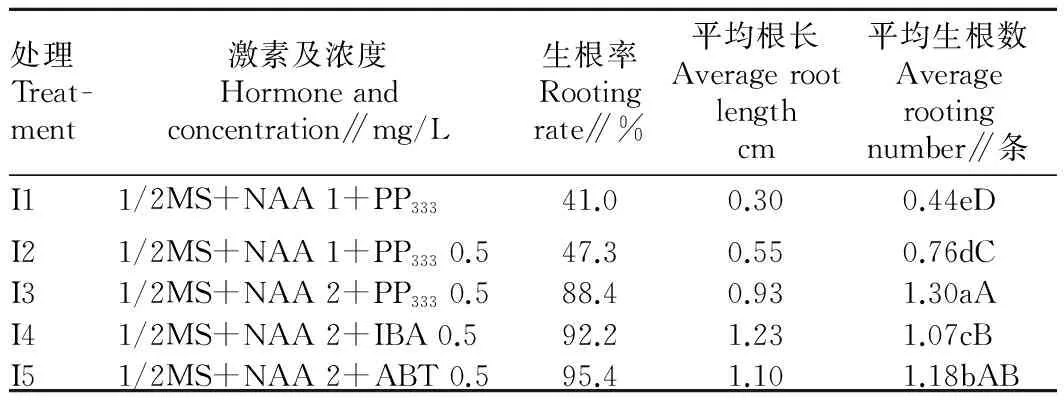
处理Treat-ment激素及浓度Hormoneandconcentration∥mg/L生根率Rootingrate∥%平均根长Averagerootlengthcm平均生根数Averagerootingnumber∥条I11/2MS+NAA1+PP33341.00.300.44eDI21/2MS+NAA1+PP3330.547.30.550.76dCI31/2MS+NAA2+PP3330.588.40.931.30aAI41/2MS+NAA2+IBA0.592.21.231.07cBI51/2MS+NAA2+ABT0.595.41.101.18bAB
3 讨论
从田间直接采取的西番莲外植体,由于其携带大量的外源微生物,且植物体本身带有内生细菌,因此,在进行组织培养时,如何成功地对其灭菌是进行后续研究的前提。同时,茎段过嫩或过老,均不利于灭菌效果。过嫩,则在灭菌过程中极易被灭菌剂损伤,造成外植体无法萌发;过老,则外植体内含菌类较多,既提高了灭菌难度也不利于芽的产生和生长。另外,污染率还与灭菌剂种类、灭菌时间、操作过程中的每个环节以及外植体的带菌程度、外植体结构等因素有关。因此,在实际应用中,可根据外植体的幼嫩程度,取材季节的不同以及灭菌部位的不同,选择合适的灭菌剂种类、浓度及灭菌时间,从而提高西番莲的灭菌效果。
植物生长调节剂对植物离体培养具有重要的调控作用。选择合适的生长调节剂种类和浓度是愈伤组织诱导及分化的关键因素。该试验过程中发现,不同部位的外植体所含的植物激素水平不同,其所需要的激素种类及浓度也不尽相同[5]。因此,西番莲外植体不同部位也是影响其愈伤组织诱导与分化的另一因素。
诱导西番莲生根的无菌幼苗,首先要选择生活力强、健壮的幼苗,对于生长不良的小苗、弱苗、老化苗、发黄苗因其不利于生根,要淘汰掉。其次,培养基不能是高盐成分的培养基,因培养基中含盐量过高不利于根的生长。最后,选择植物激素种类和浓度是关键,因不同植物生长所需的环境条件不同,即使是相同植物,不同季节及不同部位所产生的无菌苗所需的生根条件也不同,因此,在诱导西番莲生根时要综合考虑。
[1] 余东,熊丙全,袁军,等.西番莲种质资源概况及其应用研究现状[J].中国南方果树,2005,34(1):36-37.
[2] 陈金伟.保健佳果:西番莲[J].中国中医药报,2006(4):1.
[3] 赵苹,焦懿,赵虹.西番莲的研究现状及在中国的利用前景[J].资源科学,1999,2(3):77-79.
[4] 张勇,熊丙全,曾明.种子处理对西番莲活力及苗木生长的影响[J].西南农业学报,2003,25(4):136-137.
[5] 张婷婷,吴田,张瑞丽,等.紫果西番莲种子萌发及根部诱导愈伤组织研究[J].西南农业学报,2013,26(3):1148-1151.
Research on Rapid PropagationinvitroofPassifloracaeruleaL.
DONG Li-lan1, CEN Xiu-fen2, WEI Peng-xiao2
(1. Fruit Production Office of Pinggui District in Hezhou, Hezhou, Guangxi 542827; 2. Agricultural College of Guangxi University, Nanning, Guangxi 530005)
[Objective] The aim was to build a fast and efficient regeneration system ofPassifloracaeruleaL.invitro. [Method] One year stems, leaves and petioles ofP.caeruleawere used as propagation materialsinvitro, and studies focused on the selection of induced tissues, different time of getting materials, callus induction and differentiation, reproduction of irregular buds and induction of taking roots were conducted in detail. [Result] The results showed that MS+6-BA 1.0 mg/L+NAA 0.2 mg/L +TDZ 0.05 mg/L was comparatively superior, induction rate of stem tips of which is 96.6%, petioles is 88.4%, and leaf is 83.5%; MS+6-BA 1.0 mg/L +NAA 0.5 mg/L +TDZ 0.05 mg/L showed optimal, and the rate of differentiated multiple shoots of which is 92.8%; the induction rate involved with adventitious buds of MS+6-BA 2 mg/L +NAA 0.2 mg/L +TDZ 0.05 mg/L is 90.9%; the propagation times of buds of MS+6-BA 2.5 mg/L +NAA 0.2 mg/L is 2.91; the number of average taking roots of 1/2MS+NAA 2 mg/L +PP3330.5 mg/L is 1.3; the rate of taking roots of 1/2MS+NAA 2 mg/L +ABT 0.5 mg/L is 95.4%; the average root length of 1/2MS+NAA 2 mg/L +IBA 0.5 mg/L is 1.23 centimeter. [Conclusion] The study lays a foundation for breeding and integrated utilization ofP.caeruleain future.
PassifloracaeruleaL.; Tissue culture; Rapid propagation
董丽兰(1986- ),女,广西钟山人,初级农艺师,从事水果生产方面的研究。*通讯作者,副研究员,从事组织培养方面的研究。
2016-07-22
S 604+.3
A
0517-6611(2016)24-160-03

