异氰基乙酸酯参与的不对称加成反应研究进展
曹文杰,李 珅
(天津大学理学院,天津 300072)
异氰基乙酸酯参与的不对称加成反应研究进展
曹文杰,李珅
(天津大学理学院,天津 300072)
综述了异氰基乙酸酯参与的不对称加成反应的最新进展,按照反应物中亲电试剂的类型,介绍了异氰基乙酸酯与醛、酮、亚胺、烯烃等化合物在不同催化体系下发生的不对称加成反应。
不对称合成;Aldol反应;异氰基乙酸酯
手性作为自然界的基本属性之一,与生命息息相关,而具有光学活性的手性化合物在医药、香料和生命科学等领域具有重要的应用。不对称催化合成的出现与发展是20世纪以来化学界的重要成就之一。在不对称催化反应中,仅需加入少量的手性催化剂就能获得单一手性构型的化合物,2001年的诺贝尔化学奖就授予了分子手性催化的主要贡献者[1-3]。

1 异氰基乙酸酯与羰基化合物的不对称Aldol反应
1986 年,Hayashi课题组使用过渡金属Au的络合物(1)与二茂铁骨架的膦配体(2)作为手性络合物催化剂A,首次成功实现了异氰基乙酸甲酯与醛的不对称Aldol反应(图1)[4],并且发现反应底物醛的空间位阻和二茂铁配体末端氨基的结构对反应的对映选择性有一定影响;同时还发现,将过渡金属Au换为Ag或Cu时,对映选择性大大降低,这可能是由于Au与磷原子有更强的配位能力。
1987年,该课题组用该催化体系实现了α-取代异氰基乙酸甲酯与醛的不对称Aldol反应,并获得高达97%的收率和94%的ee值[5]。实验发现异氰基乙酸甲酯α位上取代基团的空间位阻越大,越有利于生成cis产物(表 1)。

图 1 二茂铁衍生的膦-金(Ⅰ)手性络合物催化的异氰基乙酸甲酯与醛的不对称Aldol反应
表 1 二茂铁衍生的膦-金(Ⅰ)手性络合物催化的α-取代异氰基乙酸甲酯与醛的不对称Aldol反应
Tab.1 Asymmetric Aldol reaction ofα-substitutedmethyl isocyanoacetate with aldehydes catalyzed by a chiralferrocenylphosphine-Au(Ⅰ) complex


entryR1R2ligandyield/%trans/ciseetrans/%eecis/%1PhMe2c9793/794532PhiPr2c8662/3888173MeMe2c8656/4486544MeEt2c9254/4687665MeiPr2c10024/762651

1991年,Hayashi课题组设计了二茂铁骨架的叔膦配体与Ag(Ⅰ)络合作为催化剂,催化异氰基乙酸甲酯与醛的不对称Aldol反应(图3)。结果表明,该反应体系底物适用性很广,对于芳香醛、脂肪醛以及不饱和醛都适用,并且dr值高达99∶1,ee值高达90%。但是,该反应需要在30 ℃条件下进行,并且需将异氰基乙酸甲酯在1 h内缓慢加到含有醛与Ag(Ⅰ)催化剂的1,2-二氯乙烷体系中,如果直接将反应物混合搅拌则对映选择性大大降低。

图 2 二茂铁衍生的膦-金(Ⅰ)手性络合物催化的异氰基乙酸甲酯与醛的不对称Aldol反应

图 3 二茂铁衍生的膦-银(Ⅰ)催化的异氰基乙酸甲酯与醛的不对称Aldol反应
1993 年,Pregosin 课题组报道了过渡金属 Pd、Pt 络合物催化的异氰基乙酸甲酯与苯甲醛的Aldol反应。所设计的催化剂包括两齿配体2,2′-联吡啶和联萘二苯基膦与金属Pd的络合物以及三齿配体Pybox与金属Pt的络合物[8],但对映选择性只有10.2%ee。
此后,许多种类的XCX型钳形配体与过渡金属形成的催化剂得以发展,其中,Zhang课题组设计的手性PCP型钳形配体与Pd(Ⅱ) 形成的催化体系4,能够以高达92%的收率和74%的ee值实现异氰基乙酸甲酯与各种芳香醛和脂肪醛的不对称Aldol反应[8](图4)。
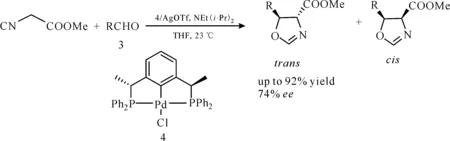
图4 手性PCP-Pd(Ⅱ) 络合物催化的异氰基乙酸甲酯与醛的不对称Aldol反应
2011年,Oh课题组报道了利用过渡金属Co与配体5形成络合物,进而与手性硫脲催化剂6通过协同催化作用催化异氰基乙酸甲酯与醛的不对称Aldol反应[9](图5)。大多数底物可以取得较高的对映选择性(90%~98%ee)和非对映选择性(>20∶1dr),但该催化体系并不适用于邻位和间位取代的苯甲醛。
键盘检测采用I/O接口键盘,在采用手动操作方式,不通过上位机设定温度,则可以通过键盘调整设定的温度,通过温度加,温度减键调整设定的温度。由于MSP5438A的I/O引脚较多,因此采用I/O接口设计键盘,操作方便。系统中设计了四个键盘,只使用两个,两个备用。

图 5 手性Co络合物与手性硫脲协同催化的异氰基乙酸甲酯与醛的Aldol反应
同年,Dixon课题组创新地设计了具有代表性的金鸡纳碱衍生的配体7和过渡金属Ag(Ⅰ)形成的双功能催化剂,成功实现了α-取代异氰基乙酸酯与醛的不对称Aldol反应(图6),并且对于芳香醛的底物适用范围很广,但同时也发现空间位阻对脂肪醛底物的对映选择性影响很大。当底物为叔丁基甲醛时,可达到99∶1dr值和91%ee值,而异丁醛只有48∶1dr值和61%ee值,乙醛则不反应,同时异氰基乙酸甲酯也适用于该反应体系[10]。
与传统的手性过渡金属催化剂相比,有机小分子催化剂具有制备简单、毒性小、廉价易得等优点。因此,实现有机小分子催化的异氰基乙酸酯与醛的不对称Aldol反应是一项很有挑战性的工作。

图 6 金鸡纳碱衍生物与Ag2O协同催化的α-取代异氰基乙酸酯与醛的不对称Aldol反应
2009年,龚流柱课题组利用金鸡纳碱衍生的有机小分子催化剂8首次实现了α-芳基取代异氰基乙酸酯与醛的不对称Aldol反应(图7),获得了高达95%的收率和90%ee值。并且该催化体系对于芳香醛底物具有很好的普适性(70%~88%ee值),但对于脂肪醛3-苯基丙醛收率仅有30%,dr值为2∶1,但ee值高达89%[11],由此可见这一催化体系适用于空间位阻较大的醛。
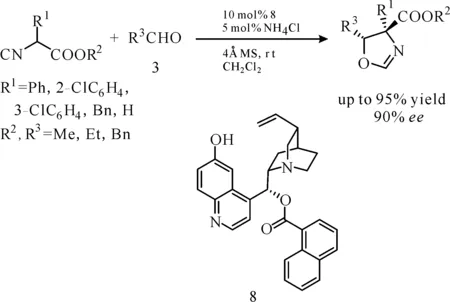
图 7 金鸡纳碱衍生物催化的α-取代异氰基乙酸酯
1.2异氰基乙酸酯与酮的不对称Aldol反应
酮的反应活性比醛低,因此有关酮参与的不对称Aldol反应的研究相对较晚,报道也比较少。1989年,Hayashi课题组报道了异氰基乙酸甲酯和异氰基乙酰胺与α-二酮酯的不对称Aldol反应(表2),反应以Au(Ⅰ)-2c为催化剂,以较好的对映选择性得到光学活性的β-烷基-β-羟基天冬氨酸衍生物,并且发现异氰基乙酰胺的反应效果明显优于异氰基乙酸酯[12]。
表 2金(Ⅰ)催化的异氰基乙酸甲酯和异氰基乙酰胺与α-二酮酯的不对称Aldol反应
Tab.2Au(I)-catalyzed asymmetric Aldol reaction ofα-ketoesters with methyl isocyanoacetate orN,N-dimethyl-α-isocyanoacetamide

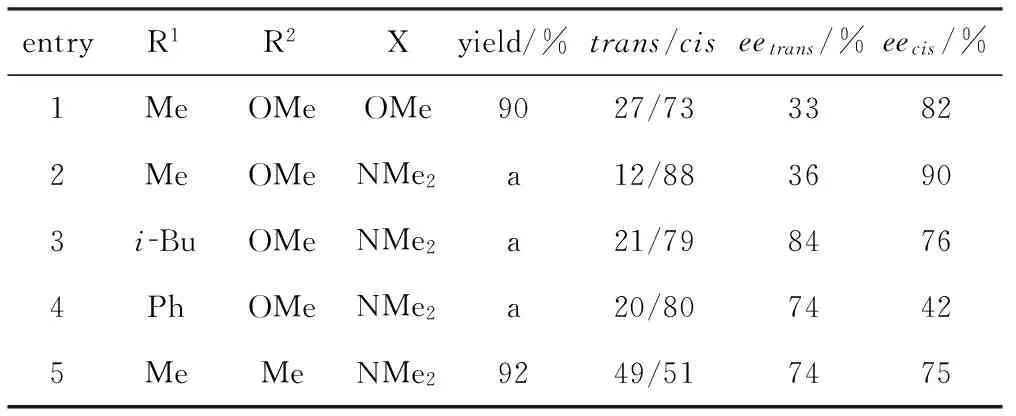
entryR1R2Xyield/%trans/ciseetrans/%eecis/%1MeOMeOMe9027/7333822MeOMeNMe2a12/8836903iBuOMeNMe2a21/7984764PhOMeNMe2a20/8074425MeMeNMe29249/517475
a:Almost quantitative yield;crude product was used in a subsequent transformation without purification.
2003年,施敏课题组设计合成了一种喹啉衍生的双功能氨基硫脲催化剂10,成功应用于催化α-芳基异氰基乙酸酯与靛红的[3+2]环加成反应(图8),ee值高达97%[13],但是对反应物异氰基乙酸酯的要求较为苛刻,需要有较大的取代基。

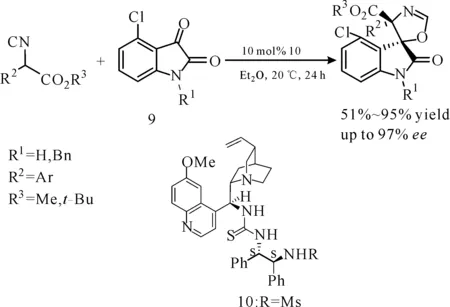
图 8 喹啉衍生的双功能氨基硫脲催化的α-芳基异氰基乙酸酯与靛红的不对称[3+2]环加成反应
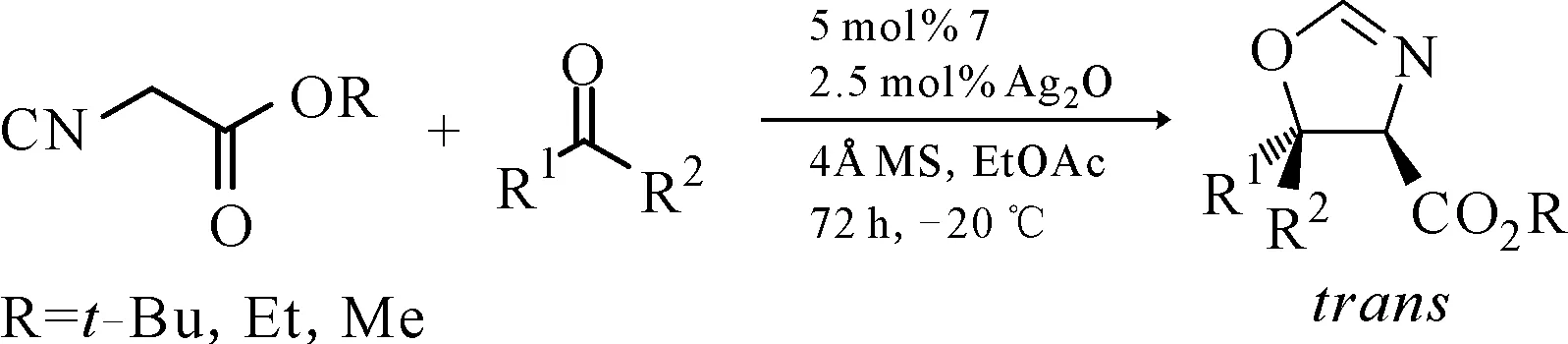
图 9 金鸡纳碱衍生的氨基膦化合物与Ag2O催化的异氰基乙酸酯与酮的不对称Aldol反应
2 异氰基乙酸酯与亚胺的反应
1999 年,Tang课题组报道了手性二茂铁叔膦配体-Me2SAuCl催化的N-磺酰亚胺与异氰基乙酸乙酯的不对称催化反应(图10),得到的2-咪唑啉产物再经过简单转化就能得到2,3-二氨基酸等其它有用的光学活性衍生物[14-15]。

图10 手性二茂铁叔膦配体-Me2SAuCl催化的异氰基乙酸乙酯与N-磺酰亚胺的反应
在该课题组工作基础上,2008年,Szabó课题组发展了一类基于手性联菲酚和手性联萘的新型的钯-钳形络合物作为催化剂,以高达98%的收率实现了异氰基乙酸甲酯与磺酰基保护的醛亚胺的不对称[3+2]环加成反应[16](图11),同时发现基于联菲酚的催化剂相对于基于联萘的催化剂有较高的对映选择性,顺式加成产物的ee值高达86%。

图 11 基于联菲酚的钯-钳形催化剂催化的异氰基乙酸甲酯与N-磺酰亚胺的反应
2010年,陈新滋课题组报道了金鸡纳碱衍生的催化剂13催化异氰基乙酸甲酯与磺酰基保护的醛亚胺的不对称Mannich反应[17](图12),该反应以反式加成产物为主,且具有良好的非对映选择性和对映选择性。

图 12 金鸡纳碱衍生的催化剂13催化的异氰基乙酸甲酯与N-磺酰亚胺的反应
2012年,Shibata课题组使用金鸡纳碱-硫脲衍生物作为双官能团手性催化剂,实现了α-取代异氰基苯乙酸酯与磺酰基保护的醛亚胺的不对称[3+2]环加成反应[18](图13),合成的2-咪唑类化合物dr值高达99∶1,ee值高达96%,并且为合成α,β-二氨基酸提供了一种方便的途径。
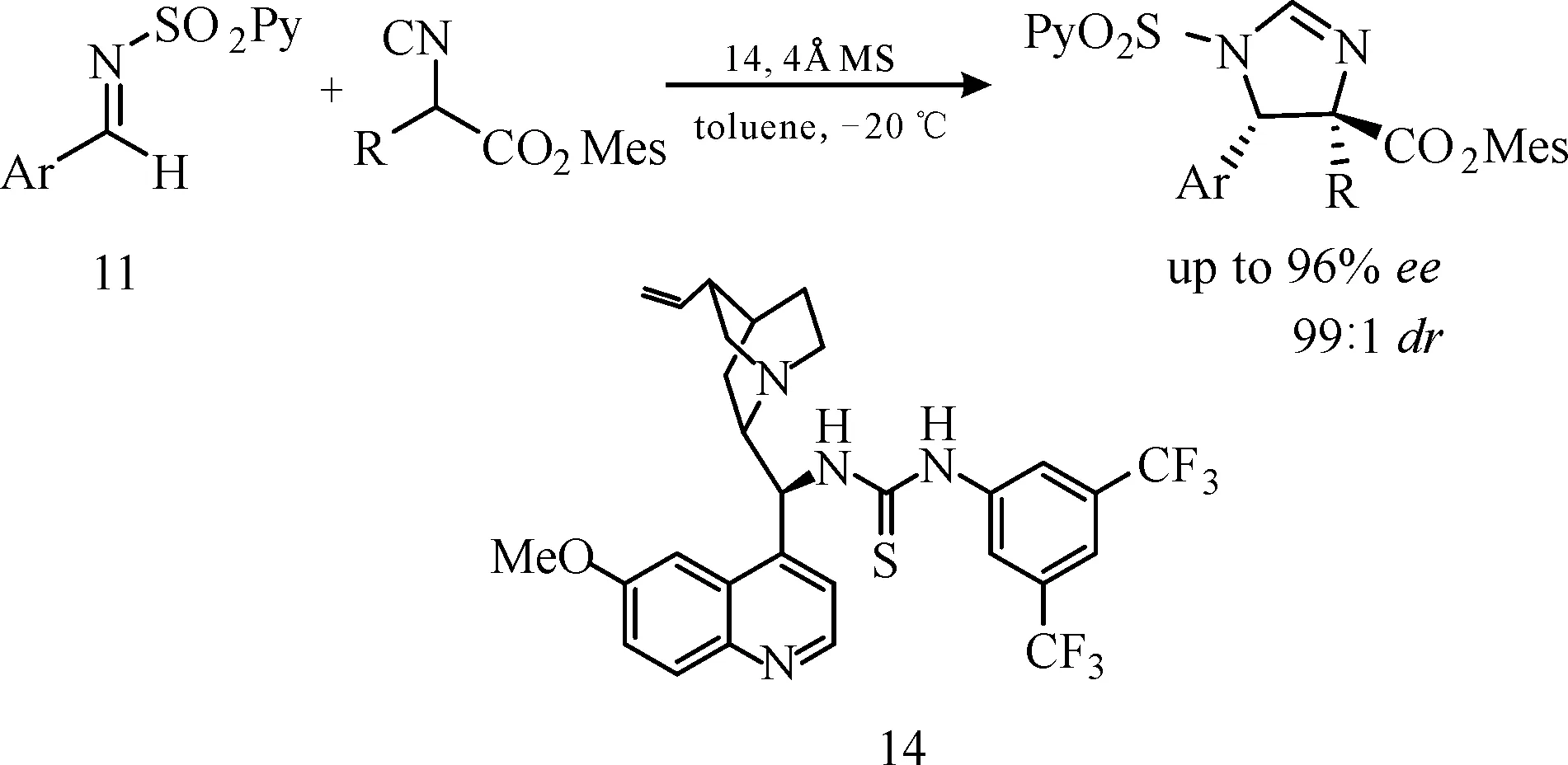
图 13 金鸡纳碱衍生硫脲催化剂14催化的α-取代异氰
2014年,Dixon课题组利用金鸡纳碱衍生的催化剂 7与 Ag2O作为催化体系,开创性地实现了异氰基乙酸酯与低活性酮亚胺的不对称 Mannich 加成反应(图14),其主要加成产物的ee值高达 96%[19]。

图14 金鸡纳碱衍生催化剂7与Ag2O协同催化的异氰基乙酸酯与酮亚胺的反应
同年,Nakamura课题组利用金鸡纳碱衍生的酰胺类衍生物15与Cu(OTf)2在碱作用下,催化α-异氰基乙酸甲酯与酮亚胺的不对称Mannich反应(图15),以高达92∶8dr值和99%ee值得到相应咪唑啉类产物,且底物适用范围广[20]。
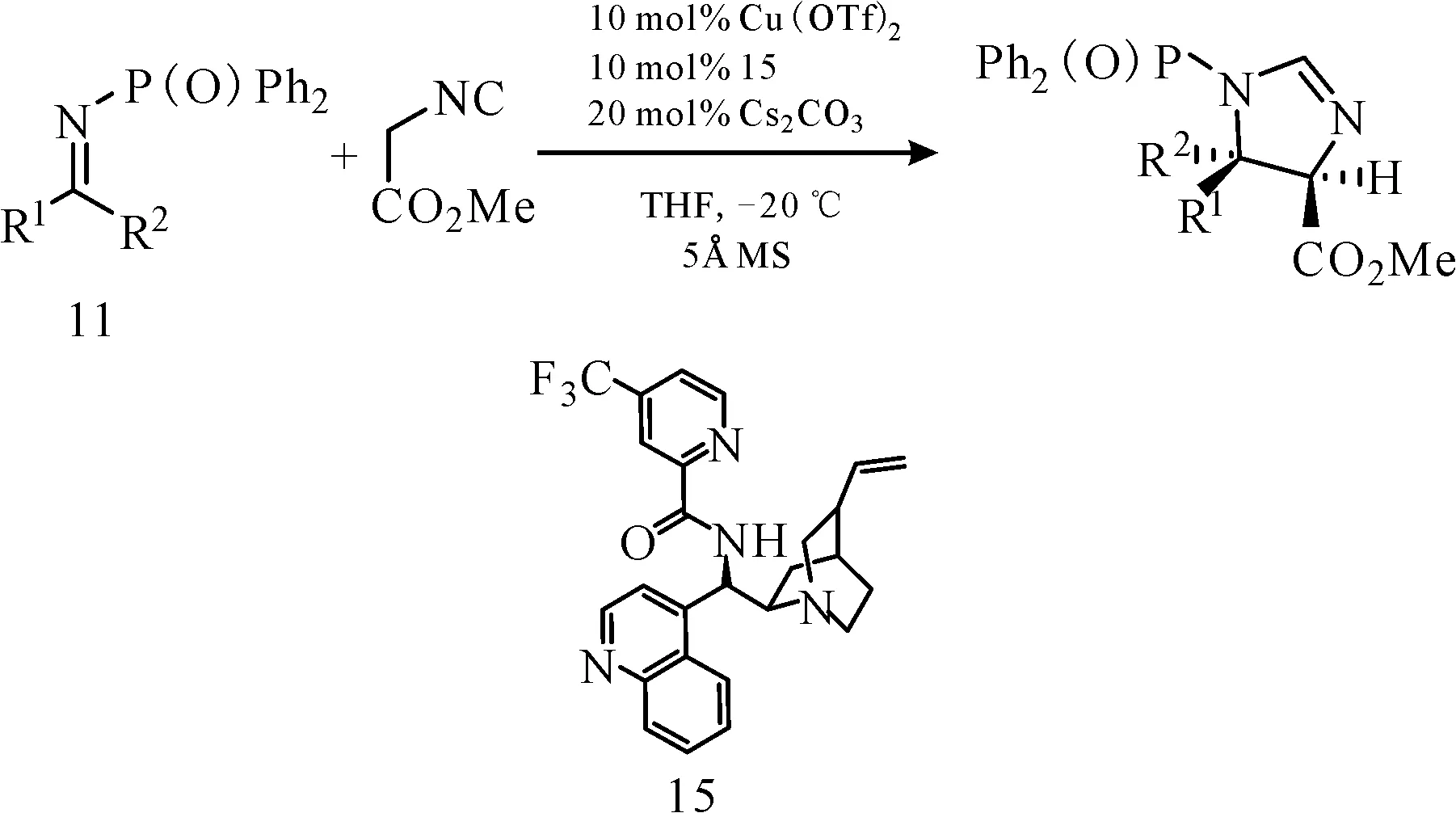
图15 在碱作用下金鸡纳碱衍生催化剂15/Cu(OTf)2催化的异氰基乙酸甲酯与酮亚胺的反应
2015年,施敏课题组进一步利用金鸡纳碱衍生的硫脲催化剂催化靛红衍生的酮亚胺与α-芳基取代的异氰基乙酸酯的Mannich反应(图16),以较好的收率和对映选择性(>20∶1dr,>98%ee)得到3,3-双取代的氧化吲哚衍生物,进一步催化反应得到光学活性的螺环吲哚化合物[21]。
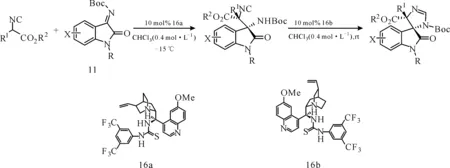
图 16金鸡纳碱衍生硫脲催化剂催化的靛红衍生的酮亚胺与α-芳基取代的异氰基乙酸酯的不对称Mannich反应
Fig.16Asymmetric Mannich reaction ofα-aryl isocyanoacetates with isatin derived ketimines catalyzed by thiourea catalyst derived from cinchona alkaloid
3 异氰基乙酸酯与烯、炔的反应
手性吡咯烷是许多生物碱和药物的中心结构单元,因此该类化合物是全合成中的重要结构基元。2008年,Gong课题组将金鸡纳碱衍生催化剂17应用于异氰基乙酸酯与缺电子烯烃的反应中[22],得到相应的环状吡咯烷化合物,对映选择性高达97%(图17)。
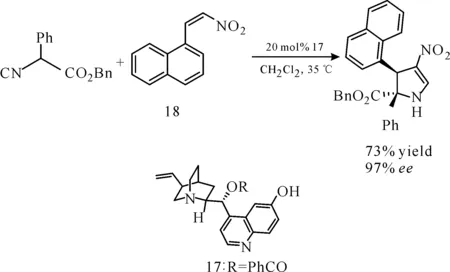
图17 金鸡纳碱衍生催化剂催化的α-芳基取代的异氰基乙
2011年,该课题组利用醋酸银与手性联萘配体形成的催化体系催化α-芳基取代的异氰基乙酸甲酯与2-氧代丁烯酸酯不对称[3+2]环加成反应(图18),并获得较好的非对映选择性和对映选择性(>4∶1dr,98%ee);且底物适用性较广,值得注意的是羟基对手性的形成起决定性作用[23]。

图18 AgOAc与手性联萘配体形成银复合物催化的 α-芳基取代的异氰基乙酸甲酯与2-氧代丁烯酸酯的不对称[3+2] 环加成反应
同年,Mercedes课题组以金鸡纳碱衍生物和硝酸银协同催化异氰基乙酸酯与α,β-不饱和酮反应(图19),以高达89%的ee值得到2,3-二氢吡咯产物[24]。
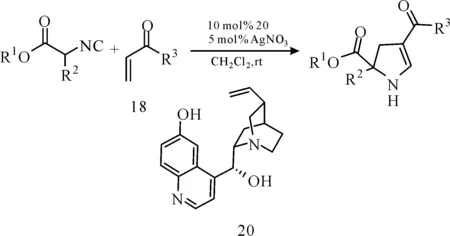
图 19 金鸡纳碱衍生催化剂与AgNO3协同催化的异氰基乙酸酯与烯酮的不对称[3+2]环加成反应
2015 年,Zhao课题组报道了以金鸡纳碱衍生物与Ag2O作为催化体系,将底物扩展到联烯与异氰基乙酸酯的[3+2]环加成反应(图20),并且获得了较好的收率和对映选择性(收率73%~94%,80%~96%ee)[25]。

图 20 金鸡纳碱衍生催化剂与Ag2O协同催化的异氰基乙酸酯与联烯的不对称[3+2]环加成反应
4 结语

[1]KNOWLES W S.Asymmetric hydrogenations[J].Angew Chem Int Ed,2002,41:1998-2007.
[2]NOYORI R.Asymmetric catalysis:science and opportunities[J].Angew Chem Int Ed,2002,41:2008-2022.
[3]SHARPLESS K B.Searching for new reactivity[J].Angew Chem Int Ed,2002,41:2024-2032.
[4]ITO Y,SAWAMURA M,HAYASHI T.Catalytic asymmetric Aldol reaction:reaction of aldehydes with isocyanoacetate catalyzed by a chiral ferrocenylphosphine-gold(Ⅰ) complex[J].J Am Chem Soc,1986,108:6405-6406.
[5]ITO Y,SAWAMURA M,HAYASHI T.Asymmetric Aldol reaction of an isocyanoacetate with aldehydes catalyzed by chiral ferrocenylphosphine-gold(Ⅰ) complex:design and preparation of new efficient ferrocenylphosphine ligands[J].Tetrahedron Lett, 1987,49(28):6215-6218.
[6]SOLOSHONOK V A,HAYASHI T.Gold(Ⅰ)-catalyzed asymmetric Aldol reaction of methyl isocyanoacetate with fluorinated benzaldehydes[J].Tetrahedron Lett,1994,35(17):2713-2716.
[7]UOZUMI Y,YAMAZAKI A,HAYASHI T.Silver(Ⅰ)-catalyzed asymmetric Aldol reaction of isocyanoacetate[J].Tetrahedron Lett,1991,40(24):2799-2802.
[8]LONGMIRE J M,ZHANG X,SHANG M.Synthesis and X-ray crystal structures of palladium(Ⅱ) and platinum(Ⅱ) complexes of the PCP-type chiral tridentate ligand (1R,1′R)-1,3-bis[1-(diphenylphosphino)ethyl]benzene.use in the asymmetric Aldol reaction of methyl isocyanoacetate and aldehydes[J].Organometallics,1998,17(20):4374-4379.
[9]KIM H Y,OH K.Highly diastereo- and enantioselective Aldol reaction of methylα-isocyanoacetate:a cooperative catalysis approach[J].Org Lett,2011,13(6):1306-1309.
[10]CAMPA R,ORTIN I,DIXON D J.Direct catalytic enantio- and diastereoselective ketone Aldol reactions of isocyanoacetates[J].Angew Chem Int Ed,2015,54(16):4895-4898.
[11]XUE M X,GUO C,GONG L Z.Asymmetric synthesis of chiral oxazolines by organocatalytic cyclization ofα-aryl isocyanoesters with aldehydes[J].Synlett,2009,13:2191-2197.
[12]ITO Y,SAWAMURA M,HAYASHI T,et al.Asymmetric Aldol reaction ofα-ketoesters with isocyanoacetate and isocyanoacetamide catalyzed by a chiral ferrocenylphosphine-gold(Ⅰ) complex[J].Tetrahedron Lett,1989,30(35):4681-4684.
[13]ZHAO M X,ZHOU H,SHI M,et al.Cinchona alkaloid-derived thiourea-catalyzed diastereoand enantioselective [3+2] cycloaddition reaction of isocyanoacetates to isatins:a facile access to optically active spirooxindole oxazolines[J].Adv Synth Catal,2003,355(7):1277-1283.
[14]ZHOU X T,LIN Y R,TANG M H,et al.A catalytic enantioselective access to optically active 2-imidazoline fromN-sulfonylimines and isocyanoacetates[J].J Org Chem 1999,64:1331-1334.
[15]ZHOU X T,LIN Y R,DAI L X.A simple and practical access to enantiopure 2,3-diamino acid derivatives[J].Tetrahedron Asymmetry,1999,10(5):855-862.
[16]AYDIN J,RYDÉN A,SZABK J.Chiral palladium-pincer complex catalyzed asymmetric condensation of sulfonimines and isocyanoacetate[J].Tetrahedron Asymmetry,2008,19(15):1867-1870.
[17]ZHANG Z W,LU G,CHAN A S C,et al.Organocatalytic asymmetric Mannich-type reaction ofN-sulfonylimines with isocyanoacetate leading to optically active 2-imidazoline-4-carboxylates[J].Tetrahedron Asymmetry,2010,21(13/14):1715-1721.
[18]NAKAMURA S,MAENO Y,SHIBATA N,et al.Enantioselective synthesis of imidazolines with quaternary stereocenters by organocatalytic reaction ofN-(heteroarenesulfonyl)imines with isocyanoacetates[J].Org Lett,2012,14(12):2960-2963.
[20]HAYASHI M,IWANAGA M,NAKAMURA S,et al.Direct asymmetric Mannich-type reaction ofα-isocyanoacetates with ketimines using cinchona alkaloid/copper(Ⅱ)catalysts[J].Angew Chem,2014,126(32):8551-8555.
[21]ZHAO M X,JING L,SHI M,et al.Cinchona alkaloid thiourea mediated asymmetric Mannich reaction of isocyanoacetates with isatinderived ketimines and subsequent cyclization:enantioselective synthesis of spirooxindole imidazolines[J].RSC Adv,2015,5:75648-75652.
[22]GUO C,XUE M X,ZHU M K,et al.Organocatalytic asymmetric formal [3+2] cycloaddition reaction of isocyanoesters to nitroolefins leading to highly optically active dihydropyrroles[J].Angew Chem Int Ed,2008,47(18):3414-3417.
[23]SONG J,GUO C,GONG L Z,et al.Asymmetric formal [3+2] cycloaddition reaction of isocyanoesters to 2-oxobutenoate esters by a multifunctional chiral silver catalyst[J].Chem Eur J,2011,17(28):7786-7790.
[24]CARLOS A,ALBERTO G G,MERCEDES A,et al.Cooperative catalysis for the first asymmetric formal [3+2] cycloaddition reaction of isocyanoacetates toα,β-unsaturated ketones[J].Eur J Org Chem,2011(20/21):3755-3760.
[25]LIAO J Y,SHAO P L,ZHAO Y.Catalytic divergent synthesis of 3H or 1H pyrroles by [3+2] cyclization of allenoates with activated isocyanides[J].J Am Chem Soc,2015,137(2):628-631.
Research Progress on Asymmetric Addition Reactions Participating by Isocyanoacetate
CAO Wen-jie,LI Shen
(SchoolofScience,TianjinUniversity,Tianjin300072,China)
Theresearchprogressonasymmetricadditionreactionsparticipatingbyisocyanoacetateisreviewed.Accordingtothetypeofelectrophilicreagentsinreactants,theadvancesofasymmetricadditionreactionsofisocyanoacetatewithaldehydes,ketones,iminesorolefinsindifferentcatalyticsystemsaresummarized.
asymmetricsynthesis;Aldolreaction;isocyanoacetate
2016-05-06
国家自然科学基金青年科学基金资助项目(21302137)
曹文杰(1989-),女,山西大同人,硕士研究生,研究方向:异腈参与的不对称反应,E-mail:2013210076@tju.edu.cn;通讯作者:李珅,副教授,E-mail:shenli@tju.edu.cn。
10.3969/j.issn.1672-5425.2016.09.002
O 621.34
A
1672-5425(2016)09-0005-07
曹文杰,李珅.异氰基乙酸酯参与的不对称加成反应的研究进展[J].化学与生物工程,2016,33(9):5-11,49.

