仔猪肠道微生物宏基因组的研究分析
项 云,章啸君,屠平光,楼芳芳,肖英平
(1.金华市农业科学研究院畜牧所,浙江金华 321017;2.浙江省农科院农产品质量标准研究所)
试验研究
仔猪肠道微生物宏基因组的研究分析
项云1,章啸君1,屠平光1,楼芳芳1,肖英平2
(1.金华市农业科学研究院畜牧所,浙江金华 321017;2.浙江省农科院农产品质量标准研究所)
试验采用高通量测序技术分析仔猪在不同生长阶段肠道微生物菌群的动态变化。从同窝仔猪中随机选择健康仔猪3头,于出生当天(0 d)、出生后5 d、7 d、15 d、23 d(21日龄断奶,即断奶后2 d)和60 d收集仔猪粪便样品进行16SDNA V3-V4段测序,对照数据库进行聚类分析和物种分类学分析,以纲分类进行仔猪粪便微生物宏基因分析。结果表明,仔猪出生当天(0 d)的优势菌主要为γ-变形菌、杆菌、β变形菌、梭状芽胞杆菌、黄杆菌、拟杆菌;出生后5 d的优势菌主要为梭状芽胞杆菌、拟杆菌、杆菌、γ-变形菌;出生后7 d的优势菌主要为梭状芽胞杆菌、杆菌、拟杆菌、γ-变形菌、黄杆菌、β变形菌、ε变形菌;出生后15 d的优势菌主要为梭状芽胞杆菌、杆菌、γ-变形菌、拟杆菌;出生后23 d的优势菌主要为梭状芽胞杆菌、拟杆菌、革兰氏阴性厚壁菌;出生后60 d的优势菌主要为梭状芽胞杆菌、拟杆菌、杆菌、革兰氏阴性厚壁菌。研究表明,仔猪在刚出生阶段肠道微生物菌群与其他阶段显著不同,且21日龄断奶对菌群分布影响较大。
肠道微生物;宏基因组;仔猪
仔猪肠道中生存着大量微生物,主要包括细菌和真核微生物等,其中细菌数量达1 000~1 150种,主要是厌氧细菌[1]。Leser TD等(2004)[2]研究发现,猪肠道中低G+C革兰氏阳性菌(硬壁菌门,真杆菌类及亲属、梭菌属及亲属、芽胞杆菌属、乳酸杆菌属、链球菌属等)占肠道细菌的81%;革兰氏阴性菌(主要为拟杆菌门,噬纤维菌属、拟杆菌属、屈挠杆菌属、普雷沃氏菌属等)占11.2%,即拟杆菌门和硬壁菌门占猪肠道细菌的90%以上。
猪肠道微生物的动态平衡是猪肠道健康的标志,肠道健康则是猪只健康生长的基础。众多研究表明,肠道微生物优势菌群的组成明显影响着猪体的健康,猪肠道中有益菌含量越高,猪只越健康[3]。目前猪日粮中普遍使用抗生素,特别是仔猪日粮中大多采用添加抗生素方法来预防仔猪腹泻,抗生素的使用则增加了病原菌的耐药性,导致了生态环境污染和食品安全问题。因此,仔猪哺乳和保育生长阶段,利用高通量测序技术开展其肠道微生物菌群结构分析,对干预猪体肠道疾病和减少抗生素使用具有重要意义,可为益生菌在养猪生产中的开发应用提供理论依据。
1 材料与方法
1.1试验材料试验在金华市某生态养殖场进行,从同窝仔猪中选择健康仔猪3头,按出生当天(0 d)、5 d、7 d、15 d、23 d、60 d分为6组采集仔猪新鲜粪便。
采集粪便时手载无菌手套防止污染,采集粪便置于50 mL无菌离心管中,冷藏保存备用。
1.2试验方法委托上海某生物医药科技有限公司进行微生物宏基因组测序。
MiSeq测序试验流程为基因组DNA提取、设计合作引物、接头 PCR扩增和产物纯 PCR定量和均一化、MiSeq PE 文库制备MiSeq高通量测序。
生物信息分析流程为Miseq测序得到PE reads,首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤。
1.3统计分析区分样本后进行聚类分析(OTU)和物种分类学分析。
基于OTU可以进行多种分析;物种分类学分析,可在各个分类水平上进行群落结构统计分析。所以,本试验主要采用纲分类水平分析。
2 结果与分析
2.1仔猪粪便微生物宏基因组纲水平上测定的OTU值与物种分类详见表1、图1。
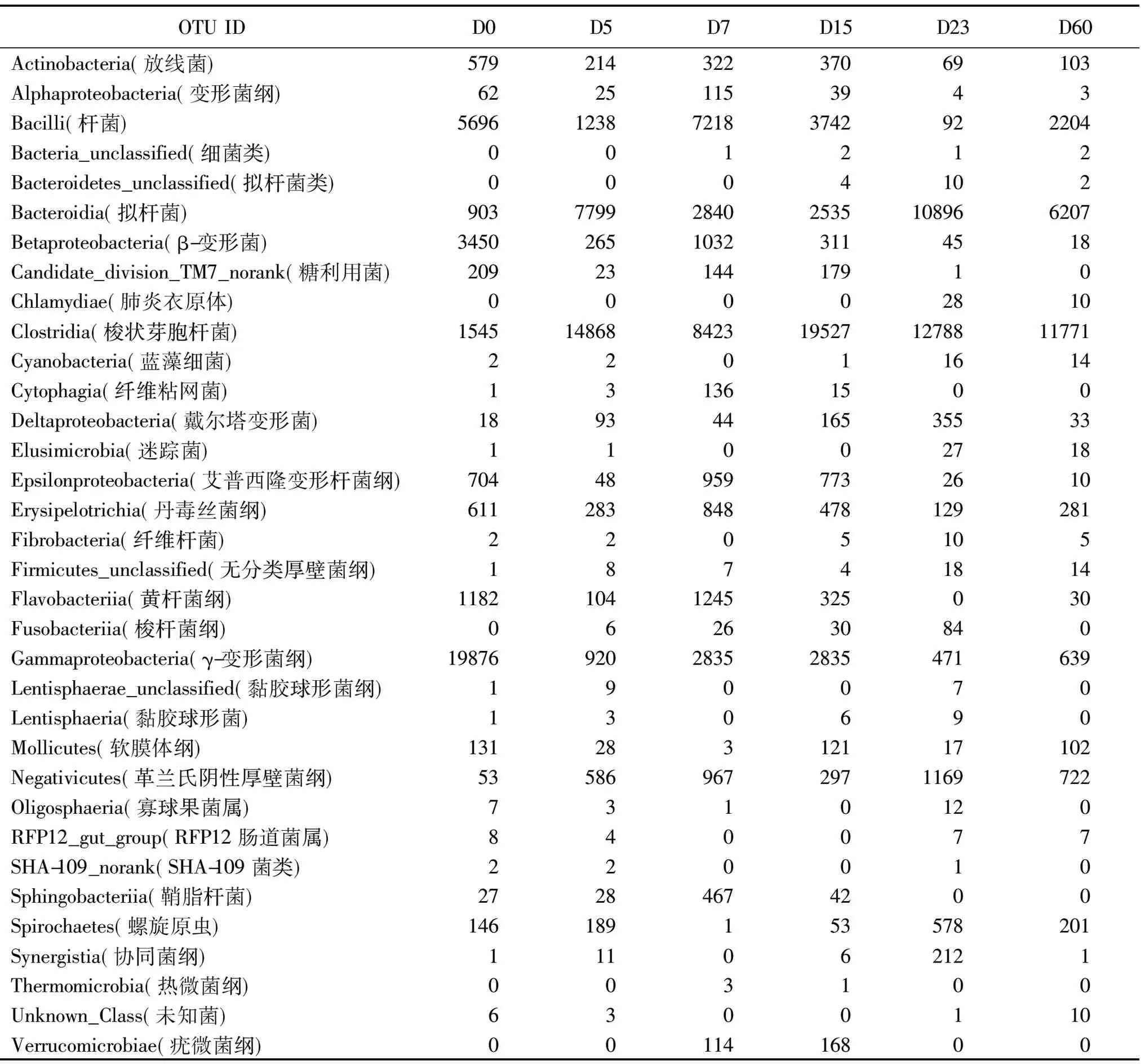
表1 不同日龄仔猪粪便微生物宏基因组的OTU测定均值

图1 各日龄仔猪粪便微生物宏基因组以纲水平测定的OUT均值
由表1、图1可见,γ-变形菌纲在仔猪刚出生时丰度最高,达到19876。5日龄后梭状芽胞杆菌丰度最高。仔猪21日龄断奶,23日龄时以拟杆菌丰度最高,杆菌丰度则较低,60日龄时则杆菌丰度回升。2.2仔猪粪便优势菌群分析详见表2。
如以某菌丰度高于平均数以上为优势菌群。由表1、表2及图1可见,其测定结果如下。
0 d:仔猪出生时肠道优势菌群纲水平依次为γ-变形菌、杆菌、β变形菌、梭状芽胞杆菌、黄杆菌、拟杆菌。
5 d:仔猪肠道优势菌群纲水平依次为梭状芽胞杆菌、拟杆菌、杆菌、γ-变形菌。
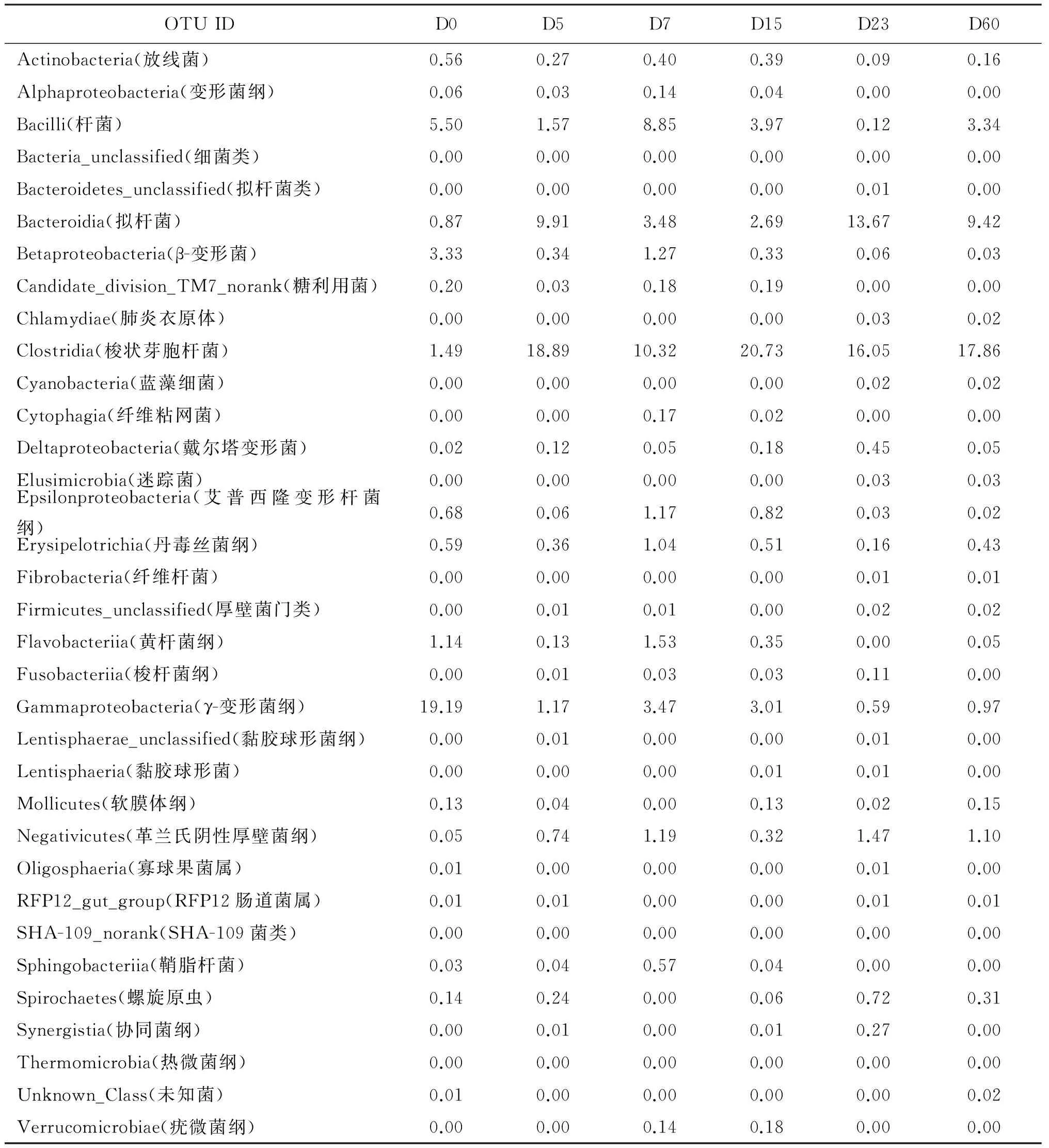
表2 不同日龄仔猪粪便微生物宏基因组测定的OTU值所占比例
7 d:仔猪肠道优势菌群纲水平依次为梭状芽胞杆菌、杆菌、拟杆菌、γ-变形菌、黄杆菌、β变形菌、ε变形菌、
15 d:仔猪肠道优势菌群纲水平依次为梭状芽胞杆菌、杆菌、γ-变形菌、拟杆菌。
23 d:仔猪肠道优势菌群纲水平依次为梭状芽胞杆菌、拟杆菌、革兰氏阴性厚壁菌。
60 d:仔猪肠道优势菌群纲水平依次为梭状芽胞杆菌、拟杆菌、杆菌、革兰氏阴性厚壁菌。
3 小结与讨论
3.1从仔猪肠道微生物宏基因组分析可知,以微生物核糖体16SrDAN可变区V3和V4进行测序的宏基因组分析方法与传统的微生物培养鉴别方法相比,可快速鉴别出从门纲目科属种各层次的微生物,为后续分析提供基础[4]。
3.2由表2、图1可见,仔猪出生时γ-变形菌占19.19%,而γ-变形菌主要为肠杆菌科、弧菌科、假单胞菌科、沙门氏菌属、绿脓杆菌等病原菌,表明仔猪一出生,外界环境中的微生物就可能通过口腔、食道进入胃肠道中。充分反映了仔猪在出生后3 d哺足初乳的重要性。因为哺足初乳有助于提高机体的免疫力,降低因外界环境中存在的病原微生物而引起疾病。在仔猪5日龄阶段,γ-变形菌含量下降,仅为1.17%,而梭状芽胞杆菌变成主要的优势菌群,占18.89%。
3.3据本次试验,5日龄仔猪的肠道菌群分布与60日龄类似,其中梭状芽胞杆菌、杆菌为优势菌群,且均为健康仔猪,表明仔猪出生后就快速建立了肠道微生物生态菌群。
3.4据试验可知,23日龄仔猪的肠道杆菌丰度下降,拟杆菌丰度增加,与5 d、7 d、15 d和60日龄阶段肠道微生物菌群结构均有一定差异,原因可能是仔猪21日龄断奶,断奶应激对肠道菌群分布影响较大所致[5]。
本次分析仅从纲分类层次进行了比较,因肠道微生物种类众多,按何种分类层次分析及微生物是否有更为理想的比例模式表达,则有待进一步研究探讨。
[1]Gill SR, Pop M, DeBoy RT, et a1. Metagenomic analysis of the Human distal gut microbiome[J]. Science, 2006,312:1355-1359.
[2]Leser TD, Amemuvor JZ, Jensen TK, et a1. Culture-independent analysis of gut bacteria: the pig gastrointestinal tract microbiatarevisited[J]. Appl Environ Microbiol, 2004,68:673-690.
[3]肖文萍. 藏猪肠道微生物多样性的研究[D]. 西北农林科技大学,2012.
[4]王雪,赵龙玉,赵凤春,等. 应用Illumina高通量测序技术探究长根菇多糖对小鼠肠道菌群的影响[J].食品科学,2015,36(19):222-226.
[5]朱伟云, 余凯凡, 慕春龙,等. 猪的肠道微生物与宿主营养代谢[J]. 动物营养学报,2014,10:3046-3051.
2016-05-20
国家自然科学基金(31402083)
项云(1963-),男,浙江金华人,研究员,主要研究方向为金华猪选育等。E-mail:xyjhzj@aliyun.com
肖英平,博士,主要研究方向为营养调控与肠道微生物。E-mail:ypxiaozju@126.com
S828.4+5
A
1005-7307(2016)05-0001-004

