钛酸纳米管形成过程中不同水热反应阶段产物表征及其对Cd(Ⅱ)吸附的特性研究
蔡斌 王婷
钛酸纳米管形成过程中不同水热反应阶段产物表征及其对Cd(Ⅱ)吸附的特性研究
蔡斌1,2王婷2,†
1. 北京大学深圳研究生院环境与能源学院, 深圳 518055; 2. 北京大学环境工程系, 水沙教育部重点实验室, 北京 100871; † 通信作者, E-mail: wang_ting@pku.edu.cn
在以 P25 二氧化钛为钛源, 水热反应时间为1, 2, 3, 4天条件下, 合成钛酸纳米管(TNTs)形成过程中的4种产物, 采用XRD, SAXS和N2吸附/脱附等温线等手段进行表征。以Cd(Ⅱ)为代表污染物, 研究4种产物对Cd(Ⅱ)的吸附, 并着重分析4种产物的结构对其吸附能力的影响。粉末XRD结果表明, TNTs的4种产物均为单斜晶胞结构。SAXS 和 N2吸附/脱附表征证实, 水热法制备 TNTs 经历二氧化钛源结构解体→钛酸纳米管形成→管状结构解体的过程, TNTs-3d 具有最为规整的管状形貌。吸附等温线结果表明, Langmuir-Freundlich模型能够更好地拟合吸附等温结果, 且 Cd(Ⅱ)的吸附量大小顺序为 TNTs-3d ≈ TNTs-1d > TNTs-4d > TNTs-2d。进一步的分析表明, 样品的回转半径、孔体积对吸附量影响较小, 而比表面积和平均孔径可能会显著影响吸附容量。
钛酸纳米管; SAXS; 吸附; Langmuir-Freundlich模型
钛酸纳米管作为一种新型的纳米材料, 具有制备方法简单、管径均一、比表面积和孔体积较大、表面带电性、离子交换能力强等优点, 在重金属吸附领域有较大的研究价值与应用潜力[1]。
Kasuga等[2–3]以锐钛矿(TiO2)为钛源, 首次通过水热反应制备出钛酸纳米管。在 110ºC条件下, 水热反应 20 小时, 得到的钛酸纳米管外径为 8 nm, 长 100 nm, 比表面积高达 400 m2/g。Chen 等[4]在此基础上进行更加深入的研究, 发现在 130ºC、72小时条件下, 水热反应得到的钛酸纳米管为多壁结构, 层间距为 0.78 nm, 外径为 9 nm, 管长为 100 nm 至数百纳米不等。对其进行成分分析发现, 钛酸纳米管化学组成为(H, Na)2Ti3O7·xH2O, 组成纳米管的最小单元是H2Ti3O7的单斜晶形, 晶胞参数为=1.603 nm,= 0.375 nm,=0.919 nm,= 101.45º。Wang 等[5]用 P25 与 10 mol/L 的 NaOH溶液也制得吸附性能良好的钛酸纳米管。Yao等[6]采用TEM表征, 发现水热法合成的钛酸纳米管是末端开口的多壁结构, 与多壁碳纳米管不同, 钛酸纳米管的管壁不是无缝结构。TiO2原料在高浓度碱液中以单层 TiO2薄片的形式剥离下来, 进一步卷曲形成钛酸纳米管。
钛酸纳米管表面具有大量可交换的羟基基团, 并且其零电荷点(point of zero charge, PZC)较低, pH>pHPZC时, 其表面带负电, 可通过离子交换和静电引力有效地吸附溶液中的阳离子。由于其较大的吸附速度与较强的吸附能力, 钛酸纳米管越来越多地用作吸附剂, 以去除废水中的 Pb2+, Cd2+, Cu2+, Cr3+等离子。但是, 已有的研究大多关注金属离子的单一[5, 7–11]或者竞争吸附[10]以及吸附机理的阐述, 少有研究从钛酸纳米管形貌结构上揭示影响吸附能力的关键因素。
本文以 P25 二氧化钛为原料, 在钛酸纳米管(titanate nanotubes, TNTs)水热反应过程中制备一系列过程产物, 并对其进行 XRD, SAXS 和 N2吸附/脱附等表征。以 Cd(Ⅱ)为代表污染物, 研究其吸附行为。研究结果对于深入揭示影响TNTs吸附能力的关键因素, 优化TNTs的合成条件有重要意义。
1 材料与方法
1.1 不同水热时间TNTs的制备及表征
将1.20 g P25 TiO2和29.04 g NaOH固体加入66 mL去离子水中, 室温下磁力搅拌24小时后, 转移到 100 mL 聚四氟乙烯内衬的反应釜中, 在130ºC条件下进行水热反应。生成的白色固体用去离子水洗涤至上清液为中性, 无水乙醇分散, 烘干, 研细待用。改变水热反应时间分别为1, 2, 3, 4 天, 以制备 TNTs 不同形成阶段的产物, 分别标记为TNTs-1d, TNTs-2d, TNTs-3d, TNTs-4d。
TNTs不同阶段产物的晶型结构采用常规粉末X 射线衍射(XRD, Rigaku, 日本)与 X 射线小角散射(SAXS)进行表征。XRD扫描范围(2)为 10°~70°,扫描速度为 4°/min, 狭缝宽 0.3 mm。SAXS扫描范围(2)为 0.6°~20°, 扫描速度为 2°/min, 狭缝宽0.15 mm。TNTs的比表面积和孔径分布采用比表面积及孔隙度分析仪(ASAP 2010, Micromeritics, 美国)进行检测。
1.2 静态吸附实验
以 Cd(Ⅱ)为代表污染物, 研究不同水热时间下制备的TNTs的吸附能力及影响因素。配制浓度为1000 mg/L的Cd(Ⅱ)储备液, 稀释, 待用。
在一系列100 mL的锥形瓶中, 加入50 mL初始浓度分别为 10, 20, 30, 40, 60, 80, 100 mg/L 的Cd(Ⅱ)溶液。用0.01 mol/L的HCl或NaOH溶液, 调节初始pH值在5~6之间。向每个锥形瓶中分别投加10.0 mg (0.2 g/L) TNTs, 在25 °C, 200 rpm下充分振荡 3 小时以达到吸附平衡, 进行吸附等温实验。取初始样和平衡样, 用0.45 µm水系滤膜过滤, 稀释, 用电感耦合等离子体–原子发射光谱仪(Leeman, Prodigy, 美国)测定Cd(Ⅱ)的浓度。
Cd(Ⅱ)在样品上的吸附量由下式计算得到:
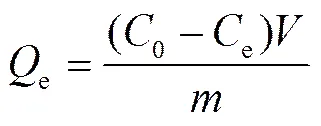
式中,e为平衡吸附量(mg/g),0和e为吸附初始和平衡时溶液中Cd(Ⅱ)的浓度(mg/L) ,为溶液体积(L),为吸附剂的质量(g)。
2 结果与讨论
2.1 XRD表征
图 1 为样品的 XRD 结果。可以明显看出, 在2= 9.5°处, 除P25二氧化钛以外, 所有样品均出现明显的衍射峰, 该峰为 TNTs 的层间距峰[12–13]。图1中, 位于 2= 24.32°, 28.36° 和48.36°(表1)处的峰为钛酸钠的特征峰。这表明, 参与合成反应的Na+起到稳定纳米管结构的作用[14–15]。这4个衍射峰是一种单斜晶形钛酸盐晶体的特征峰, 化学组成为(Na, H)2Ti3O7nH2O[4]。与之相比, 二氧化钛(P25)在 2= 25.4°, 37°~39°处出现锐钛型衍射峰, 在 2= 27.5°处出现金红石型衍射峰, 这些峰在合成的样品中并没有出现, 说明在合成的 TNTs 阶段产物中, 无残留的二氧化钛存在。
图 1 中的衍射峰均与 H2Ti3O7单斜晶形的特征峰相近或相同。已有报道也证实 TiO2粉末与NaOH 溶液水热反应后得到的产物为单斜晶形[16]。基于此, 表1列出依据X射线衍射特征峰的分析结果。晶胞参数为= 1.603 nm,= 0.375 nm,= 0.919 nm,= 101.45°[4]。具体而言, 它的结构是由共用棱的TiO6八面体以类似波纹丝带的方式衔接而成。衔接时, 每 3 个八面体为一组[4], 每一组八面体间以顶点相互连接, 形成台阶状的分子层, 层与层之间被填充着的 Na+和 H+分隔开。因此, 其分子式可以简单地认为是(Na, H)2Ti3O7。
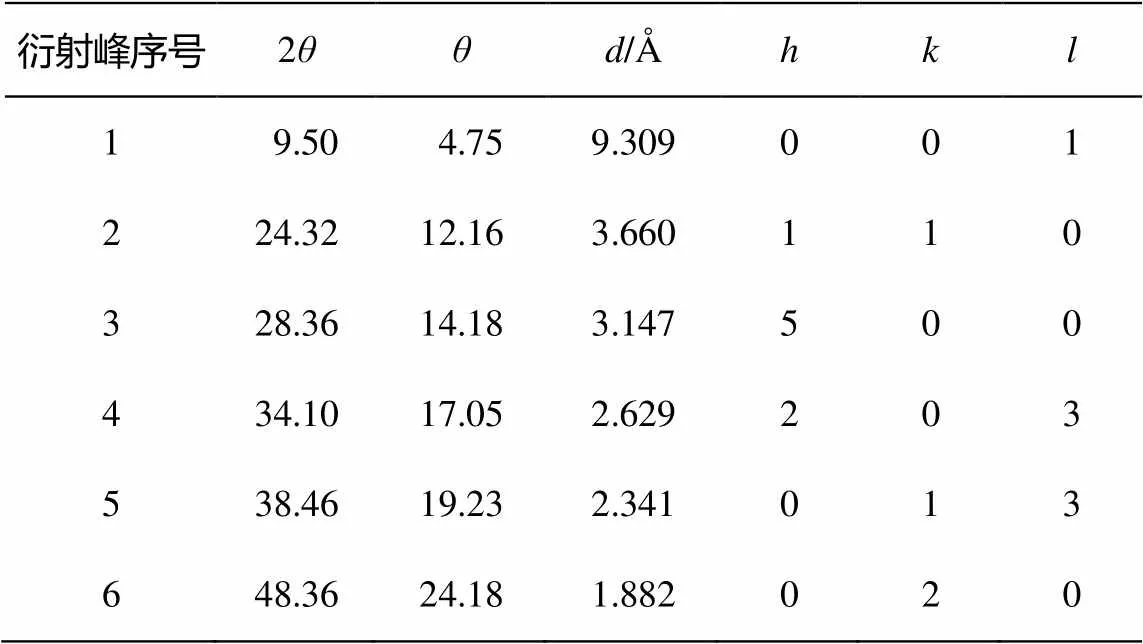
表1 TNTs系列样品的X射线衍射分析结果
2.2 SAXS表征研究
图 2 为样品的 SAXS 结果。SAXS 的结果是基于被测材料各原子中的电子对 X 射线的衍射和散射的叠加。被测材料中的电子密度和 X 射线散射测试结果中的峰值幅度之间的关系[17]如下:

X射线散射结果中的强度用材料中电子衍射和散射后的电磁波的振幅与它的共轭复数的乘积来计算。在形状和大小相近或相同的分散颗粒(或孔)体系中, SAXS的强度表达式[17]可简化为

式(3)被称为 Guinier 公式。其中为颗粒的回转半径,(0)为= 0 时的衍射强度。考虑到在 2角度较小时(25°),2, 式(3)可转换为下式[17]:
。 (4)
取对数, 得到下式[17]:
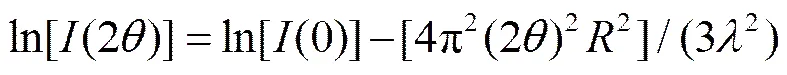
式(5)表明, 若体系严格遵循 Guinier 法则, 那么ln[(2)]与(2)2之间将线性相关。SAXS 计算结果见表 2。ln[(2q)]与2相关系数均大于 0.95, 说明体系严格遵循Guinier法则。同时, P25和TNTs阶段产物的回转半径的平方均为几百Å2, 回转半径值大多在 15 Å左右, 这表明样品的介观结构可能没有任何变化。另一方面, TNTs系列样品的平均回转半径是 15.85 Å, 略小于 P25 的 16.81 Å。据此可以认为, 在水热合成反应的过程中, 发生了一些结构上的转变。
从表2还可以看出, TNTs-1d的回转半径(16.92 Å)与P25(16.81 Å)十分接近, 而与TNTs-2d的回转半径(13.35 Å)差距较大, 据此推断TNTs-1d 与 P25的介观结构较相近。即, TNTs-1d 中包含一部分尚未开始解体的P25结构和少量解体后形成的纳米级碎片, TNTs-2d 中 P25 则接近完全解体, 并开始重组为钛酸纳米管。TNTs-3d的回转半径(15.85 Å)较之TNTs-2d又有所上升, 且与TNTs-4d接近, 表明两者钛酸纳米管含量进一步增加。
2.3 比表面积与孔径分布分析
TNTs-1d, TNTs-2d, TNTs-3d和TNTs-4d这 4种阶段产物以及二氧化钛(P25)的比表面积、孔径分布和孔体积等由 N2吸附/脱附等温线获得。各种材料的比表面积等性能数据如表3所示。

表2 TNTs系列样品的小角X射线散射分析结果
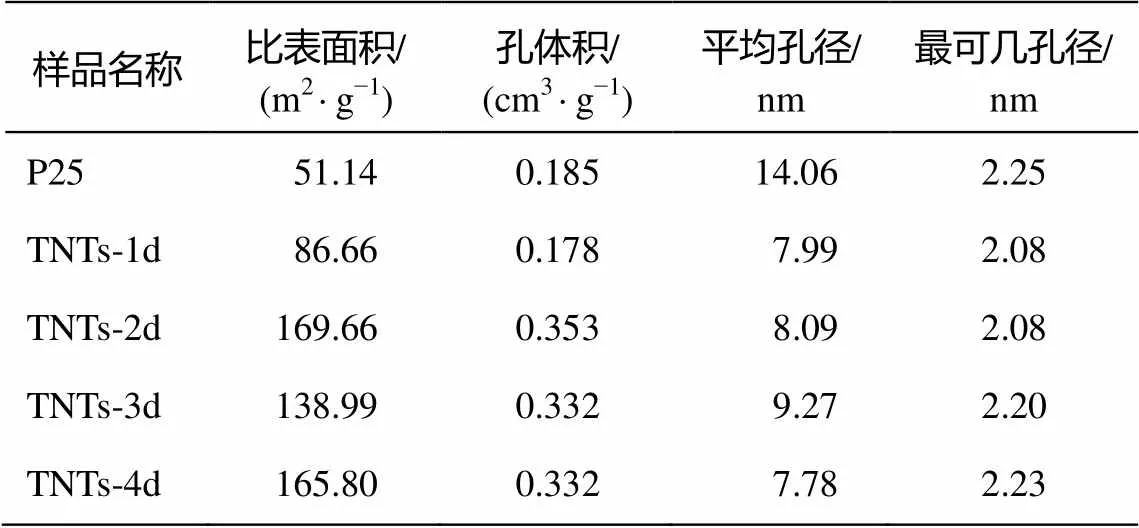
表3 几种TNTs阶段产物的比表面积与孔径分布
从表 3 可以看出, TNTs-2d, TNTs-3d和 TNTs-4d 的比表面积及孔体积比较接近, 而与 TNTs-1d和 P25 差距较大。P25 的比表面积为 51.14 m2/g, TNTs- 1d较P25有明显的增加, 为86.66 m2/g, 而TNTs-2d, TNTs-3d和TNTs-4d的比表面积均在100 m2/g以上。孔体积方面, P25与TNTs-1d比较接近, 约为0.18 cm/g左右; TNTs-2d, TNTs-3d和TNTs-4d的孔体积为 0.33~0.35 cm3/g。P25 的平均孔径为14.06 nm, 而 TNTs 系列样品相比之下, 平均孔径都明显缩小, 为8~9 nm。4种TNTs阶段产物中, TNTs-2d和TNTs-4d的比表面积最大, TNTs-3d的平均孔径最大。
图 3 为 P25 和 TNTs 系列样品的孔径分布。对比吸附支孔径分布(图 3(b))可以发现, 脱附支(图3(a))TNTs系列样品在 3~4 nm 处有一个孔径分布峰, 是由抗拉强度效应(tensile strength effect, TSE)引起的假峰[18–19]。因此, 对于 TNTs 系列样品, 吸附支得到的孔径分布更准确。从图 3(b)可知, TNTs系列样品的最可几孔径均在 2~2.2 nm 范围内。根据国际纯粹与应用化学协会(IUPAC)的定义, 孔径小于 2 nm 的称为微孔。因此, 所有样品的最可几孔径均已接近微孔范围。同时, TNTs 系列样品的最可几孔径均在 2~2.2 nm 范围内, 且不随水热反应时间的增加而变化。说明在水热反应过程中, [TiO6]八面体这一基本机构并没有遭到破坏, 样品结构的改变只发生在不同[TiO6]八面体的连接方式上。
从表3还可以发现, P25最可几孔径虽然在2.2 nm左右, 但是其平均孔径显著大于 TNTs 系列样品, 说明原料P25本身并不具有太多的孔状结构。随着水热反应的开始, 样品内部发生改变, 产生大量直径在 20 nm 以下的孔状结构, 进而验证了 P25样品在水热反应过程中发生结构解体。水热反应48 小时的时候孔体积最大, 生成的孔状结构最多, 此时 P25 解体最彻底。水热反应 72 小时的时候孔体积略有减小, 这是由于此时生成一种规整有序的结构。当水热反应达到 96 小时, 孔体积不变, 平均孔径减小, 说明此时孔状结构再次增加, 样品结构再次趋向无序化, 即管状结构开始部分解体。
2.4 Cd(Ⅱ)吸附等温线
为深入阐述TNTs系列样品的形貌结构对金属离子吸附行为的影响, 图 4 描述 TNTs 系列样品对Cd(Ⅱ)的吸附等温线。随着平衡浓度的增大, Cd(Ⅱ)的吸附量逐渐增大, 最后趋于平衡。且Cd(Ⅱ)的饱和吸附量大小顺序为 TNTs-1d > TNTs-3d > TNTs-4d > TNTs-2d。与多壁碳纳米管(10.86 mg/g)、贝得石(42.01 mg/g)、黄土(9.37 mg/g)和活性炭(19.50 mg/g)相比, 吸附容量高出很多[9]。为了描述TNTs系列样品对 Cd(Ⅱ)的吸附等温线, 分别采用Langmuir模型, Freundlich模型, Langmuir-Freundlich模型进行拟合。
Langmuir吸附模型假设: 吸附剂表面均匀; 吸附质之间没有相互作用力; 吸附为单层吸附; 吸附平衡后是动态平衡, 吸附速率与解析速率相同。公式如下:

其中,e(mg/g)和e(mg/L)分别为平衡吸附量和吸附平衡时溶液中 Cd(Ⅱ)的浓度,m(mg/g)为最大单分子层吸附量,为与吸附自由能相关的常数。
Freundlich模型为经验模型, 它假设吸附剂表面非均匀且不局限于单层吸附。公式如下:

式中,F为与吸附量有关的Freundlich 常数(mg/g),为与吸附剂强度相关的异质性因子。
Langmuir-Freundlich 模型为修正模型, 公式如下:

吸附等温式对实验数据的拟合结果如表 4 所示。三参数 Langmuir-Freundlich 模型拟合结果r>0.9, 与实验结果更接近。从 TNTs-1d 至 TNTs-4d, 平衡吸附量分别为189.26, 154.62, 182.50和164.83 mg/g。TNTs-1d 与 TNTs-3d 具有近似相等的平衡吸附容量, 且明显高于 TNTs-2d 和 TNTs-4d。已有研究表明, TNTs 表面存在均匀的表面活性位点, 且 Cd(Ⅱ)在 TNTs 表面的吸附为单分子层吸附[14]。本研究结果表明, 吸附到 TNTs 系列样品上的Cd(Ⅱ)与材料之间可能存在相互作用。
从材料表征结果可知, 水热法制备钛酸纳米管的过程经历了二氧化钛源结构解体→钛酸纳米管形成→钛酸纳米管解体的过程。TNTs-3d 样品代表其中形成钛酸纳米管这一阶段的样品, 具有最为规整的形貌, 因而其平衡吸附容量最大。
2.5 吸附量与材料孔径的关系
表 5 列出不同水热反应时间合成的TNTs系列样品的结构参数及对 Cd(Ⅱ)的平衡吸附量。吸附时间为Cd(Ⅱ)吸附量达到平衡吸附量 95%时所用的时间。TNTs-2d, TNTs-3d 和 TNTs-4d 在结构方面与 TNTs-1d 有比较大的差别, 因此对吸附的研究主要集中在 TNTs-2d, TNTs-3d 和 TNTs-4d 三者的相互对比上。

表4 TNTs系列样品对Cd(Ⅱ)的吸附等温线参数

表5 TNTs系列样品的结构参数及吸附容量
说明: 吸附时间为达到平衡吸附量95%时的时间。
从表 5 可以看出, TNTs-1d 和 TNTs-3d 对Cd(Ⅱ)的吸附量最高, TNTs-2d 与 TNTs-4d 有显著的差别。随着水热反应时间的延长, TNTs系列样品的回转半径逐渐增加, 吸附平衡时间逐渐缩短, 这与吸附量的变化规律不一致。因此, 样品的回转半径与平衡吸附量无直接关系, 可能与平衡时间有关。
TNTs-2d, TNTs-3d 和 TNTs-4d 的孔体积均在0.33~0.35 cm3/g范围内, 差异较小, 因此, 样品的孔容量也与平衡吸附量无直接关系。相比之下, TNTs-3d的比表面积和平均孔径显著大于TNTs-2d和TNTs-4d, 这可能与样品的吸附容量有关。
3 结论
1) 水热时间分别为1, 2, 3, 4天, 合成了4种钛酸纳米管不同形成阶段的系列产物, 粉末 XRD 表征证实均为单斜晶胞结构。
2) SAXS 和 N2吸附/脱附表征证实, 水热法制备钛酸纳米管经历了二氧化钛源结构解体→钛酸纳米管形成→管状结构解体的过程, TNTs-3d钛酸纳米管具有最为规整的管状形貌。
3) 吸附等温线结果表明, Langmuir-Freundlich模型能够更好地拟合吸附等温结果, 并且 Cd(Ⅱ)的吸附量大小顺序为: TNTs-3d > TNTs-1d > TNTs-4d > TNTs-2d。
4) 样品的回转半径、孔体积对吸附量影响较小, 而比表面积和平均孔径可能会影响吸附容量。
参考文献
[1]Chen Q, Peng L M. Structure and applications of titanate and related nanostructures. International Journal of Nanotechnology, 2007, 4(1/2): 44–63
[2]Kasuga T, Hiramatsu M, Hoson A, et al. Formation of titanium oxide nanotube. Langmuir, 1998, 14(12): 3160–3163
[3]Kasuga T, Hiramatsu M, Hoson A, et al. Titania nanotubes prepared by chemical processing. Advan-ced Materials, 1999, 11(15): 1307–1311
[4]Chen Q, Zhou W Z, Du G H, et al. Trititanate nanotubes made via a single Alkali treatment. Advanced Materials, 2002, 14(17): 1208–1211
[5]Wang T, Liu W, Xu N, et al. Adsorption and desorption of Cd(Ⅱ) onto titanate nanotubes and efficient regeneration of tubular structures // 36th International Convention on Information & Communi- cation Technology Electronics & Microelectronics (MIPRO). Opatija, 2013: 379– 386
[6]Yao B D, Chan Y F, Zhang X Y, et al. Formation mechanism of TiO2nanotubes. Applied Physics Letters, 2003, 82(2): 281–283
[7]Chen Y C, Lo S L, Kuo J. Pb(Ⅱ) adsorption capacity and behavior of titanate nanotubes made by micro-wave hydrothermal method. Colloids and Surfaces A, 2010, 361: 126–131
[8]Du A J, Sun D D, Leckie J O. Sequestration of cadmium ions using titanate nanotube.Journal of Hazardous Materials, 2011, 187: 401–406
[9]Xiong L, Chen C, Chen Q, et al. Adsorption of Pb(Ⅱ) and Cd(Ⅱ) from aqueous solutions using titanate nanotubes prepared via hydrothermal method. Journal of Hazardous Materials, 2011, 189(3): 741–748
[10]Liu W, Wang T, Alistair G L, et al. Adsorption of Pb2+, Cd2+, Cu2+and Cr3+onto titanate nanotubes: competition and effect of inorganic ions. Science of the Total Environment, 2013, 456/457: 171–180
[11]Yang D J, Sarina S, Zhu H Y, et al. Capture of radioactive cesium and iodide ions from water by using titanate nanofibers and nanotubes. Angewandte Chemie International Edition, 2011, 50(45): 10594 –10598
[12]盛国栋, 杨世通, 赵东林, 等. 静态法和EXAFS技术研究Eu(Ⅲ)在钛酸纳米管上的吸附行为和微观机制. 中国科学B辑: 化学, 2012, 42(1): 60–73
[13]Suetake J, Nosaka A Y, Hodouchi K, et al. Charac-teristics of titanate nanotube and the states of the confined so dium ions. Journal of Physical Chemistry C, 2008, 112(47): 18474–18482
[14]Lin K S, Cheng H W, Chen W R, et al. Synthesis, characterization, and adsorption kinetics of titania nanotubes for basic dye wastewater treatment. Adsor-ption, 2010, 16(1): 47–56
[15]Liu J L, Luo M B, Yuan Z Z, et al. Synthesis, characterization, and application of titanate nanotubes for Th(Ⅳ) adsorption.Journal of Radioanalytical and Nuclear Chemistry, 2013, 298(2): 1427–1434
[16]张月, 陈清, 龚巍巍, 等. 钛酸钠纳米线的合成和结构. 北京大学学报: 自然科学版, 2007, 43(1): 125–131
[17]朱育平. 小角X射线散射理论、测试、计算及应用. 北京: 化学出版社, 2008
[18]Gregg S J, Sing K S W. Adsorption, surface area, and porosity. 2nd ed. London: Academic Press, 1982
[19]Groen J C, Peffer L A A, Perez-Ramirez J. Pore size determination in modified micro- and mesoporous materials, Pitfalls and limitations in gas adsorption data analysis. Microporous and Mesoporous Materials, 2003, 60: 1–17
Characterization of Titanate Products with Different Formation Stages and Adsorption Characteristics of Cd(Ⅱ)
CAI Bin1, 2, WANG Ting2,†
1. School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; 2. Department of Environmental Engineering, Peking University, The Key Laboratory of Water and Sediment Sciences, Ministry of Education, Beijing 100871; † Corresponding author, E-mail: wang_ting@pku.edu.cn
Series of products with different formation stages of titanate nanotubes (TNTs) are synthesized, with the hydrothermal reaction time of 1, 2, 3, 4 days. XRD, SAXS and N2adsorption/desorption have been chosen to detect the morphology and structure of various products. Afterwards, the adsorption behavior of Cd(Ⅱ) onto various products are also compared, and possible mechanism for the different adsorption capacities are detected based on their structures. XRD detection depictes that all products are monoclinic system. Results from SAXS and N2adsorption/desorption suggeste that the formation processes of TNTs are the disintegration of TiO2→the formation of titanate nanotubes→the destruction of tubular structures. Among all products, TNTs-3d displayes the best defined structure. As for Cd(Ⅱ) adsorption, Langmuir-Freundlich model can better describe the adsorption isotherm, and the adsorption capacities rank as: TNTs-3d ≈ TNTs-1d > TNTs-4d > TNTs-2d. Further detection proves that gyration radius and pore volume play little role, while BET surface area and the average pore diameter possibly affect the adsorption capacity.
titanate nanotubes; SAXS; adsorption; Langmuir-Freundlich model
10.13209/j.0479-8023.2016.108
O614; X131
2015-05-26;
2015-06-02;
网络出版日期: 2016-11-05
深圳市科技研发资金(CXY201106290063A)资助

