GST-SUMO-MT融合蛋白在大肠杆菌中的自诱导表达
彭冬 杨威 王昭 王席 柳忠玉
(长江大学生命科学学院,荆州 434025)
GST-SUMO-MT融合蛋白在大肠杆菌中的自诱导表达
彭冬 杨威 王昭 王席 柳忠玉
(长江大学生命科学学院,荆州 434025)
旨在考察在大肠杆菌中自诱导表达GST-SUMO-MT融合蛋白的可行性,并对自诱导培养条件及培养基成分进行优化,以提高蛋白产量。采用摇瓶培养,利用单因素和正交实验对工程菌自诱导的培养条件(诱导时间、诱导温度)和培养基组分(蛋白胨、酵母粉、甘油、葡萄糖、乳糖)进行优化,检测菌体浓度、可溶性目的蛋白的表达量。结果表明,自诱导培养基碳氮源的最优配比为:2% 蛋白胨、2% 酵母粉、0.3% 甘油、0.05% 葡萄糖和0.3% 乳糖。重组菌自诱导表达最优发酵条件为:采用两阶段温度控制,37℃培养3 h,25℃继续培养 13 h。此时可溶性目的蛋白的表达量和菌体浓度分别为 LB 培养基(IPTG 诱导)的 2.2倍和2.3倍。
金属硫蛋白;融合蛋白;可溶性表达;自诱导
金属硫蛋白(Metallothionein,MT)是一类普遍存在于生物体内的富含半胱氨酸、相对分子质量较低的金属结合蛋白,具有高诱导特性和多种生物学功能。目前比较明确的是MT具有清除体内自由基、参与体内微量元素代谢、解除重金属的毒性、增强机体各种不良状态的适应能力、调控机体生长发育和细胞代谢等功能,MT还参与纤维化疾病、神经退行性疾病及肿瘤的发生发展[1]。采用基因工程方法规模化生产制备金属硫蛋白,对其应用开发和作用机理的研究具有重要的意义。目前,不同来源MT基因先后被克隆入不同的表达载体,在大肠杆菌中进行表达[2-4]。在原核表达体系中常常采用IPTG作为诱导剂。但是IPTG应用于大规模生产基因工程药物有一定的局限性,例如易形成包涵体、对于人体具有潜在的毒性、价格贵成本高。2005年Studier等[5]提出了外源基因表达自诱导的方法,自诱导培养基中的乳糖是一种二糖,无毒且价格低廉。国内外研究者发现乳糖作为诱导剂表达大肠杆菌重组产物具有明显的优越性,可溶性表达高,蛋白产量高,成本低等[6-8]。本实验室前期为了在大肠杆菌中融合表达人金属硫蛋白MT-1A,以GST为表达标签和SUMO为分子伴侣,构建了融合蛋白表达载体pET20b-GSMT,并表达成功,但目的蛋白多以包涵体的形式表达。本研究拟考察在大肠杆菌中自诱导表达GST-SUMO-MT融合蛋白的可行性,通过优化自诱导培养基的碳氮源组分及调整乳糖浓度,筛选能高效可溶表达GST-SUMO-MT蛋白的工艺条件,旨为进一步的研究及工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 表达融合蛋白GST-SUMO-MT的重组基因工程菌pET20b-GSMT/BL21(DE3)由暨南大学医药生物技术研究开发中心黄亚东教授惠赠。蛋白质分子量标准和 IPTG 均购自生工生物工程(上海)股份有限公司。其他试剂均为国产分析纯。
1.1.2 培养基 ZYM-5052 培 养 基:1%胰蛋白胨,0.5%酵母粉,25 mmol/L Na2HPO4,25 mmol/L KH2PO4,50 mmol/L NH4Cl,5 mmol/L Na2SO4,2 mmol/L MgSO4,0.5%甘油,0.05%葡萄糖,0.2%乳糖。LB培养基:1%胰蛋白胨,0.5%酵母粉,1% NaCl。
1.2 方法
1.2.1 菌体生长曲线 挑取含有重组质粒pET20b-GSMT的单菌落接种到5 mL LB培养基的试管中,在37℃、200 r/min条件下培养14 h作为种子。按1∶100接种到摇瓶中,分别加入新鲜 LB 培养基、ZYM-5052 自诱导培养基,在 37℃条件下培养24 h。其中LB 菌体培养至 3 h 后,菌体 OD600值达到0.5,加入终浓度 0.5 mmol/L 的 IPTG进行诱导。检测不同培养时间菌体OD600值,绘制生长曲线。
1.2.2 目的蛋白的可溶性考察 培养结束后收集菌体,加入菌液体积1/20的 PBS悬浮菌体,冰上超声裂解,12 000×g 离心10 min,分别收集上清和沉淀,进行12% SDS-PAGE电泳。经凝胶光密度扫描分析可溶性蛋白表达含量。相对产量(%)=OD600×可溶性蛋白表达量×100%。
1.2.3 诱导温度的优化 以 1%的接种量接种到ZYM-5052培养基,首先在37℃培养3 h后,再分别在30、25和20℃继续培养。选取在ZYM-5052培养基中 37℃恒温培养 20 h作为对照。发酵结束时测定菌体密度和可溶性蛋白的表达量,并计算相对产量。
1.2.4 诱导时间的优化 利用两阶段温度进行发酵,37℃培养3 h,然后降温至25℃继续培养,分别在降温后1、5、9、13和17 h取样检测菌体密度和可溶性表达量,并计算相对产量。
1.2.5 正交实验设计 选取蛋白胨、酵母粉、甘油、葡萄糖4 个因素,每个因素选取 4 个水平,采用正交表 L16(45)进行实验设计的优选。
1.2.6 乳糖浓度的优化 培养物以1% 的接种量分别接种于乳糖含量为0.2%、0.3%、0.4%、0.5%和0.6%的优化后的培养基中,37℃培养 3 h,降温至25℃再培养 13 h。培养结束后分别测定工程菌的菌体密度及可溶性蛋白的含量。本研究中每1组实验均重复3次,数据用SPSS19 进行统计分析,并用EXCEL绘制图表。
2 结果
2.1 菌体生长曲线
用ZYM-5052 自诱导培养基对重组基因工程菌pET20b-GSMT/BL21(DE3)进行自诱导发酵,37℃恒温培养 24 h。选取IPTG诱导的LB培养基作为对照。结果(图1和图2)显示,在IPTG诱导的LB培养基中,菌体在 0-6 h 内菌体密度呈对数增长,10 h后菌体密度不再增加,发酵终点菌体OD600为2.21,可溶性蛋白表达量为 9.2%。自诱导培养基在0-6 h内菌体密度呈对数增长,10 h后菌体密度继续缓慢增长,发酵终点菌体OD600为2.78,可溶性蛋白表达量为10.21%。结果表明,同LB培养基相比,ZYM-5052培养基更合适菌体密度的提高和可溶性蛋白表达。
2.2 诱导温度对发酵的影响
对基因工程菌在ZYM-5052自诱导培养基中的发酵条件进行优化。以 1%的接种量接种到ZYM-5052培养基,首先在37℃培养 3 h 后,再分别在30、25和20℃继续培养。选取在ZYM-5052培养基中37℃恒温培养20 h作为对照。SDS-PAGE 电泳(图3)显示,自诱导后的重组菌可见相对分子质量约45 kD 的特异蛋白条带,与GST-SUMO-MT融合蛋白理论值相符;37℃恒温培养时,大部分目的蛋白在沉淀中以包涵体的形式存在,而两阶段培养时,大部分目的蛋白可溶性地存在于离心后的上清溶液中。随着温度的降低可溶性蛋白表达量明显提高,GST-SUMO-MT的相对产量在25℃时为最大值,此时的菌体OD600为2.38,可溶性蛋白表达量为18.3%(图4)。结果表明,同37℃恒温发酵相比,两阶段温度发酵的可溶性表达量大幅度提升,后续实验选择利用两阶段温度控制进行发酵,培养条件为37℃培养3 h,25℃继续培养。
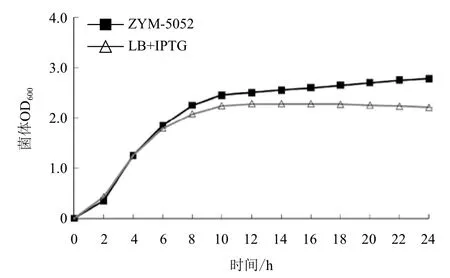
图1 pET20b-GSMT/BL21(DE3)工程菌生长曲线
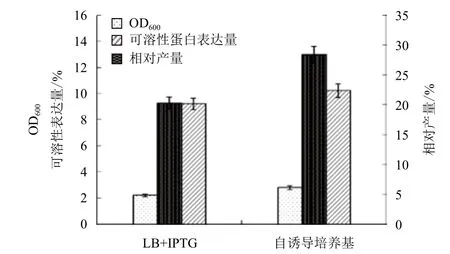
图2 不同培养基对工程菌密度和可溶性表达量的影响
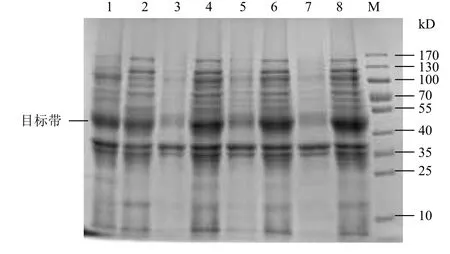
图3 不同温度诱导对可溶性表达的影响
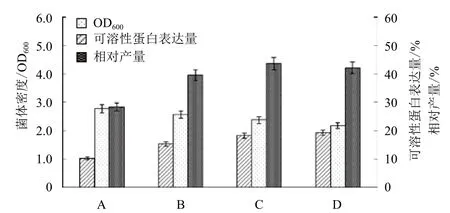
图4 不同温度对工程菌密度和可溶性表达量的影响
2.3 诱导时间对发酵的影响
利用两阶段温度进行发酵,37℃培养3 h,然后降温至25℃继续培养,分别在降温后1、5、9、13和17 h取样检测菌体密度和可溶性表达量。诱导不同时间后GST-SUMO-MT 的 SDS-PAGE 电泳和表达量分析结果(图5和图6)显示,随着时间的延长菌体密度逐渐增大,降温后5-13 h 内可溶性表达量急剧升高,13 h之后表达量不再明显增加。GSTSUMO-MT的相对产量在13 h已达最大值,13 h以后变化不明显。因此确定发酵条件为 37℃培养3 h,降温至25℃后继续培养 13 h。
2.4 正交实验优化培养基
采用L16(45)正交实验对培养基的碳氮比进行优化,对蛋白胨、酵母提取物、甘油及葡萄糖进行4 因素 4 水平的正交实验;考察培养基碳源、氮源组分对菌体生长及表达的综合影响,选取最优的培养基配方。正交实验因素水平见表 1,实验结果和极差分析实验因素对指标的影响结果见表 2。结果表明,培养基对相对产量的影响顺序为 B>C>D>A,最终确定优化培养基的组分为A4B4C1D2,即 2% 蛋白胨、2% 酵母粉、0.3% 甘油、0.05%葡萄糖。在此配比下,菌体OD600达到4.26,可溶性表达量为19.81%。
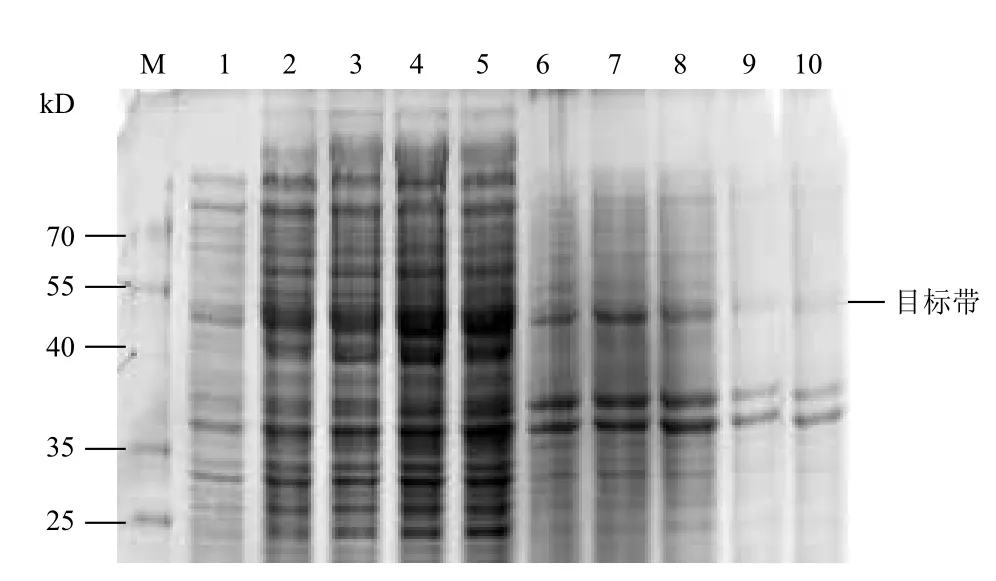
图5 诱导时间对可溶性表达的影响
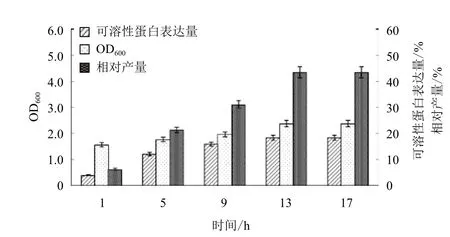
图6 诱导时间对工程菌密度和可溶性表达量的影响
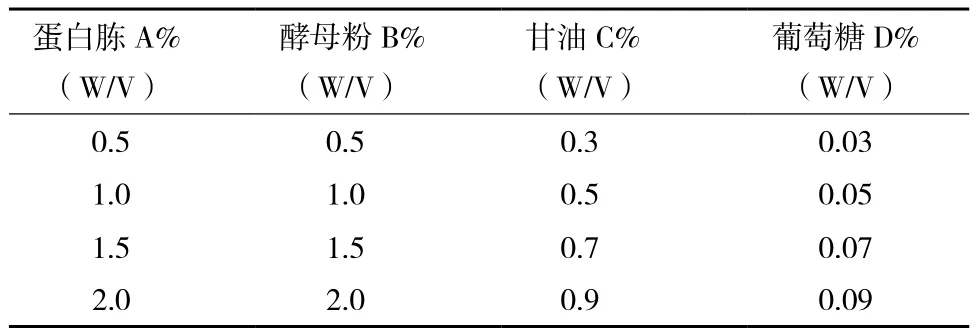
表1 优化培养基碳氮比实验的因素水平设计
2.5 乳糖浓度对发酵的影响
在优化培养基的碳氮比的基础上,设置乳糖终浓度分别为0.2%、0.3%、0.4%、0.5%和0.6%,37℃培养 3 h,降温至 25℃再培养 13 h。图7显示,菌株在乳糖0.2%-0.4%时维持较高的可溶性表达,乳糖超过 0.6% 时表达量急剧下降。图8显示,乳糖在0.2%-0.4%对菌体的生长有一定的促进作用,超过0.6%时菌体密度也明显下降,GST-SUMO-MT的相对产量在乳糖为 0.3% 时达最大值,此时的菌体OD600为4.94,可溶性蛋白的表达量为19.81%。综合考虑可溶性表达量和菌体密度因素,工程菌表达的最适乳糖的诱导浓度为0.3%。
2.6 重组基因工程菌在3种培养基中的发酵情况的比较
用优化后的 ZYM-5052 自诱导培养基对重组基因工程菌进行自诱导发酵,并以 IPTG诱导的 LB 培养基、文献[5]给出ZYM-5052自诱导培养基为对照进行比较。结果(表 3)显示,优化后的自诱导培养基的发酵产量最高,其可溶性蛋白表达量和菌体浓度分别为 LB 培养基(IPTG 诱导)的2.2倍和2.3倍。
3 讨论
自诱导培养基已经成功应用于多种酶和蛋白的高效表达[9-11]。本课题组前期构建了基因工程菌pET20b-GSMT/BL21(DE3),但是目的蛋白GSTSUMO-MT在LB培养基(IPTG诱导)中以包涵体的形式表达,为解决包涵体问题,本实验研究了在ZYM-5052 培养基中自诱导表达GST-SUMO-MT融合蛋白的可行性。
通过对温度优化,本实验选择利用两阶段温度控制进行发酵,采用变温培养模式较单一温度培养模式,可溶性蛋白表达量有明显提高。这主要是由于先在 37℃下培养增加菌体量,然后低温培养减缓重组蛋白的合成速率以促进蛋白正确折叠,这种两阶段温度调控策略有助于提高蛋白的可溶性表达[12,13]。张芙华等[13]提出利用枯草芽胞杆菌(Bucillis subtilis)分批发酵生产角质酶的两阶段温度控制策略,即0-4 h时发酵温度为37℃,4 h后将温度设置为30℃,采用该策略最高酶活比37℃恒温培养提高了83.4%。杨鑫等[14]提出了利用灰产色链霉菌发酵生产海藻糖合成酶的两阶段温度控制策略,即37℃培养2.5 h,25℃继续培养14 h,结果显示与37℃恒温培养相比酶活提高了 55.25%。前人的研究为本实验中两阶段温度控制策略的制定提供了依据。在本研究中37℃培养3 h时OD600为0.7,菌体已经进入对数生长期,可以进行蛋白的诱导表达。通过诱导温度和诱导时间的优化,本研究确定了两阶段温度控制策略,即37℃培养3 h,降温至25℃继续培养13 h。
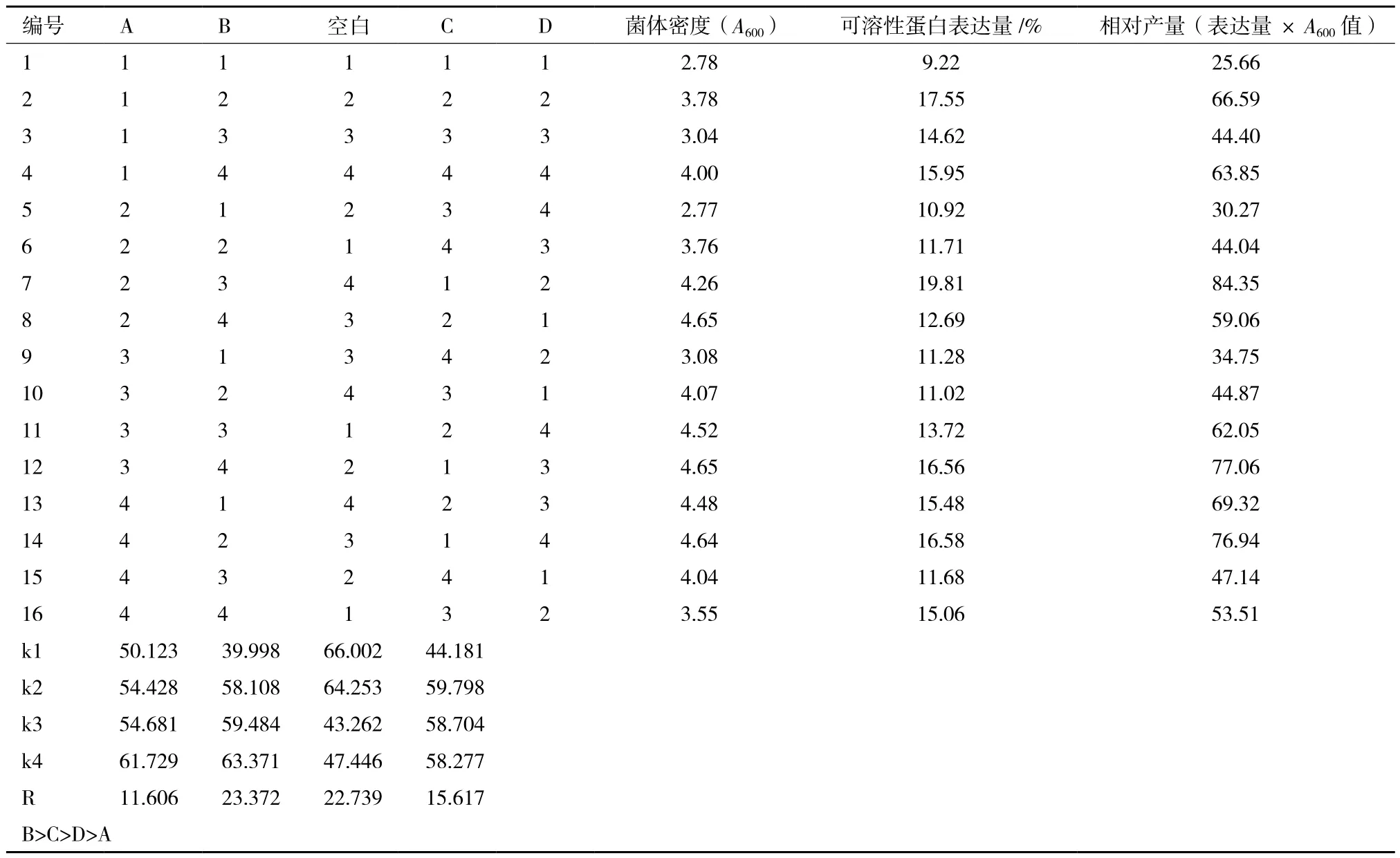
表2 优化培养基碳氮比对工程菌生长及表达的影响
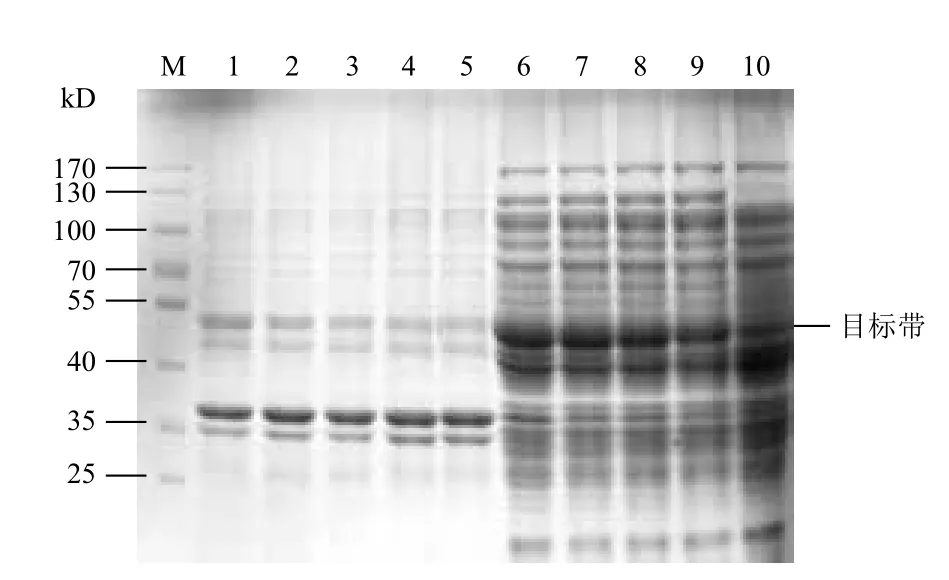
图7 乳糖浓度对可溶性表达的影响
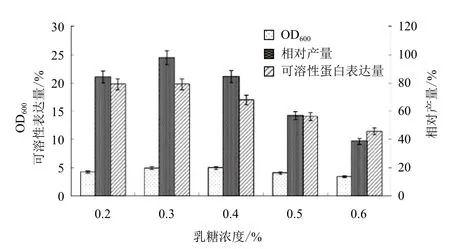
图8 乳糖浓度对工程菌密度和可溶性表达量的影响
通常使用的LB培养基组成成分简单,不能满足高密度发酵对营养的要求,本研究通过正交实验对ZYM-5052 自诱导培养基碳氮源的主要成分进行了适当优化,对其含量进行适当的提高,大大提高了该菌株的发酵密度。IPTG的诱导极易形成包涵体,并且对细胞生长有抑制作用,导致细胞不能高密度生长[15]。本研究优化后的自诱导培养基的发酵产量最高,其可溶性蛋白表达量和菌体浓度分别为LB 培养基(IPTG 诱导)的2.2倍和 2.3倍。这主要是由于乳糖可以作为细胞生长的能源,促进细胞高密度生长,同时可以作为诱导剂,从而提高细胞活性和蛋白表达量,与传统培养基相比可以使菌体密度和可溶性蛋白表达量增加数倍[16]。但本研究中当乳糖浓度过高(0.6%)时产生抑制效应,与文献报道类似[17]。乳糖自诱导表达系统既保证了乳糖诱导蛋白表达的稳定性,同时自诱导发酵过程中无需检测菌体的生长状态,避免了不必要的污染,并且节省成本[18]。
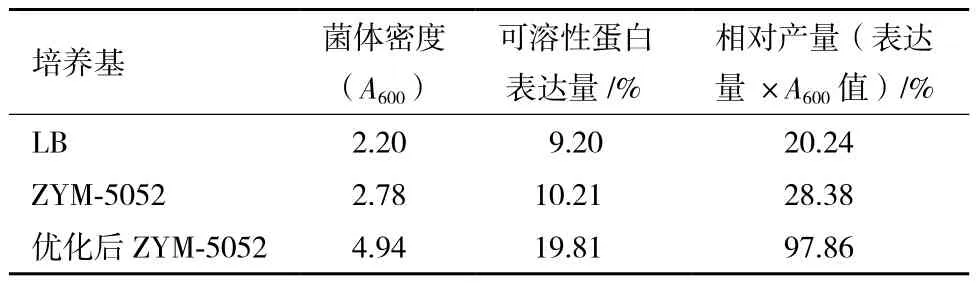
表3 培养基优化前后培养工程菌效果的比较
4 结论
经过优化得出最优培养基成分为:2% 蛋白胨、2% 酵母、0.3% 甘油、0.05%葡萄糖、0.3%乳糖。在37℃培养 3 h,降温至 25℃再培养 13 h。优化后的自诱导培养基的发酵产量大幅度提高,其可溶性蛋白表达量和菌体浓度分别为 LB 培养基(IPTG 诱导)的2.2倍和 2.3倍。本研究通过对培养基的调整和发酵工艺的优化,降低了生产成本。
[1]Babula P, Masarik M, Adam V, et al. Mammalian metallothioneins:properties and functions[J]. Metallomics, 2012, 4(8):739-750.
[2] 麦杰晖, 于波, 张其中. 近江牡蛎金属硫蛋白(MT)的原核表达、纯化及多克隆抗体制备[J]. 农业生物技术学报, 2015, 23(8):1104-1111.
[3] 孟红恩, 刘忠渊. 植物金属硫蛋白研究进展[J]. 广东农业科学,2014, 30(15):133-138.
[4] 许黎明, 蒋国凤, 周兴. 人金属硫蛋白基因(MT1E)在毕赤酵母中的表达及其铬抗性[J]. 环境科学学报, 2014, 34(10):2724-2730.
[5] Studier FW. Protein production by auto-induction in high-density shaking cultures[J]. Protein Expr Purif, 2005, 41(1):207-234.
[6] 顾娟, 劳勋, 金明飞, 等. 人胰高血糖素样肽-1突变体融合蛋白在大肠杆菌中的自诱导表达优化[J]. 微生物学通报, 2010,37(5):726-731.
[7] Lu ZS, Chen WT, Liu R, et al. A novel method for high-level production of psychrophilic TAB5 alkaline phosphatase[J]. Protein Expr Purif, 2010, 74(2):217-222.
[8] Chen WB, Nie Y, Xu Y, et al. Enhancement of extracellular pullu lanase production from recombinant Escherichia coli by combined strategy involving auto-induction and temperature control[J]. Bioprocess Biosyst Eng, 2014, 37(4):601-608.
[9]李娟, 刘雯, 肖磊, 等. 实现人源FGF-21高效可溶性表达的两种策略[J]. 华东师范大学学报:自然科学版, 2012, 10(6):114-121.
[10]聂恒, 高志芳, 吴利先. 结核分枝杆菌MTB8. 1蛋白自诱导发酵研究[J]. 大理学院学报, 2014, 13(8):18-22.
[11] 马闪闪, 韩来闯, 刘亚娟, 等. CBM2蛋白的高密度自诱导[J].中国农学通报, 2015, 31(18):140-145.
[12]朱至, 廖鲜艳, 纪凯, 等 . 两阶段温度控制策略提高 Lactobacillus kefiranofaciens发酵生产 Kefiran[J]. 过程工程学报,2008, 8(1):144-147.
[13]张芙华, 华兆哲, 陈坚, 等. 温度两阶段控制策略发酵生产重组角质酶[J]. 应用与环境生物学报, 2009, 10(5):730-733.
[14]杨鑫, 吴茜, 崔怀言, 等. 灰产色链霉菌海藻糖合成酶的自诱导表达及两阶段温度控制发酵的优化[J]. 食品与发酵工业,2015, 41(5):14-18.
[15]Sadraeian M, Ghoshoon MB, Mohkam M, et al. Modification in media composition to obtain secretory production of STxB-based vaccines using Escherichia coli[J]. Virol Sin, 2013, 28(1):43-48.
[16]丛楠, 卢士英, 任洪林, 等. 重组免疫毒素IL-6_(T23)-PE38KDEL在大肠杆菌中自诱导表达条件的优化[J]. 中国生物制品学杂志, 2013, 10(5):717-722.
[17]龚志飞, 杨翔, 颜法宝, 等. 重组人抗血栓蛋白在大肠杆菌中的自诱导表达及纯化[J]. 生物技术通报, 2011(12):192-198.
[18]Blommel PG, Becker KJ, Duvnjak P, et al. Enhanced bacterial protein expression during auto-induction obtained by alteration of lac repressor dosage and medium composition[J]. Biotechnol Prog, 2007, 23(3):585-598.
(责任编辑 马鑫)
Auto-inducing Expression of GST-SUMO-MT Fusion Protein in Escherichia coli
PENG Dong YANG Wei WANG Zhao WANG Xi LIU Zhong-yu
(College of Life Sciences,Yangtze University,Jingzhou 434025)
The auto-inducing expression of GST-SUMO-MT fusion protein in Escherichia coli BL21(DE3)was studied. In order to increase the protein yield, we optimized both the auto-induction fermentation conditions and medium. Recombinant E. coli was cultured in shake flask, of which the culture condition(time and temperature for induction)and medium composition(tryptone, yeast extract, glycerol, glucose and lactose)were optimized by single factor and orthogonal tests, and bacterial concentration, expression level of soluble target protein were determined. Result showed that the optimal carbon and nitrogen composition ratio in auto induction medium was obtained as followed:2% tryptone, 2% yeast extract, 0.3% glycerol, 0.05% glucose, 0.3% lactose. The optimum fermentation conditions were:cultivating in 37℃ for 3 h firstly, then culturing in 25℃ for 13 h. Under the optimal condition, the expression level of soluble target protein and bacterial concentration were 2.2 and 2.3 times of those in LB medium under induction of IPTG respectively.
metallothionein;fusion protein;soluble expression;auto-induction
10.13560/j.cnki.biotech.bull.1985.2016.02.030
2015-08-31
长江大学大学生创新创业训练计划项目(104892013034),长江大学博士启动基金项目(801100010122)
彭冬,男,研究方向:生物工程;E-mail:1182359426@qq.com
柳忠玉,女,博士,讲师,研究方向:生物制药;E-mail:zyliu2004@126.com

