固相萃取结合气相色谱-串联质谱测定卷烟中3种禁用香料
郑 阳,许秀丽,纪顺利,袁 飞,黄志强,杨丙成*,张 峰*
(1.华东理工大学 药学院,上海 200237;2.中国检验检疫科学研究院 烟草安全与控烟技术中心/食品安全研究所,北京 100176;3.湖南检验检疫科学技术研究院,湖南 长沙 410004)
固相萃取结合气相色谱-串联质谱测定卷烟中3种禁用香料
郑阳1,2,许秀丽1,纪顺利2,袁飞1,黄志强3,杨丙成1*,张峰2*
(1.华东理工大学药学院,上海200237;2.中国检验检疫科学研究院烟草安全与控烟技术中心/食品安全研究所,北京100176;3.湖南检验检疫科学技术研究院,湖南长沙410004)
利用固相萃取结合气相色谱-串联质谱(SPE/GC-MS/MS)检测技术,建立了烟草制品中3种禁用香料(侧柏酮、樟脑及黄樟素)的高灵敏度分析方法。对前处理条件及质谱条件进行优化,在最佳实验条件下,3种香料在10.0~500.0 μg/L质量浓度范围内的线性关系良好(r2≥0.998 6),方法检出限(LOD,S/N=3)及定量下限(LOQ,S/N=10)分别为2.3~5.8 μg/kg及7.7~19.3 μg/kg。在LOQ,1.5LOQ及2LOQ加标水平下,3种禁用香料的平均回收率为74.9%~90.9%,相对标准偏差(RSD)均不大于2.6%。该方法准确可靠,灵敏度高,可满足国内对于这3种禁用香料的检测要求。
固相萃取;气相色谱-串联质谱;禁用香料;卷烟
人类利用植物中的天然香味物质作为香料加入到烟草中已有很长的历史,但植物提取物成分十分复杂,随着对烟用香料安全性问题的日益关注和现代毒理学的发展,人们发现植物提取物尤其是精油中一些化合物可对人体造成不同性质的伤害。侧柏酮[1]、樟脑[2]及黄樟素[3]广泛存在于多种植物中,且被证实是对人体健康具有威胁的天然有害物质,其中侧柏酮是艾叶挥发油的主要成分,具有神经毒性[4-6];樟脑广泛存在于香樟油中,对神经系统及生殖系统具有明显毒性,可通过呼吸麻痹导致动物死亡,对生殖细胞的成熟及受精能力亦会产生影响,同时其长期慢性毒性也会对人体健康造成潜在威胁[7-9];黄樟素是许多食用天然香精如黄樟精油、八角精油和樟脑油的主要成分,也是制备洋茉莉香精和香兰素香精的主要原料[10-12]。黄樟素具有致癌可能性,其在小鼠体内首先代谢为苯乙醇形式,然后被激活转化为乙酸盐或硫酸盐,成为最终的致癌物,后者的双键因其亲电性与遗传物质DNA发生反应,可导致癌症的发生[13-14]。基于以上原因,美国食品药品管理局(FDA)已禁止黄樟素作为香味添加剂使用,德国烟草法、捷克烟草法也将侧柏酮、樟脑及黄樟素列入不允许使用的香料物质名单。然而部分烟用添加剂如植物精油[15-16]和植物提取液在生产过程中可能带入黄樟素、侧柏酮等有害成分,因此建立简单快速、灵敏的测定这些有害物质的分析方法对烟草制品的质量控制具有重要意义。
目前,针对这些有害物质的检测方法报道较少[17-20],基质主要集中于烟用精油及药用制剂。李韵等[21]采用高效液相色谱/荧光检测法同时测定了香精香料中的黄樟素等4种禁限用添加剂,其中黄樟素的定量下限为40 μg/kg。张琳等[22]采用离子液体-静态顶空气相色谱法测定了十滴水中的樟脑和桉油精,其中樟脑的检出限为160 μg/kg。然而,烟草基质复杂,含有大量的脂肪酸、色素[23-24]等,运用现有方法已不能满足复杂基质中的痕量检测要求,因此发展高效、高灵敏度的检测方法具有重要意义。本文首次利用固相萃取[25-27]结合气相色谱-串联质谱[28-30](SPE/GC-MS/MS)建立了针对卷烟中侧柏酮、樟脑及黄樟素的检测方法。其中,固相萃取能够对样品进行有效的分离、净化及富集,而GC-MS/MS定性定量准确、抗基质干扰强、检测灵敏度高、稳定性好。本文所建立的分析方法可为卷烟中此3种禁用香料的安全控制提供很好的技术支持。
1 实验部分
1.1仪器与试剂
Agilent 7890-7000C三重四极杆气相色谱-质谱联用系统(GC-MS/MS);涡旋混合仪(美国Scientific Industries公司);KQ-500DE数控超声波清洗器(昆山市超声仪器有限公司);Avanti J-26 XPI离心机(美国 Beckman Coulter公司);超纯水系统(美国Millipore Milli-Q Gradient公司);固相萃取柱Oasis HLB,Sep-Pak C18,Sep-Pak Silica,Sep-Pak CN(规格均为6 mL/500 mg,美国Waters公司)。
正己烷、二氯甲烷、丙酮、乙醇、乙腈、甲醇(色谱纯,美国Fisher Scientific公司);侧柏酮、樟脑、黄樟素(Sigma公司)。 未经加工的烤烟叶片研磨成粉后作为空白实验样品。10种商品卷烟作为待测样品。
1.2标准溶液的配制
分别称取10 mg(精确至±0.001 mg)标准品,用正己烷溶解并定容于10 mL容量瓶中,配成1 000 mg/L的单标储备液,将单标储备液混合、稀释配制成5.0 mg/L的混合工作储备液,于4 ℃冰箱中避光保存。使用前根据需要将混合工作储备液用正己烷稀释至所需浓度,配制系列标准溶液。
基质匹配标准溶液是按照样品前处理步骤提取的不含目标化合物的空白基质,在空白基质上配制标准品溶液,用于制作基质匹配标准工作曲线,以对基质效应进行校正。本文采用空白样品提取液建立基质匹配标准曲线,可从一定程度上减弱基质效应对目标物的影响。基质匹配标准溶液的配制过程为:对空白样品(不含待测目标物的未加工烤烟烟末)按“1.3”方法进行前处理,氮气吹至近干后分别用1.0 mL系列标准溶液复溶,过0.22 μm有机滤膜后用GC-MS/MS测定。
1.3样品前处理
烟草样品首先按照YC/T 31-1996[31]进行粉碎处理,即在35 ℃恒温箱中干燥2 h除去水分,再研磨过筛,并避光保存。
精确称取待测样品(1.000±0.001) g,置于50 mL聚丙烯塑料离心管内,加入20 mL乙醇萃取,加盖后轻摇离心管使溶剂浸润烟末,放入超声装置中在20 ℃ 100 Hz的条件下超声15 min,然后于4 ℃ 8 000 r/min的条件下冷冻离心10 min。吸取10 mL上清液进行SPE净化,净化液经氮吹、1 mL乙醇复溶后过0.22 μm有机滤膜,滤液转移至色谱分析瓶中,用于GC-MS/MS分析测定。
1.4色谱-质谱条件
色谱条件:色谱柱:Agilent DB-5MS 弹性石英毛细管(30 m×0.25 mm×0.25 μm);载气:高纯氦气;流速:1.0 mL/min;不分流进样;进样口温度:250 ℃;程序升温:初始温度60 ℃,以25 ℃/min升至200 ℃;进样量:1 μL;溶剂延迟3 min。
质谱条件:电子轰击(EI)离子源,温度230 ℃;电离能量70 eV;四极杆温度150 ℃;传输线温度280 ℃;碰撞气:氩气;监测模式:多反应监测(MRM)模式。
2 结果与讨论
2.1质谱条件的优化
采用全扫描(Full scan)方式对单个分析物标准溶液进行逐一扫描,确定待测物的母离子,然后采用产物离子扫描(Product scan)方式,对选定的母离子进行二级裂解扫描,确定产物子离子,并优化碰撞电压,最后采用MRM模式对待测物进行定性定量分析。
碰撞电压是MS/MS重要的参数,优化过程中,分析了不同电压下母离子的裂解质谱图,选出在保证母离子不被全部打碎的情况下子离子丰度最优的条件,对每一组母离子/子离子,分别选择碰撞能量为5,10,15,20,25,30,35 V进行扫描,以响应信号大小为依据对碰撞能量进行优化;在此优化的碰撞能量附近进行微调,做二次能量优化,得到最优的碰撞能量。各目标物优化的质谱条件见表1。

表1 3种目标物的分子式、保留时间及GC-MS/MS参数Table 1 Formulas,retention times(tR) and GC-MS/MS parameters of 3 analytes
*quantitation ion pair
2.2提取溶剂的优化
提取溶剂是影响提取效率的关键因素,提取溶剂的极性与目标物相近,则目标物在溶剂中的溶解度较大,较易被提取,反之则很难提取完全。以100 μg/kg加标样品回收率为指标,按照上述条件及步骤,分别考察了5种不同极性溶剂(正己烷、乙酸乙酯、乙醇、乙腈、甲醇)对3种禁用香料的提取效率。结果表明,5种溶剂对目标物的提取回收率均在60%以上,其中乙醇对目标物的提取回收率最高,均大于80%。考虑到乙醇的价格较低,且毒性较小,因此实验选用乙醇作为提取溶剂。
2.3提取时间的优化
提取时间是影响提取回收率的另一关键因素,提取时间过短,目标物提取不完全,提取时间过长则可能导致目标物分解,降低提取效率。实验考察了100 μg/kg加标样品在5,10,15,20,25 min提取时间下的提取效率,发现大部分目标物在15 min时即获得较高的提取效率,回收率均高于80%,继续延长提取时间,目标物回收率反而下降,这可能是由于目标物在较长时间的提取环境下发生了部分分解,导致提取效率下降。因此,确定提取时间为 15 min。
2.4固相萃取条件的优化
分析过程中发现在侧柏酮的出峰时间附近有1个基质杂质峰对其干扰较大,为进一步净化样品,使用固相萃取柱对样品进行净化,并对固相萃取条件进行了考察。
2.4.1固相萃取柱的选择考察了C18柱、HLB柱、Silica柱及CN柱4种常用的固相萃取柱。取实验样品加标50 μg/kg标准溶液过不同的固相萃取柱,收集上样液和洗脱液后采用GC-MS/MS分析。首先考察了上样阶段是否穿透。样品上样后,收集上样液上机检测。结果发现,4款萃取柱均未发生穿透。随后对比了4款萃取柱对3种目标物的回收率(图1)。结果表明,CN柱对3种目标分析物的回收率最低;HLB柱对3种目标分析物的回收率最高,为77.5%~93.2%,因此实验选择HLB柱作为净化柱。
2.4.2洗脱溶剂的选择为了获得最大的萃取效率,比较了丙酮、二氯甲烷、正己烷及甲醇对50 μg/kg加标样品的洗脱效果。结果表明,正己烷对黄樟素的回收率不足40%,甲醇对侧柏酮和黄樟素的回收率均低于60%,丙酮对侧柏酮的回收率为58%,上述3种洗脱溶剂的回收率均无法满足要求。当使用二氯甲烷作为洗脱溶剂时,目标物的回收率均在84%以上,故最终选择二氯甲烷作为洗脱溶剂。
2.4.3洗脱溶剂体积的选择考察了不同体积的二氯甲烷洗脱溶剂(1,2,3,4,5 mL)对50 μg/kg加标样品回收率的影响。结果表明,当洗脱体积小于3 mL时,目标物的回收率随洗脱体积的增加而增大,当洗脱体积为3 mL时,目标物的回收率均大于90%,因此选择洗脱溶剂体积为3 mL。
实验结果显示,经上述优化后的固相萃取条件进行净化后,杂质峰对侧柏酮的干扰明显降低(图2)。
2.5线性关系、检出限与定量下限
配制3种目标物质量浓度分别为5.0,10.0,50.0,100.0,300.0,500.0 μg/L的基质匹配标准溶液,在优化条件下,以目标组分的峰面积(Y)与对应的质量浓度(X,μg/L)绘制标准曲线,结果见表2。侧柏酮、樟脑和黄樟素在10.0~500.0 μg/L范围内具有良好的线性关系,相关系数均不低于0.998 6,3种化合物的检出限(LOD,S/N=3)分别为4.3,5.8,2.3 μg/kg,定量下限(LOQ,S/N=10)分别为14.2,19.3,7.7 μg/kg。表明方法的灵敏度可满足痕量物质的检测要求。
取100.0 μg/L的基质匹配标准溶液在优化条件下于同一天内连续进样6次,其日内精密度为0.9%~2.6%;每天进样1次,持续6 d,其日间精密度为1.1%~2.7%,说明该方法具有较好的重复性(表2)。
2.6回收率与精密度
选取空白实验样品,添加LOQ,1.5LOQ,2LOQ浓度水平的各物质混合标准溶液,按照本方法进行加标回收率实验,每一浓度样品平行测定6次,结果见表3。在不同的添加水平下,侧柏酮的回收率为74.9%~80.2%,樟脑的回收率为80.1%~83.2%,黄樟素的回收率为86.8%~90.9%,3种目标物的相对标准偏差(RSD)均不大于2.6%,说明该方法的准确度及精密度较好。
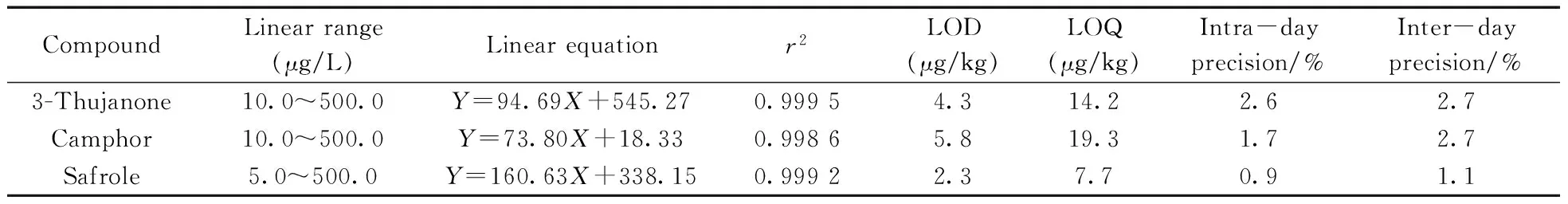
表2 3种目标物的线性范围、线性方程、相关系数、检出限、定量下限与精密度(n=6)Table 2 Linear ranges,linear equations,correlation coefficients(r2),LODs,LOQs and accuracies for the determination of 3 analytes(n=6)
2.7实际样品的测定
应用所建立的方法分别对10种实际样品中的目标物进行测定,每个样品重复测定6次。结果显示,10个样品均未检出该3种禁用香料。
3 结 论
本文建立了一种SPE/GC-MS/MS同时测定卷烟中侧柏酮、樟脑及黄樟素3种禁用香料的检测方法。该方法灵敏度和准确度良好,可用于国内外烟草制品中侧柏酮、樟脑及黄樟素的检测分析,同时为其他基质中此3种化合物的分析提供了参考。
[1]Albert-Puleo M.Econ.Bot.,1978,32(1):65-74.
[2]Ding Y G,Ma H M,Zhang B L.Chin.J.Pharmacovigilance(丁元刚,马红梅,张伯礼.中国药物警戒),2012,9(1):38-42.
[3]Liu Z Q,Chen J.FlavourFragranceCosmetics(刘志秋,陈进.香料香精化妆品),2001,(4):14-19.
[4]Shoaib M,Shah I,Ali N,Shah S W A.Bangl.J.Pharmacol.,2015,10(1):87-91.
[5]Li Y,Dong W,Chen F X,Liu J Q,Zhou Y,Yang K,Bai F.Chin.J.Exp.Tradit.Med.Formulae(李颖,董武,陈复兴,刘军权,周燏,杨琨,白枫.中国实验方剂学杂志),2014,20(23):107-110.
[6]Khan M,Khan A,Gilani A H.J.Nat.Med.,2012,66(2):292-301.
[7]Santos C D,Cabot J C.J.Emerg.Med.,2015,48(3):298-304.
[8]Marwah P,Marwah A.Indian.J.Pediatr.,2014,81(9):956.
[9]Patra C,Sarkar S,Dasgupta M K,Das A.J.Pediatr.Neurosci.,2015,10(1):78.
[10]Yu F S,Yang J S,Yu C S,Lu C C,Chiang J H,Lin C W,Chung J G.J.Dent.Res.,2011,90(2):168-174.
[11]Chu S S,Wang C F,Du S S,Liu S L,Liu Z L.J.Insect.Sci.,2011,11(1):152.
[12]Jin M,Kijima A,Suzuki Y,Hibi D,Inoue T,Ishii Y,Nohmi T,Nishikawa A,Ogawa K,Umemura T.Toxicology,2011,290(2):312-321.
[13]Zhang Y,Chen Y J.ActaAcad.Med.Suzhou(章瑜,陈跃进.苏州医学院学报),1995,15(2):241-242.
[14]Chen C L,Chi C W,Chang K W,Liu T Y.Carcinogenesis,1999,20(12):2331-2334.
[15]Zhong R M,Zeng Q X,Zhang Z M,Wang Y H,Peng H G.J.Instrum.Anal.(钟瑞敏,曾庆孝,张振明,王羽海,彭华贵.分析测试学报),2006,25(5):16-20.
[16]Tian Y H,Zhang X M,Huang T S,Li G X,Zou K X,Zhou J.GuangdongChem.Ind.(田玉红,张祥民,黄泰松,李桂湘,邹克兴,周俊.广东化工),2007,34(10):73-75.
[17]Zhu X L,Hong S Q,Li P P,Gao Y,Li Y G.J.Instrum.Anal.(朱晓兰,洪深求,李盼盼,高芸,李渊根.分析测试学报),2012,31(3):351-354.
[18]Wu T,Jin Q Z.Chin.FoodAddit.(吴婷,金其璋.中国食品添加剂),2010,(1):223-228.
[19]Lisko J G,Stanfill S B,Watson C H.Anal.Methods,2014,6(13):4698-4704.
[20]Yin C,Lu Y,Yang T,Long Z R,Ding C R.Chin.J.Anal.Lab.(殷超,鹿毅,杨涛,龙泽荣,丁春瑞.分析试验室),2014,33(11):1281-1285.
[21]Li Y,Wang H Y,Liao X L,Xiao S H,Chen H.TobaccoSci.Technol.(李韵,汪宏毅,廖晓玲,肖少红,陈慧.烟草科技),2014,12:32-35.
[22]Zhang L,Ni M P,Jiang Y.Chin.J.Anal.Chem.(张琳,倪美萍,蒋晔.分析化学),2015,41(4):590-593.
[23]Tian H Y,Wei F J,Zhang D Y,Guo P,Zhang H T,Li S Y.TobacooSci.Technol.(田海英,韦凤杰,张东豫,郭平,张弘韬,李世勇.烟草科技),2009,(4):32-36.
[24]Zhang X,Liu Z H,Yang G Y,Yang L,Duan Y X,Liu C B,Chen Y K,Miao M M.J.Instrum.Anal.(张霞,刘志华,杨光宇,杨柳,段沅杏,刘春波,陈永宽,缪明明.分析测试学报),2014,33(5):545-550.
[25]Lindsey M E,Meyer M,Thurman E M.Anal.Chem.,2001,73(19):4640-4646.
[26]Hennion M C.J.Chromatogr.A,1999,856(1):3-54.
[27]Fu R N.Chin.J.Anal.Lab.(傅若农.分析试验室),2007,26(2):100-122.
[28]Hernández F,Cervera M I,Portolés T,Beltrána J,Pitarch E.Anal.Methods,2013,5(21):5875-5894.
[29]Lisko J G,Stanfill S B,Duncan B W,Duncan B W,Watson C W.Anal.Chem.,2013,85(6):3380-3384.
[30]Ai L F,Li W,Wang J,Ma Y S,Chen R C,Guo C H.J.Instrum.Anal.(艾连峰,李玮,王敬,马育松,陈瑞春,郭春海.分析测试学报),2015,34(5):570-575.
[31]YC/T 31-1996.Tobacco and Tobacco Products-Preparation of Test Sample and Determination of Water Content-Oven Method.Tobacco Industry Standards of China(YC/T 31-1996.烟草及烟草制品 试样的制备和水分测定 烘箱法.中华人民共和国烟草行业标准).
Determination of Three Restricted Flavor Additives in Cigarettes by Solid-phase Extraction with Gas Chromatography-Tandem Mass Spectrometry
ZHENG Yang1,2,XU Xiu-li1,JI Shun-li2,YUAN Fei1,HUANG Zhi-qiang3,YANG Bing-cheng1*,ZHANG Feng2*
(1.Institute of Tobacco Safety and control/Institute of Food Safety,Chinese Academy of Inspection and Quarantine,Beijing100176,China;2.School of Pharmacy,East China University of Science and Technology,Shanghai200237,China;3.Hunan Academy of Inspection and Quarantine,Changsha410004,China)
An analytical method for the simultaneous determination of three restricted flavor additives(3-thujanone,camphor and safrole) in tobacco products by solid-phase extraction with gas chromatography-tandem mass spectrometry(GC-MS/MS)was developed and evaluated.The extraction conditions and MS conditions were optimized.Under the optimal conditions,three flavor additives had good linearities in the range of 10.0-500.0 μg/L,with correlation coefficients(r2) not less than 0.998 6.The limits of detection(LODs) and limits of quantitation(LOQs) for these additives were in the ranges of 2.3-5.8 μg/kg and 7.7-19.3 μg/kg,respectively.The average recoveries of three analysts were in the range of 74.9%-90.9% at three spiked levels of LOQ,1.5 LOQ and 2 LOQ,with relative standard deviations(RSDs) not more than 2.6%.The method is accurate,reliable and sensitive,and could satisfy the requirements for detection of three restricted flavor additives in domestic.
solid phase extraction(SPE);gas chromatography-tandem mass spectrometry(GC-MS/MS) ;restricted flavor additives;cigarettes
2016-01-07;
2016-02-25
质检公益性行业科研专项(201410088,201310134);中国检验检疫科学研究院基本科研业务费项目(2016JK009,2015JK008);国家质检总局科研计划项目(2014IK084);国家重大仪器设备开发专项(2012YQ14000806)
杨丙成,博士,教授,研究方向:色谱相关技术及其在药物分析中的应用,Tel:021-64250622,E-mail:bcyang@ecust.edu.cn
张峰,博士,研究员,研究方向:食品药品安全研究分析,Tel:010-53898008,E-mail:fengzhang@126.com
研究简报
10.3969/j.issn.1004-4957.2016.08.010
O657.6;S816.74
A
1004-4957(2016)08-0987-06
——香草传

