琼脂磁珠消减SELEX技术筛选HIV P24抗原适配体
葸玉琴,赵运旺,马梅兰,曾家豫,廖世奇
(1.西北师范大学生命科学学院,甘肃兰州 730070;2.甘肃省医学科学研究院医学分子生物学研究中心,甘肃兰州 730050)
琼脂磁珠消减SELEX技术筛选HIV P24抗原适配体
葸玉琴1,赵运旺1,马梅兰1,曾家豫1,廖世奇2*
(1.西北师范大学生命科学学院,甘肃兰州730070;2.甘肃省医学科学研究院医学分子生物学研究中心,甘肃兰州730050)
建立以羧基化琼脂磁珠为筛选介质,快速筛选高特异性、高亲和力的HIV P24抗原适配体的方法.利用消减SELEX技术及靶标替换的方法,以HIV P24抗原作为靶分子,羧基化琼脂磁珠为载体,进行6轮筛选,筛选到3条特异性核酸适配体.特异性检测表明,筛选得到的HIV P24抗原适配体与HIV P24抗原的结合解离常数均在纳摩尔级水平.该方法为HIV早期检测提供了新的检测技术,对适配体与靶分子相互作用机理的研究具有重要价值.
HIV P24抗原;消减SELEX技术;DNA适配体;靶标替换
P24抗原是HIV-1的核心抗原,机体感染HIV-1后,P24在血清中出现的时间较早,一般在HIV-1感染后2~3周就可以检测,可作为艾滋病窗口期检测的血清标志物,通过检测血液中的P24,可达到早期诊断和治疗的目的[1].DNA适配体相比于抗体检测具有许多优点:① DNA适配体更稳定,不易降解,可长期保存[2-3];② 筛选周期一般1~2个月[4-5];③ 无免疫原性[6-7];④ 变性、复性速度较快,可反复使用[8],可在室温下运输、保存;⑤ 易于化学修饰[9].本文利用靶标替换消减SELEX技术通过6轮筛选快速得到HIV P24抗原适配体,筛选周期为10~15 d,明显地缩短了筛选周期,提高了筛选效率.
1 材料与方法
1.1实验材料
ssDNA文库序列(88 nt,1.2 nmol,OD 1.0) 5’-CTATAGCAATGGTACGGTACTTCC-40N-CAAAAGTGCACGCTACTTTGCTAA-3’(N=A、G、T、C);上游引物P7序列5’-CTATAGCAATGGTACGGTACTTCC-3’(9.6 nmol,OD 2.0);下游引物P11序列5’-TTAGCAAAGTAGCGTGCACTTTTG-3’(4.2 nmol,OD 1.0)及Bio-P11(4.2 nmol,OD 1.0)引物(上海生物工程有限公司),羧基化琼脂磁珠由甘肃省医学科学研究院医学分子生物学中心提供.
链霉亲和素(1 mg·mL-1)(上海生物工程有限公司);HIV P24抗原(2 mg·mL-1)、羊抗HIV P24多抗(2 mg·mL-1)、HIV gp41抗原(6 mg·mL-1)、辣根过氧化物酶-标记的山羊抗人HIV P24抗体(0.2 mg·mL-1)(北京科卫有限公司),去离子水;封闭液(0.1 g蔗糖,12.5 mg牛血清白蛋白,12.5 mg酪蛋白溶在10 mL 1×Binding buffer中);1×Binding buffer(137 mmol NaCl,2.7 mmol KCl,6.5 mmol Na2HPO4,1.8 mmol NaH2PO4,2.5 mmol MgCl2,1 mmol CaCl2);0.05% Tween-20的1×Binding buffer溶液(将Tween-20的母液稀释至25%,再按比例用1×Binding buffer将其稀释至0.05%).
1.2HIV P24抗原活性检测
以羧基化琼脂磁珠作为载体,通过ELISA实验检测HIV P24抗原的活性.操作过程如下[10]:
取0.1 mL羧基化琼脂磁珠,等量分成两份,一份作为阳性(+);一份作为阴性(-),放置于1.5 mL EP管中,然后标记“+”的载体加入用纯水稀释100倍的HIV P24抗原50 μL,“-”加入等体积的纯水,并设置两组平行样,置于37 ℃滚筒式恒温振荡器中孵育2 h;分别弃去上述载体中孵育的液体,用1×Binding buffer洗3遍,各加入配制好的封闭液1 mL,置于37 ℃滚筒式恒温振荡器中孵育1 h;分别弃去上述载体中的一抗,用含0.05% Tween-20的1×Binding buffer洗4遍,各加入稀释2 000倍的HRP-标记的山羊抗人HIV P24抗体50 μL,置于37 ℃滚筒式恒温振荡器中孵育2 h;分别弃去上述载体中的二抗,用含0.05%Tween-20的1×Binding buffer洗4遍,各滴入一滴底物A、底物B,然后置于37 ℃恒温调速摇床,避光显色15 min.显色结束后各滴入一滴终止液;将终止显色反应后的液体各取100 μL,置于酶标仪(490 nm的波长,快速振荡2 s),读取对应的OD值.
1.3消减SELEX技术筛选HIV P24抗原适配体
1.3.1正筛取0.5 mL羧基化琼脂磁珠放置于1.5 mL EP管中,加入用纯水稀释的HIV P24抗原500 μL(稀释100倍),置于37 ℃滚筒式恒温振荡器中孵育1 h;用1×Binding buffer洗3遍,加入1 mL封闭液,置于37 ℃滚筒式恒温振荡器中孵育1 h;包被HIV P24抗原的羧基化琼脂磁珠用1×Binding buffer洗3遍,与ssDNA库(用3 mL 1×Binding buffer溶解ssDNA库,95 ℃加热10 min,冰浴5 min)结合,置于37 ℃滚筒式恒温振荡器中孵育1 h.用1×Binding buffer洗3遍,加入500 μL 1×Binding buffer,95 ℃加热5 min,12 000 r·min-1离心5 min,重复上述步骤3次,共收集1 500 μL上清,作为下一轮筛选的ssDNA次级库.然后将ssDNA通过qRT-PCR扩增得到dsDNA.
1.3.2琼脂磁珠法制备ssDNA取0.2 mL羧基化琼脂磁珠放置于1.5 mL EP管中,加入用纯水稀释的链霉亲和素200 μL(稀释100倍),置于37 ℃滚筒式恒温振荡器中孵育2 h;包被链霉亲和素的羧基化琼脂磁珠用1×Binding buffer洗3遍,与dsDNA孵育,置于37 ℃滚筒式恒温振荡器中孵育1 h;弃去上述载体中孵育的液体,用TPBS,40 ℃水浴,每次3 min,重复3次.加入200 μL 1×Binding buffer,95 ℃加热5 min,收集上清作为下一轮筛选的ssDNA次级库.
1.3.3反筛取0.2 mL羧基化琼脂磁珠放置于1.5 mL EP管中,标记为“1”,即正筛管,偶联HIV P24抗原;取等量的羧基化琼脂磁珠放置于1.5 mL EP管中,标记为“2”,即反筛管,偶联HIV gp41抗原,正筛管、反筛管置于37 ℃滚筒式恒温振荡器中孵育1 h;反筛管先与制得的ssDNA结合,置于37 ℃滚筒式恒温振荡器中孵育1 h;吸取反筛管中的ssDNA加入到正筛管中,置于37 ℃滚筒式恒温振荡器中孵育1 h;正筛管、反筛管用TPBS洗5遍,加入100 uL纯水95 ℃加热5 min,12 000 r·min-1离心5 min,重复上述步骤3次,共收集300 μL上清,为下一轮筛选的ssDNA次级库.
重复上述筛选步骤,并在每轮筛选中加入tRNA非特异性竞争剂进行筛选,增加筛选的特异性.共进行6轮筛选.
1.3.4qRT-PCR检测ssDNA富集程度配制qRT-PCR体系(PCR buffer 10 μL,dNTP 0.8 μL,P7 0.4 μL,Bio-P11 0.4 μL,荧光 1 μL,rTaq酶2 μL,纯水 85.4 μL),充分混用,每管24 μL,分成4管.分别加入阳性上清、阴性上清、纯水各6 μL,qRT-PCR检测.筛选中采用靶蛋白用量分别为1~2轮6 μL,3~5轮3 μL,6轮1.5 μL,直到第6轮次级库为最终文库.
1.4HIV P24抗原适配体的克隆测序
经过6轮筛选,将筛选产物进行PCR并经非变性 PAGE切胶回收dsDNA,连接pMDTM18-Tvector转化到 E.coli DH5α 感受态细胞中,同时设立阳性对照与阴性对照,经氨苄抗性筛选,挑取所有阳性克隆,鉴定其与HIV P24抗原的结合能力,并将鉴定后的阳性克隆送上海生工测序.
1.5HIV P24抗原适配体特异性检测
按照不对称PCR法制备ssDNA,配制不对称PCR体系[11](10×Buffer 10 μL,dNTP 0.8 μL,P7 2 μL,P11 0.2 μL,rTaq酶 1 μL,纯水86 μL),充分混匀,每管9 μL,再分别各加1 μL阳性克隆菌液.按(95 ℃,5 min;94 ℃,30 s→55 ℃,30 s→72 ℃,5 min)这个条件扩增30个循环.扩增产物待用.然后取2份等量羧基化琼脂磁珠,分别为标记“1”、“2”.“1”管即筛选管,偶联HIV P24抗原,“2”管偶联HIV gp41抗原.“1”、“2”EP管置于37 ℃滚筒式恒温振荡器中孵育1 h,弃去上述载体中孵育的抗原,“1”、“2”EP管各加入100 μL ssDNA,置于37 ℃滚筒式恒温振荡器中孵育1 h;弃去载体中的ssDNA,“1”、“2”EP管分别用TPBS洗5遍,分别加入100 μL纯水,95 ℃加热5 min,12 000 r·min-1离心5 min,qRT-PCR检测.
1.6HIV P24抗原适配体识别靶蛋白的亲和力
选用8个不同的浓度,即HIV P24抗原适配体稀释倍数分别为100倍,200倍,300倍,400倍,500倍,600倍,700倍以及原液,分别与包被HIV P24抗原羧基化琼脂磁珠结合,置于37 ℃滚筒式恒温振荡器中孵育1 h.选择适配体4,5,12作为备选的适配体,用ELISA的方法[12]进一步测定各自的亲和力(Kd)大小.
1.7测序分析
测序结果先在核酸适配体序列查询数据库中检索(http://www.aptagen.com∕aptamer-index∕aptamer-list.aspx),先排除已知的序列,进行比对分析,用RNA structure 5.3软件预测分析二级结构.
2 结果与分析
2.1HIV P24抗原活性测定分析
ELISA技术是目前应用最为普遍的免疫分析方法,具有灵敏性好,特异性强,便于操作等优点,因此得以在抗原、抗体活性测定领域广泛应用[13].根据ELISA测定分析,阳性均值是阴性均值的2.1倍说明检测的抗原有活性.在检测过程中为了提高ELISA实验的稳定性,阳性、阴性组各重复3组.检测结果表明,阳性三组平行样均值完全高于阴性均值,阳性均值是阴性均值的21.97倍,证明从试剂公司购买的HIV P24抗原有活性(表1).
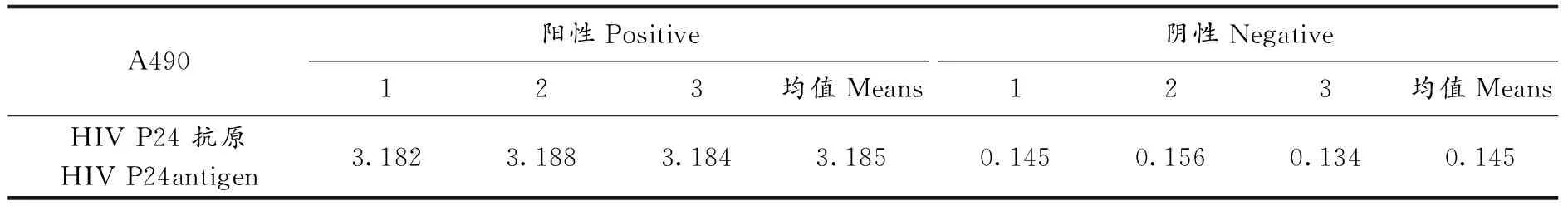
表1 HIV P24抗原活性检测结果
在每一轮的筛选中,HIV P24抗原的活性直接关系到能否形成稳定的磁珠-HIV P24抗原化学偶联复合物.HIV P24抗原的活性高,有利于特异性的ssDNA与HIV P24抗原的结合,更有利于快速筛选高特异性的HIV P24抗原的适配体.
2.2HIV P24抗原适配体筛选
本实验通过2轮正筛和4轮反筛,采用qRT-PCR实时检测筛选文库与HIV P24抗原的亲和富集程度[14].第6轮正筛管和反筛管qRT-PCR检测结果表明正筛管在反筛到第5轮的时候与HIV P24抗原结合的特异性适配体富集达到了饱和.说明用磁珠法筛选能够快速的消除非特异性ssDNA,从而增加对特异性适配体的富集,提高了筛选效率(图1).

图1 6轮筛选后qRT-PCR检测结果
每一轮筛选过程中用的ssDNA文库与HIV P24抗原的用量直接关系到筛选是否成功.在最初两轮筛选时,为了获得与HIV P24抗原特异性结合的适配体,ssDNA与HIV P24抗原用量要大.后续的几轮筛选为了筛选出特异性更高、亲和力更强的适配体,ssDNA与HIV P24抗原的用量要逐渐减少,但ssDNA/HIV P24抗原要提高,使亲和力更强的ssDNA结合到HIV P24抗原的结合靶点上,洗脱力度随筛选轮数的增多逐渐加大,从而除去亲和力较弱的ssDNA,以获得特异性更高、亲和力更强的适配体.
2.3HIV P24抗原适配体识别特异性
用靶标替换消减SELEX技术筛选得到的HIV P24抗原的适配体分别与HIV P24抗原和HIV gp41抗原结合,qRT-PCR检测结果表明,1、2分开10个循环左右,PCR体系空白和2几乎重合,说明筛选得到的HIV P24抗原适配体只与HIV P24抗原特异性的结合,不与HIV gp41抗原结合,利用这一特异性,可以作为检测HIV P24抗原的一种新技术(图2).
适配体对HIV P24抗原的特异性识别能力是作为特异性分子识别探针的关键,因此本文考察了适配体序列与HIV P24抗原特异性识别能力.一方面在筛选过程中扣除相似非目标靶物质上所具有的靶分子适配体[15],消减后的次级文库再投入到目标靶物质进行筛选,得到目标靶分子的特异性适配体;另一方面在筛选过程中通过反筛过程,如加入蛋白封闭液以掩蔽非特异性的作用位点,同时逐渐地增加筛选过程中的洗脱力度以除掉非特异性吸附,这些筛选条件的严格控制使得到的适配体为高度特异性识别HIV P24抗原靶标.
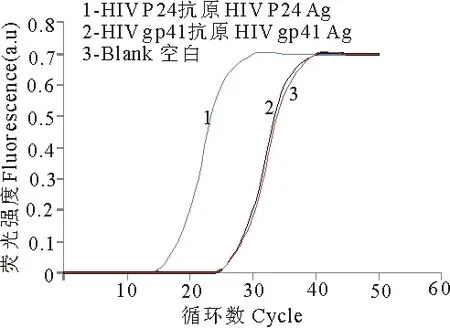
图2 HIV P24抗原适配体特异性检测
2.4HIV P24抗原适配体与靶蛋白识别的亲和力
通过ELISA方法测得4,5,12号适配体的亲和力大小(Kd)(表2).结果显示这3条适配体序列与HIV P24抗原结合的平衡解离常数值均在纳摩尔级水平,其中4号适配体的亲和力最强,12号适配体的亲和力相对较弱,表明筛选得到的3个适配体序列与HIV P24抗原有高亲和性(图3).
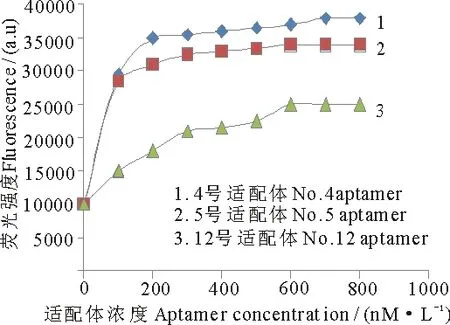
图3 Kd值检测结果
通过消减SELEX技术筛选得到的适配体全长为40个核苷酸序列,然而实际上并不是所有的核苷酸序列都参与构成与靶蛋白结合的识别位点,因此我们可以对筛选获得的适配体序列进行结构序列优化[16],更有利于适配体在实际应用中的合成与设计,可作为HIV早期检测分子识别探针.
2.5序列比对
共筛选得到18个阳性克隆测序,但只获得3条不同的序列,分别为4,5,12号测序结果.分析测序结果发现,获得的3条HIV P24抗原适配体序列长度均为40 bp,符合适配体的长度要求,同时在核酸适配体序列查询数据库中未检索到HIV P24抗原适配体的序列,表明我们成功的获得了3条新的HIV P24抗原适配体序列(图4).
利用RNA structure 5.3软件分析HIV P24抗原适配体可能的折叠方式,对获得的3条HIV P24抗原适配体序列进行二级结构预测,未知的HIV P24抗原适配体序列片段都位于茎环结构上(图5).
获得的3个适配体序列的二级结构主要以茎环为主,包括凸环和圆环.推测茎环结构可能是适配体与HIV P24抗原结合的结构基础,它们可能通过疏水作用、碱基堆积力和氢键等作用力与靶物质形成“锁与钥匙”结构,可以通过化学修饰进一步提高适配体与靶蛋白的特异性,为后期适配体在血清中检测HIV P24抗原提供了理论依据.
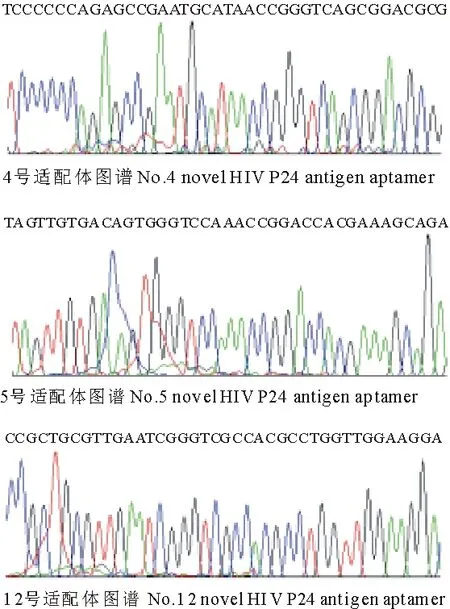
图4 获得的3条HIV P24抗原适配体测序图谱
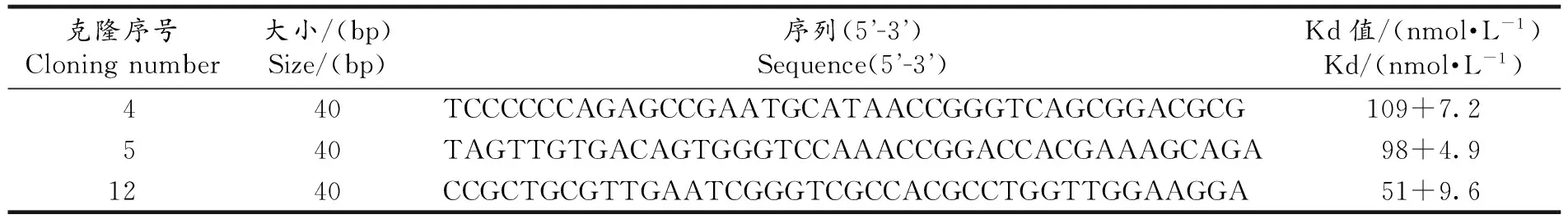
克隆序号Cloningnumber大小/(bp)Size/(bp)序列(5 -3 )Sequence(5 -3 )Kd值/(nmol·L-1)Kd/(nmol·L-1)440TCCCCCCAGAGCCGAATGCATAACCGGGTCAGCGGACGCG109+7.2540TAGTTGTGACAGTGGGTCCAAACCGGACCACGAAAGCAGA98+4.91240CCGCTGCGTTGAATCGGGTCGCCACGCCTGGTTGGAAGGA51+9.6
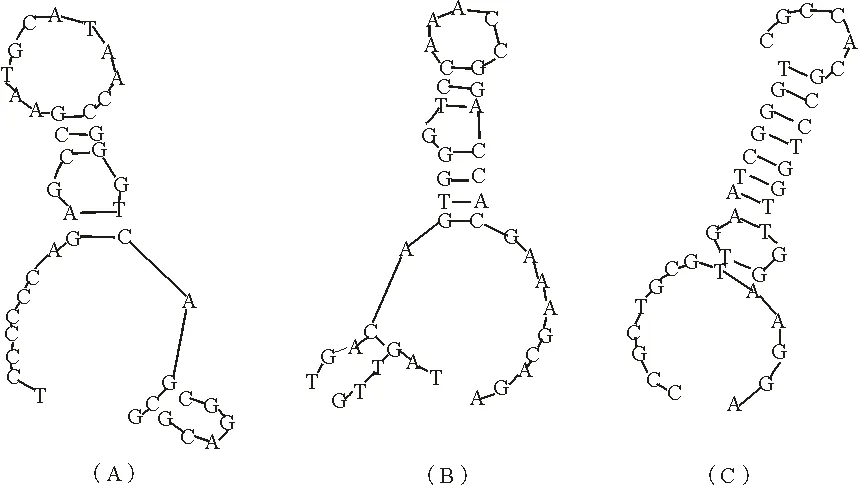
(A)4号序列茎环结构预测;(B)5号序列茎环结构预测;(C)12号序列茎环结构预测
(A)on the 4th sequence stem-loop structure prediction;(B)the 5th sequence of stem-loop structure prediction;(C)on the 12th sequence of stem-loop structure prediction
图5新获得的HIV P24抗原适配体序列的茎环结构预测
Fig 5HIV P24 antigen ssDNA with a base sequence obtained stem-loop structure prediction
3 讨论
传统SELEX技术采用液相结合、硝酸纤维素膜分离、酚-氯仿抽提的方法从随机单链寡核苷酸库中筛选出针对某一靶分子的特异性核酸适配体[17].应用此方法筛选靶蛋白的适配体实验周期长、筛选过程繁琐、筛选成本较高.琼脂磁珠是由磁性的材料制成,具有较高的化学稳定性和分散性,良好的生物相容性和生物降解性等特性,表面还可以连接不同的活性基团[18],而且羧基化琼脂磁珠能够交联感兴趣的靶蛋白[19],是筛选靶蛋白适配体良好的分离介质,通过离心就能将琼脂磁珠和结合在琼脂磁珠上的配基与未结合的文库分离开来,方法简单实用[20].
利用消减SELEX技术以羧基化琼脂磁珠为筛选介质,建立快速简单的靶分子适配体筛选方法.通过多次反筛获得HIV P24抗原适配体.在反筛过程中进行靶标替换,相比于其他筛选方法,这种靶标替换的筛选方法能够获得特异性更高的适配体.这种方法成本低、操作简便,能快速、高效的去除非特异性ssDNA的富集,筛选效率得到极大地提高.适配体具有结构的多样性,与靶分子结合时显示出高选择性、高亲和力和高特异性,在检测蛋白方面,优于传统的抗原-抗体免疫手段[21,22],具有广阔的应用前景.对于后期分子机理的研究,以及适配体检测技术和药物等相关研究具有重要作用[23].
本实验以羧基化琼脂磁珠为筛选介质[24],利用靶标替换消减SELEX技术经过6轮筛选,获得了3条HIV P24抗原适配体,并对HIV P24抗原适配体识别特异性及亲和力进行了考察,这3条适配体序列与HIV P24抗原结合的平衡解离常数值均在纳摩尔级水平,其中4号适配体的亲和力最强,12号适配体的亲和力相对较弱.这种适配体可以特异性的识别HIV P24抗原,不识别其它的靶分子,有利于进一步研究筛选得到的适配体与HIV P24抗原的结合位点,为HIV的早期诊断提供了一种有效的工具和手段.对抗原与适配体相互作用机理的研究提供了理论基础.
[1]詹少兵.HIV-1抗原免疫PCR检测及其适配子筛选应用&HPV血清学检测方法研究[D].北京:中国疾病预防控制中心,2013.
[2]REDA E,MOHAMED S,MOHAMMED Z.DNA aptamers selection and characterization for development of label-free impedimetric aptasensor for neurotoxin anatoxin-a[J].BiosensorsandBioelectronics,2015,68(2):295.
[3]ERIC O,LAGALL Y,KAREN C.A simple method for eliminating fixed-region interference of aptamer binding during SELEX[J].BiotechnologyandBioengineering,2014,111(11):2265.
[4]MARIIA D,SILVIE R,HELENA G.Current approaches in SELEX:An update to aptamer selection technology[J].BiotechnologyAdvances,2015,13(33):1141.
[5]WANG C Y,HUNG T C.Sequence-constructive SELEX:A new strategy for screening DNA aptamer binding to Globo H[J].BiochemicalandBiophysicalResearchCommunications,2014,33(8):484.
[6]ZSUZSANNA S.Is less more? Lessons from aptamer selection strategies[J].JournalofPharmaceuticalandBiomedicalAnalysis,2014,101(6):58.
[7]WANG C,ZHANG M,YANG G.Single-stranded DNA aptamers that bind differentiated but not parental cells:subtractive systematic evolution of ligands by exponential enrichment[J].Biotechnology,2003,30(12):15.
[8]BERARD A,NGUYEN Y,MARIA G.Development of a bead-based aptamer/antibody detection system for C-reactive protein[J].AnalyticalBiochemistry,2015,34(1):67.
[9]PARK J P,SHIN H J,PARK S G.Screening and development of DNA aptamers specific to several oral pathogens[J].Biotechnology,2015,3(25):393.
[10]万波.癌胚抗原特异性单克隆抗体核酸适配体的筛选[D].兰州:西北师范大学,2015.
[11]田育佼,王晓清,曾家豫,等.SELEX 筛选中不同筛选介质的富集效果比较[J].生物技术,2012,11(6):48.
[12]徐雯,薛婷,余娟,等.一种基于适配体的快速检测宫颈癌标志物P16INK4A的方法[J].华中科技大学学报(医学版),2015,44(6):667.
[13]CUI J,ZHANG K,HUANG Q,et al.An indirect competitive enzyme-linked immunosorbent assay for determination of norfloxacin in waters using a specific polyclonal antibody[J].AnalyticaChimicaActa,2011,688(1):84.
[14]LIAO S Q,LIU Y Q.Aptamer-based sensitive detection of target molecules via RT-PCR signal amplication[J].BioconjugateChem,2010,21(12):2183.
[15]WANG Deng-Liang,SONG Yan-Ling.Selection of DNA aptamers against epidermal growth factor receptor with high affinity and specificity[J].BiochemicalandBiophysicalResearchCommunication,2014,453(5):681.
[16]郭秋平,刘小丹,谭誉宇,等.人肝细胞性肝癌细胞株的高特异识别核酸适配体筛选[J].科学通报,2013,58(27):2745.
[17]TUERK C,GOLD L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249(4968):505.
[18]李文章,李洁,丘克强,等.超顺磁性Fe3O4纳米颗粒的制备及修饰[J].功能材料,2007,38(8):1279.
[19]MUSHINOTO E,MITANI H.Bilateral coordination pattern of masticatory muscle activities during chewing in normal subjects[J].JProsthDent,1982,48(2):191.
[20]汪林,王成龙,储冰峰,等.磁珠-流式细胞术SELEX技术的建立[J].中华老年口腔医学杂志,2007,5(2):104.
[21]赵娟,顾月清.核酸适配体在肿瘤诊断与治疗中的研究进展[J].药物生物技术,2013,20(4):369.
[22]WILLNER I,ZAYATS M.Electronic aptamer-based sensors[J].AngewChemIntEd,2007,46(27):6408.
[23]陈桦,葛廷,王小琦,等.靶标替换消减SELEX技术筛选小鼠IgG Fc片段的DNA配基及其活性鉴定[J].兰州大学学报(自然科学版),2011,2(1):66.
[24]曾家豫,杨楠,万波,等.环氧基化磁性微球的制备及表征[J].西北师范大学学报(自然科学版),2014,50(2):93.
(责任编辑俞诗源)
Agar magnetic beads subtractive SELEX screening HIV P24 antigen aptamers
XI Yu-qin1,ZHAO Yun-wang1,MA Mei-lan1,ZENG Jia-yu1,LIAO Shi-qi2
(1.College of Life Sciences,Northwest Normal University,Lanzhou 730070,Gansu,China;2.Medical Molecular Biology Research Center,Gansu Academy of Medical Sciences,Lanzhou 730050,Gansu,China)
Take carboxyl agar magnetic beads as medium,a method that can rapidly screen HIV P24 antigen aptamers with high specificity and affinity is established.Use subtractive SELEX technology and target replacement method,HIV P24 antigen as the target molecules,carboxyl agar magnetic beads as the carrier,three specific aptamers are found after 6 rounds of screening.The specificity detection shows that the dissociation constant is at the nanomloe level while HIV P24 antigen aptamers are combined with HIV P24 antigen.The technology provides a new detecting technology for early HIV testing,it has important value to study of the aptamers interact with target molecular.
HIV P24 antigen;subtractive SELEX technology;DNA aptamers;target replacement
10.16783/j.cnki.nwnuz.2016.05.018
2016-03-04;修改稿收到日期:2016-04-06
国家自然科学基金地区基金资助项目(30960104;30770639)
葸玉琴(1964—),女,甘肃永昌人,副教授,硕士研究生导师.主要研究方向为低等植物生理生化和污染生态学.E-mail:xiyuqin@nwnu.edu.cn
*通讯联系人,男,教授,硕士研究生导师,主要研究方向为分子生物学.E-mail:lshiqi@126.com
Q 7
A
1001-988Ⅹ(2016)05-0079-06

