单向式完全胸腔镜下肺癌根治术治疗早期非小细胞肺癌的远期疗效及预后因素分析
朱玉龙, 马红霞, 冯新海
(新疆医科大学附属中医医院, 1. 呼吸一科; 2. 心胸外科, 新疆 乌鲁木齐, 830000)
单向式完全胸腔镜下肺癌根治术治疗早期非小细胞肺癌的远期疗效及预后因素分析
朱玉龙1, 马红霞1, 冯新海2
(新疆医科大学附属中医医院, 1. 呼吸一科; 2. 心胸外科, 新疆 乌鲁木齐, 830000)
目的探讨单向式完全胸腔镜下(c-VATS)肺癌根治术治疗早期非小细胞肺癌(NSCLC)的远期疗效及预后相关影响因素。方法选取早期NSCLC患者56例为研究对象,均行单向式c-VATS肺癌根治术,观察患者手术情况及术后3、5年生存率,对患者进行长期规律随访,对可能影响患者预后的因素进行考察分析。结果本研究56例患者均顺利完成手术,无围术期死亡病例。术中无大出血,术后无肺动脉栓塞、肺部感染等并发症发生。术后随访时间2~65个月,中位总生存期为38个月,3年生存率为64.3%(36/56),5年生存率为48.2%(27/56)。单因素及多因素分析结果显示,病理分期、术后有无规范放疗、肿瘤直径及脉管内栓瘤与术后3年、5年生存情况有显著相关性(P<0.05)。结论单向式c-VATS肺癌根治术用于早期NSCLC患者安全有效,生存期长,病理分期、术后有无规范放疗、肿瘤直径及脉管内栓瘤是患者预后的相关因素。
非小细胞肺癌; 完全胸腔镜手术; 单向式; 病理分期; 预后
目前肺癌的治疗手段多样化,如手术、化疗、放疗、生物靶向治疗等,但手术是早期肺癌患者最为有效的治疗手段。肺癌的手术方式主要有经胸后外侧切口传统开胸手术及电视辅助胸腔镜手术(VATS)。完全胸腔镜下(c-VATS)肺癌根治术能完成解剖学的肺叶切除,纵膈、肺门淋巴结亦能达到规范化清扫,安全性高、创伤小、术后恢复快,且在局部复发及生存率上不劣于开胸手术[1-2]。单向式c-VATS肺癌根治术能够解决肺裂发育不全所致的中转开胸,使得c-VATS手术得到进一步发展,成为肺癌的主要手术方式之一[3]。本研究观察56例早期非小细胞肺癌(NSCLC)患者行单向式c-VATS肺癌根治术的远期疗效,并探讨预后相关影响因素,现报告如下。
1 资料与方法
1.1一般资料
选取2009年2月―2011年1月新疆医科大学附属中医医院呼吸科收治的早期NSCLC患者56例为研究对象。入组患者均经临床影像学检查及术后病理证实为NSCLC患者,均为初治患者,中途无中转开胸者。术前完善血生化、尿常规、凝血常规、免疫学检查、胸部CT、心电图、肺通气功能检查等,部分患者进行了PET-CT检查。本研究纳入患者均有手术指征,无严重心、肝、肾等功能障碍,无合并其他恶性肿瘤,无肺部手术史。56例患者中男38例,女18例;年龄45~78岁,中位年龄64岁;其中Ⅰa期8例, Ⅰb期22例,Ⅱa期18例, Ⅱb期8例;腺癌38例,鳞癌12例,腺鳞癌6例;低分化11例,中分化31例,高分化14例。本研究经医院伦理委员会批准,患者及家属知情同意。
1.2方法
采用双腔支气管内插管静脉复合全身麻醉,健侧单肺通气。取健侧卧位,患侧上肢前举,固定于托手架上。于患侧腋中线偏前第7肋间为胸腔镜入口,切口长约1.5 cm; 以腋前线为中心3~4 cm为主操作孔,在第3肋间做上叶切除,在第4肋间做下叶切除;在腋后线偏后第8、9肋间做长约2 cm切口为辅助操作孔。主操作孔和辅助操作孔分别置入直径3.5 cm和2 cm的切口保护套。手术遵循直视原则,操作过程完全在胸腔镜下进行。如术前未有明确诊断,即将肺外周的肿物楔形全部切除,术中快速冰冻病理检查。在肺门部位软组织内由最表浅的结构开始解剖,依次暴露、离断,沿一个方向逐渐深入,最后处理肺裂;切除上、中叶时采取从前向后单方向推进;切除下叶时为从下向上单方向推进;对肺门遵循肺静脉-支气管-肺动脉-肺裂的游离及离断顺序[4-5]。肺叶切除后进行系统纵隔和肺门淋巴结清扫,使用电凝钩或超声刀打开淋巴结表面纵隔胸膜,用淋巴结钳夹持并提起淋巴结及其周围脂肪组织,利用电钩或超声刀与吸引器配合剔除。注意避免损伤喉返神经。右侧清扫2R、3、4R、7、8、9、10R、11组淋巴结,左侧清扫5、6、7、8、9、10L、11组淋巴结。术毕冲洗胸腔,止血,改双肺通气,膨胀肺,检查无漏气及活动性出血后置入胸腔闭式引流管,如上叶切除,于胸腔镜入口和辅助操作孔置入2枚,如中、下叶切除,则于胸腔镜入口置入1枚[6]。
1.3观察指标
观察患者手术情况及术后3、5年生存率。对患者进行长期、规律随访,对可能影响患者预后的因素进行考察分析,包括性别、年龄、家族病史、肺癌类型、病理分期、吸烟史、分化程度、术后有无规范化疗、肿瘤累及脏层胸膜、肿瘤直径、脉管内栓瘤等。
1.4统计学方法

2 结 果
2.1手术情况
本研究56例患者均顺利完成手术,无围术期死亡病例。术中清扫淋巴结平均数量为(8.2±4.0)个,手术平均时间(185.3±35.6) min, 术中平均出血量(204.3±103.5) mL, 术后平均置管引流时间(2.6±1.1)d, 术后平均住院时间(10.8±1.7)d。术后患者均无肺动脉栓塞、肺部感染、心律失常、胸膜瘘、肺不张、脓胸等并发症发生。
2.2远期疗效
术后随访2~65个月,无失访病例,中位生存期为38个月,3年生存率为64.3%(36/56),5年生存率为48.2%(27/56)。
2.3影响单向式c-VATS肺癌根治术生存期的单因素分析
性别、病理分期、分化程度、术后有无规范放疗、肿瘤直径及脉管内栓瘤是影响单向式c-VATS肺癌根治术3、5年生存情况的相关因素,差异有统计学意义(P<0.05或P<0.01)。见表1。
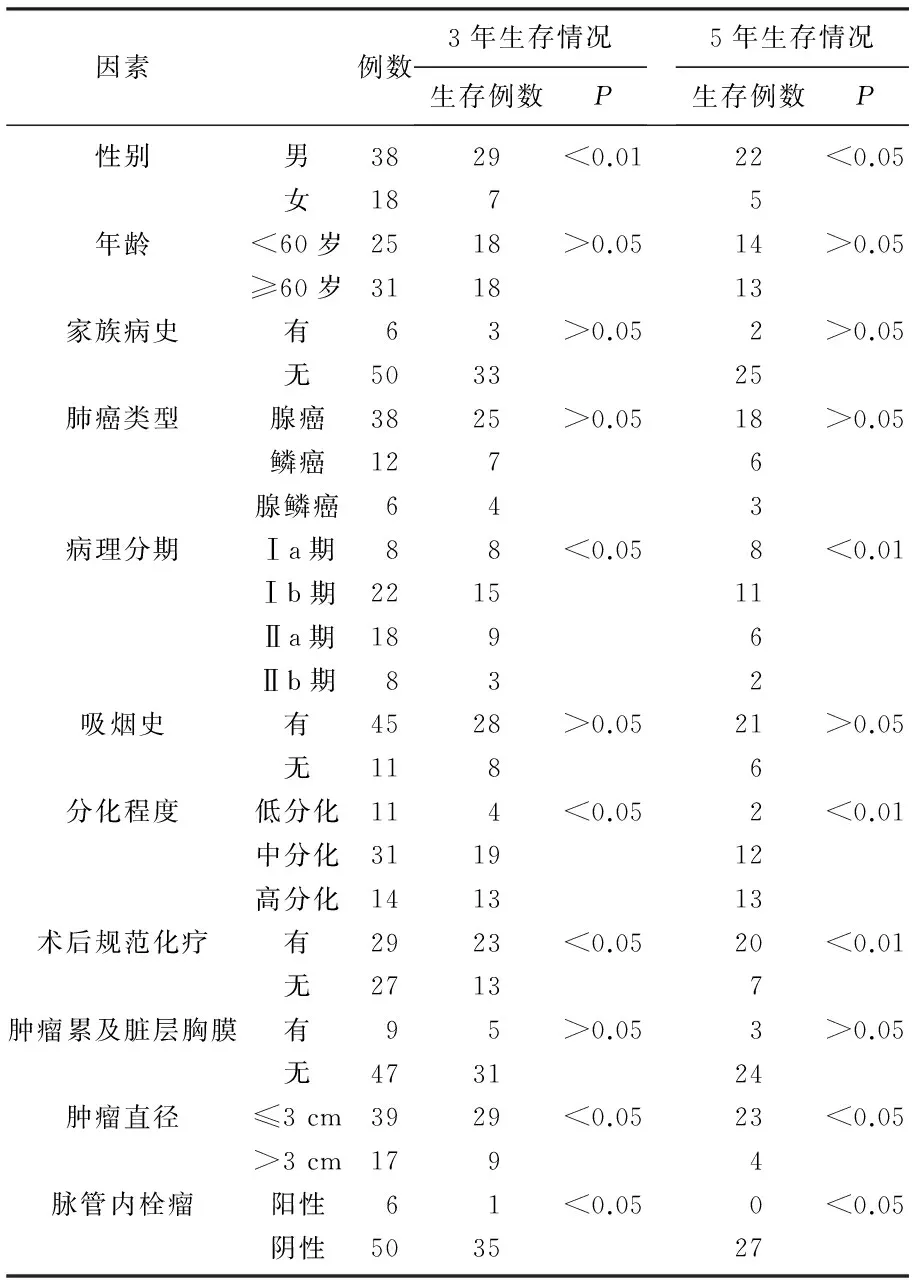
表1 影响单向式c-VATS肺癌根治术生存情况的 单因素分析 (n)
2.4影响单向式c-VATS肺癌根治术3年生存期多因素分析
以生存情况(生存=1,死亡=0)作为因变量,对性别、病理分期、分化程度、术后有无规范放疗、肿瘤直径及脉管内栓瘤这6个变量分别赋值,进行Logistic回归分析,结果显示,病理分期、术后有无规范放疗、肿瘤直径及脉管内栓瘤与术后3年生存情况有显著相关性(P<0.05)。见表2。
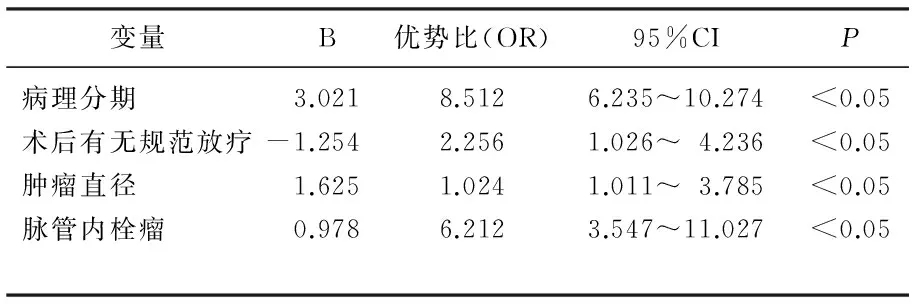
表2 影响单向式c-VATS肺癌根治术患者术后3年 生存情况多因素分析
2.5影响单向式c-VATS肺癌根治术5年生存期多因素分析
以生存情况(生存=1,死亡=0)作为因变量,对性别、病理分期、分化程度、术后有无规范放疗、肿瘤直径及脉管内栓瘤这6个变量分别赋值,进行Logistic回归分析,结果显示,病理分期、术后有无规范放疗、肿瘤直径及脉管内栓瘤与术后5年生存情况有显著相关性(P<0.05)。见表3。

表3 影响单向式c-VATS肺癌根治术5年生存情况多因素分析
3 讨 论
随着胸腔镜技术的快速发展及微创外科理念的推广, VATS术在胸外科治疗领域已经广泛普及,更是被列入美国NCCN肺癌早期手术的相关指南中[7]。研究[8-9]表明, c-VATS肺癌根治术在NSCLC治疗中可行,在某些临床指标上甚至优于传统开胸肺癌根治术。本研究中56例NSCLC患者行单向式c-VATS肺癌根治术临床效果较好,均顺利完成手术,围术期无死亡病例,手术时间、术中出血量、术后置管引流时间、术后住院时间均较少,且患者均无肺动脉栓塞、肺部感染、心律失常等并发症发生。总结手术成功关键如下: ① 手术医生需要具备丰富的开胸和胸腔镜手术经验,对肺门解剖十分熟悉; ② 术中确保胸腔镜的光源照到胸腔内各个角落,避免对肺血管、肺组织辨认不完全,误伤需要保留的肺叶血管和组织; ③ 手术医生能成熟运用内镜手术器械,如肺血管及肺组织切割缝合器等,保证手术的快捷和安全; ④ 淋巴结清扫时,建议夹持淋巴结周围结缔组织一并清除,避免直接钳夹淋巴结导致其破裂出血及残留。
本研究对患者进行了长期随访,术后随访时间2~65个月,无失访病例,中位生存期为38个月,3年生存率为64.3%(36/56),5年生存率为48.2%(27/56)。这与文献[10-12]报道的传统开胸手术生存率无显著差异。c-VATS肺癌根治术较常规手术创伤小,降低了术后早期急性期炎性细胞因子反应,对自身免疫有一定的保护作用,提高肿瘤免疫监视,且研究[13]表明行c-VATS肺癌根治术的患者较开胸手术的化疗耐受性更好。
本研究收集了56例患者的临床资料,对可能影响患者预后的11个因素进行了分析,单因素分析结果显示,性别、病理分期、分化程度、术后有无规范放疗、肿瘤直径及脉管内栓瘤是影响患者术后3年及5年生存情况的相关因素(P<0.05或P<0.01),进一步对这5项因素进行多因素Logistic回归分析,结果显示病理分期、术后有无规范放疗、肿瘤直径及脉管内栓瘤与术后3、5年生存情况有显著相关性(P<0.05)。在病理分期方面, Ⅰa期、Ⅰb期、Ⅱa期及Ⅱb期患者的3年生存率分别为100.0%、68.2%、50.0%、37.5%,5年生存率分别为100.0%、50.0%、33.3%、25.0%,提示手术时患者临床病理分期越早患者预后越好。术后规范化疗患者3年、5年生存率分别为79.3%及48.1%,显著高于未规范化疗患者的69.0%及25.9%(P<0.05或P<0.01),多因素分析结果亦表明,规范化化疗是患者预后的保护性因素。术后化疗能够减少肿瘤的复发、转移概率,且最大限度地减少肿瘤细胞耐药性的产生,能够使NSCLC患者术后生存获益[14-15]。在肿瘤直径方面,肿瘤直径≤3 cm的患者3年、5年生存率分别为74.4%及59.0%,显著高于肿瘤直径>3 cm患者的52.9%及23.5%(P<0.05),说明肿瘤瘤体越小,患者远期生存率越高。脉管内栓瘤在NSCLC中发病率为5%~30%,与患者预后相关[16]。本研究结果显示有脉管内栓瘤的患者预后较差。
[1]Swanson S J, Meyers B F, Gunnarsson C L, et al. Video-assisted thoracoscopic lobectomy is less costly and morbid than open lobectomy: a retrospective multiinstitutional database analysis[J]. Ann Thorac Surg, 2012, 93(4): 1027-1032.
[2]Gonzalez-Rivas D, Paradela M, Fernandez R, et al. Uniportal video-assisted thoracoscopic lobectomy: two years of experience[J]. Ann Thorac Surg, 2013, 95(2): 426-432.
[3]宋德胜, 于在诚, 胡旭, 等. 单向式全胸腔镜肺癌根治术探讨[J]. 中华腔镜外科杂志: 电子版, 2014, 7(6): 3-5.
[4]石帅, 罗于海, 文光瑞, 等. 单向式全胸腔镜与传统开胸式手术治疗早期非小细胞肺癌的对照研究[J]. 中国内镜杂志, 2013, 19(8): 828-831.
[5]张志强, 申佃京, 张召卓, 等. 单向式全胸腔镜肺叶切除术治疗非小细胞肺癌的临床效果研究[J]. 医学综述, 2013, 19(6): 1149-1150.
[6]吕宾, 胡德宏, 卢恒孝, 等. 全胸腔镜单向式肺叶切除在Ⅰ/Ⅱ期非小细胞肺癌治疗中的临床应用[J]. 中华腔镜外科杂志: 电子版, 2012, 5(1): 46-49.
[7]Gradishar W J, Anderson B O, Balassanian R, et al. Invasive Breast Cancer Version 1. 2016, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2016, 14(3): 324-354.
[8]Ettinger D S, Akerley W, Borghaei H, et al. Non-small cell lung cancer, version 2. 2013. [J]. J Natl Compr Canc Netw, 2013, 11(6): 645-653.
[9]Gonzalez-Rivas D, Paradela M, Fernandez R, et al. Uniportal video-assisted thoracoscopic lobectomy: two years of experience[J]. Ann Thorac Surg, 2013, 95(2): 426-432.
[10]Bendixen M, Jrgensen O D, Kronborg C, et al. Postoperative pain and quality of life after lobectomy via video-assisted thoracoscopic surgery or anterolateral thoracotomy for early stage lung cancer: a randomised controlled trial[J]. Lancet Oncol, 2016, 17(6): 836-844.
[11]Lee P C, Nasar A, Port J L, et al. Long-term survival after lobectomy for non-small cell lung cancer by video-assisted thoracic surgery versus thoracotomy. [J]. Ann Thorac Surg, 2013, 96(3): 951-960.
[12]Higuchi M, Yaginuma H, Yonechi A, et al. Long-term outcomes after video-assisted thoracic surgery (VATS) lobectomy versus lobectomy via open thoracotomy for clinical stage IA non-small cell lung cancer[J]. J Cardiothorac Surg, 2013, 9(1): 1-7.
[13]Jiang G, Yang F, Li X, et al. Video-assisted thoracoscopic surgery is more favorable than thoracotomy for administration of adjuvant chemotherapy after lobectomy for non-small cell lung cancer[J]. World J Surg Oncol, 2011, 9(1): 1-6.
[14]戴聪军. 电视胸腔镜下早期肺癌切除术后生存及预后因素分析[J]. 中国内镜杂志, 2013, 19(1): 19-22.
[15]任军龙, 刘冰, 薛磊, 等. 早期非小细胞肺癌患者术后化疗依从性影响因素分析[J]. 成都医学院学报, 2015, 10(3): 294-297.
[16]程蕾, 许亚萍, 毛伟敏. 非小细胞肺癌临床病理因素与预后的相关性分析[J]. 浙江实用医学, 2014, 19(1): 8-11.
Analysis of long-term efficacy of unidirectional complete video-assisted thoracoscopic surgery guided radical resection for lung cancer in treatment of early NSCLC and the prognostic factors
ZHU Yulong1, MA Hongxia1, FENG Xinhai2
(1.No. 1DepartmentofRespiration; 2.DepartmentofThoracicSurgery,TCMHospitalAffiliatedtoXinjiangMedicalUniversity,Urumchi,Xinjiang, 830000)
ObjectiveTo explore the long-term efficacy of unidirectional complete video-assisted thoracoscopic surgery (c-VATS) guided radical resection for lung cancer and prognostic influencing factors. MethodsA total of 56 patients with early non-small cell lung cancer (NSCLC) were selected as study subjects, and given unidirectional c-VATS guided radical resection for lung cancer. Surgical condition and 3- and 5-year survival rates were observed, long-term regular follow up was conducted, and influencing factors for prognosis were analyzed. ResultsAll of the 56 patients finished the surgery successfully, none died in peri-operative period. There was no massive intra-operative hemorrhage and postoperative pulmonary embolism and pulmonary infection. Postoperative follow-up period was 2~65 months, and median overall time was 38 months. And 3- and 5-year survival rates were 64.3% (36/56) and 48.2% (27/56), respectively. Univariate and multivariate analysis results showed that pathological patterns, whether there was postoperative specific radiotherapy, tumor diameter and intravascular tumor embolus had significant association with postoperative 3- and 5-year survival conditions (P<0.05). ConclusionUnidirectional c-VATS guided radical resection for lung cancer is safe and effective and long in survival time in the treatment of early NSCLC patients. Pathological patterns, whether there was postoperative specific radiotherapy, tumor diameter and intravascular tumor embolus are influencing factors for patients′ prognosis.
non-small cell lung cancer; complete video-assisted thoracoscopic surgery; unidirectional; pathological patterns; prognosis
2016-13-21
中国高校医学期刊临床专项资金(11526908)
马红霞, E-mail: Jasmine0991@163.com
R 734.2
A
1672-2353(2016)17-025-04
10.7619/jcmp.201617008

