农用硫酸钾中钙离子、镁离子和硫酸根离子含量的测定方法
郭 峰
(国投新疆罗布泊钾盐有限责任公司 新疆哈密 839000)
农用硫酸钾中钙离子、镁离子和硫酸根离子含量的测定方法
郭峰
(国投新疆罗布泊钾盐有限责任公司新疆哈密839000)
农用硫酸钾是常用的优质钾肥,其质量优劣关系着我国农业生产的安全。通过反复试验摸索,得出了适合测定硫酸钾中钙离子、镁离子和硫酸根离子含量的测定方法,以期为农用硫酸钾中这些离子含量的测定提供理论依据与数据基础。
农用硫酸钾硫酸根离子钙离子镁离子
氮、磷、钾作为植物生长所需要的三大元素,其在化肥中的含量是用户最为关注的。随着大量元素肥料和高浓度肥料使用量的不断增加,土壤中氮、磷、钾三大要素以外的营养因得不到应有的补充而日益不足,钙、镁、硫酸根和微量元素已经越来越多地显现肥效而受到重视[1]。
在农用硫酸钾专业标准上,只有氧化钾、氯离子、水分、酸度和粒径的测定方法,而没有钙离子、镁离子和硫酸根离子含量的测定方法。国投新疆罗布泊钾盐有限责任公司通过反复试验摸索,获得了适合测定农用硫酸钾中钙离子、镁离子和硫酸根离子含量的方法。
1 农用硫酸钾抽样的过程
由于农用硫酸钾大都是批量生产,使得在对其检测时就增加了困难,所以要构建一套合理抽样检测硫酸钾的方案。据调查,硫酸钾的生产批量一般以1 d或2 d的产量为1个批次,1次最大产量为500 t。袋装的产品在10袋以内的要求全部检查,10~49袋的至少要检查11次,50~64袋的要求12次,65~81袋的要求13次,82~101袋要求14次,102~125袋的要求15次,126~151袋要求16次,152~181袋的要求17次,182~216袋的要求18次,217~254袋的要求19次,255~296袋的要求20次,297~343袋要求21次,344~394袋的要求22次,395~450袋的要求23次,451~512袋的要求24次;大于512袋的时候,按照袋数=3×N1/3来测验(N为每批产品的总袋数)。在确定了检验袋数后(袋数如出现小数,则进为整数),对于产品的堆放位置要进行合理调控,检验点要有代表性。采样时,用采样器沿着袋装硫酸钾的对角线在3/4处取样,每个袋装硫酸钾取样量不少于100 g,每批取样量不得少于2 kg。采样后,应迅速混匀,用缩分器或四分法尽量把样品缩分至不少于500 g(粒状产品缩分至不少于1 kg),分装于2个洁净、干燥的有磨口塞的玻璃瓶或塑料瓶中密封,一瓶用于产品质量分析,另一瓶保存2个月,以备查用。
2 钙离子、镁离子和硫酸根离子的检验
2.1硫酸钡法测定硫酸根离子
2.1.1原理
在碱金属和碱土金属的硫酸盐、氯化物溶液中,可直接加入适当过量的氯化钡以定量沉淀溶液中的硫酸根,然后将硫酸钡沉淀分离,灼烧(或烘干)后称其质量。测定试液中硫酸根含量的反应方程式为:
2.1.2试剂和溶液
氯化钡溶液(质量分数5%),称取BaCl2·2H2O(分析纯)5 g溶于100 mL水中;浓盐酸溶液。
2.1.3测定方法
称取一定量试样用水溶于400 mL烧杯中,加水稀释至200 mL左右,加1 mL浓盐酸溶液,加热至近沸,并对热溶液滴加10~15 mL质量分数5%的氯化钡溶液,不断搅拌,沉淀和母液置于沸水浴上加热2 h,取下放置冷却[2];用G4玻璃坩埚抽气过滤,用热水转移并洗涤沉淀,直至洗涤溶液无氯离子反应为止;沉淀和坩埚于130 ℃烘干至恒重。硫酸根离子质量浓度按式(1)计算:
(1)
W——硫酸钡沉淀质量,g;
V——吸取试样体积,mL;
0.411 6——硫酸钡对硫酸根的换算因数。
2.2乙二胺四乙酸二钠络合滴定法测定钙离子
2.2.1原理
在碱性溶液(pH>9)的条件下,钙指示剂与钙离子生成可溶的酒红色络合物,而与镁离子则无此反应。当用乙二胺四乙酸二钠(EDTA)滴定时,EDTA的阴离子(H2Y2-)从钙指示剂络合物中夺取钙离子并与自身结合成无色络合物,滴定终点时溶液呈现指示剂本身在碱性介质中的天青色。其反应方程式为:
CaIn-+ H2Y2-= CaY2-+ HIn2-+ H+
2.2.2试剂与溶液
EDTA标准溶液(0.015 00 mol/L),钙指示剂,氢氧化钠(2 mol/L)。
2.2.3试样中钙离子的测定
称取1.0~2.0 g(精确至±0.000 1 g)试样置于250 mL烧杯中,加水溶解,定容至250 mL容量瓶中,稀释至刻度,记为A液。移取10.00 mL A液于250 mL锥形瓶中,加30 mL水,再加2 mL氢氧化钠调整至pH>9,再加入少许(约50 mg)钙指示剂,震荡使其溶解后,用EDTA标准溶液滴定至酒红色变为天青色。记录消耗的EDTA标准滴定溶液的体积,同时进行空白试验。试样中钙离子质量分数按式(2)计算:
(2)
式中:c——EDTA标准滴定溶液的物质的量浓度,mol/L;
V1——消耗EDTA标准滴定溶液的体积,mL;
V0——做空白试验时消耗EDTA标准滴定溶液的体积,mL;
G——试样质量,g;
40.08——以Ca2+为基本单元的物质的量质量,g/moL。
2.3EDTA络合滴定法测定镁离子
2.3.1原理
在碱性缓冲溶液中,指示剂与钙离子和镁离子生成可溶的酒红色络合物,当用EDTA滴定时,EDTA的阴离子从钙、镁指示剂络合物中夺取镁离子与自身结合成无色的络合物,终点时溶液呈现指示剂本身在碱性介质中的天青色。当溶液中有镁离子和钙离子存在时,其反应方程式为:
CaIn-+ H2Y2-= CaY2-+ HIn2-+ H+
MgIn-+ H2Y2-= MgY2-+ HIn2-+ H+
从上述反应方程式可以看出,只要减去滴定钙时消耗的EDTA标准滴定溶液的体积及空白值,即可算出试样中镁离子的含量。
2.3.2试剂与溶液
EDTA标准溶液(0.015 00 mol/L),钙指示剂,氨-氯化铵溶液(pH=10),氢氧化钠溶液(2 mol/L),铬黑T指示剂(质量分数0.5%)。
2.3.3试样中镁离子的测定
称取1.0~2.0 g(精确至±0.000 1 g)试样置于250 mL烧杯中,加水溶解,定容至250 mL容量瓶中,稀释至刻度,记为A液。移取10.00 mL A液于250 mL锥形瓶中,加30 mL水、10 mL氨-氯化铵溶液、5滴铬黑T指示剂,摇匀,用EDTA标准溶液滴定至酒红色变为天青色,同时做空白试验。如被测试样中不含钙离子,则EDTA消耗量即为被测试样中镁离子的含量;如果试样中含钙离子,则需进行钙离子的测定,由差减法求镁离子的含量。试样中镁离子质量分数按式(3)计算:
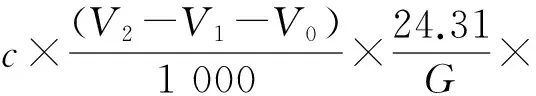
(3)
式中:c——EDTA标准滴定溶液的物质的量浓度,mol/L;
V1——滴定钙离子时消耗EDTA标准滴定溶液的体积,mL;
V2——滴定钙离子和镁离子总量时消耗EDTA标准滴定溶液的体积,mL;
V0——做空白试验时消耗EDTA标准滴定溶液的体积,mL;
G——试样质量,g;
24.31——以Mg2+为基本单元的物质的量质量,g/mol。
3 结语
通过反复试验摸索,得出了适合测定农用硫酸钾中钙离子、镁离子和硫酸根离子含量的测定方法,以期为农用硫酸钾中这些离子含量的测定提供理论依据与数据基础。
Determination Method of Content of Calcium Ion, Magnesium Ion and Sulfate Ion in Agricultural Potassium Sulfate
GUO Feng
(SDIC Xinjiang Luobupo Hoevellite Co., Ltd.Xinjiang Hami839000)
The agricultural potassium sulfate is a common high quality potash fertilizer, which quality is related to the safety of national agricultural production. Through repeated trial and error, the determination method suitable for detecting calcium ion, magnesium ion and sulfate ion content in agricultural potassium sulfate is obtained, which can provide theoretical basis and data foundation for determination of content of these ions in agricultural potassium sulfate.
agricultural potassium sulfatesulfate ioncalcium ionmagnesium ion
郭峰(1983—),助理工程师,主要从事质量检验管理;guofeng19830116@163.com。
TQ443.2
A
1006- 7779(2016)04- 0082- 03
[1]范宾,张求真,王寅,等.关于《复混肥料中钙、镁、硫含量的测定》的国家标准[J].磷肥与复肥,2003(3):44- 46.
[2]魏钟晴,马培华,徐刚,等. 水合碱式硫酸镁晶须的物理化学性能表征[J].盐湖研究,1998(2):1- 10.
2016- 06- 18)

