MELAS综合征的随访MRI分析
朱雅馨,张思裕,杨笛,徐雯,叶信健,白光辉,严志汉
(温州医科大学附属第二医院 放射科,浙江 温州 325027)
MELAS综合征的随访MRI分析
朱雅馨,张思裕,杨笛,徐雯,叶信健,白光辉,严志汉
(温州医科大学附属第二医院放射科,浙江温州325027)
目的:随访分析线粒体脑肌病合并高乳酸血症与卒中样发作(MELAS)综合征的动态MRI影像学特征。方法:回顾性分析2005年9月至2015年4月确诊的MELAS综合征患者15例,男9例,女6例,平均15.5岁。所有病例在急性发作期(30 d内)均行常规MRI检查(包括T1WI平扫、T2WI、FLAIR及DWI),14例在急性发作期后(30~60 d)复查MRI,其中8例随访时行磁共振波谱(MRS)检查;10例在缓解期(>60 d)复查常规MRI。着重分析病变的部位、信号、范围及其动态变化。结果:在急性发作期,单侧大脑皮层或皮层下受累占46.7%(7/15),双侧大脑皮层或皮层下同时受累占53.3%(8/15),双侧基底节受累4例,脑干受累1例。病灶在T1WI上呈低信号,在T2WI上呈高信号,在DWI上呈等或高信号。在急性发作期后,14例中,64.3%(9/14)病例的部分病灶范围扩大;71.4%(10/14)病例的部分病灶缩小,42.9%(6/14)的病例出现新的病灶。8例MRS检查中均出现Lac峰增高,2例病灶对侧脑组织出现Lac双峰,6例出现NAA峰降低。在缓解期,40%(4/10)的病灶出现脑萎缩,40%(4/10)的病灶出现软化灶。结论:MELAS综合征的病灶多为大脑皮层或皮层下游走性病灶,MRS会出现增高的Lac峰,随着病程发展会出现脑萎缩和病灶减小,结合临床资料,可早期提高其诊断的准确性。
MELAS综合征;磁共振成像;磁共振波谱成像
线粒体脑肌病(mitochondrial encephalomyopathy,ME)是一组以线粒体DNA(mtDNA)或细胞核DNA突变导致线粒体结构或功能异常为病理基础,并且以脑和肌肉系统受累为主要临床表现的疾病。线粒体脑肌病合并高乳酸血症和卒中样发作(mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes,MELAS)综合征是ME的一种类型。影像学表现容易与脑梗死、病毒性脑炎、胶质瘤病混淆。目前有关MELAS综合征的动态影像学研究的报道甚少,因此本文回顾性分析15例MELAS综合征患者的初诊影像学特征,并随访卒中样发作(stroke like episode,SLE)后脑内病灶的动态影像学变化,以加深对该病的认识。
1 资料和方法
1.1一般资料 搜集2005年9月-2015年4月在温州医科大学附属第二医院确诊为MELAS综合征的患者15例,其中男9例,女6例,14例具有完整的随访资料。患者发病年龄2月龄~43岁,平均年龄15.5岁,总病程为1个月~10年。共进行62次MRI检查,急性发作期(30 d内)25次、急性发作期后(30~60 d)16次、缓解期(>60 d)21次。从发病至第1次行MRI扫描的中位时间约10.8 d,从第1次行MRI扫描至第1次诊断MELAS综合征的中位时间约55.3 d,随访MRI检查次数均值为3次,每次检查的间隔时间均值为3.1个月。15例中,10例经基因检测被证实为mtDNA的A3243G位点突变,其中2例经肌肉活检发现破碎红纤维(ragged red fibers,RRF)(均行肱二头肌活检术,光学显微镜观察若发现典型的RRF即为阳性);5例符合临床诊断,MELAS综合征临床诊断标准,需同时符合以下3项[1-2]:①临床至少有1次SLE;②急性期在CT或MRI上可见与临床表现相关的责任病灶;③脑脊液和(或)运动前后血乳酸升高。主要临床表现为SLE占86.7%(13/15);癫痫占73.3%(11/15);肌阵挛占86.7%(13/15);肢体无力、运动耐力减低占60%(9/15);智力下降占46.7%(7/15);视觉障碍占60%(9/15);听力障碍占20%(3/15);另还有1例嗅觉下降及1例肠梗阻合并肠壁水肿、积气。
1.2方法
1.2.1MRI检查方法:MRI检查使用Philips Gyroscan Intera 1.5 T、GE signa HDXT 3.0 T超导型全身磁共振成像仪,头相控阵线圈。所有病例均行常规头颅MRI检查,扫描序列包括:SE T1WI(TR 300~500,TE 8~12 ms);FSE T2WI(TR 2 500~5 000,TE 90~110 ms);FLAIR(TR 8 000~10 000 ms,TE 80~110 ms,TI 2 000~2 500 ms);DWI(TR 1 500~4 800,TE 45~93 ms,b=0和1 000 s/mm2,层厚5 mm,层距1 mm,矩阵192×192)。8例行磁共振波谱(MRS),其中3例多体素选择多个感兴趣区(ROI)进行检测,即在脑内选择与病灶对称的组织作为ROI,也称为镜像组织。1H-MRS采用单层(2D)化学位移成像技术,覆盖病灶所在的脑区和层面,扫描参数:视野16×16 cm,矩阵16×16,点解析波谱(PRESS)序列(TR 2 000,TE 135 ms)。波谱数据通过波谱软件包进行自动后处理。2例行MRA,2例行MRI增强,2例行3D-ASL。MRA图像后处理:在后处理工作站进行3DMPR,重建层厚以显示目标血管最佳为准,重建范围为5~200 ms,任意方向。3D-ASL(TR 4 580,TE 9.8 ms,TI 1 525 ms),层厚4.0,层间隔0,NET=4,矩阵512×8 mm。
1.2.2观测指标:MRI图像由2位具有10年以上神经影像诊断工作经验的主治医师分别进行判读,当双方意见出现分歧时,由更高年资的神经影像科教授进行复核并确定最终诊断意见。影像学观察的主要内容包括病灶位置、数目、信号强度(以正常脑皮质信号为参照)、MRS特征和随访变化等。
2 结果
2.1MELAS综合征患者初诊MRI特征 急性发作期(30 d内)的病灶仅位于单侧大脑皮质或皮质下占46.7%(7/15),双侧大脑皮质或皮质下同时受累占53.3%(8/15);枕叶受累占80%(12/15),顶叶受累占73.3%(11/15),颞叶受累占53.3%(8/15),额叶受累占26.7%(4/15),岛叶受累占6.7%(1/15),双侧基底节受累4例,脑干受累1例。病灶平扫表现为大脑皮质或皮质下片状T1WI低信号,T2WI、FLAIR 及DWI呈高信号,ADC图信号升高;2例行MRI增强扫描,均显示为脑回样强化。
2.2随访MRI特征 在急性发作期后(30~60 d),64.3%(9/14)病例的部分病灶范围扩大,71.4% (10/14)病例的部分病灶缩小,42.9%(6/14)的病例出现新的病灶。14例ADC图信号较急性发作期(30 d内)降低。8例MRS检查中均出现增高的Lac峰,2例病灶对侧脑组织出现增高的Lac峰,6例出现NAA峰降低。2例MRA图均表现为新鲜病灶周围动脉分支异常增多,未见大动脉的闭塞及狭窄,而陈旧性病灶周围动脉未见明显异常。2例3D-ASL图病灶均表现为片状高信号。在缓解期(>60 d),30%(3/10)病例的部分病灶范围扩大,60%(6/10)病例的部分病灶缩小,20%(2/10)的病例出现新的病灶,20%(2/10)病例的部分病灶无明显变化,40%(4/10)病例的部分病灶出现脑萎缩,40%(4/10)病例的部分病灶出现软化灶,见图1。
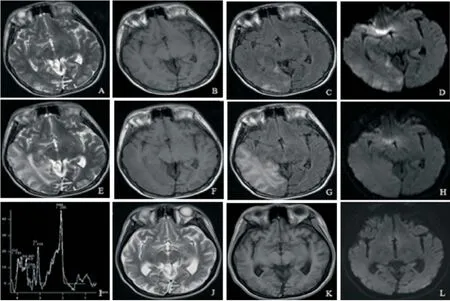
图1 男,13岁,诊断为MELAS综合征
3 讨论
线粒体是位于细胞浆内负责产生能量的细胞器,它是通过氧化磷酸化过程以三磷酸腺苷(ATP)形式产生能量。目前公认线粒体疾病是由于mtDNA或细胞核DNA突变导致线粒体结构和功能异常,使机体出现能量代谢障碍,当病变侵及中枢神经系统及肌肉时,则称为ME。中枢神经系统和肌肉是能量需求非常高的器官,当线粒体功能异常造成ATP降低时,便不能满足正常器官功能所需,从而较易出现功能障碍。MELAS综合征是ME的一种类型,临床表现复杂,本组主要以SLE、癫痫、肌阵挛、肢体无力、视觉障碍为主,部分患者伴发智力下降、听力障碍、嗅觉障碍、肠梗阻等症状。
本组患者发病30 d内病灶主要累及枕、颞、顶叶皮质或皮质下,病灶可单发或多发,一般呈不对称分布,与以往报道[3-5]一致。MELAS综合征ATP产生较少,大脑皮质较白质对ATP的需求量更大,对线粒体功能异常更敏感,所以常累及皮质,当累及皮层下白质时,说明患者病情较严重,且一般都伴有灶周水肿。病灶平扫DWI为等或高信号,ADC图信号增高,DWI对于MELAS这样类似卒中样的病灶比MRI平扫及增强更加敏感[5]。文献[6-8]报道,MELAS综合征的病灶DWI呈等或高信号,ADC图信号增高,并且ADC图高信号将持续1个月甚至更久[7-9]。这与急性缺血性梗死相反,后者ADC图信号在发作4周内一直较低[10]。ADC图信号增高是因为线粒体呼吸链结构和功能异常,损伤血管内皮细胞,累及血脑屏障,从而导致血管源性水肿[11],与本组急性发作期(30 d内)表现一致。MRI增强扫描皆表现为脑回样强化,表示血脑屏障被破坏,通透性增加。
本组患者在急性发作期后(30~60 d)的病灶范围出现扩大,甚至出现病灶的迁移[12],但病灶范围以缩小为主,临床症状也会随之减轻,不同时期的病灶可以共存[13];此时病灶ADC图信号下降,是因为经过一段时间后,神经元因为缺血缺氧出现坏死,从而会引起细胞毒性水肿[8]。本阶段8例MRS显示异常升高的Lac峰,1H-MRS上出现Lac峰可以作为MELAS综合征早期诊断的一个特征性依据。MRS谱线中出现Lac峰的原因是MELAS综合征的机制为ATP产生过少,组织代谢缺氧,出现无氧呼吸,进而产生乳酸,且易蓄积在需氧量较大的脑及肌肉[14]。2例病灶镜像脑组织也出现倒置Lac峰,并且在DWI上尚未出现高信号的部位发现Lac峰,这一发现验证了Ikawa等[15]的观点,在DWI上尚未出现高信号的部位,可以在1H-MRS上发现Lac峰。笔者认为这一表现增加了诊断MELAS综合征的特异性,提高了MRI诊断MELAS综合征的准确性,同时6例较陈旧病灶NAA峰明显降低,表明神经元受到损伤。MRA图均表现为新鲜病灶周围动脉分支异常增多,未见大动脉的闭塞及狭窄,而陈旧性病灶周围动脉未见明显异常,且病变区与动脉供血区域不吻合,3D-ASL图均表现病灶为片状高信号,提示急性期病灶呈现高灌注状态,这2种序列所显示的结果相互吻合及支持,刚好验证了既往文献[16]的报道MELAS综合征的血管状态为毛细血管的高渗透性,过度灌注,据我们所知,很少有文章报道关于MELAS综合征同时行MRA及3D-ASL序列,且急性期血管状态均表现为毛细血管的高渗透性及过度灌注。缓解期(>60 d)病灶以出现萎缩、软化灶为主,萎缩提示大脑皮质神经元出现损害,可能由于细胞能量代谢障碍,造成神经元数量减少,软化灶则符合疾病引起后相应脑组织神经元坏死改变。除此之外,缓解期还出现新病灶,符合其为基因缺陷导致的病变活动性持续存在的特点。
MELAS综合征需要与脑梗死、病毒性脑炎、胶质瘤病等鉴别。脑梗死MRI常规序列的信号与MELAS综合征可以类似,前者好发于中老年,MRA及3D-ASL检查前者会出现动脉狭窄、闭塞和低灌注状态,病变范围一般按脑动脉供血范围。病毒性脑炎多有感染病史,发病部位主要为额颞叶,呈单一病程,鉴别困难时可通过脑脊液检查等临床检查鉴别。胶质瘤病为占位性病变,主要累及白质,灶周会出现较大范围水肿,一般增强后可看见瘤体。
本研究还存在一些不足:①样本量少,只能代表部分MELAS综合征患者的影像及临床特征,下一步研究应扩大样本量;②随访资料不完全,并非所有患者均在以上3个时期内运用上述所有的检查方法,缺少3个时期之间的MRS、3D-ASL对比分析。
∶
[1]LIZUKA T, SAKAI F, SUZUKI N, et al. Neuronal hyperexcitability in stroke-like episodes of MELAS syndrome[J]. Neurology, 2002, 59(6): 816-824.
[2]BARSHOP B A, NAVIAUX R K, MCGOWAN K A, et al. Chronical treatment of mitochondrial disease patients with dichloroacetate[J]. Mol Genet Metab, 2004, 83(1-2): 138-149.
[3]FRIEDMAN S D, SHAW D W, ISHAK G, et al. The use of neuroimaging in the diagnosis of mitochondrial disease[J]. Dev Disabil Res Rev, 2010, 16(2): 129-135.
[4]ITO H, MORI K, KAGAMI S. Neuroimaging of stroke-like episodes in MELAS[J]. Brain Dev, 2011, 33(4): 283-288.
[5]赵丹华, 王朝霞, 于磊, 等. 线粒体脑肌病伴高乳酸血症和卒中样发作综合征患者的脑磁共振成像改变动态演变规律[J]. 中华神经科杂志, 2014, 47(4): 229-231.
[6]BETTS J, JAROS E, PERRY R H, et al. Molecular neuropathology of MELAS; level of heteroplasmy in individual neurones and evidence of entensive vascular involvement[J]. Neuropathol Appl Neurobiol, 2006, 32(4): 359-373.
[7]OHSHITA T, OKA M, IMON Y, et al. Serial diffusionweighted imaging in MELAS[J]. Neuroradiology, 2000, 42 (9): 651-656.
[8]ITO H, MORI K, HARADA M, et al. Serial brain imaging analysis of stroke-like-episodes in MELAS[J]. Brain Dev,2008, 30(7): 483-488.
[9]REN L. Precipitation of stroke-like-event by chickenpox in a child with MELAS-syndrome[J]. Neurol India, 2005, 53 (3): 323-325.
[10]SCHLAUG G, SIEWERT B, BENFIELD A, et al. Time course of the apparent diffusion coeffcient (ADC) abnormality in human stroke[J]. Neurology, 1997, 49(1): 113-119.
[11]YONEDA M, MAEDA M, KIMURA H, et al. Vasogenic edema on MELAS: a serial study with diffusion-weighted MR imaging[J]. Neurology, 1999, 53(9): 2182-2184.
[12]WEISS D, BROCKMANN K, NÄGELE T, et al. Rapid emergence of temporal and pulvinar lesions in MELAS mimicking Creutzfeldt-Jakob disease[J]. Neurology, 2011,77(9): 914.
[13]TZOULIS C, BINDOFF L A. Serial diffusion imaging in a case of mitochondrial encephalomyopathy, lacticacidosis,and stroke-like episodes[J]. Stroke, 2009, 40(2): e15-e17.
[14]MAJOIE C B, AKKERMAN E M, BLANK C, et al. Mitochondrial encephalomyopathy: comparison of conventionalMR imaging with diffusion-weighted and diffusion tensor imaging: case report [J]. AJNR Am J Neuroradiol, 2002, 23 (5): 813-816.
[15]IKAWA M, YONEDA M, MURAMATSU T, et al. Detection of preclinically latent hyperperfusion due to stroke-like episodes by arterial spin-labeling perfusion MRI in MELAS patient[J]. Mitochondrion, 2013, 13(6): 676-680.
[16]MOUDY A M, HANDRAN S D, GOLDBERG M P, et al. Abnormal calcium homeostasis and mitochondrial polarization in a human encephalomyopathy[J]. Proc Natl Acad Sci U S A, 1995, 92(3): 729-733.
(本文编辑:赵翠翠)
The follow-up analysis of MR imaging in MELAS syndrome
ZHU Yaxin, ZHANG Siyu, YANG Di, XU Wen,
YE Xinjian, BAI Guanghui, YAN Zhihan. Department of Radiology, the Second Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To analyze the MRI features of dynamic change of mitochondrial encephalomyopathy, lactic acidosis and stroke-like episodes (MELAS). Methods: The clinical data and imaging fi ndings of 15 cases of MELAS patients were retrospectively analyzed. All of patients underwent MRI examinations (including T1WI, T2WI, T2FLAIR and DWI) in acute attack stage (within 30 days). Forteen cases underwent MRI scanning after the acute attack stage (between 30 days~60 days), of which 8 cases were examined on MRS. Ten cases were repeated the MRI examinations in remission stage (>60 days). The location, range, signal intensity and dynamic change of the lesions were intensively analyzed. Results: In acute attack stage (within 30 days), 46.7% (7/15) unilateral cortical or subcortical cortex were affected, 53.3% (8/15) on bilateral cortical or subcortical cortex, 4 cases on bilateral basal ganglia and 1 case on brainstem. The gray matter of all 15 cases was hypointense on T1WI, hyperintense on T2WI and isointense or hyperintense on DWI. After the acute attack stage (between 30 days and 60 days) of the 14 cases, the lesions expanded in 64.3% cases (9/14), shrinked in 71.4% cases (10/14),and new foci emerged in 42.9% cases (6/14). Lactate peak increased in the fresh lesions of 8 cases, and the Lac peak increased in the contralateral area in 2 cases, while the nitrogen-acetyl aspartic acid (NAA) peaks decreased in 6 cases. In remission stage (>60 days), the atrophy was found in 40% cases (4/10) and encephalomalacia foci were found in 40% cases. Conclusion: Transient lesions are easily referred to the cerebral cortex and subcortex in MELAS patients. MRS shows prominent increasing peak. Brain atrophy in the MELAS patients develops gradually and stroke-1ike lesions shrink with progression of the disease. Combined with clinical data, the accuracy of early diagnosis of MELAS syndrome can be improved.
MELAS syndrome; magnetic resonance imaging; magnetic resonance spectroscopy
R747.9;R445.2
A DOI: 10.3969/j.issn.2095-9400.2016.07.006
2015-09-10
浙江省自然科学基金资助项目(LY13H070005);浙江省卫生厅项目一般研究计划(2014KYA145,2014KYA 141);温州市科技局项目(Y20130175)。
朱雅馨(1989-),女,湖北武汉人,硕士生。
严志汉,主任医师,教授,硕士生导师,Email:yanzhihanwz@163.com。

