物质结构与元素周期律高频考点剖析
◇ 广东 雷范军 四川 银代智
物质结构与元素周期律高频考点剖析
◇广东雷范军1四川银代智2
物质结构和元素周期律是每年高考的热点,主要通过元素的推断考查考生对原子结构、离子结构、化合物结构、元素周期律、元素的单质及化合物的性质、强弱酸或碱的电离、盐的电离和水解等知识.主要以2类题型呈现:一是在选择题中结合物质结构、元素周期表、元素周期律、元素化合物的知识考查元素的推断,如2016年全国I卷第13题、全国Ⅱ卷第9题、全国Ⅲ卷第12题等;二是在非选择题中考查“位、构、性”的关系及利用物质结构和元素化合物的性质综合考查元素的推断、相关计算,如2016年天津卷第7题、海南卷第13题等.下面根据课标、教材、考纲的要求,对该部分内容高考高频考点进行分类分析.
1 根据限定的元素周期表信息,推断位、构、性及相关计算
如果题目已知元素周期表的片段信息,可以根据元素的特殊位置关系推断元素的名称、符号、原子序数、原子或离子结构示意图等,进而可以推断有关元素的单质及其重要化合物的结构和性质,并根据有关反应的基本原理进行计算.
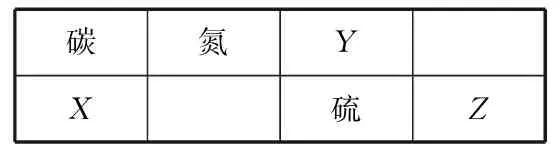
表1

回答下列问题:
(1)Z元素在周期表中的位置为________.
(2) 表中元素原子半径最大的是________(写元素符号).
(3) 下列事实能说明Y元素的非金属性比S元素的非金属性强的是________;
AY单质与H2S溶液反应,溶液变浑浊;
B在氧化还原反应中,1molY单质比1molS得电子多;
CY和S这2种元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z这2种元素的单质反应生成1molX的最高价化合物,恢复至室温,放出687kJ热量,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式________.
(5) 碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为________,Q与水反应的化学方程式为________.
(6) 铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的2种气体均由表中2种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1NaOH溶液和1molO2,则2种气体的分子式及物质的量分别为________、________,生成硫酸铜物质的量为________.

4mol=xmol+3ymol.
①
由题意可知,n(NaOH)=2.2mol,由钠元素质量守恒关系式NaOH~NaNO3可知,n(NaNO3)=2.2mol;由氮元素质量守恒关系式NO2~NaNO3、NO~NaNO3可知,
n(NO2)+n(NO)=xmol+ymol=2.2mol.
②
由式①、②可得y=0.9,x=1.3,由铜元素质量守恒关系式Cu~CuSO4可知,n(CuSO4)=2mol.

2 根据原子或离子结构、元素及其化合物的特征,推断元素的名称和其他性质
根据短周期元素的原子、单核阴阳离子的核外电子排布特点,可以推断元素的名称、符号、位置.元素的性质也是推断元素的重要依据,如非金属性最强的元素是氟,短周期主族元素的原子半径最大的是钠,最小的是氢等.根据常见短周期主族元素的单质及其二元或多元化合物的特性(如颜色、状态、气味、熔点、沸点、密度、硬度、溶解性、挥发性、导电性、酸性、碱性、中性、氧化性、还原性、漂白性、吸附性、吸水性、脱水性等),能够推断有关元素的名称、符号及其位置.应用元素周期律,可以判断离子半径、气态氢化物的热稳定性、最高价氧化物的水化物的酸碱性、化合物的性质等.

A简单离子半径:r(W) BW与X形成的化合物溶于水后溶液呈碱性; C气态氢化物的热稳定性:W弱于Y; D最高价氧化物的水化物的酸性:Y强于Z 根据短周期主族元素的原子、单核离子的电子层结构、单质或化合物的性质特征,可以推断元素的名称、符号、位置.根据化学键、离子或共价化合物的形成、元素周期律、物质的分类及其性质,可以判断单质、氧化物、酸、碱、盐之间能否反应或转化,推断化学键的类型,书写化学方程式等. (1)M元素位于周期表中的第________周期、________族. (2)Z元素是________,其在自然界中常见的二元化合物是________. (3)X与M的单质在高温下反应的化学方程式为________,产物分子为直线形,其化学键属于________共价键(填“极性”或“非极性”). (4) 4种元素中的____可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为____. 通过上述分析不难发现,2016年全国各地高考有关物质结构和元素周期律的试题密切联系生产、生活实际,在设问角度、呈现方式等方面进行创新,进一步凸显对探究能力、应用能力、自学能力以及化学语言表达能力的考查,有利于区分不同水平的学生,对2017年高考备考具有较好的导向作用.

3 根据元素单质的性质和原子结构的特征,推断元素的位置、结构和性质





