不同酿酒酵母发酵的干红樱桃酒酒体成分及感官质量分析
刘文丽,孙舒扬,贡汉生,车长远,金成武
(鲁东大学 食品工程学院,山东 烟台,264025)
不同酿酒酵母发酵的干红樱桃酒酒体成分及感官质量分析
刘文丽,孙舒扬*,贡汉生,车长远,金成武
(鲁东大学 食品工程学院,山东 烟台,264025)
为选择适宜樱桃酒酿造的专用酵母,测试和对比了7株市售商业化酿酒酵母对樱桃酒的发酵过程、酒体成分以及感官质量的影响。研究发现,菌株D254发酵效率高,能够高效萃取樱桃果浆中的生物活性物质(如多酚、花色苷等),且赋予樱桃酒较佳的感官品质,使其香气馥郁协调、酒体圆润,因而是适宜樱桃酒酿造的优良酿酒酵母菌株。
樱桃酒;酿酒酵母;筛选;酒体成分;感官分析
樱桃营养丰富、味道鲜美,含有多种矿物质和维生素,具有良好的药用价值及保健疗效[1-2]。然而,随着我国引种栽培规模的不断扩大,鲜樱桃已出现供过于求的局面。在常见的樱桃品种中,中国樱桃较不耐贮藏,它于每年四五月份集中上市,由于其成熟期短,保鲜技术不完善,因此非常容易腐败变质,造成的经济损失每年达上亿元[2]。在樱桃深加工的产品中,开发樱桃果酒是较为理想的选择。樱桃果酒富含矿物质、维生素和多酚等保健成分,具有促进血液循环和机体代谢、改善心脑血管功能等功效,能够有效地减少樱桃腐败、提高樱桃的附加值[3-5]。
樱桃酒的酿造是一个复杂的微生物学过程,它利用酵母菌将樱桃内的大部分糖转化为乙醇和CO2,同时生成甘油、高级醇等代谢产物,直接影响果酒的色泽、香气及口感[4-5]。要获得优良品质的果酒,酿酒酵母的选择至关重要[6-9]。性能优良的酵母菌在整个发酵过程中具有生长速率快、耐高糖、耐SO2、酒精产率高、发酵完全、最终代谢产物能赋予酒类特有风味等优点,且能保证酒类的质量安全[20]。本研究利用商业化酵母发酵生产樱桃酒,通过对其发酵力及其对酒体成分和感官品质的影响进行测试,筛选出各项性能优秀的菌株,为生产优质樱桃酒提供参考。
1 材料与方法
1.1材料
实验用樱桃品种为长把红,采自山东莱阳,2014年5月成熟并采集。基本化学成分:总糖 169 g/L,可溶性固形物17.3%,可滴定酸5.8 g/L,pH 4.08。
1.2菌种
7株酿酒酵母分别购于加拿大Lallemand公司(菌株BM 4×4、QA23、D254、RHST和EC1118)和法国Laffort公司(菌株F33和FX10)。
1.3试剂
亚铁氰化钾,天津市滨海科迪化学试剂有限公司;酒石酸钾钠、次甲基蓝,天津市科密欧化学试剂有限公司;亚硝酸钠,山东莱阳市双双化工有限公司;二甲花翠素-3-葡萄糖苷、单宁酸、没食子酸、儿茶素、美国Sigma公司;其他试剂均为国产分析纯。
1.4仪器
附温度计密度瓶(25 mL),德国Isolab公司;721G型分光光度计,上海精密科学仪器有限公司;pB-10型pH计,新锐仪表仪器有限公司;ZD-2A自动电位滴定仪,上海高致精密仪器有限公司。
1.5实验方法
1.5.1樱桃酒发酵工艺
樱桃果实采摘后清洗、破碎,输入发酵罐中,102 ℃灭菌10 min,加入50 mg/L的SO2抑制果浆氧化,而后通过压榨和皮渣分离,得到樱桃果浆,再加入30 mg/L的果胶酶反应6 h。添加酿酒酵母之前,调整樱桃果浆的总糖浓度,添加适量蔗糖使糖度达到210 g/L,然后接种酿酒酵母(300 mg/L),并于25℃持续发酵7~8 d。
酒精发酵过程中,监测果浆糖度和温度变化,定期搅拌循环;当樱桃果酒的总糖含量小于4 g/L时,离心分离出酿酒酵母,终止酒精发酵,得到樱桃酒。
1.5.2分析方法
酒精度、还原糖、总酸、挥发酸的测定方法参照《葡萄酒、果酒通用分析方法》(GB/T 15038—2006)执行。其中,酒精度采用密度瓶法测定;还原糖采用斐林氏剂直接滴定法测定,以葡萄糖计;挥发酸和总酸采用氢氧化钠滴定法测定,分别以乙酸和苹果酸计。pH 采用酸度计测定。总酚、单宁、花色苷、黄酮的测定参考XIAO方法测定[16];总酚含量采用Folin-Ciocalteu法进行测定,以没食子酸计;单宁采用福林-丹尼斯法进行测定,以单宁酸计;花色苷浓度利用pH示差法测定,以二甲花翠素-3-葡萄糖苷计;黄酮含量采用比色法测定,以儿茶素计。
酵母活细胞数采用稀释平板法测定。在发酵过程中,每隔12 h取样,用无菌水梯度稀释至10-3~10-6,涂布于酵母膏胨葡萄糖琼脂培养基(YPD),于25 ℃好氧条件下培养72 h后计数[17]。
1.5.3样品感官质量分析
对具有食品专业背景的46人按照GB/T 15038—2006《葡萄酒、果酒通用分析方法》标准进行调查,初筛出具有兴趣、健康良好、时间充裕等符合品评要求的33人,再通过调查表筛选、敏锐性实验、排序/打分实验,最终通过综合面试筛选出11人,包括6男5女,年龄20~35岁之间。进行5轮为期5周的培训。
正式实验过程在标准品评室完成(单间小格90 cm×100 cm,噪音低于40 dB,通风良好,周围无杂物及产异味物等)。将以3位数字随机编号的20 mL左右的樱桃酒样品呈递给品评人员。品评杯具为透明郁金香酒杯,样品随机放置。品评者将对样品的香气特征、颜色特征及味道属性进行描述强度选择与各项打分,实验重复3次。所有感官评价均采用定量描述分析法(quantitative descriptive analysis, QDA),选取 10 点制标度:0-9(香气:0=没气味,9=气味最强;颜色:0=无颜色,9=颜色最深;味道:0=没味道,9=味道最强)。
2 结果与分析
2.1不同酵母在樱桃酒中的发酵进程
分别取7株商业化酿酒酵母,包括BM 4×4、F33、QA23、D254、RHST、FX10和EC1118,经过活化后接种到樱桃汁中,25 ℃恒温培养,每间隔12 h定期测定酵母总数和还原糖含量,待还原糖质量浓度低于4 g/L,终止酵母发酵。
7株酿酒酵母的生长情况如图1所示。通过观察发现,接种24 h后,多数酿酒酵母均能快速启动,特别是EC1118、BM 4×4和D254,仅F33和RHST启动稍缓慢。发酵72 h后,各发酵液中酵母活细胞数几乎达到最大。在随后的发酵过程中,随着酒精度逐渐升高,部分酿酒酵母的活力受到一定的抑制,发酵速度减缓,活细胞数也出现了一定程度的减少。
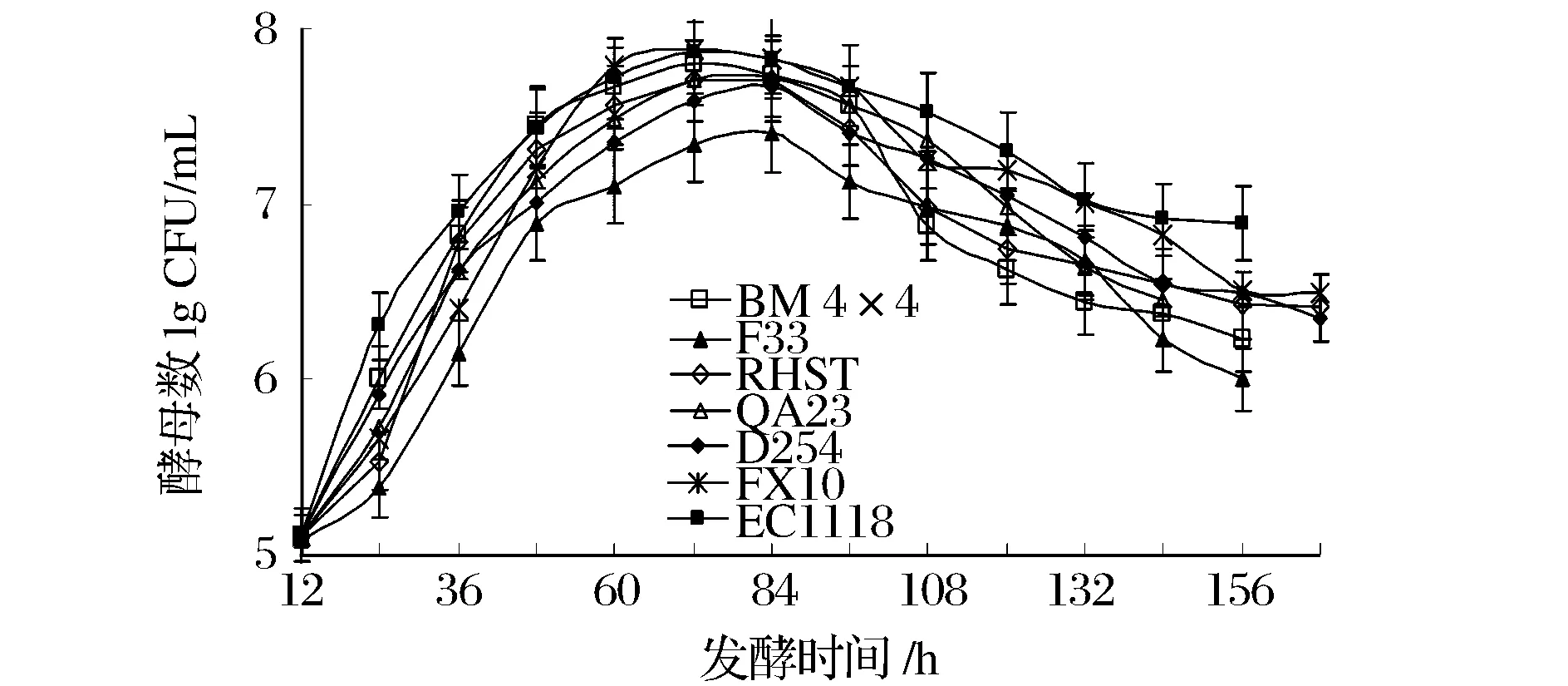
图1 7株酿酒酵母在樱桃酒中的发酵进程Fig.1 The evolution of seven S. cerevisiae strains during cherry wine-making
发酵果酒残糖量的变化过程如图2所示。在整个发酵过程中,大多数樱桃酒的还原糖的含量出现急剧下降,特别是BM 4×4和EC1118,仅需5天就使果酒中的还原糖质量浓度降至4 g/L以下,说明此2株酿酒酵母较其他菌株的发酵能力更强。菌株RHST适应樱桃汁的时间较长,需要1周或更长的时间才能将果汁中的还原糖完全降解。其他酵母菌株,如QA23、FX10等表现相似。

图2 接种不同酵母的樱桃酒的还原糖分解进程Fig.2 The consumption of reducing sugars by different S. cerevisiae strains during cherry wine-making
以上结果说明各种酿酒酵母在发酵速度上存在明显差异,其中BM 4×4、EC1118、D254的发酵效率较高,可以考虑作为樱桃果酒的发酵菌株。
2.2不同酵母对樱桃酒理化指标的影响
发酵结束后,去除发酵残渣,获得澄清酒体,樱桃酒的各种基本理化指标见表1。
各品种樱桃酒残糖含量均在4 g/L及其以下,符合干红樱桃酒的要求。酒精度都在10.5%~11.2%,说明各个酿酒酵母转化葡萄糖生成乙醇的能力相当,其中转化能力最强的菌株是D254和BM 4×4,而相对稍弱的菌株是FX10。

表1 接种不同酵母的樱桃酒基本理化指标
滴定酸含量均在5.33~5.72 g/L之间,较发酵前均有一定程度的降低。非挥发性的有机酸虽然不是樱桃酒的香气成分,但其是主要的呈味物质,而且含量必须控制在适当范围之内[21]。根据研究结果,试验中所用的酿酒酵母均具备一定的分解有机酸的能力,其中降酸能力最强的菌株是D254,由最初的可滴定酸5.8 g/L降至5.33 g/L,降幅达0.47 g/L,降酸程度最小的菌株是FX10和RHST。
另外,根据葡萄酒的国标规定,挥发酸的质量浓度必须低于1.2 g/L,否则视为不合格产品。本研究中EC1118发酵的樱桃酒挥发酸质量浓度为0.47 g/L,其他樱桃果酒的挥发酸质量浓度均低于0.36 g/L,说明所有样品均发酵成功,符合果酒的相关标准[22]。
2.3不同酵母对樱桃酒生物活性成分的影响
本研究对不同酵母发酵生产的樱桃酒中重要的生物活性成分:总酚、黄酮、单宁和花色苷含量进行了测定,结果如表2所示。

表2 接种不同酵母的樱桃酒生物活性组分的含量
酚类化合物是樱桃酒的骨架成份,多酚不仅与樱桃酒的色泽、风味等品质指标密切相关,而且适量摄入能够降低心血管疾病、动脉粥样硬化、血小板聚集和癌症等多种疾病的发病率[4-5,16]。如表2所示,7株酿酒酵母萃取莱阳长把红樱桃中多酚类物质的能力差异显著。接种D254的樱桃酒中总酚含量最高,达到724.5 mg/L,而接种QA23和BM 4×4的樱桃酒中的总酚含量最低,仅分别为592.1 mg/L和599.3 mg/L。其他樱桃酒样中多酚含量介于642~683 mg/L之间。
单宁是樱桃酒中的一种多酚类化合物,在红樱桃酒中含量较多,它是组成樱桃酒骨架的重要组分,对樱桃果实的色泽、风味,樱桃酒的色泽、滋味和口感及樱桃酒的陈酿老化等都具有很重要的作用[4,5,16]。如果果酒中的单宁含量过高,会直接影响其口感属性和整体质量[23]。如表2所示,7株酿酒酵母萃取樱桃单宁的能力差异显著,在75.98~126.28 mg/L之间。接种D254的樱桃酒中的单宁含量最高,接种F33的樱桃酒次之,能够赋予樱桃酒醇厚的口感;而接种QA23和BM 4×4的樱桃酒中的单宁含量较低,均低于80 mg/L,可能会造成樱桃酒酒体单薄、口感寡淡。
黄酮类化合物尤其是儿茶酸、花色苷、黄酮醇在樱桃酒质量中起着重要的作用。它们赋于樱桃酒的感官特征主要是颜色和收敛性,同时还具有广泛的生物化学与药理作用,如抗癌、抗动脉硬化、消炎、抗菌、抗氧化作用等[24]。接种D254的樱桃酒中的黄酮含量最高(0.96 mg/L),而接种QA23和BM 4×4的樱桃酒中的黄酮含量最低,分别仅为0.71 mg/L和0.73 mg/L。
花色苷是樱桃酒中重要的呈色物质,不仅影响樱桃酒的颜色和口感,还能在酒体中发挥重要的抗氧化作用,如清除自由基和螯合金属离子等作用[16]。在整个酿酒过程中,樱桃中的花色苷会因为醪液性质的变化而发生一定的变化[25],因此,樱桃酒中花色苷的研究对于樱桃酒生产具有非常重要的意义。7株酿酒酵母萃取长把红中花色苷的能力差异显著,在0.71~1.16 mg/L之间。接种D254的樱桃酒中花色苷含量最高,RHST、EC1118次之;而接种BM 4×4的樱桃酒花色苷含量最低,可能会导致酒体颜色黯淡,外观色泽欠佳。
7株酿酒酵母萃取多酚、单宁、黄酮和花色苷的能力差异较大,其中D254的萃取能力最强,能够赋予果酒醇厚的口感;而QA23和BM 4×4等酵母的萃取能力相对较弱,可能会造成果酒口感淡薄,因而不适宜作为樱桃果酒的出发菌株。
2.4不同酵母对樱桃酒感官品质的影响
定量描述分析(QDA)是美国Targon公司于20世纪70年代创立的感官分析方法,利用统计方法对感官测得的数据进行分析,是一种定性和定量结合的描述分析检验方法。QDA适用于新产品开发与测评,有利于控制产品质量,是有较强实用性的感官评定方法[26-27]。
正式实验之前,经过多轮检验和讨论,已确定了樱桃酒的6个主要香气特征,分别是花香、果香、甜香味、生青气味、醇香和发酵香。4个主要的味道属性,分别是酸、甜、苦、涩。3个主要的颜色特征分别是红色、黄色和棕色。所有感官评价均采用定量描述分析法,选取 10 点制标度。11名感官评定人员对7株不同酿酒酵母发酵的樱桃酒的香气特征、色泽以及滋味等感官指标进行描述分析,并对各描述特征强度取平均值,如表3所示,并形成风味剖面图(图3)。

表3 接种不同酵母的樱桃酒的各项感官属性平均得分表

图3 接种7株酵母的樱桃酒的感官分析结果Fig.3 Results obtained during sensory analyses for cherry wines fermented by seven S. cerevisiae strains
就香气属性而言,接种D254和EC1118的樱桃酒的果香最浓郁,BM 4×4发酵的樱桃酒的果香得分最低。接种BM 4×4、FX10的樱桃酒的醇香最强烈,而F33发酵樱桃酒却醇香寡淡。发酵香气在各樱桃酒间差异较大,以BM 4×4得分最高,而EC1118得分最低。生青气味在部分酒样中较浓郁,如FX10。
就色泽属性而言,D254、RHST发酵的樱桃酒色泽红艳或紫红,红色调突出,外观感觉较好。而接种BM 4×4的樱桃酒颜色较浅,有黄色和棕色色调,外观质量一般。
就味道属性而言,D254和EC1118发酵的樱桃酒酒体圆润、丰满,酸甜适中,爽口,后味干净,单宁、黄酮引起的苦涩感中等,因而总体评价位于各发酵樱桃酒前列。接种RHST和QA23的3种樱桃酒的总体评价中等,虽然入口舒顺、滋味纯正、爽净,但是较之D254其酸味、苦涩感偏少,降低了酒体的醇厚感。接种QA23、BM 4×4的樱桃酒的各种味觉属性均得分较低,特别是苦味和涩感,因而感觉酒体单薄,口感寡淡。
综合各种感官属性,D254发酵的樱桃酒获得了最优的评价结果,其颜色红艳,香气馥郁协调,入口舒顺,酒体圆润,滋味纯正、爽净,属于上乘的樱桃酒。
3 结论
以市售的商业化酿酒酵母为研究对象,通过对比7株酵母的发酵性能、萃取生物活性物质,以及对樱桃酒感官品质的影响,发现酿酒酵母D254不仅在发酵过程中表现卓越,发酵速度快、转化效率高,而且具备一定的降解果酒中的有机酸和较强的萃取多酚和单宁的能力,因而能够赋予樱桃果酒鲜艳的色泽、适宜的酸涩度和口感。而且该菌株为产香浓郁的酵母菌,能够增强樱桃酒的果香、花香等香气特征,使酒样香气馥郁协调。基于以上优点,本研究选定D254为发酵起始菌株,负责樱桃果酒的酒精发酵。本课题的研究结果可为进一步优化樱桃酒发酵工艺及樱桃酒的生产提供一定的理论依据。
[1]SUN Shu-yang,JIANG Wen-guang,ZHAO Yu-ping.Characterization of the aroma-active compounds in five sweet cherry cultivars grown in Yantai(China)[J].Flavour and Fragrance Journal,2010,25(4):206-213.
[2]张浩玉,张珂,孙卫华.我国樱桃深加工开发利用现状 [J].广东农业科学,2011(9): 80-82.
[3]JAGTAP U B,BAPAT V A.Wines from fruits other than grapes: current status and future prospectus [J].Food Bioscience,2015,9:80-96 .
[4]NIU Yun-wei,ZHANG Xiao-ming,XIAO Zuo-bing,et al.Characterization of taste-active compounds of various cherry wines and their correlation with sensory attributes [J].Journal of Chromatography B,2012, 902:55-60.
[5]SUN Shu-yang,JIANG Wen-guang,ZHAO Yu-ping.Comparison of aromatic and phenolic compounds in cherry wines with different cherry cultivars by HS-SPME-GC-MS and HPLC[J].International Journal of Food Science & Technology,2012,47(1):100-106.
[6]孙祖莉,郭明恩,刘玉田.酿制樱桃补酒工艺参数的优化[J].烟台大学学报(自然科学与工程版),2005,18(2):141-145.
[7]冯志彬,程显好,夏利江.樱桃果酒发酵工艺研究[J].中国酿造,2008(3):90-92.
[8]庄志发,冯紫慧,王凤艳.发酵法半甜型樱桃酒的研制[J].山东食品发酵, 2009(2):47-49.
[9]段先瑶,王屾,郝林,等.樱桃酒发酵工艺的优化[J].酿酒科技,2013(1): 93-95.
[10]方玲玲,肖作兵,牛云蔚,等.超高效液相色谱串联质谱法测定樱桃酒中的5种酚酸[J]. 食品与发酵工业,2011,37(6):172-176.
[11]何兰兰,张妮,于海燕.基于气相色谱-质谱联用对樱桃酒香气分析[J].食品工业科技, 2013,34(21): 141-148;365.
[12]牛云蔚,张晓鸣,肖作兵,等.不同酵母种类对樱桃酒呈味成分的影响[J].食品工业, 2013, 34(9):40-43.
[13]牛云蔚.樱桃酒的特征风味及品质调控研究[D].无锡:江南大学,2012.
[14]张艳.中国樱桃果实酿酒工艺及香气成分变化研究[D].雅安:四川农业大学, 2008.
[15]XIAO Zuo-bing,ZHOU Xuan,NIU Yun-wei,et al.Optimization and application of headspace-solid-phase micro-extraction coupled with gas chromatography-mass spectrometry for the determination of volatile compounds in cherry wines[J].Journal of Chromatography B,2015,978-979: 122-130.
[16]XIAO Zuo-bing,FANG Ling-ling,YU Hai-yan,et al.Effect of cultivar and variety on phenolic compounds and antioxidant activity of cherry wine [J].Food Chemistry,2015,186: 69-73.
[17]SUN Shu-yang,GONG Han-sheng,JIANG Xia-man,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations withSaccharomycescerevisiaeon alcoholic fermentation behaviour and wine aroma of cherry wines[J].Food Microbiology,2014,44:15-23.
[18]SUN Shu-yang,CHE Chang-yang,SUN Teng-fei,et al.Evaluation of sequential inoculation ofSaccharomycescerevisiaeandOenococcusoenistrains on the chemical and aromatic profiles of cherry wines [J].Food Chemistry, 2013,138(4):2 233-2 241.
[19]于海燕,张妮,许春华.樱桃酒发酵过程中的主要香气成分及其变化[J].食品与发酵工业, 2011,37(10):159-163.
[20]MAURIELLO G,CAPECE A,D'AURIA M, et al. SPME-GC method as a tool to differentiate VOC profiles inSaccharomycescerevisiaewine yeasts[J].Food Microbiology,2009,26(3):246-252.
[21]沈颖,刘晓艳,白卫东,等.果酒中有机酸及其对果酒作用的研究[J].中国酿造,2012, 31(2): 29-32.
[22]GB 15037-2006.葡萄酒[S].
[23]刘朝霞,刘青,李荀,等.葡萄酒中单宁含量调查与口感关系的分析[J].食品安全质量检测学报,2014,5(7):2 226-2 230.
[24]陶永胜,李华,王华.葡萄酒中主要的黄酮类化合物及其分析方法[J].中外葡萄与葡萄酒, 2001(4): 14-17.
[25]杜文华,刘忠义.葡萄酒中花色苷的研究进展[J].食品与机械,2011,27(4):169-172.
[26]王二霞,赵健.感官评价原理及其在肉质评价中的应用[J].肉类研究,2008(4):71-74.
[27]牛云蔚,张晓鸣,肖作兵,等.樱桃酒感官评价与电子舌感官分析的相关性研究[J].食品工业科技,2012, 33(16): 105-107.
The compositional profile and sensory analysis of cherry wines fermented by differentSaccharomycescerevisiaestrains
LIU Wen-li, SUN Shu-yang*,GONG Han-sheng,CHE Chang-yuan,JIN Cheng-wu
(College of Food Engineering,Ludong University,Yantai 264025,China)
Wine yeasts have a significant effect on the quality of cherry wines. In order to select an appropriate yeast for cherry wines fermentation, seven commercialSaccharomycescerevisiaestrains were assayed and compared. Results demonstrated that D254 strain showed better performance during the alcoholic fermentation, and was able to efficiently extract many biological active substances from the cherry musts, such as polyphenols and anthocyanins. In addition, the cherry wines fermented by D254 obtained the highest score during the sensory analysis, presenting a harmonious flavor and texture. Therefore, D254 was selected as the most suitable yeast starter for production of cherry wines.
cherry wine;Saccharomycescerevisiae; screening; compositional profile; sensory analysis
博士,讲师(孙舒扬副教授为通讯作者,E-mail:sysun81@aliyun.com)。
山东省高校科技发展计划(J13LE10);国家自然科学基金(31501577)
2015-08-21,改回日期:2015-10-14

