大孔树脂对核桃青皮中胡桃醌的分离纯化
马乐,张有林,韩军岐,周星余,夏莎莎
(陕西师范大学 食品工程与营养科学学院, 陕西 西安,710119)
大孔树脂对核桃青皮中胡桃醌的分离纯化
马乐,张有林,韩军岐*,周星余,夏莎莎
(陕西师范大学 食品工程与营养科学学院, 陕西 西安,710119)
比较6种不同极性大孔树脂对核桃青皮提取物中胡桃醌的静态吸附和解吸性能,筛选出最佳的大孔树脂。通过与胡桃醌标准品HPLC 保留时间相比较的方法对胡桃醌含量进行分析。结果表明:D101树脂为纯化核桃青皮胡桃醌的最佳树脂,较佳的动态吸附条件为上样液胡桃醌浓度0.114 mg/mL,pH 2.0,上样速率为1.0 mL/min,吸附率可达81.85%;较佳的洗脱条件为体积分数95%的丙酮,pH 4.0,洗脱速率为0.33 mL/min,解吸率为76.5%。经 HPLC鉴定和分析,D101分离纯化核桃青皮胡桃醌不会造成组成变化和较大损失。 D101大孔树脂对核桃青皮胡桃醌有较好的分离纯化效果。
核桃青皮;胡桃醌;大孔树脂;分离纯化
核桃青果皮(walnut green husk)在中药中被称为青龙衣,是核桃外部一层厚厚的绿色果皮,青龙衣含有一类生物活性较高的物质——胡桃醌(5-羟基-1,4-萘醌)。青龙衣辛、苦、涩、平,有清热解毒、祛风疗癣、止痛止痢的功效[1]。由于胡桃醌具有广泛的药用价值,所以近年来备受人们关注。据相关研究表明,核桃青皮中胡桃醌有抑癌、抗肿瘤作用,因此综合开发和有效利用核桃青皮中的胡桃醌具有重要意义[2]。大孔吸附树脂有较好的选择性、吸附容量大和易于再生等优点,被广泛应用于天然产物活性物质的分离纯化[3],但尚未见此法应用于核桃青皮胡桃醌分离纯化的相关报道。因此,本研究以核桃青皮为原料,通过6种不同性能树脂(见表1)的吸附解吸试验,筛选适合树脂,对核桃青皮胡桃醌进行分离纯化,以期获得最佳的纯化效果。

表1 6种大孔树脂的基本性能
1 材料与方法
1.1材料与仪器
青皮核桃:8月中旬核桃采摘于陕西省蓝田县 青皮核桃取青皮,冷冻干燥处理后研磨,过 60 目筛,装于棕色玻璃瓶内,冷藏备用;大孔吸附树脂AB-8、S-8、NKA-9、D-101,西安蓝晓科技新材料股份有限公司;X-5、LS-300,西安蓝深特种树脂有限公司;胡桃醌标准品,美国Sigma公司;H3PO4、甲醇 色谱纯,天津市科密欧化学试剂有限公司;无水乙醇、丙酮、甲醇、NaOH、浓HCl,分析纯, 天津富宇化工有限公司。
KQ3200DE型数控超声波清洗器,昆山市超声仪器有限公司;RE-52旋转蒸发仪,上海安亭实验仪器有限公司; UV-1100紫外可见分光光度计,上海美谱达仪器有限公司; HL-2S恒流泵,上海沪西分析仪器厂有限公司;SHZ-82恒温振荡器,金坛市富华仪器有限公司; LGJ-18C冷冻干燥机,北京四环科学仪器厂;PHS-3C精密pH计,上海精密科学仪器有限公司;JA1203电子天平,上海精密科学仪器有限公司;Breeze1525高相液相色谱仪,美国Waters公司。
1.2实验方法
1.2.1样品溶液的制备
称量一定量的核桃青皮干粉,以体积分数85%乙醇为提取剂,设置超声波功率为 150 W,处理时间30 min,提取温度35 ℃,料液比1∶20(g∶mL),提取2次,真空抽滤,合并滤液;旋转蒸发去除溶剂,获得胡桃醌粗品,以甲醇溶解制得样品溶液。
1.2.2胡桃醌含量的测定
精确称取胡桃醌对照品7.50 mg,甲醇溶解定容至50 mL,即为胡桃醌标准品溶液。分别取胡桃醌标准品溶液0、0.5、1.0、2.0、4.0、8.0、16.0 mL 定容至50 mL,即得浓度分别为0、0.001 5、0.003、0.006、0.012、0.024、0.048 mg/mL梯度溶液。在紫外可见分光光度计下,422 nm波长处测定各梯度溶液的吸光值。绘制吸光值(A)与胡桃醌标准品质量浓度(c)的标准曲线,获得回归方程。
1.2.3大孔树脂的预处理
大孔树脂先用4% NaOH 溶液浸泡4 h,蒸馏水洗至中性;后用 4% HCl 溶液浸泡4 h,蒸馏水洗至中性;最后通过体积分数95%乙醇浸泡处理4 h,蒸馏水冲洗至无醇味,备用。
1.2.4大孔树脂静态吸附与解吸
(1)静态吸附实验。准确称取1.0 g 湿树脂放置于50 mL具塞锥形瓶中,加入样品溶液30 mL,密封置于175 r/min摇床上,25 ℃下振荡12 h,吸取上清液测定胡桃醌含量。根据公式(1)和(2)计算吸附量和吸附率[4-5]:
(1)
(2)
式中:qe,吸附量,mg/g;E,吸附率, %;c0,起始质量浓度,mg/mL;c1,平衡质量浓度,mg/mL;V1,吸附溶液体积,mL;m,树脂的质量,g。
(2)静态解吸实验。将已经充分吸附的树脂用蒸馏水清洗,直至表面无样品液残留,然后再用滤纸吸干水分,放置于具塞锥形瓶中。分别加入30 mL不同溶剂密封置于175 r/min振荡器中,25 ℃下振荡,解吸12 h后,吸取上清液测定胡桃醌含量。根据下列公式计算解吸率和解吸量[4-8]:
(3)
(4)
式中:D,解吸率, %;qd,解吸量,mg/g;c0,起始质量浓度,mg/mL;c1,平衡质量浓度mg/mL;V1,吸附溶液体积mL;c2,解吸液中多酚质量浓度,mg/mL;V2,解吸溶液体积,mL;m,树脂取量,g。
1.2.5大孔树脂动态吸附与解吸
将预处理好的大孔树脂湿法装入(16 mm×500 mm)层析柱中,用蒸馏水平衡后,将样品溶液以一定流速上样并收集流出液,每10 mL为一管,测定并计算流出液的浓度,确定流速、体积等条件,得到最佳的吸附条件,绘制动态吸附曲线。
将吸附饱和的树脂进行解吸试验,用蒸馏水洗至无粗提液残留,适当浓度的洗脱液以一定流速进行洗脱并收集洗脱液,计算流出液浓度,确定洗脱流速、体积等条件,得到最佳的洗脱条件,绘制动态洗脱曲线。
1.3核桃青皮中胡桃醌的含量HPLC分析
经过大孔树脂纯化后的核桃青皮胡桃醌提取物采用 HPLC法测定其含量。具体 HPLC 条件参考曲中原等的方法[2],色谱柱为Agilent C18柱(4.6 mm×250 mm, 5 μm), 流动相为V(甲醇)∶V(水)=55∶45, 水相用H3PO4调pH 值约为 3.5(磷酸∶水体积比为 1∶500), 体积流量0.8 mL/min, 检测波长250 nm, 柱温30 ℃。样品色谱峰保留时间与标准品保留时间相比较,根据峰面积计算胡桃醌含量,结果以1g核桃青皮干粉中胡桃醌含量(μg)计。
1.4统计分析
试验重复3次,结果以均值±标准差表示,结果采用DPS进行方差分析及Excel软件对数据统计分析。
2 结果与分析
2.1标准曲线的绘制
以胡桃醌标准品浓度为横坐标(X, mg/mL),吸光度值为纵坐标(Y),绘制标准曲线,见图1。回归方程为:Y=20.279X+0.001 9,R2=0.999 7,表明该曲线具有较好的线性关系。
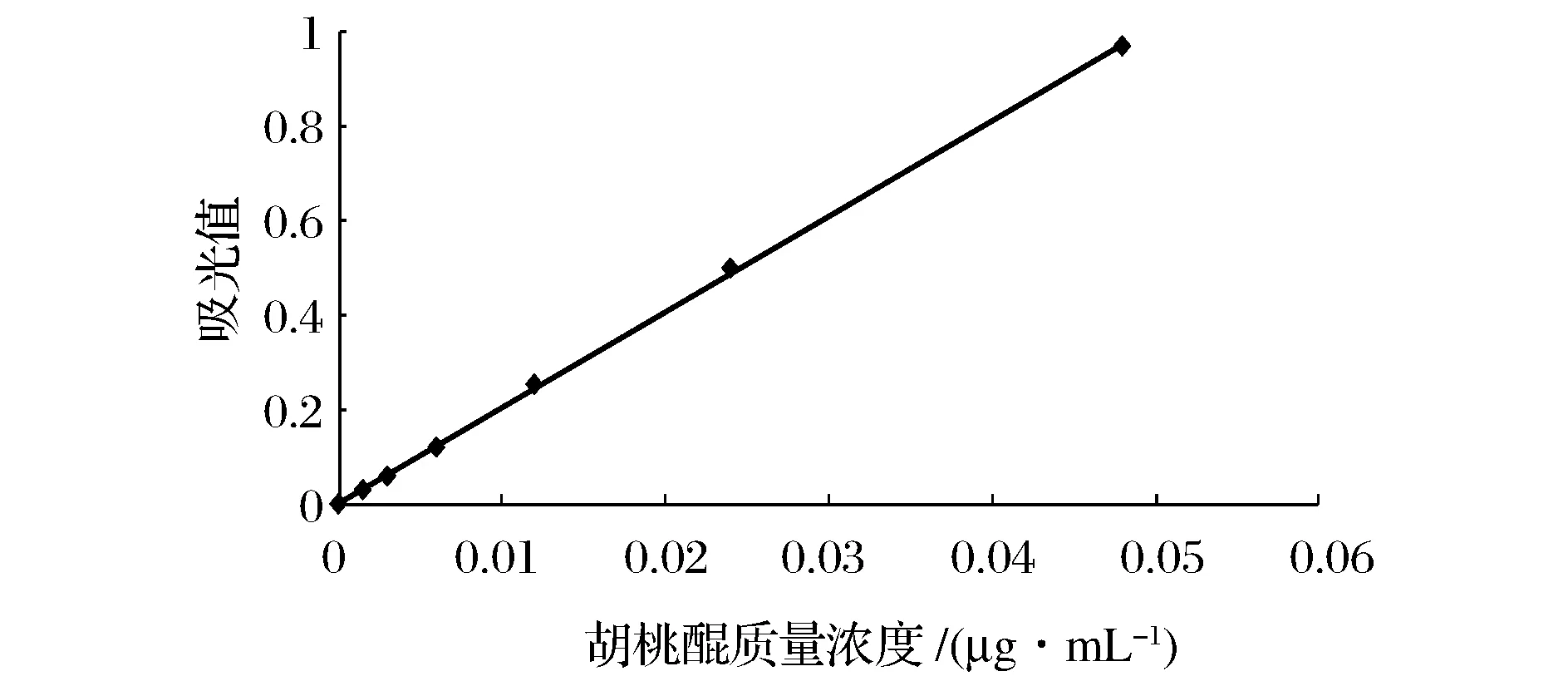
图1 胡桃醌标准曲线图Fig.1 Standard curve of juglone
2.2大孔树脂的筛选
由于大孔树脂物理结构、化学性质的不同,所以对胡桃醌的吸附、解吸效果也有所不同,表2显示了6种大孔树脂对核桃青皮粗提液中胡桃醌的静态吸附量、解吸量和解吸率。
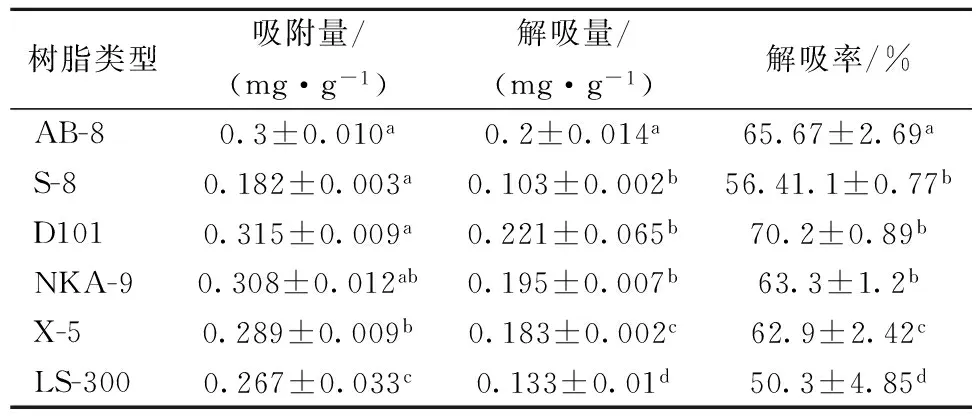
表2 6种大孔树脂静态吸附和解析性能的分析比较
注:同列不同字母表示统计学上具有显著差异(P<0.05)。
据表2可知,D101对核桃青皮胡桃醌的吸附量最高,可达到0.315 mg/g;其次是NKA-9吸附量为0.308 mg/g;吸附效果最差的S-8吸附量仅为0.182 mg/g。通过对6种大孔树脂解吸性能试验可得,D101对胡桃醌的解吸性能最好,解吸率可达70.2%;其次AB-8解吸率为65.67%;LS-300的解吸率最差仅有50.3%。这一现象说明,大孔树脂对核桃青皮胡桃醌的吸附和解吸存在一定的选择性。D101树脂吸附量明显高于其他5种树脂(P<0.05),可能是由于D101树脂的极性和核桃青皮中胡桃醌极性相似,且D101在解吸效果中也明显优于其他树脂(P<0.05),故综合考虑D101树脂为此次试验中纯化胡桃醌的最佳树脂。
2.3静态吸附与解吸条件的优化
2.3.1大孔树脂对核桃青皮胡桃醌的吸附性能
D101树脂中加入胡桃醌粗提液进行静态吸附,每隔一段时间测定胡桃醌含量,计算吸附量。将吸附饱和树脂进行静态解吸试验,同样测定胡桃醌含量,计算解吸量,并绘制静态吸附和解吸动力学曲线。
D101树脂在静态吸附起始阶段对核桃青皮胡桃醌的吸附量快速增加,属快速平衡型[9]。随着时间的延长,吸附量逐渐达到饱和。当在4 h时树脂吸附基本达到平衡,如果再延长吸附时间,吸附量的变化幅度不大,因此可选择4 h作为吸附平衡态,见图2。

图2 D101树脂静态吸附和解吸动力学曲线Fig.2 The static adsorption and desorption kinetic curve of D101 resin
通过解吸曲线可知,解吸开始时随着时间的延长而不断增大,当处在2h时树脂解吸量已达较高,再延长时间解吸量变化不太明显,说明2 h后就达到了解吸平衡状态。
2.3.2粗提液pH值对大孔树脂吸附效果的影响
调节粗提液pH值为1.0~7.0,经过一段时间的静态吸附,测吸附后胡桃醌含量,计算吸附率,结果见图3。

图3 pH值对胡桃醌吸附率的影响Fig.3 The effect of pH on adsorption ratio of juglone
由图3可知,当pH 2.0时树脂对胡桃醌吸附效果最佳,随pH值升高D101树脂吸附能力逐渐下降,这可能是因为核桃青皮胡桃醌结构中的-OH基团中的H+被解离出来,以离子形式存在于溶液中,在此状态下不易被树脂吸附。说明核桃青皮中的胡桃醌可能在酸性环境下能够保持分子状态,有利于D101树脂的吸附。
2.3.3粗提液胡桃醌浓度对树脂吸附效果的影响
配制粗提液胡桃醌浓度为0.072 4~0.201 0 mg/mL,进行静态吸附试验,测胡桃醌含量并计算吸附率,结果见图4。

图4 不同浓度胡桃醌静态吸附曲线Fig.4 Static adsorption curve of different juglone concentration
上样浓度大小影响大孔树脂的吸附性能。一般情况,大孔树脂吸附量与上样液浓度成反比,低浓度有利于吸附进行[10]。由图4可知,随样品液初始浓度不断增加,D101树脂的吸附量也不断升高,当胡桃醌浓度增加到0.114 mg/mL时,树脂吸附率由高逐渐降低。应该是由于在低浓度时,胡桃醌分子能够有机会充分接触树脂,而在高浓度条件下,胡桃醌分子扩散受到抑制使树脂吸附能力下降,故试验选择胡桃醌上样浓度0.114 mg/mL为宜。
2.3.4不同洗脱剂对大孔树脂解吸效果的影响
将已吸附饱和的树脂进行静态解吸试验,分别选用甲醇、乙醇和丙酮作为洗脱剂,经过一段时间的洗脱,测定胡桃醌含量并计算解吸率,结果见图5。

图5 不同洗脱剂对胡桃醌解吸率的影响Fig.5 Effect of different elution reagents on the desorption rate of juglone
一般情况,大孔树脂使用的洗脱剂主要有甲醇、乙醇和丙酮[11]。如图5所示,甲醇作为洗脱剂进行解吸,解吸率仅为17.7%,均低于乙醇和丙酮,而丙酮对胡桃醌的洗脱能力最强,因此丙酮为最佳洗脱剂。
2.3.5丙酮浓度对大孔树脂解吸效果的影响
将不同浓度的丙酮溶液分别放入吸附饱和的树脂中,静态解吸一段时间,测胡桃醌含量,计算解吸率,结果见图6。

图6 丙酮浓度对胡桃醌解吸率的影响Fig.6 Effect of acetone concentration on desorption rate of juglone
如图6所示,随着丙酮浓度提高,解吸率不断增加,当丙酮浓度增加到95%时,再进一步增加浓度,解吸率反而会降低,可能是因为洗脱剂的极性在一定程度上影响吸附质洗脱[12],所以选择95%丙酮为较佳的洗脱浓度。
2.3.6解吸液pH值对大孔树脂解吸效果的影响
调节洗脱剂pH值为1.0~7.0,经过一段时间静态解吸测定解吸后的胡桃醌含量,计算解吸率,结果见图7。

图7 pH对胡桃醌解吸率的影响Fig.7 Effect of pH on desorption rate of juglone
图7所示,随洗脱剂pH不断升高,胡桃醌解吸率逐渐增加,当pH 4.0时解吸率达到最大,但当pH值继续升高,解吸能力反而下降。这可能是因为酸性不断降低使胡桃醌分子结构发生变化,导致解吸率降低。而当pH值为4.0时,因胡桃醌与树脂之间的作用较弱,胡桃醌容易被洗脱,故解吸率达到最大。
2.4大孔树脂动态吸附与解吸条件优化
2.4.1上样流速对大孔树脂吸附效果的影响
大孔树脂湿法装柱后, 胡桃醌粗提液分别以0.33、1.0和1.7 mL/min流速上样,收集流出液,测胡桃醌浓度并绘制动态吸附曲线,结果见图8。
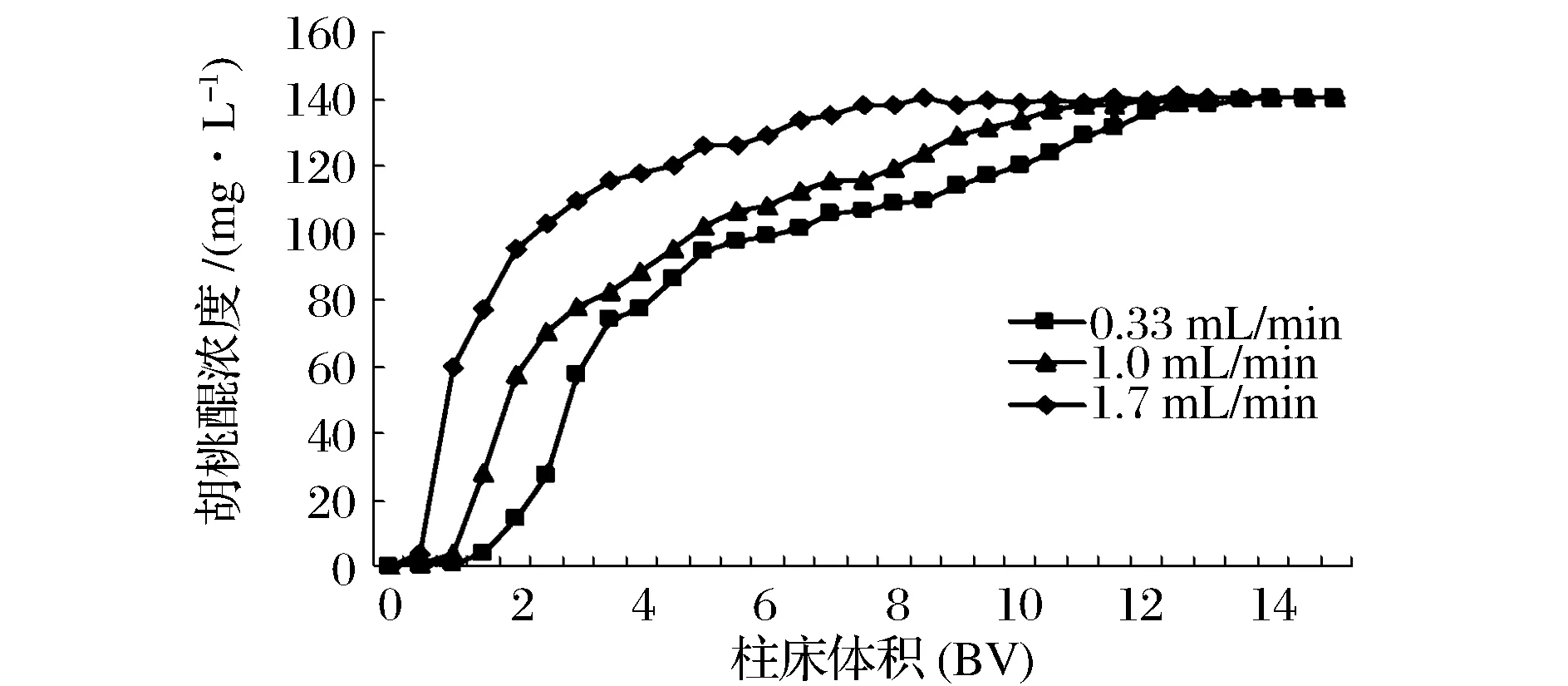
图8 流速对吸附效果的影响Fig.8 Influence of flowing rates on adsorption effect
通常上样速度慢有利于树脂对胡桃醌吸附,如果流速过快,样品液中部分胡桃醌来不及扩散到树脂内表面,就流出柱子,导致树脂对胡桃醌的吸附量下降;但是如果流速过慢,不仅会影响生产效率,而且还会增长生产周期[13]。如图8所示,在0.33 mL/min和1.0 mL/min两种上样流速下,树脂吸附胡桃醌的能力均优于1.7 mL/min的情况。在0.33、1.0 mL/min速率下,树脂的吸附能力相差不大(P>0.05),因此选择流速1.0 mL/min为宜。
2.4.2洗脱剂流速对大孔树脂解吸效果的影响
吸附饱和的树脂,用95%丙酮溶液进行洗脱,洗脱流速分别为0.33、1.0和1.7 mL/min流速上样,收集洗脱液,测定胡桃醌浓度并绘制动态解吸曲线,结果见图9。

图9 洗脱剂流速解吸效果的影响Fig.9 Influence of eluting rates on desorption effect
一般而言,洗脱流速要求慢,如果流速快,可能会使洗脱剂不能够和树脂充分接触,导致解吸量降低,生产效率下降;但如果流速过慢,又会延长生产周期,故生产中要进行综合考虑[14]。由图9可知,随着洗脱速度的增加,解吸量不断下降,当洗脱速度为0.33 mL/min时有较好的洗脱效果,所以选此流速为最佳洗脱流速。
2.5核桃青皮中胡桃醌的含量HPLC分析
D101纯化前后的核桃青皮胡桃醌提取物及胡桃醌标准品HPLC谱见图10。核桃青皮胡桃醌纯化前保留时间4~15 min 之间有许多杂峰,经D101纯化后杂峰被有效降低,与胡桃醌标准品对比出峰时间也无明显变化,表明D101 大孔树脂适用于分离纯化核桃青皮胡桃醌且不会造成成分变化。核桃青皮胡桃醌纯化前后含量见表3。

表3 D101大孔树脂纯化前后胡桃醌含量比较1)
注:1)含量以 μg/ g核桃青皮粉计,均值±标准差;2)保留率:核桃青皮胡桃醌纯化后与纯化前含量的比值。

A:纯化前;B:纯化后 C:胡桃醌标准品图10 大孔树脂D101纯化前、后的核桃青皮提取物HPLC谱及胡桃醌标准品 HPLC 谱Fig.10 Effects of D101 resin on HPLC spectrum of walnut green husk extract and the HPLC spectrum of standard juglone
3 结论
通过静态吸附、解吸试验对6种大孔树脂进行筛选,得到适用于核桃青皮胡桃醌分离纯化的D101树脂。试验对胡桃醌粗提液pH值、质量浓度、洗脱剂种类、洗脱液浓度以及上样液流速等影响因素进行考察,初步确定了胡桃醌的吸附、解吸条件。(1)最佳吸附条件为:核桃青皮胡桃醌上样质量浓度为0.114 mg/mL,pH 2.0时,以1.0 mL/min的流速上样,在此条件下树脂对胡桃醌的吸附率最高,可达到81.85%。(2)最佳解吸条件为:洗脱剂为体积分数95%的丙酮,pH 4.0时,以0.33 mL/min的流速洗脱,解吸效果较好,解吸率可达76.5%。经HPLC分析鉴定,D101树脂分离纯化核桃青皮胡桃醌不仅能够有效去除杂质而且也不会引起胡桃醌成分的变化。由此可见,D101树脂分离核桃青皮胡桃醌是可行的,且为以后在生产中开展胡桃醌的分离纯化奠定理论基础。
[1]江苏新医学院.中药大辞典(下) [M]. 上海:上海科学技术出版社,1986.
[2]曲中原,邹翔,胡国军, 等. 青龙衣中胡桃醌提取工艺研究[J].中医药学报,2008,36(4):30-32.
[3]IGNAT I, VOLF I, POPA V I. A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables [J]. Food Chemistry, 2011, 126(4): 1 821-1 835.
[4]LIN Lian-zhu , ZHAO Hai-feng ,DONG Yi et al. Macroporous resin purification behavior of phenolics and rosmarinic acid from Rabdosia serra (MAXIM.) HARA leaf [J]. Food Chemistry, 2012,130(2):417-424.
[5]SUN Yan , YUAN Hong-yan, HAO Li-li, et al. Enrichment and antioxidant properties of flavone C-glycosides from trollflowers using macroporous resin [J]. Food Chemistry, 2013,141(1):533-541.
[6]XIONG Qing-ping , ZHANG Qiang-hua ,ZHANG Dan-yan, et al. Preliminary separation and purification of resveratrol from extract of peanut (Arachishypogaea) sprouts by macroporous adsorption resins [J]. Food Chemistry, 2014,145(7):1-7.
[7]曹增梅,黄和.大孔树脂纯化番石榴多酚的工艺优化[J].食品工业科技,2013,34(7):215-218.
[8]熊何健,吴国宏.大孔吸附树脂分离纯化葡萄多酚的研究[J]. 食品研究与开发.2007, 28(11): 74-76.
[9]苏东晓,张瑞芬,张名位,等. 荔枝果肉酚类物质大孔树脂分离纯化工艺优化[J].中国农业科学, 2014,47(14):2 897-2 906.
[10]刘丽香. 甘薯叶中多酚提纯工艺及抗氧化活性研究[D]. 南京: 南京农业大学,2008.
[11]周向军, 高义霞, 李宏娟,等. 大孔树脂纯化苋菜多酚的工艺研究[J].广东农业科学, 2012,39(21):108-111.
[12]王振宇, 刘春平. 大孔树脂 AB-8对苹果多酚的分离纯化[J].食品研究与开发,2009,30(4):21-24.
[13]艾志录,王育红,王海,等. 大孔树脂对苹果渣中多酚物质的吸附研究[J].农业工程学报,2007,23(8):245-248.
[14]周跃勇, 王岸娜, 吴立根. 大孔吸附树脂分离纯化猕猴桃中多酚的优选研究[J]. 河南工业大学学报:自然科学版, 2007,28(5):32-36.
Separation and purification of juglone from walnut green husk by macroporous resin
MA Le, ZHANG You-lin, HAN Jun-qi*, ZHOU Xing-yu,XIA Sha-sha
(College of Food Engineering and Nutritional Science Shanxi Normal University, Xi'an 710119, China)
The content of juglone from walnut green husk extraction was relatively low, which influences its biological activity. So it is important to find a simple and effective method to separate and purify it. Moreover, the optimum technology and conditions were also needed. Method: The static adsorption and desorption performance of six different polarities macroporous resins to juglone of walnut green husk extracts were compared to select the most suitable resin. The juglone content of walnut green husk extracts were analyzed by HPLC (high performance liquid chromatography) through comparing to the retention time of juglone standard. Result: Macroporous resin D101 was the best one for purification of walnut green husk juglone. Its optimum absorption condition was: feeding concentration 0.114 mg/mL, pH2.0, feeding rate 1.0mL/min, then the adsorption ratio was 81.85%. The optimum desorption conditions were: elute acetone concentration 95%, pH4.0, elution rate 0.33mL/min. The desorption ratio could reach to 76.5%. Identified and analyzed by HPLC, there was no large lose and change on the juglone profiles of walnut green husk with D101 macroporous resin purification. Conclusion: D101 macroporous resin could be used to purify juglone of walnut green husk.
walnut green husk; juglone; macroporous resin; separation and purification
10.13995/j.cnki.11-1802/ts.201601020
硕士研究生(韩军岐博士为通讯作者)。
西安市农业公关项目(NC1505.4)
2015-07-29,改回日期:2015-09-01

