剖析命题类型 破解高考“NA”易错题
◇ 云南 周维清 杨兴多
(作者单位:1.云南腾冲第八中学 2.云南腾冲五中
剖析命题类型 破解高考“NA”易错题
◇云南周维清1杨兴多2
以阿伏加德罗常数为载体的试题在历年高考中频繁出现,试题的变化幅度也非常大.其考查的内容主要涉及物质的量、物质的量浓度、阿伏加德罗定律、气体摩尔体积、物质的结构、物质的性质、物质的存在状态、化学方程式等基础知识,具有综合性强,试题容易得分难的特点.从试题的类型看,此类试题可以分为2大类型:一是考查有关“粒子数”的试题,考生应特别注意题目所给出的基本单元或化学变化过程中的粒子变化情况,考生往往因为判断不清而易混或出错;二是将NA与化学反应、物质的物理性质和化学性质、具体反应的产物、溶液中的存在状态(特别是水溶液中物质的电离及水解)等其他化学知识连在一起的试题,考生往往因为联系不够广泛而容易出错.笔者结合2005—2015年的高考试题对高考“NA”题进行了归类整理,分析了常见的考查方式和命题的角度,并提出了解题策略,以期对广大考生突破这一热点内容有所帮助.
1 以化学反应过程为载体进行考查
以化学反应为载体考查NA常数问题,是目前高考试题中最为常见的一种情况.而承载考查内容最主要的化学反应为氧化还原反应,最常考的考点则是氧化还原反应中转移的电子数目.

A电解食盐水若产生2g氢气,则转移的电子数目为2NA;
B标准状况下铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA;
C5.6g铁与足量盐酸反应转移的电子数为0.3NA;
D5.6g铁粉与硝酸反应失去的电子数一定为0.3 NA;
E7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA;
F1molCl2作为氧化剂得到的电子数为NA;
G1molCl2参加反应转移电子数一定为2 NA;
HNa2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为0.2NA;
I1.5molNO2与足量H2O反应,转移的电子数为NA;
J1molNa与足量O2反应,生成Na2O和Na2O2的混合物,Na失去NA个电子;
K电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g;
L密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA;
M标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA;
N50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA

此类题型的解题思路一般为: 1)审清题意,抓住题目研究的对象是什么物质,它的量是多少,在反应中转化为何种价态的物质或由哪种价态的物质生成,如铁在反应中的产物有+2价、+3价或者2种价态都有.2)重视几个典型反应(Na2O2与H2O、Cl2与NaOH、NO2与H2O等)的分析.3)注意反应的可逆性及反应的隐含限制条件.如MnO2与浓HCl、Cu与浓H2SO4的反应,随着反应的进行,酸的浓度变小反应就会停止.
2 借助电离、水解平衡原理进行考查
以电解质溶液为载体考查NA的问题是高考命题者比较青睐的一种方式.主要考查弱电解质的电离平衡判断及简单计算的能力,考查方式多为计算常见溶液中的离子数、分子数.

A100mL2.0mol·L-1的盐酸与醋酸溶液中的氢离子均为0.2NA;
B1.0L1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为NA;

D1.0L的0.1mol·L-1Na2S溶液中含有的S2-数目为0.1NA;
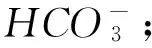
F1L1mol·L-1的NaClO溶液中含有ClO-的数目为NA;
G10LpH为1的硫酸溶液中含有的H+数目为2NA;
H0.1mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA个;
I0.50mol的硫酸钠中含有6.02×1023个钠离子;
J25℃,pH为13的NaOH溶液中含有OH-的数目为0.1NA;
K常温下,100mL1mol·L-1Na2CO3溶液中阴离子总数大于0.1NA;
L常温下,1L1mol·L-1NH4NO3溶液中氮原子数为2NA;
M1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA;
N室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA;
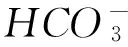
P2L0.5mol·L-1亚硫酸溶液中含有的H+数为2NA

此类题型的解题思路一般为: 1) 看浓度与体积数据是否齐全.2) 看溶质是什么:若为酸碱则考虑电离(强酸强碱全部电离,弱酸弱碱部分电离);若为盐主要考虑水解,当有弱酸根或弱碱阳离子存在时因水解导致离子数目减少.3) 看清题目问的是溶质还是溶液(是否包含溶剂水).4) 看清题目问的是离子数还是分子数,是等于、大于还是小于.
3 结合物质的物理性质及状态进行考查
物质体积取决于构成这种物质的粒子数目、粒子大小和粒子之间距离这3个因素.对于气体,因分子之间的距离比分子本身的体积大很多倍,分子可以在较大的空间内运动,故气体体积由分子数目和分子间距离决定.分子间距离随温度和压强的改变而改变,故当外界条件一定时,气体的体积取决于分子数目.在标准状况(0 ℃、101.325kPa)时,1mol任何气体的体积约为22.4L,分子数为NA,即Vm=22.4L·mol-1的适宜条件是标准状况.在试题中常利用在标准状况下非气态物质和非标准状况如“常温、常压,在25 ℃、101kPa时”等设置陷阱.

A标准状况下,22.4L单质溴所含有的原子数目为2NA;
B标准状况下,22.4L甲苯所含的分子数为NA;
C标准状况下,11.2LSO3所含的分子数为0.5NA;
D标准状况下,22.4LCHCl3中含有氯原子数目为3NA;
E标准状况下,33.6LH2O含有9.03×1023个H2O分子;
F标准状况下,5.6L四氯化碳含有的分子数为0.25 NA;
G标准状况下,22.4L己烷中共价键数目为19NA;
H标准状况下,22.4L乙醇的分子数为NA;
I标准状况下,22.4L甲醇中含有的氧原子数为1.0NA;
J标准状况下,22.4L二氯甲烷的分子数约为NA个;
K标准状态下,33.6L氟化氢中含有氟原子的数目为1.5 NA;
L在常温、常压下,11.2L氮气所含的原子数目为NA;
M2.24LCO2中含有的原子数为0.3 NA;
N22.4L氧气中必然含有NA个氧分子;
OCO和N2为等电子体,22.4L的CO气体与1molN2所含的电子数相等;
P分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g;
Q常温、常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA;
R常温、常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA;
S常温、常压下,22.4L的NO2和CO2混合气体含有2 NA个O原子;
T常温、常压下,22.4LH2的分子数小于NA

此类题型的解题思路一般为: 1) 一般解题过程为“一看、二找、三定”:一看,先看体积数;二找,找条件是否为标准状况;三定,定所给物质在标准状况下是否为气体.2) 熟记常见物质在标准状况下的状态和认真审题是解题的关键.关于气态与非气态的判断:在标准状况下,无机物中常见的SO3、H2O、Br2等为非气态;有机物中,碳原子在4以内的烃为气态,烃的衍生物常考有CH3Cl、HCHO为气态.3) 注意是等于还是小于.4) 客观看待常温、常压,不能盲目将常温、常压选项排除.如果讨论物质的量、质量与微粒数目的关系时,则与是否为标准状况无关,如“常温、常压下,1mol氦气的核外电子数为2NA”就是正确的.
4 基于物质的组成与结构进行考查
根据物质组成和结构考查粒子数和化学键数是近年来高考的热点之一.试题往往是给出一定质量、物质的量或一定体积的物质来计算构成或组成物质中所含的分子数、原子数、质子数、中子数、电子数、化学键数等.

A在同温、同压时,相同体积的任何气体单质所含的原子数目相同;
B由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA;
C盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol;
D17g氨气所含电子数目为10NA;
E1mol羟基中电子数为10 NA;
F1molNaCl中所有Na+的最外层电子总数为8NA;
G1molAl3+含有的核外电子数为3NA;
H2L0.5mol·L-1硫酸钾溶液中阴离子所带电荷数为NA;
I18gH2O中含有的质子数为10NA;
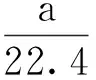
K1molNaCl中含有NA个NaCl分子;
L1molNa2O2固体中含离子总数为4 NA;
M常温、常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA;
N常温、常压下,92g的NO2和N2O4混合气体含有的原子数为6 NA;
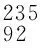
P1molCH4分子中共价键总数为4NA;
Q30g甲醛中含共用电子对总数为4NA;
R4.5gSiO2晶体中含有的硅氧键数目为0.3 NA;
S12g金刚石含有的共价键数为4NA;
T17.6g丙烷中所含的极性共价键为4NA个;
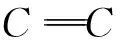
V12g石墨烯(单层石墨)中含有六元环的个数为0.5NA;
W60g丙醇中存在的共价键总数为10NA

此类题型的解题思路一般为:
1) 明确要求计算的是什么微粒数目:试题提供的情境中有多种微粒,如含分子、原子、质子、中子或电子、最外层电子等,首先要明确回答的种类.若求中子数时,要清楚不同核素(如氕、D、T、等)的中子数及质子数、中子数、质量数的关系;若求电子数,要注意根、基、离子对核外电子的影响.
2) 注意物质的组织形式:判断分子中原子个数时要注意分子的构成情况,常考稀有气体He、Ne等单原子分子,Cl2、O2、N2等双原子分子及O3、P4等多原子分子,离子化合物由阴阳离子构成,不存在分子.
3) 具有相同最简式的物质(如NO2和N2O4、乙烯与丙烯、同分异构体、乙炔与苯、乙酸与葡萄糖等),只要质量一定,其中所含原子数与二者比例无关,利用通式进行计算.如:求mg乙烯和环丙烷的混合物中微粒数.因为乙烯与环丙烷的实验式都为CH2,所以混合物的通式为 (CH2)x,则各原子数的求法为:
4) 要注意晶体的结构,不能只看表面分子构成确定化学键数,要联想分子结构和晶体结构来确定.常考物质有金刚石(1mol含2molC—C)、白磷(P4、1mol含6molP—P)、SiO2(1mol含4molSi—O)、CH4、CO2等.在有机物中把双键(或叁键)视为2条(或3条)共价键.
5 通过隐含反应进行考查
同位素原子的质子数、电子数分别相同,但由于中子数不同,质量数和相对原子质量也不相同.因此,命题者常以此为切入点进行设陷考查质子数、电子数.另外,在分析有些物质分子数(如NO2)时应考虑有无隐含反应,若有,则会导致分子数目的改变.

A常温、常压下,18.0g重水(D2O)所含的电子数为10NA;
B18g18O2中含有NA个氧原子;
C46gNO2和N2O4的混合物含有的分子数为1NA;
D密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA;
E50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA;
F在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得到NH3分子数为NA

此类题型的解题思路一般为:
1) 由质量计算物质的量时,要注意存在同位素元素构成的物质的相对分子质量的变化,如D2O、18O2等.
2) 题目涉及NO2时要注意求分子数还是原子数,若求分子数则因为2NO2N2O4,分子数会减少.
3) 要注意给出物质彼此间是否发生反应,是否能完全反应(如可逆反应、浓硫酸与铜反应).
纵观近几年高考试题,有些考点经常出现,在复习过程中应特别关注,防止无谓的失分.虽然阿伏加德罗常数涉及的内容多,但多为基本概念和基础知识.只要复习时加强对基本知识的归纳总结,熟悉考点和设置的陷阱,在练习中不断反思,就能提高解答有关阿伏加德罗常数问题的能力.
(作者单位:1.云南腾冲第八中学2.云南腾冲五中

