滤纸覆盖法采样检测食品加工台面上食源性致病菌的研究
索 标,李 玺,王 娜,范会平,潘治利,谢新华,艾志录
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.河南省冷链食品工程技术研究中心,河南 郑州 450002;3.速冻面米及调制食品河南省工程实验室,河南 郑州 450002)
滤纸覆盖法采样检测食品加工台面上食源性致病菌的研究
索 标1,2,3,李 玺1,王 娜3,范会平3,潘治利1,谢新华1,艾志录1,2,3
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.河南省冷链食品工程技术研究中心,河南 郑州 450002;3.速冻面米及调制食品河南省工程实验室,河南 郑州 450002)
以滤纸为采样工具,建立表面致病菌采样和监测方法。以食品加工企业常见的不锈钢接触表面为平台,人工接种金黄色葡萄球菌、沙门氏菌以及单核细胞增生李斯特菌后,通过系列相关评估,确定合适的滤纸覆盖技术采样检测表面致病菌方法体系。经过系列优化后,滤纸以添加0.1%蛋白胨和0.1% Tween 80的0.85% NaCl溶液润湿处理后,覆盖于接触表面完成采样,随后投入到10 mL的PBS溶液中充分涡旋,以用于活细胞数目的计数。结果表明,此方法采样操作相对简单快速、结果稳定,且表面致病菌检测值与棉签擦拭法无显著差异(P>0.05),对试验条件下3种菌的检测限分别为0.78、1.33、2.40 Log(CFU·cm-2),可应用于食品加工环境的微生物检测。
食源性致病菌;检测;滤纸覆盖;食品加工台面
食源性致病菌作为食品安全问题中的重要生物危害,每年在全世界范围内引发数百万人感染疾病事件[1-2],是引发食源性疾病的主因之一。食品加工环境中食品接触表面及设备上附着有各类微生物[3-4],食品加工过程中的接触使得这些环境表面上的致病菌交叉感染至食品中,尤其是已经过杀菌处理过的食品中,引发食品质量及安全危害,因而食品加工环境中接触表面致病菌的监测是食品质量及安全控制和防范食源性疾病暴发的重要一环。环境接触表面微生物分析分为表面采样及处理和后续检测手段两大部分,其中表面采样及其处理是决定表面微生物检测效果的关键步骤[5]。已报道的接触表面微生物采样方法有培养基直接接触待测表面技术[6]、荧光显微镜镜检技术[7]、拭子采样技术[8]、无菌海绵等擦拭巾类采样技术[9-10],复合材料薄片法[11]、滚筒法[12]等,这些方法各自有其适用性和局限性[13]。拭子擦拭法是应用最广泛的采样方法,然而,对于食品加工场所操作台面而言,棉签拭子体积小、不能满足大面积采样的需要,其操作也难以标准化,影响结果再现性[12]。目前关于食品接触表面致病菌检测尚未建立严格的标准方法程序[13]。理想的采样方法应满足3个重要标准,一是采样过程有效吸附获得接触表面细菌,二是采样后分析前的过程条件最大程度保持细菌数目和活性,最后是获得细菌有效释放至检测体系[5,14]。本研究以吸附能力较强的滤纸为擦拭材料,建立食品加工台面上致病菌检测前处理技术。此外,在实际应用中,采样后很难做到立即处理或保持推荐的分析前低温储藏[15],故本研究首先以3种致病菌在其中的生长情况并结合滤纸上细菌在其中的洗脱释放效能评估样品处理液,然后评估不同溶液润湿处理滤纸的表面菌检测效能,建立起一套合理的滤纸覆盖加微生物培养评估表面菌体系,最后综合评估滤纸覆盖法检测效能。
1 材料与方法
1.1材料与试剂
金黄色葡萄球菌ATCC 6538、单核细胞增生李斯特菌 ATCC 27708,美国菌种保存中心(ATCC)提供,-80 ℃甘油管保存;沙门氏菌CMCC 50035,中国医学微生物菌种保藏中心(CMCC)提供,-80 ℃甘油管保存。
胰蛋白胨大豆肉汤培养基(TSB),北京陆桥技术有限责任公司;酵母浸粉,生工生物工程(上海)有限公司;琼脂(Agar Powder),北京索莱宝科技有限公司;氯化钠(分析纯),天津市德恩化学试剂有限公司。使用时均按使用说明配制。
滤纸,杭州特种纸业有限公司;棉签,广州永益医疗器械有限公司;食品级不锈钢钢板(型号304,规格5 cm × 5 cm),无锡市嵘晟华钢业有限公司。
1.2仪器与设备
SX-500高压蒸汽灭菌锅,日本Tomy公司;JJ-CJ-2F 金净洁净工作台,吴江市净化设备总厂;BS-S氧浴恒温振荡器,国华企业;LHP-250智能恒温恒湿培养箱,上海鸿都电子科技有限公司;WH-966旋涡混合器,上海康华生化仪器制造厂。
1.3试验方法
1.3.1 菌悬液制备 在无菌条件下,将供试菌株接种到TSA平板,37 ℃培养18~24 h,挑选典型菌落接种于已灭菌的TSB培养基中培养至指数后期(约108~109 CFU·mL-1),并以6×6计数法[16]在添加0.6%酵母浸粉的胰蛋白胨大豆肉汤琼脂培养基上培养计数,备用。
1.3.2 不锈钢表面致病菌的检测
1.3.2.1 不锈钢板人工污染 取目标浓度菌液25 μL接种于钢板上,用无菌涂布棒均匀涂布于整个钢板面积范围,超净工作台中风干15 min后采样。
1.3.2.2 棉签擦拭法 参照ISO 18593—2004标准[17],手持浸润后的棉签杆平行于污染后的钢板平面,先按从左往右的顺序上下擦拭5次至完全覆盖,然后再按从上到下顺序左右擦拭5次至完全覆盖,把手处剪段,签头部投入10 mL相应洗脱处理溶液中。
1.3.2.3 棉签擦拭法 事先剪好的无菌干燥滤纸(5 cm×5 cm)浸润后用无菌镊子夹起,对齐平铺覆盖于人工污染过的钢板取样,取样后用镊子夹起并投入10 mL相应洗脱处理溶液中。
1.3.2.4 样品检测 采样后液瓶立即置于混合器上涡旋30 s,使棉签或滤纸上细菌充分释放至洗脱液体中,取样液系列稀释,以倾注平板培养法计数。
1.3.3 3种致病菌在不同处理液中的数量变化 选取0.85% NaCl溶液、磷酸盐缓冲液(PBS)、添加了0.1% Tween 80的0.85% NaCl溶液、添加了0.1%蛋白胨(PW)的0.85% NaCl溶液、同时添加0.1% Tween 80和0.1% PW的0.85% NaCl溶液作为采样后样品洗脱处理液,取目标母菌液的103倍稀释液25 μL接种到10 mL各样品处理液中,分4 ℃和25 ℃2个条件放置,稀释平板计数第0、6、24 h时的菌液浓度,结果用Log(CFU·mL-1)表示。
1.3.4 不同处理液中致病菌洗脱释放效果的评估 将无菌干燥滤纸浸入0.85% NaCl溶液中润湿后直接在其上接种25 μL母菌液(约109CFU·mL-1),接种后的滤纸立即投入10 mL样品处理液中,涡旋30 s,用TSA-0.6%Ye培养基取样,检测各处理组含菌数,用logCFU表示。
1.3.5 滤纸在不同溶液中润湿处理的表面致病菌检测效能评估 除1.3.3中几种溶液外,增加添加1% Tween80的0.85% NaCl溶液,分别以此6种溶液事先润湿滤纸,采样检测同浓度污染水平不锈钢钢板,采样后投入到PBS处理液中取样检测,每种处理做3个重复试验。
1.3.6 滤纸覆盖法检测效果验证 同时以棉签擦拭法和滤纸覆盖法采样检测相同浓度细菌污染量(106CFU·cm-2)的不锈钢钢板,润湿棉签或滤纸的润液为0.85% NaCl+0.1% Tween80+0.1% PW,样品处理液为PBS,计数致病菌获得量(以单
位Log(CFU·cm-2)表示)和检测获得率Recovery%,每种处理做10个重复样品。同时以滤纸覆盖法采样检测3种菌的系列梯度浓度污染不锈钢板以评估方法的检测限(未稀释样品处理液1 mL倾注平板培养后未见菌落长出者视为阴性结果)。
Recovery%=N/N0(式中:N表示平面采样所得致病菌数目(CFU·cm-2);N0表示不锈钢表面初始接种量CFU·cm-2)
2 结果与分析
2.13种致病菌在不同溶液中的数量变化
理想条件下,为保证检测的准确性,采样后的样品应立即处理检测,但在实际应用中一般很难做到立即处理或保持被检测分析前的低温条件储存[14],故评估目标微生物在不同溶液中的生长变化规律很重要。4 ℃条件下,3种致病菌在这5种处理液中24 h内数量变化均不大,变幅未超出0.5个对数值。25 ℃条件下,金黄色葡萄球菌6 h以内各溶液中数量变化均不大,6 h以后仅在添加蛋白胨的0.85% NaCl溶液增菌明显(图1-A);沙门氏菌6 h以内除了2种含有蛋白胨的溶液外,在其他溶液中数量稳定,6 h后仅在PBS溶液中数量变化较微,其余增菌显著(图1-B);单核细胞增生李斯特菌6 h以内除了2种含有蛋白胨的溶液外在其他溶液中数量稳定,6~24 h 2种含蛋白胨溶液持续增长,添加Tween 80的NaCl溶液中菌数减少0.57 Log(CFU·mL-1),NaCl溶液和PBS溶液中菌数几乎无变化(图1-C)。综上可知,4 ℃条件细菌生长率最低,有利于保藏样品[18]。25 ℃条件PBS溶液中3种菌均可保证数量稳定。
2.2不同处理液中致病菌洗脱释放效果
本方法中接触表面致病菌的最终量化计数来源于样品处理液。研究表明,样品处理检测时不同材料的采样工具本身会保留一部分菌体,这些菌体不能释放至检测溶液中[14],故除了分析前定性定量保持样品中细菌外,不同配方组成的样品处理液对滤纸上目标菌的洗脱释放效果对表面致病菌检测的准确性很重要,如图2所示。由多重比较分析得出,5种样品处理液对滤纸上金黄色葡萄球菌的洗脱释放效果差异显著(P<0.05),0.85% NaCl+0.1% Tween 80溶液最优;沙门氏菌在0.85% NaCl+0.1% Tween 80溶液中洗脱释放效果显著优于其他溶液(P<0.05),其他溶液处理间无显著差异;单核细胞增生李斯特菌在0.85% NaCl+0.1% Tween 80溶液中洗脱释放效果较优。但从数值上看,3种菌在各样品处理液中处理获得菌数比滤纸上初始接种菌量减少的区间分别为0.24~0.80、0.21~0.44、0.21~0.56 LogCFU,差别并不是很大,表明试验条件下所选5种样品处理液对滤纸上3种菌体洗脱释放效果均较佳,与滤纸上直接接种菌量最多相差0.8个对数值。以上结果结合3.1中结果及分析,试验条件下选用PBS作为样品处理液。
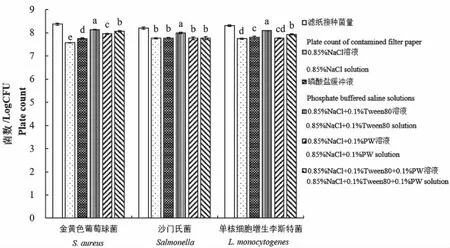
注:标注不同字母者存在显著性差异(P<0.05)。Treatments marked by different letters means significant differences(P<0.05).
2.3滤纸在不同溶液中润湿处理的表面治病菌检测效能
接触面上细菌的采样获得是表面致病菌检测的首要基础,接触表面进入干燥状态后细菌粘附于表面,不易从表面移除,故常用一定溶液润湿处理采样工具,以促进其对表面细菌的吸附,同时减少干燥状态直接摩擦采样对细菌的损伤作用,不同的润湿液和采样工具组合是采样工具从表面采样获得细菌效果的重要影响因素,如图3所示。金黄色葡萄球菌不同润湿液处理滤纸的检测结果比初始表面接种量减少量为-0.97~-0.27 Log(CFU·cm-2),沙门氏菌为-1.08~-0.43 Log(CFU·cm-2),单核细胞增生李斯特菌为0.05~0.75 Log(CFU·cm-2)。多重比较分析结果表明,0.85% NaCl+0.1% Tween 80+0.1%PW溶液和0.85% NaCl+1% Tween 80溶液润湿处理滤纸对接触表面金黄色葡萄球菌的获得效果显著优于其他溶液(P<0.05);PBS溶液和0.85% NaCl+1% Tween 80溶液处理对表面沙门氏菌的获得值显著低于其他4种溶液(P<0.05),而此4种溶液处理相互之间无显著差异;0.85% NaCl+0.1% Tween 80+0.1%PW溶液和0.85% NaCl+1% Tween 80溶液处理对接触表面单核细胞增生李斯特菌的获得效果显著优于其他溶液(P<0.05)。3种致病菌检测结果最大值均为0.85% NaCl+0.1% Tween 80+0.1%PW溶液,因此本研究采用该溶液作为采样滤纸湿润处理液。
2.4滤纸覆盖法检测表面致病菌效果
为了评估滤纸覆盖法检测表面治病菌的可行性,本研究以常规的棉签擦拭法为对照,评估其表面致病菌检测效能并验证其对不同程度污染表面致病菌检测效果。当表面致病菌污染水平为106CFU·cm-2时,滤纸覆盖与棉签擦拭法采样3种致病菌结果相差均不大,差异均不显著(P>0.05)。其中金黄色葡萄球菌和沙门氏菌检测结果与不锈钢表面初始接种量相差1个对数值左右,而单核细胞增生李斯特菌检测结果与初始接种量相差2个对数值左右(图4),滤纸覆盖法金黄色葡萄球菌平均获得率为5.84%±1.51%,沙门氏菌为10.60%±4.84%,单增李斯特菌为1.76%±0.60%。滤纸覆盖法检测金黄色葡萄球菌的检测限为0. 78 Log(CFU·cm-2),沙门氏菌检测限为1.33 Log(CFU·cm-2),单核细胞增生李斯特菌检测限为2.40 Log(CFU·cm-2)。
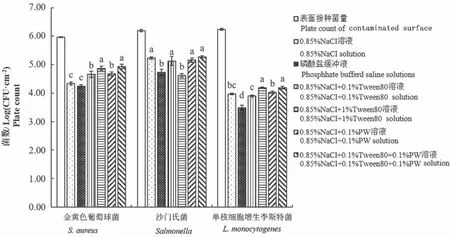
图3 不同溶液润湿处理滤纸对表面致病菌检测的影响Fig.3 Effect of different wetting solutions on detection of pathogens from surfaces
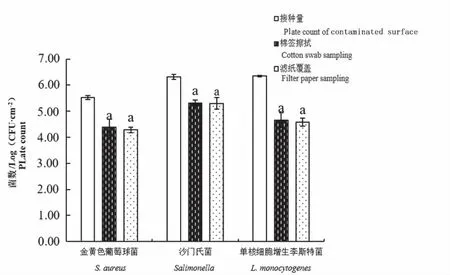
图4 滤纸覆盖法和棉签擦拭法检测表面致病菌数量Fig.4 The counts of pathogens by filter paper sampling and cotton swab sampling methods
3 结论与讨论
采样处理液对于检测结果的准确性具有重要意义,本研究结果表明,25 ℃条件3种菌在添加0.1% PW的NaCl溶液中均增长显著,前人研究表明,致病菌在含营养性物质的溶液中增菌显著[14]。对比3种菌在同时含有Tween 80和PW的溶液与添加PW的NaCl溶液中生长状况,发现Tween 80的添加对金黄色葡萄球菌和单核细胞增生李斯特菌的增长有影响,对沙门氏菌无影响。有研究指出,Tween 80对革兰氏阳性细菌有明显抑制或损伤作用[19-20],而Tween 80、EDTA、Triton-X-100等表面活性类物质以及具有中和消毒剂作用的一类物质对某些细菌的生长抑制或损伤甚至致死作用都有报道[21-23]。故对样品处理液或采样用润湿液的选择需充分考虑成分对目标分析菌的影响[24]。
选择0.85% NaCl+0.1% Tween 80+0.1%PW溶液作为滤纸润湿处理液,可得到这3种致病菌的最大检测值。Tween 80为表面活性剂加入润湿液配方作为采样洗脱液,可促进细菌从吸附表面上的分离,减少由微生物聚集及采样过程中在管壁的吸附造成的计数损失。而蛋白胨可保护受采样接触面已受损细胞或减弱采样过程中可能造成的机械损伤破坏[14];单独的0.85%NaCl溶液润湿处理滤纸对接触表面沙门氏菌的获得效能较佳,并不低于添加了蛋白胨或Tween 80成分的盐溶液。
本研究建立的滤纸覆盖法检测食品加工台面上金黄色葡萄球菌、沙门氏菌和单核细胞增生李斯特菌的检测限分别为0.78、1.33以及2.40 Log(CFU·cm-2)。MARTINON等[25]用棉签擦拭法采样接种水平为106CFU·cm-2的0 h放置不锈钢钢板金黄色葡萄球菌检测值为4.25 Log(CFU·cm-2),单核细胞增生李斯特菌为4.08 Log(CFU·cm-2),30 min风干处理结果分别为2.02、1.47 Log(CFU·cm-2),其检测效能明显低于本方法。LUTZ等[8]用不同方法对一系列梯度金黄色葡萄球菌污染表面进行采样,人造纤维拭子、静电擦布、表面直接接触平板、表面直接接触滚筒采样,检测的总平均获得率分别为24%、18%、0.04%、10%,而4种方法对低浓度致病菌污染表面和高浓度致病菌污染表面检测效能的大小排序差别很大,说明方法各有其适用性。DAVIDSON等[26]以藻酸钙材料拭子采样含不同蔬菜汁基质的人工污染0 h放置表面所得沙门氏菌获得率为3%~32%,干燥2 h后的表面沙门氏菌获得率均≤0.3%。有学者用纤维素海绵和毛料纤维小滚筒采样,由从肉制品中分离培养得的4种单核细胞增生李斯特菌污染的不锈钢钢板的细菌平均获得率分别为0.64%±0.58%和1.36%±0.91%[4]。关于食品接触表面采样方法的研究和比较很多,而其致病菌检测效能结果差别很大,这是因为除采样方法外,接触表面状态(干燥或湿润,有机物负载等)、细菌状态(种属来源、代谢活性等)、环境条件(温度湿度等)等均对表面致病菌检测效能有影响。
拭子类工具小巧灵活,可采样细菌粘附性强的、不规则或不平整表面及不易采样到的角落等,应用范围很广,是很多标准中推荐的环境表面卫生检查采样方法,但是该方法不适用于大面积采样需要,且有其自身局限性,技术本身特点造成的操作程序难以严格标准化,如采样过程中涂抹接触面施力角度和强度等因素都难以控制,更易造成检测结果的差异,影响检测的重复性和结果再现性[4,14],前人试验研究证实,不同人员操作棉签擦拭法采样不锈钢表面结果差异显著。滤纸覆盖法操作程序简单,可减少操作差异带来的结果误差,同时提高大批量采样台面类的效率,不需要反复摩擦从而减少采样过程对细菌的损伤作用,且检测效能与常规棉签采样差别不大。
总之,本研究建立了一种可用于食品加工台面上食源性致病菌检测的滤纸覆盖采样法,该方法采用PBS作为样品处理液,0.85% NaCl+0.1% Tween 80+0.1%PW溶液作为滤纸润湿处理液,该方法对于食品加工台面上的金黄色葡萄球菌、沙门氏菌和单核细胞增生李斯特菌的检测限分别为0.78、1.33、2.40 Log(CFU·cm-2)。因此,本滤纸覆盖法采样操作简单方便,结果稳定,可改善棉签擦拭法的一些固有缺陷,而且能保持其检测效能,故可应用于食品加工场所操作台面致病菌的采样检测。
[1] WANG Y X, SUO B. A new 7-plex PCR assay for simultaneous detection of shiga toxin-producingEscherichiacoliO157 andSalmonellaEnteritidis in meat products[J]. Journal of Consumer Protection and Food Safety, 2011, 6(4): 441-447.
[2] 李英英,邵刘云,刘肖,等.生鲜猪肉中致病性球菌的双重PCR检测方法的建立与应用[J].河南农业大学学报,2014,48(5):613-618.
[3] RUCKERL I, MUHTEREM-UYAR M, MURI-KLINGER S, et al.L.monocytogenesin a cheese processing facility: Learning from contamination scenarios over three years of sampling[J]. International Journal of Food Microbiology, 2014, 189: 98-105.
[4] GOMEZ D, ARINO A, CARRAMINANA J J, et al. Sponge versus mini-roller for the surface microbiological control ofListeriamonocytogenes, total aerobic mesophiles and enterobacteriaceae in the meat industry[J]. Food Control, 2012, 27(1): 242-247.
[5] GILBERT S E, ROSE L J, Howard M, et al. Evaluation of swabs and transport media for the recovery ofYersiniapestis[J]. Journal of Microbiological Methods, 2014, 96(1):35-41.
[6] DECKERS S M, SINDIC M, ANCEAU C, et al. Possible influence of surfactants and proteins on the efficiency of contact agar microbiological surface sampling[J]. Journal of Food Protection, 2010, 73(11): 2116-2122.
[7] FUSTER-VALLS N, HEMADES-HERRERO M, et al. Effect of different environmental conditions on the bacteria survival on stainless steel surfaces[J]. Food Control, 2008, 19(3): 308-314.
[8] LUTZ J K, CRAWFOLD J, HOET A E, et al. Comparative performance of contact plates, electrostatic wipes, swabs and a novel sampling device for the detection ofStaphylococcusaureuson environmental surfaces[J]. Journal of Applied Microbiology, 2013, 115(1): 171-178.
[9] KRAUTER P A, PIEPEL G F, BOUCHER R, et al. False-negative rate and recovery efficiency performance of a validated sponge wipe sampling method[J]. Applied and Environmental Microbiology, 2012, 78(3): 846-854.
[10] DOWNEY A S, DA SILVA S M, OLSON N D, et al. Impact of processing method on recovery of bacteria from wipes used in biological surface sampling[J]. Applied and Environmental Microbiology, 2012, 78(16): 5872-5881.
[11] GOMEZ D, ARINO A, CARRAMINANA J J, ROTA C, YANGUELA J. Comparison of sampling procedures for recovery ofListeriamonocytogenesfrom stainless steel food contact surfaces[J]. Journal of Food Protection, 2012, 75(6): 1077-1082.
[12] VERRAN J, REDFEM J, SMITH L A, et al. A critical evaluation of sampling methods used for assessing microorganisms on surfaces[J]. Food and bioproducts processing, 2010, 88(4): 335-340.
[13] TRAFNY E A, LEWANDOWSKI R, STEPINSKA M, et al. Biological threat detection in the air and on the surface: how to define the risk[J]. Archivum Immunologiaeet Therapiae Experimentalis, 2014, 62(4): 253-261.
[14] MOORE G, GRIFFITH C. Problems associated with traditional hygiene swabbing: the need for in-house standardization[J]. Journal of Applied Microbiology, 2007, 103(4): 1090-1103.
[15] GRIFFITH C, LELIEVELD H L M, MOSTERT M A, et al. Handbook of hygiene control in the food industry[M]. Cambridge: Woodhead Publishing Ltd, 2005, 588-618.
[16] CHEN C Y, NACE G W, IRWIN P L. A 6×6 drop plate method for simultaneous colonycounting and MPN enumeration of Campylobacter jejuni, listeria monocytogenes, and Escherichia coli[J]. Journal of Microbiological Methods, 2003, 55(2): 475-479.
[17] International Organization for Standardization.2004-Microbiology of food and animal feeding stuffs-horizontal methods for sampling techniques from surfaces using contact plates and swabs[S].Switzerlanch:ISO,2004.
[18] HUBBARD K, PELLAR G, EMANUEL P. Suitability of commercial transport media for biological pathogens under nonideal conditions[J]. International Journal of Microbiology,2011:1-9.
[19] LIAO C-H, SHOLLENBERGER L M. Survivability and long-term preservation of bacteria in water and in phosphate-buffered saline[J]. Letters in Applied Microbiology, 2003, 37(1): 45-50.
[20] EGWANI L O, TAIWO M A. Survival and surface adherence ability of bacterial pathogens in oral liquid pharmaceuticals and their containers[J]. West Indian Medical Joural, 2004, 53(3): 164-169.
[21] WELLS J M, LIAO C H, HOTCHKISS A T. Invitroinhibition of soft-rotting bacteria by EDTA and nisin and invivoresponse on inoculated fresh cut carrots[J]. Plant Disease, 1998, 82(5): 491-495.
[22] HELANDER I M, MATTILA-SANDHOLLM T. Permeability barrier of the gram-negative bacterial outer membrane with special reference to nisin[J]. International Journal of Food Microbiol, 2000, 60(2/3): 153-161.
[23] TSUKAMURA M. Some observations on the mechanism of bactericidal activity of Tween 80 on mycobacteria[J]. Kekkaku, 1991, 66(2): 75-79.
[24] NEDOLUHA P C, OWENS S, RUSSEK-COHEN E, et al. Effect of sampling method on the representative recovery of microorganisms from the surfaces of aquacultured finfish[J]. Journal of Food Protection, 2001, 64(10): 1515-1520.
[25] MARTINON A, CRONIN UP, QUEALY J,et al. Swab sample preparation and viable real-time PCR methodologies for the recovery ofEscherichiacoli,StaphylococcusaureusorListeriamonocytogenesfrom artificially contaminated food processing surfaces[J]. Food Control, 2012, 24(1/2):86-94.
[26] DADIDSON C A, GRIFFITH C J, PETERS A C, et al. Evaluation of two methods for monitoring surface cleanliness-ATP bioluminescence and traditional hygiene swabbing[J]. The journal of biological and chemical luminescence. 1999, 14(1): 33-38.
(责任编辑:朱秀英)
Recoveryoffoodbornepathogensfromfoodprocessingsurfacebyfilterpapersamplingmethod
SUO Biao1,2,3,LI Xi1,WANG Na3,FAN Huiping3,PAN Zhili1,XIE Xinhua1,AI Zhilu1,2,3
(1.College of Food Science and Technology, Henan Agricultural University, Zhengzhou 450002, China;2.Henan Engineering Research Center for Cold-Chain Food, Zhengzhou 450002, China;3.Henan Engineering Laboratory of Quick-Frozen Flour-Rice Food and Prepared Food, Zhengzhou 450002, China)
In order to quantitatively detect the foodborne pathogens from food processing surface, filter paper sampling technology was established. Surfaces of stainless steel that are commonly used in food-producing places were artificially contaminated by different levels of Staphylococcus aureus, Salmonella or Listeria monocytogenes. A proper filter paper covering surfaces sampling method was established after a series of experiments and optimizations. The final optimized procedure was as follows: filter paper was premoistened with 0.85% saline solution supplemented with 0.1% Tween-80 and 0.1% Peptone, then was placed on the stainless steel surface. After vortexing in 10 ml of phosphate buffered saline solutions, the filter paper was used for quantitative analysis. The results showed that there was no obvious difference between the two methods (P>0.05). The detection limit of the filter paper based sampling method for S. aureus, Salmonella and L. monocytogenes was 0.78, 1.33 and 2.40Log (CFU·cm-2), respectively. Furthermore, the filter paper based sampling method holds the advantages of being simple, fast, effective, easy to operate, and reproducible. Taken together, the presently established filter paper based method has a potential in the foodborne pathogens detection from food processing surface.
foodborne pathogen; detection; filter paper covering; food processing surface
2015-04-02
“十二五”国家科技支撑计划项目(2012BAD37B07);河南省科技攻关计划重点项目(152102110055);河南省重大科技专项(151100110100);河南省产学研合作计划资助项目(142107000092)
索 标(1982-),男,安徽颍上人,副教授,博士,主要从事食品微生物与食品安全方面的研究。
艾志录(1964-),男,河南辉县人,教授,博士生导师。
1000-2340(2016)06-0811-07
Q93
:A

