痛宁凝胶临床研究模拟剂中柠檬黄、诱惑红和亮蓝的含量测定△
王星星,刘莉莉,吴云,于丹,王振中,萧伟*
(1.江苏康缘药业股份有限公司,江苏 连云港 222067;2.中药制药过程新技术国家重点实验室,江苏 连云港 222067)
痛宁凝胶临床研究模拟剂中柠檬黄、诱惑红和亮蓝的含量测定△
王星星1,2,刘莉莉1,2,吴云1,2,于丹1,2,王振中1,2,萧伟1,2*
(1.江苏康缘药业股份有限公司,江苏 连云港 222067;2.中药制药过程新技术国家重点实验室,江苏 连云港 222067)
目的:建立紫外分光光度法对痛宁凝胶临床研究模拟剂中柠檬黄、诱惑红和亮蓝3种色素的含量测定方法,用于监控模拟剂的质量及稳定性。方法:应用紫外分光光度法测定柠檬黄、诱惑红和亮蓝在痛宁凝胶临床研究模拟剂中的含量,确定色素的最大吸收波长及最大吸收波长处的吸收系数和摩尔吸收系数,并测定样品中色素的含量。结果:柠檬黄在426 nm处的a=41.2 L·g-1·cm-1,ε=2.201 3×104mol·L-1·cm-1;诱惑红在503 nm处的а=45.5 L·g-1·cm-1,ε=2.225 6×104mol·L-1·cm-1;亮蓝在629 nm处的а=141.3 L·g-1·cm-1,ε=1.207 1×105mol·L-1·cm-1;在(40±2)℃、RH 65%±5%条件下,亮蓝的含量未发生变化,柠檬黄和诱惑红的含量明显下降。在(25±2)℃、RH 60%±10%条件下,3种色素含量稳定无变化。结论:建立的紫外分光光度法能够准确地测定模拟剂中色素的含量;通过紫外分光光度法的测定,模拟剂在高温高湿[(40±2)℃、RH 65%±5%]条件下不稳定,色素含量下降,在常温[(25±2)℃、RH 60%±10%]条件下色素含量无变化,稳定性好,此方法可以较好地监控模拟剂的质量及稳定性。
紫外分光光度法;柠檬黄;诱惑红;亮蓝;稳定性
柠檬黄、诱惑红、亮蓝作为我国允许使用的食用合成色素,其规定最大用量为0.1 g·Kg-1。合成色素常采用比值导数波谱法[1]、主成分回归光度法[2]、示波极谱法[3-4]、因子分析-光度法[5]、高效液相色谱法[6-7]、多波长线性回归-导数分光光度法[8-9]、多元线性回归K系数法[10-11]、薄层色谱扫描分析法[12]、计算机差谱法[13]、毛细管电泳法[14-15]、导数吸附伏安法[16]、固定PH值滴定法[17]、高聚物萃取分光光度法[18]、三维荧光光谱结合平行因子算法[19]等进行测定。对于两组分及以上人工合成色素多采用紫外分光光度法[20]、双波长K系数法[21]等进行同时测定。
痛宁凝胶临床研究模拟剂(安慰剂)主要用于突显痛宁凝胶药物的临床疗效,其由卡波姆加水溶胀,与柠檬黄、诱惑红、亮蓝3种色素配制而成,色素的使用量符合国家规定。由文献报道[22]得出,柠檬黄和诱惑红在高温高湿条件下不稳定。本文将研究建立柠檬黄、诱惑红和亮蓝3种色素的含量测定方法,以考察和控制模拟剂的质量,为监控样品稳定性提供有效的评价方法。紫外分光光度法虽然不是最先进的检测方法,但它多用于食品工业的色素测定,本研究旨在将其用于药品色素的检测中,为药品的色素检测提供一种方法。
1 仪器和试剂
UV-2450 紫外可见分光光度计(岛津);聚酰胺树脂(浙江永在化工有限公司);柠檬黄、诱惑红、亮蓝[浙江吉高德色素科技有限公司(中意合资)];柠檬酸(国药集团化学试剂有限公司,分析纯);甲醇-甲酸(3∶2)、乙醇-氨水-水混合溶液(7∶2∶1)、冰乙酸(南京化学试剂有限公司);实验用水均为一次蒸馏水。
2 实验部分
2.1 实验原理
当3种吸光物质的吸收光谱两两互相重叠,且其最大吸收互有干扰时,可依据吸光度的加和性,通过解联立方程组来进行测定[23-25]。设试样中有A、B、C 3种吸光组分,根据其吸收光谱,确定A、B、C 3种组分的最大吸收波长λ1、λ2和λ3,然后分别测定3种组分在λ1、λ2和λ3处的吸收系数,再分别测量三组分在波长为λ1、λ2和λ3处的吸光度值,设为Aλ1和Aλ2,Aλ3,解联立方程:
(1)
(2)
(3)


(4)
ε=α·M
(5)
其中,α为吸收系数,M为色素的摩尔质量。
2.2方法与结果
2.2.1 模拟剂的制备 卡波姆加水溶胀,色素加适量水溶解制成溶液,缓慢加入溶胀后的卡波姆中,搅拌均匀后灌装,备用。
2.2.2 对照品溶液的制备 分别准确称取柠檬黄、诱惑红和亮蓝0.100 0 g,用pH≈6的蒸馏水分别溶解定容100 mL,配成质量浓度为1 g·L-1的储备液。稀释成0.1 g·L-1的对照品溶液,此溶液每1.0 mL相当于0.1 mg的商品合成色素。
2.2.3 吸收光谱的测定 分别准确吸取0.5 mL柠檬黄、诱惑红和亮蓝色素对照品溶液,置于10 mL比色管中,蒸馏水稀释至刻度。在UV-2450全波长紫外可见分光光度计上选择重叠扫描方式,在330~700 nm扫描3种色素的吸收光谱,确定最大吸收波长。见图1。
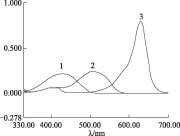
注:1.柠檬黄;2.诱惑红;3.亮蓝。图1 柠檬黄、诱惑红和亮蓝的吸收光谱
结果表明,柠檬黄在330~520 nm处有明显吸收,最大吸收波长为λmax=426 nm;诱惑红在430~580 nm处有明显吸收,最大吸收波长为λmax=503 nm;亮蓝在580~670 nm处有明显吸收,最大吸收波长为λmax=629 nm。
2.2.4 柠檬黄、诱惑红、亮蓝在不同波长下吸收系数的测定 依据2.2.3,在波长426、503、629 nm处分别测定柠檬黄、诱惑红和亮蓝的吸光度,由式(4)、(5)计算出柠檬黄、诱惑红和亮蓝的吸收系数а及摩尔吸收系数ε,结果见表1~3。

表1 柠檬黄色素在不同波长处的ε值
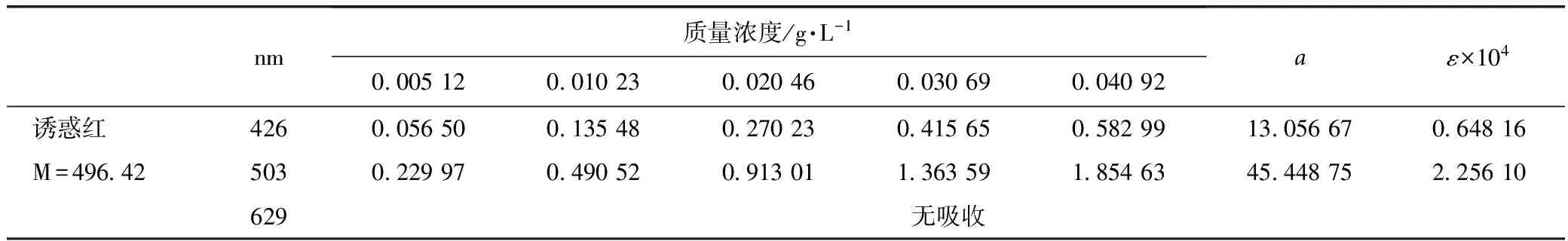
表2 诱惑红色素在不同波长处的ε值

表3 亮蓝色素在不同波长处的ε值
2.2.5 柠檬黄、诱惑红和亮蓝标准曲线的测定 分别准确吸取0.5、1.0、2.0、3.0、4.0 mL柠檬黄和诱惑红色素对照品溶液,0.5、1.0、1.5、2.0、2.5 mL亮蓝色素对照品溶液,置于10 mL比色管中,蒸馏水稀释至刻度。UV-2450全波长紫外可见分光光度计,1 cm比色皿,蒸馏水为参比,分别在426、503、629 nm处测定吸光度值,绘制标准曲线。计算得到方程,柠檬黄:Y=41.52X-0.003,r=0.999 0;诱惑红:Y=45.73X+0.009,r=0.999 0;亮蓝:Y=141.3X+0.175,r=0.994 0,其斜率即为待测组分的吸收系数。结果表明,实验值与所述计算值基本相符,证明此方法可行。
2.3 模拟剂中色素含量的测定
2.3.1 供试品溶液的制备 称取制备好的模拟剂5 g,放入100 mL烧杯中,加入50%乙醇溶液30 mL,温热溶解,加热至60 ℃。将1 g聚酰胺粉加少许水调成糊状,倒入试样溶液中,搅拌片刻,以G3垂融漏斗抽滤,用60 ℃、pH值为4的水(柠檬酸水)洗涤3~5次,然后用甲醇-甲酸混合溶液(3∶2)洗涤3~5次,再用蒸馏水洗至中性。用乙醇-氨水-水混合溶液(7∶2∶1)解吸3~5次,每次5 mL,收集解吸液,加乙酸中和,蒸发至近干,加水溶解,定容至5 mL。
2.3.2 空白样品吸收光谱的测定 卡波姆加水溶胀制得空白样品,按照2.3.1方法处理得供试品溶液,测定吸光度。结果表明,空白样品在426、503、629 nm处均无吸收,排除了卡波姆的干扰。
2.3.3 模拟剂吸光度的测定 利用紫外分光光度计分别在426、503、629 nm处测定模拟剂的吸光度值,解联立方程(1)、(2)、(3),计算模拟剂中柠檬黄、诱惑红和亮蓝的浓度,结果见表4。

表4 模拟剂中柠檬黄、诱惑红和亮蓝的含量
2.3.4 回收率的测定 在模拟剂50%乙醇溶液中分别加入0.126 μg·mL-1的柠檬黄、0.079 μg·mL-1的诱惑红和0.01 μg·mL-1的亮蓝对照品溶液1 mL,每个加标水平重复6次。利用2.3.1的方法处理样品,分别在426、503、629 nm处测定样品的吸光度值,解联立方程(1)、(2)、(3),计算样品中柠檬黄、诱惑红和亮蓝的浓度及回收率。结果见表5~7。
由表5~7得出,柠檬黄、诱惑红和亮蓝的回收率分别为96.8~100.0、97.2~100.2、98.2~100.3,均在合格范围内。
2.3.5 影响因素实验 高温高湿实验:将制备好的模拟剂放入加速箱内[(40±2)℃、RH 65%±5%]及常温[(25±2)℃、RH 60%±10%],分别于0、3、6、8、10 d观察其形态及颜色的变化,并测定色素的含量。色素的分离及吸光度的测定同2.3.1和2.3.3。结果见表8~9。

表5 柠檬黄的回收率
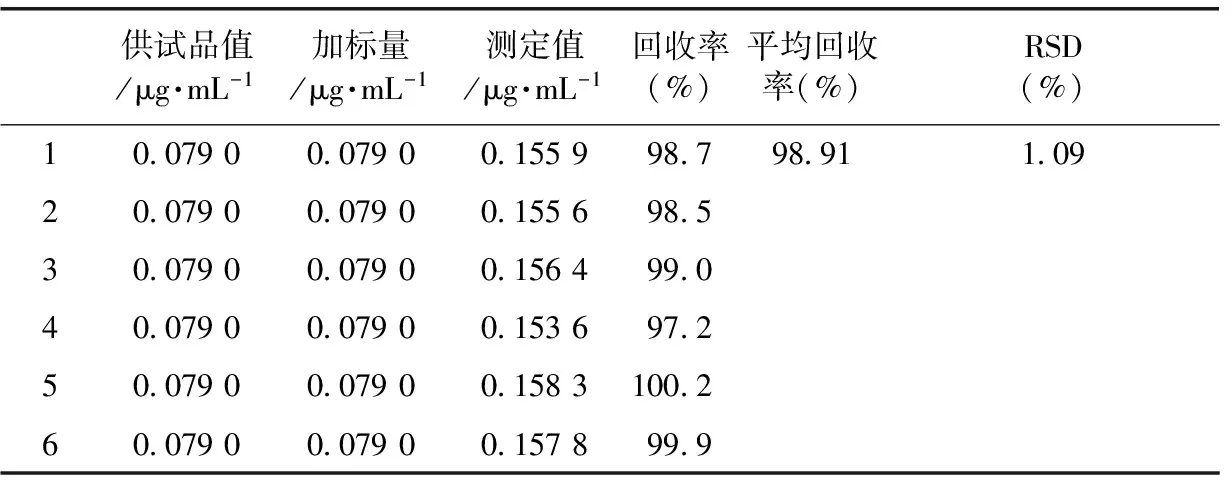
表6 诱惑红的回收率

表7 亮蓝的回收率
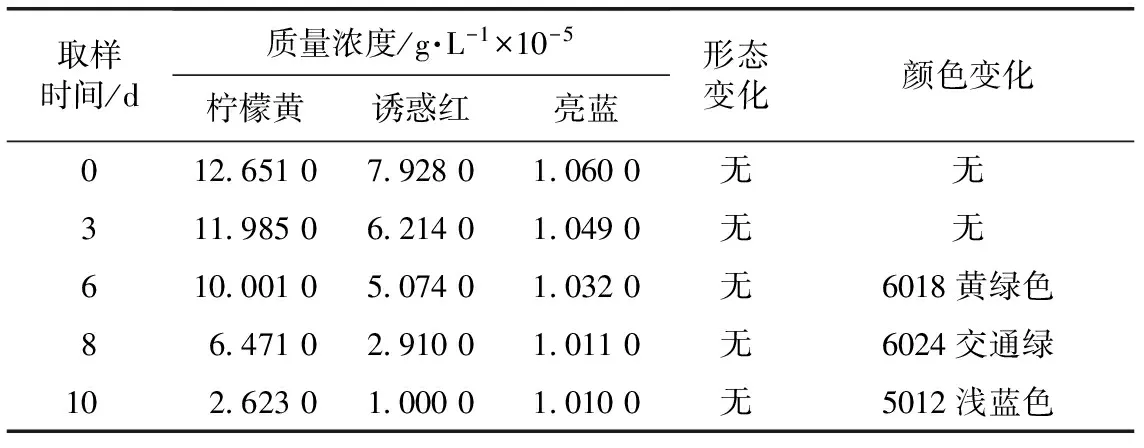
表8 模拟剂在高温高湿条件下的测定结果
注:1.颜色依据工业国际标准色卡对照表;2 d样品的颜色为8003土棕褐色。
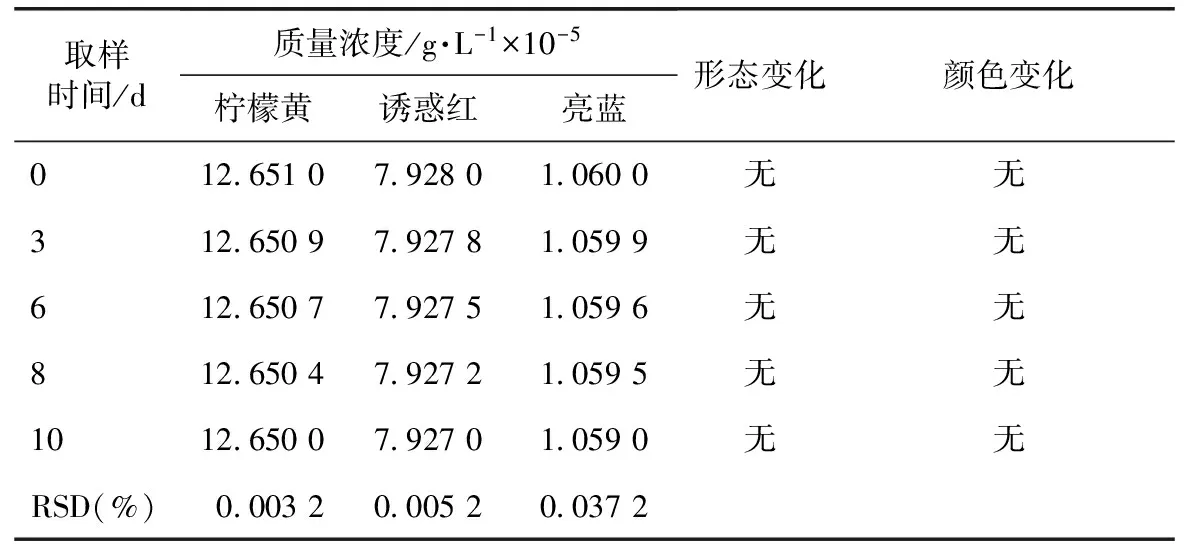
表9 模拟剂在常温条件下的测定结果
由表8得出,模拟剂在(40±2)℃、RH 65%±5%的条件下,放置时间≥6 d时,形态无变化,但颜色发生了改变,模拟剂中的柠檬黄和诱惑红两种色素的浓度明显降低,RSD值分别为47.8%和58.9%,因此湿度是导致样品颜色发生改变的原因。此实验证明,柠檬黄和诱惑红两种色素在此条件下不稳定。因此我们要降低贮藏温湿度为(25±2)℃、RH 60%±10%。由表9得出,模拟剂在(25±2)℃、RH 60%±10%的条件下,形态和颜色均无变化,稳定性好。
强光照射实验:制备好的模拟剂于照度为(45 001±5001)x条件下放置10 d,保持室温为(25±2)℃、RH 60%±10%,分别于0、5、10 d取样检测,色素的分离及吸光度的测定同2.3.1和2.3.3。结果见表10。
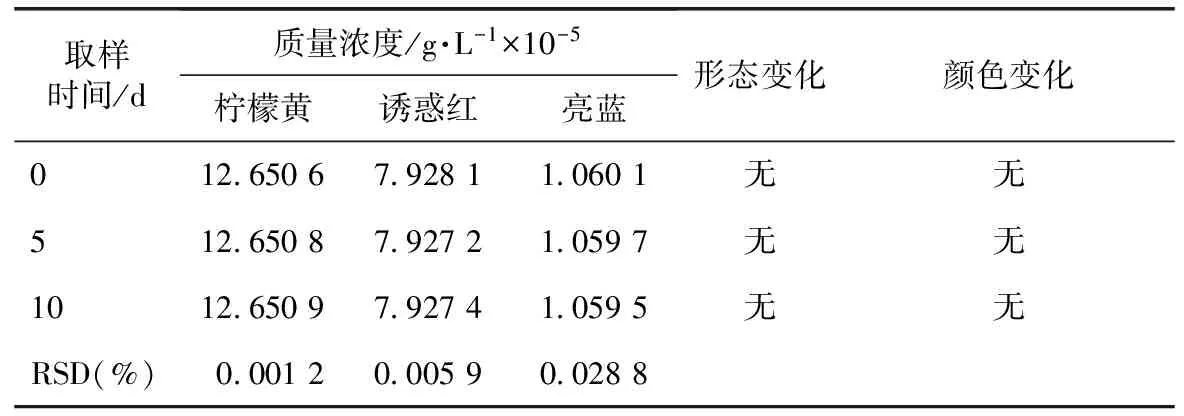
表10 模拟剂在强光照射条件下的测定结果
由表10得出,模拟剂在强光照射10 d后,形态和颜色均无变化,稳定性好。
2.3.6 18个月稳定性试验 制备好的3批模拟剂,常温[(25±2)℃、RH 60%±10%]放置,分别于0、1、2、3、6、9、12、18个月取样,观察性状及颜色的变化,并测定色素的含量。结果见表11。
由表11可以看出,0~18个月,样品的形态和颜色均无变化,同时紫外分光光度法检测数据也未发生明显改变。因此,模拟剂可以在常温[(25±2)℃、RH 60%±10%]的条件下贮藏,质量基本稳定。
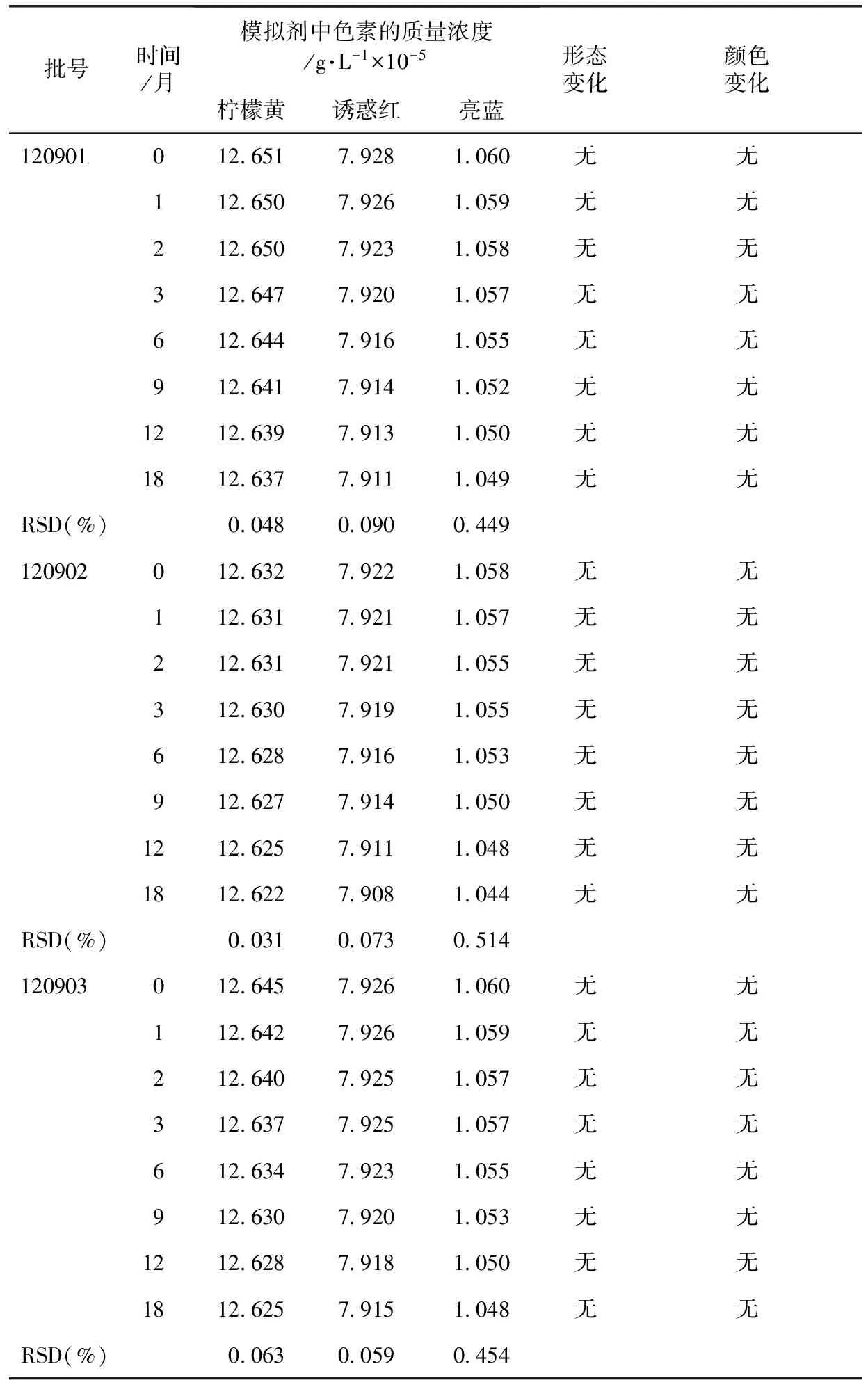
表11 18个月稳定性的测定结果
3 结论
研究拟定的紫外分光光度法同时测定模拟剂中柠檬黄、诱惑红和亮蓝的检测方法,可以灵敏的检测出模拟剂中色素的含量,该方法准确度高、灵敏度好、重现性强,可用于模拟剂的质量及稳定性的监控。
4 讨论
我们考察了模拟剂在高温高湿、光照影响因素条件下的形态和颜色变化,在(40±2)℃、RH 65%±5%条件下模拟剂的颜色和浓度均发生变化,故又考察了温湿度(25±2)℃、RH 60%±10%对模拟剂18个月稳定性的影响,以确定样品的贮藏条件。
柠檬黄和诱惑红在高温高湿条件下不稳定,提示此类色素在模拟剂制备过程中需要严格控制产品的贮藏条件。应用紫外分光光度法检测可以准确反应样品中色素含量的变化,且变化规律与样品实际颜色发生改变存在明显正相关系,说明检测的灵敏度明显优于肉眼观察,可以更加准确地监控产品质量。
本研究也提示,模拟剂的贮藏条件是不应忽视的问题。消除不稳定因素,才能确保模拟剂在临床使用过程中的质量稳定,进而保证样品的稳定、均一及安全。
[1] 张社,杨惠琴,庄慎谦.比值导数波谱法分析食品中混合色素[J].理化检验(化学分册),2000,36(8):341-345.
[2] 皇甫立霞,陈文杰.主成分回归-光度法研究食用色素混合体系的同时测定[J].合肥联合大学学报,1998,8(3):45.
[3] 刘玉莹,马永民.示波极谱法测定饮料及糖果中合成色素日落黄[J].中国卫生检验杂志,1998,8(6):351-352.
[4] 李翱楠,好春香.示差脉冲极谱法测定柠檬黄[J].广州化工,2011,39(21):112-114.
[5] Moberg L.Robertsson G,Karlberg B.Spectro-photometric determination of chlorophylls and pheopig-ments using parallet factor analysis[J].Talanta,2001,54(1):161-170.
[6] 方国桢,郭忠光.六种化学计量学法同时分光光度测定饮料中糖精钠和苯甲酸[J].分析试验室,1994,22(3):265-271.
[7] 程小会,邓敬颂.液相色谱法测定果蔬中柠檬黄和日落黄的方法优化[J].化学分析计量,2010,19(2):70-71.
[8] 周彤,戈早川.多波长线性回归导数分光光度法同时测定饮料中糖精钠和苯甲酸[J].分析试验室,1999,18(3):87.
[9] 黄红霞.多波长线性回归-导数分光光度法同时测定柠檬黄、日落黄、维生素B2[J].福建轻纺,2000,(8):7-10.
[10] 陈海春.多元线性回归K系数法同时测定食品添加剂[J].仪器仪表与分析监测,2003(1):25-26.
[11] 张永生,魏新军,颜振敏,等.第十届中国科协年会论文集(三)[G].北京:国防工业出版社,2008.
[12] 陆晓华.化学计量学[M].武汉:华中理工大学出版社,1997.
[13] 杜鸣.计算机差谱法测定桔子粉中混合色素含量[J].分析化学,1992,20(2):212-214.
[14] 张一丁,常翠兰,郭启雷,等.食品中柠檬黄铝色淀和日落黄铝色淀的毛细管区带电泳分析[J].色谱,2014,32(4):438-442.
[15] 巫素琴,温亚波,邹兰,等.毛细管电泳法分离测定饮料中色素含量的研究[J].湛江师范学院学报,2009,30(6):73-77.
[16] 白洁玲,金玲,倪永年.导数吸附伏安法同时测定柠檬黄及日落黄[J].分析测试学报,1996,15(4):56-59.
[17] 徐刚,李卓君,柳华平.固定pH滴定法同时测定合成食用色素胭脂红和柠檬黄[J].江苏石油化工学院学报,1999,11(3):39-42.
[18] 李秋贵,余秋娜,杜建中.高聚物萃取分光光度法测定果冻中色素含量的研究[J].湛江师范学院学报,2012,33(3):65-69.
[19] 李润,陈国庆,朱纯,等.三维荧光光谱结合平行因子算法测定两种食品色素的含量[J].光谱学与光谱分析,2014,34(1):111-115.
[20] 陈海春,王宓娜.多元线性回归分光光度法同时测定柠檬黄和日落黄[J].仪器仪表与分析监测,2001(4):29.
[21] 陈海春.双波长K系数分光光度法同时测定柠檬黄与日落黄[J].化学试剂,2003,25(2):98.
[22] 景顺杰,李建晴,姚建红.饮料中柠檬黄色素稳定性的研究[J].运城学院学报,2007,25(5):37-39.
[23] 高倩.紫外分光同时测定四种食用合成色素[J].食品科学.1993,3,56-58.
[24] 刘冷,李建晴,郭芬,等.紫外分光光度法同时测定柠檬黄和日落黄[J].光谱实验室,2007,24(3):423-427.
[25] 张浩,魏新军,任玉芬.饮料中柠檬黄和亮蓝的同时测定[J].饮料工业,2001,4(4):43-45.
ContentsDeterminationofLemonYellow,FancyRedandBrightBlueinClinicalPlaceboofTongningGel
WANG Xingxing1,2,LIULili1,2,WUYun1,2,YUDan1,2,WANGZhenzhong1,2,XIAOWei1,2*
(1.JiangsuKanionPharmaceuticalCo.Ltd.JiangsuLianyungang222067,China;2.StateKeyLaboratoryofNew-TechforChineseMedicinePharmaceuticalProcess,JiangsuLianyungang222067China)
Objective:To establish a quantitative method of three pigments lemon yellow,fance red and bright blue for quality control of the placebo.Method:The pigments were determined by UV spectrophotometry,and the maximum absorption and absorption coefficient and molar absorption coefficient of the pigments were determined,and their contents o in clinical placebo of Tongning gel were thereafter quantified.Result:The results were follows:lemon yellow:α=41.2 L·g-1·cm-1,ε=2.201 3×104 mol·L-1·cm-1on 426 nm,fancy red:α=45.5 L·g-1·cm-1,ε=2.225 6×104 mol·L-1·cm-1on 503 nm,and bright blue:α=141.3 L·g-1·cm-1,ε=1.207 1×105 mol·L-1·cm-1on 629 nm;The concentration of bright blue was unchanged,but lemon yellow and fancy red were unstable.Conclusion:The established UV spectrophotometry method is suitable for determination the pigments in placebo of Tongning gel at room temperature and destructive test.It can accurately control quality and stability of the placebo.
UV spectrophotometry;lemon yellow;fancy red;bright blue;stability
2014-11-26)
重大新药创制(2013ZX09402203)
*
萧伟,博士,研究员级高级工程师,研究方向:中药新药的开发与研究;Tel:(0518)81152367,Email:kanionlunwen@163.com
10.13313/j.issn.1673-4890.2016.5.024

